Comparar las concentraciones de interleucina-18 en pacientes con preeclampsia y embarazadas normotensas sanas.
MétodoSe seleccionó un total de 100 pacientes. Se incluyeron 50 pacientes preeclámpticas como los casos (grupo A) y un grupo control seleccionado por tener una edad y un índice de masa corporal similares al grupo de estudio que consistió en 50 embarazadas normotensas sanas (grupo B). Las muestras de sangre se recogieron en todas las pacientes antes del parto e inmediatamente después del diagnóstico en el grupo B para determinar las concentraciones de interleucina-18.
ResultadosNo se encontraron diferencias significativas con relación a la edad materna, edad gestacional e índice de masa corporal en el momento de la toma de la muestra (p=ns). Se encontraron diferencias estadísticamente significativas en las concentraciones de interleucina-18 entre las pacientes en el grupo de estudio (grupo A; 38,6 ± 6,5 pg/ml) y las pacientes del grupo control (grupo B; 32,2 ± 8,5 pg/ml; p<0,05). Se observó una correlación moderada, positiva y significativa con los valores de presión arterial sistólica (r=0,341; p<0,05) y con los valores de presión arterial diastólica (r=0,408; p<0,05).
ConclusionesLas preeclámpticas presentaron concentraciones significativamente más altas de interleucina-18 al compararlas con embarazadas normotensas sanas.
To compare concentrations of interleukin-18 in pre-eclampsia patients and healthy normotensive pregnant women.
MethodA total of 100 patients were selected. Fifty pre-eclamptic patients were selected as cases (group A) and a control group selected by having the same age and body mass index to study group, consisting of 50 healthy normotensive pregnant women. Blood samples were collected in all patients before labour and immediately after diagnosis in group B to determine interleukin-18 concentrations.
ResultsThere were no significant differences in relation to maternal age, gestation age and body mass index at the time of taking the sample (P = ns). There was a statistically significant difference in interleukin-18 concentrations between patients in cases group (group A; 38.6 ± 6.5 pg/ml) and patients in control group (group B; 32.2 ± 8.5 pg/ml; P<.05). There was a moderate, positive and significant correlation with systolic blood pressure values (r=0.341; P<.05) and with diastolic blood pressure values (r=0.408; P<.05).
ConclusionsPre-eclampsia patients had significantly higher concentrations of interleukin-18 when compared with healthy normotensive pregnant women.
La preeclampsia, una complicación específica del embarazo que ocurre durante la segunda mitad de este, está caracterizada por la presencia de hipertensión y proteinuria. Además, es una de las principales causas de morbimortalidad materna y perinatal1. A pesar de los grandes esfuerzos para establecer los mecanismos y moléculas que inducen la preeclampsia, no se ha identificado ningún factor específico2. La isquemia placentaria y el daño endotelial han sido considerados eventos clave en la fisiopatología del síndrome; sin embargo, los mediadores que llevan a estos daños aún no han sido completamente estudiados3,4.
La naturaleza y cantidad de las sustancias inmunorreguladoras presentes en el suero materno pueden ser parcialmente responsables de la regulación in vivo de las condiciones asociadas a la preeclampsia. Determinar las alteraciones de las citoquinas en el suero de las preeclámpticas sería de interés y permitiría mejorar el entendimiento de la etiología y patogénesis de la preeclampsia1,5,6.
La interleucina (IL)-18 es una citoquina proinflamatoria que es principalmente sintetizada por los macrófagos y monocitos. Se considera que tiene cualidades pleitróficas tanto en la regulación de las respuestas inmunes (innatas y adquiridas) como en la estimulación de la inmunidad Th17,8. Potencia los procesos inflamatorios estimulando la producción de interferón gamma, factor de necrosis tumoral alfa e IL-1 beta, por lo que tiene la capacidad de promover la formación de placas ateroscleróticas9. Se encuentra presente en la interfase materno-fetal y se expresa en la decidua y el corion10,11. Las concentraciones de IL-18 están marcadamente elevadas en el embarazo normal y estan aún más elevadas durante el parto y en algunas complicaciones obstétricas12,13. Se ha propuesto un papel clave para la IL-18 en el embarazo, inicio del parto y complicaciones obstétricas, pero los cambios en las concentraciones séricas en pacientes preeclámpticas presentan resultados contradictorios13,14.
El objetivo de la investigación fue comparar las concentraciones de IL-18 en pacientes con preeclampsia y embarazadas normotensas sanas.
MétodoSe seleccionó a un total de 100 pacientes: se incluyó a 50 pacientes preeclámpticas en el grupo de los casos (grupo A) y un grupo control seleccionado por tener edad e índice de masa corporal similares al grupo de estudio, que consistió en 50 embarazadas normotensas sanas (grupo B). Todas las pacientes eran primigestas. El comité de ética del hospital aprobó el estudio.
La preeclampsia se definió como la presión arterial sistólica de 140mmHg o más, o presión arterial diastólica de 90mmHg o más, confirmadas por 6h o más de diferencia, mientras que la proteinuria se definió como 300mg o más de proteína en una muestra de 24h, o 1-2 cruces de proteinuria en un examen cualitativo después de las 20 semanas de gestación.
Los criterios de exclusión fueron antecedentes de enfermedad hipertensiva preexistente (antes de las 20 semanas), enfermedad cardíaca o renal, diabetes mellitus, hábito tabáquico, embarazo múltiple y tratamiento con medicamentos que puedan alterar las concentraciones de IL-18.
Las muestras de sangre (10ml) se recogieron en todas las pacientes antes del parto e inmediatamente después del diagnóstico en el grupo de casos de la vena antecubital y se las dejó coagular a temperatura ambiente. Posteriormente, fueron centrifugadas a 1.000g por 15 minutos a los 60 minutos de tomada la muestra y almacenadas con posterioridad a −80°C. Se utilizó una prueba de inmunoabsorbencia ligada a enzima para la medición cuantitativa de la IL-18 en cada muestra. Todas las mediciones fueron hechas por duplicado y el promedio de las 2 fue el resultado final. La sensibilidad fue de 12 pg/ml. El coeficiente de variación intra e interensayo fue menor del 6 y del 10%, respectivamente.
Los valores obtenidos se presentaron como promedio ± desviación estándar. La prueba de la t de Student para muestras no relacionadas se utilizó para el análisis de los grupos y para comparar las variables continuas. Los coeficientes de correlación entre la IL-18 y la presión arterial sistólica y diastólica se evaluaron usando la prueba de Pearson. La precisión de la IL-18 para el diagnóstico de preeclampsia se presenta en función de la sensibilidad, la especificidad, el valor predictivo positivo, el valor predictivo negativo y la precisión. Se utilizó el análisis operador-receptor para determinar el mejor valor de corte. Se consideró p<0,05 como estadísticamente significativa.
ResultadosLas características generales de los dos grupos de pacientes se muestran en la tabla 1. No se encontraron diferencias significativas con relación a la edad materna, la edad gestacional y el índice de masa corporal en el momento de la toma de la muestra (p=ns). Se observaron diferencias estadísticamente significativas entre los grupos en los valores promedio de presión arterial sistólica y diastólica (p<0,05).
Características generales
| Grupo A, preeclámpticas (n=50) | Grupo B, controles (n=50) | p | |
| Edad materna, años | 22,3 ± 2,6 | 21,3 ± 3,8 | ns |
| Edad gestacional, semanas | 36,9 ± 1,9 | 37,3 ± 2,0 | ns |
| Índice de masa corporal, kg/m2 | 27,6 ± 1,7 | 27,5 ± 1,7 | ns |
| Presión arterial sistólica, mmHg | 148,6 ± 11,8 | 103,9 ± 6,8 | < 0,05 |
| Presión arterial diastólica, mmHg | 103,2 ± 8,1 | 73,5 ± 7,7 | < 0,05 |
En la tabla 2 se muestran los valores promedio de IL-18. Se encontraron diferencias estadísticamente significativas entre las pacientes del grupo A (38,6 ± 6,5 pg/ml) y las pacientes del grupo B (32,2 ± 8,5 pg/ml; p<0,05). Al realizar la correlación entre las concentraciones de IL-18 y los valores de presión arterial (tabla 3) se observó una correlación moderada, positiva y significativa con los valores de presión arterial sistólica (r=0,341; p<0,05) y con los valores de presión arterial diastólica (r=0,408; p<0,05).
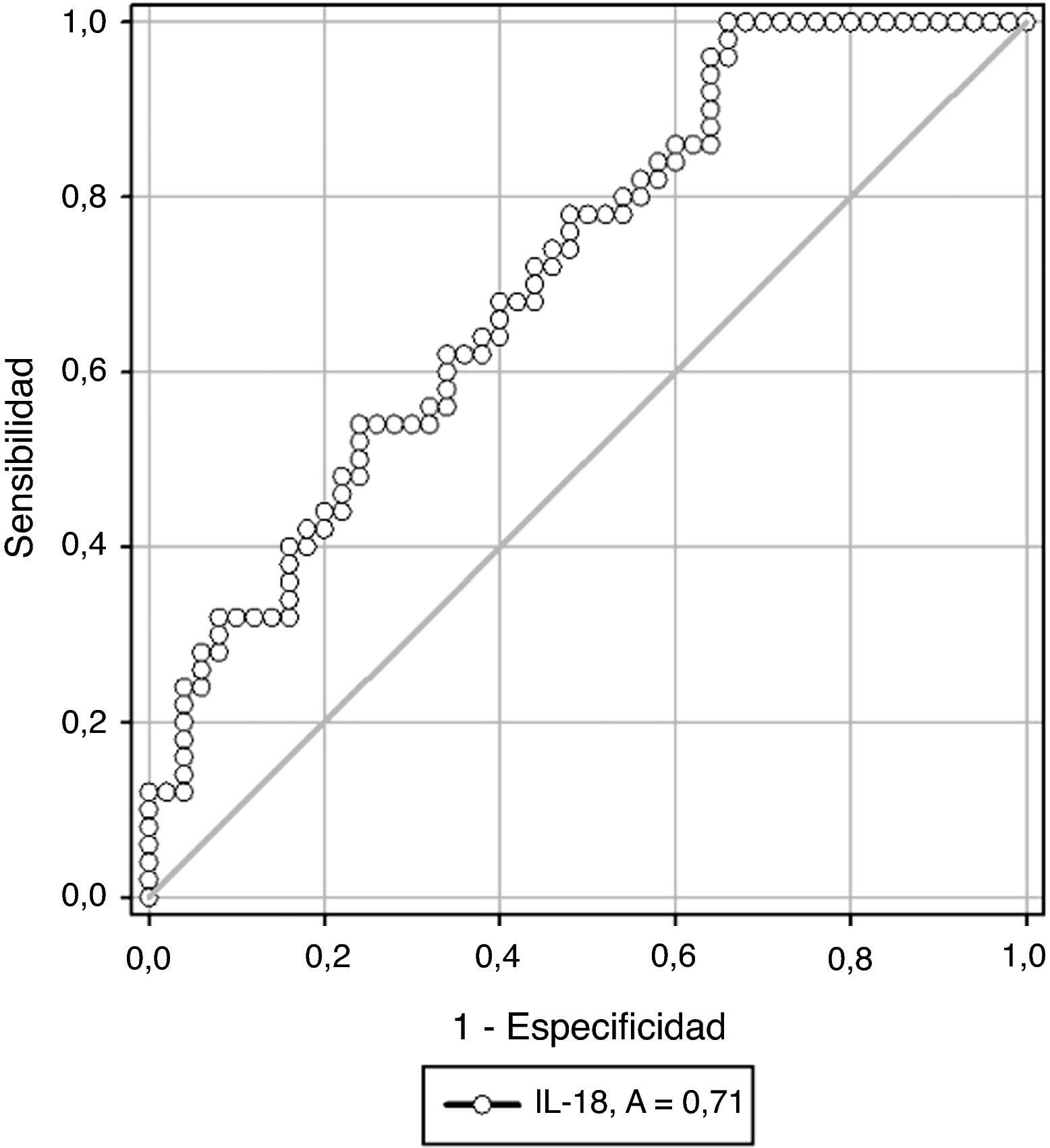
En la figura 1 se muestra la curva operador-receptor para la precisión de la IL-18 para el diagnóstico de preeclampsia. Un valor de corte de 34 pg/ml presentó un valor por debajo de la curva de 0,71 y tiene una sensibilidad del 61,0% (intervalo de confianza [IC] del 95%, 48,5-73,4), una especificidad del 65,8% (IC del 95%, 51,3-80,3), un valor predictivo positivo del 72,0% (IC del 95%, 59,5-84,4) y un valor predictivo negativo del 54,0% (IC del 95%, 40,1-67,8) con una exactitud diagnóstica del 63,4%.
DiscusiónEn el presente estudio, las pacientes con preeclampsia presentaron concentraciones significativamente más altas de IL-18 en comparación con embarazadas normotensas sanas. Los hallazgos de esta investigación suministran evidencia que apoya la hipótesis de una respuesta inflamatoria excesiva e implica que la IL-18 puede jugar un papel en la preeclampsia12–15.
La IL-18 es una citoquina clave, la cual regula el balance Th1/Th2, ya que sola puede inducir la inmunidad Th2 y actúa sinergísticamente con la IL-12 para promover el desarrollo de la inmunidad Th116. Se han descrito las funciones de la IL-18 en numerosas enfermedades inflamatorias incluyendo artritis reumatoide, diabetes mellitus no insulinodependiente y enfermedades pulmonares17.
Al igual que los resultados en la presente investigación, Huang et al.14 reportaron elevación de las concentraciones séricas de IL-18 en pacientes con preeclampsia. También encontraron altas concentraciones en la placenta, lo cual puede contribuir a la elevación de las concentraciones séricas. Seol et al.18 también reportaron un aumento en las concentraciones de IL-18 en las pacientes con preeclampsia al compararlas con embarazadas normotensas. Sin embargo, estos investigadores no encontraron diferencias en las concentraciones entre los pacientes con diferentes grados de proteinuria. Por otra parte, Roland et al.19 reportaron concentraciones de IL-18 más bajas en las preeclámpticas que en los controles, mientras que Adams et al.15 encontraron concentraciones más bajas en las preeclámpticas que en los controles, pero después de excluir a las pacientes que recibieron hidralazina o dexametasona, las concentraciones en las preeclámpticas fueron similares a las de los controles. Sin embargo, los autores no reportaron si las concentraciones de IL-18 eran diferentes entre las preeclámpticas que recibieron esteroides y aquellas que no, y la dosis y duración del tratamiento. El incremento en las concentraciones apoya la propuesta de una respuesta inflamatoria excesiva en el embarazoy sus complicaciones12,13,15.
En la preeclampsia se produce un cambio en la secreción de citoquinas, observándose un aumento de la producción de IL-12 e IL-18, produciendo un perfil predominante de inmunidad Th1, pero también se puede estimular la inmunidad Th2 en ausencia de IL-1216. Las producciones de factor de necrosis tumoral alfa, interferón gamma y factor estimulante de colonias granulocitos-macrófagos están igualmente aumentadas en respuesta al incremento de estas dos interleucinas20–22. Estas citoquinas probablemente contribuyen a la inflamación y disfunción endotelial excesiva observada en la preeclampsia.
Diferentes investigaciones indican que la IL-18 se expresa en sitios de inflamación crónica, ya que regula en forma positiva la ciclooxigenasa 2, la sintetasa inducible de óxido nítrico y las moléculas de adhesión20,21. Se ha propuesto que la respuesta inflamatoria intravascular excesiva es la causa de las manifestaciones clínicas de la preeclampsia4, por lo que la elevación de la secreción de la IL-18 en la preeclampsia podría contribuir a la respuesta inflamatoria.
La IL-18 puede actuar directa y/o indirectamente en el inicio y desarrollo de las enfermedades cardiovasculares. Potencia la expresión de proteína 1 quimioatrayente de monocitos y también incrementa la expresión de moléculas de adhesión como la molécula 1 de adhesión intercelular y la molécula 1 de adhesión celular vascular por las células endoteliales23,24, lo cual puede facilitar la entrada de células inflamatorias. Por otra parte, la IL-18 por sí misma tiene el potencial de inducir la expresión de quimiocinas y moléculas de adhesión en forma independiente25. También se ha reportado que la expresión de los genes de la IL-18 puede ser inducida por otras citoquinas proinflamatorias y por lipopolisacáridos16.
Las diferencias en las concentraciones de IL-18 de esta investigación con respecto a otras previas pueden ser explicadas por los diferentes reactivos utilizados, el uso de algún medicamento en otros estudios y las diferencias en las poblaciones estudiadas. De forma adicional no se puede excluir algún problema en la selección de las pacientes. Esto último se trató de limitar seleccionando pacientes primigestas que no recibieron tratamiento previo. Sin embargo, se debe considerar que el tamaño de la muestra de esta investigación es pequeño.
Las elevaciones en las concentraciones de IL-18 son posiblemente debidas a la activación de los monocitos y los macrófagos como resultado de una respuesta materna exagerada a los restos placentarios. Esta, junto con otras citoquinas proinflamatorias, formas reactivas de oxígeno y enzimas liberadas por células activadas, podrían estar entre los mediadores que llevan a la disfunción endotelial y, por lo tanto, pudieran estar asociadas con la patogénesis de la preeclampsia14.
Se concluye que las preeclámpticas presentaron concentraciones significativamente más altas de IL-18 al compararlas con embarazadas normotensas sanas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.