Los Talleres de Histocompatibilidad, Español primeramente e Ibérico posteriormente, tienen una trayectoria amplia y tradicional desde hace muchos años, así como los Talleres Internacionales1-3. Estos han permitido la estandarización y el control de calidad en los diferentes laboratorios, cuando los programas de calidad actuales eran solo un rudimento. Hoy en día, tras la implementación del programa de Garantía Externa de Calidad para Laboratorios de Inmunología Diagnóstica (GECLID) como programa de calidad diagnóstica en Inmunología, amparado por la Sociedad Española de Inmunología, los Talleres funcionan más como una intercomparación de resultados y métodos entre laboratorios con metodologías distintas, cuyo resultado no es el cumplimiento de unas normas más o menos estrictas, sino como un foro de discusión y análisis.
El Taller Ibérico de Histocompatibilidad del año 2012 ha constado de 2 componentes principales: un primer componente de asignación e identificación de alelos HLA que proseguía abierto desde el año pasado y dirigido por Antonio Balas del Centro de Transfusión de Madrid y un segundo componente de estandarización de resultados mediante tecnología Luminex® o ensayo en fase sólida y dirigido por Manuel Muro del Hospital Universitario Virgen de la Arrixaca de Murcia y Alberto Torio del Hospital Insular de Gran Canaria.
A partir de este punto, los resultados referenciados y comentados corresponderán al segundo componente de este Taller de Histocompatibilidad 2012.
Datos referentes a la determinación rutinaria de anticuerpos en los laboratoriosLa implementación de la tecnología Luminex® ha generado un amplio conocimiento del campo de la sensibilización HLA como nunca antes se había producido4-7 pero, al mismo tiempo, genera una serie de problemáticas y una gran necesidad de estandarización entre los diferentes laboratorios para que exista una homogeneización entre los resultados que puedan emitir 2 laboratorios distintos para una misma muestra.
En este segundo componente participaron y enviaron resultados válidos un total de 27 laboratorios de España y Portugal, los cuales se reflejan en la tabla 1.
Laboratorios participantes en el Taller de estandarización de anticuerpos
| N.° | Taller 2012: estandarización de anticuerposcoordinadores: Manuel Muro y Alberto Torio | |
| Responsables | Laboratorio | |
| 1 | Artur Paiva, Jeanette Braz | Centro du Histocompatibilade du Centro - Coimbra |
| 2 | María Azkarate | Centro Vasco de Transfusión - Galdakano |
| 3 | Juan José Gimeno | Hospital Miguel Servet - Zaragoza |
| 4 | Luis Marín | Hospital Clínico - Salamanca |
| 5 | Maria Jose Castro, Estela Paz, Raul Ruiz | Hospital 12 de Octubre - Madrid |
| 6 | Arantza Arrieta | Hospital de Cruces - Bilbao |
| 7 | Abelardo Caballero | Hospital Carlos Haya - Málaga |
| 8 | Luis Larrad/Pilar Lasierra | Hospital Clínico - Zaragoza |
| 9 | Javier Gonzalo Ocejo | Hospital Marques de Valdecilla - Santander |
| 10 | Iván Bernardo | Hospital San Pedro - Logroño |
| 11 | Antonio López/Rebeca Alonso | Hospital Central de Asturias - Oviedo |
| 12 | Antonio Garrido | Hospital Virgen de las Nieves - Granada |
| 13 | Cristina Moreno | Clinica Universitaria de Navarra - Pamplona |
| 14 | Manuel Muro | Hospital Universitario Virgen de la Arrixaca - Murcia |
| 15 | Javier Gonzalo Ocejo | Hospital Marques de Valdecilla - Santander |
| 16 | Mercedes Nocito | Hospital Clínico - Valladolid |
| 17 | Azucena González/Martorell | Hospital Clínic i Provincial - Barcelona |
| 18 | Miguel Fernández Arquero | Hospital Clínico San Carlos - Madrid |
| 19 | Alberto Torio | Hospital Insular - Las Palmas |
| 20 | José Luis Vicario | Centro de transfusión de la Comunidad de Madrid |
| 21 | Natalia Pomar/Julio Iglesias | Hospital Son Espases - Mallorca |
| 22 | Cristina González Roiz | Hospital Infanta Cristina - Badajoz |
| 23 | Francisca González Escribano/Cristina Abad | Hospital Virgen del Rocío - Sevilla |
| 24 | Andrés Franco | Complejo Hospitalario de Canarias - Tenerife |
| 25 | Antonio Nieto | Hospital Puerta del Mar - Cadiz |
| 26 | Jesús Ontañón | Hospital General - Albacete |
| 27 | Clara Alonso | Complejo Hospitalario Universitario - A Coruña |
Se enviaron, por correo electrónico, a cada laboratorio archivos output.csv de resultados de los mismos sueros problema procesados y obtenidos por los 2 laboratorios organizadores del segundo componente del Taller, de Murcia y Gran Canaria, utilizando casas comerciales diferentes. Se solicitaba que emitieran sin historia de sensibilización HLA previa los antígenos que considerarán positivos o cuáles informarían. Además de los archivos csv, se envió una encuesta con diferentes cuestiones relevantes al análisis rutinario de anticuerpos en la Península y, de las cuales, obtuvimos datos interesantes que se comentan a continuación.
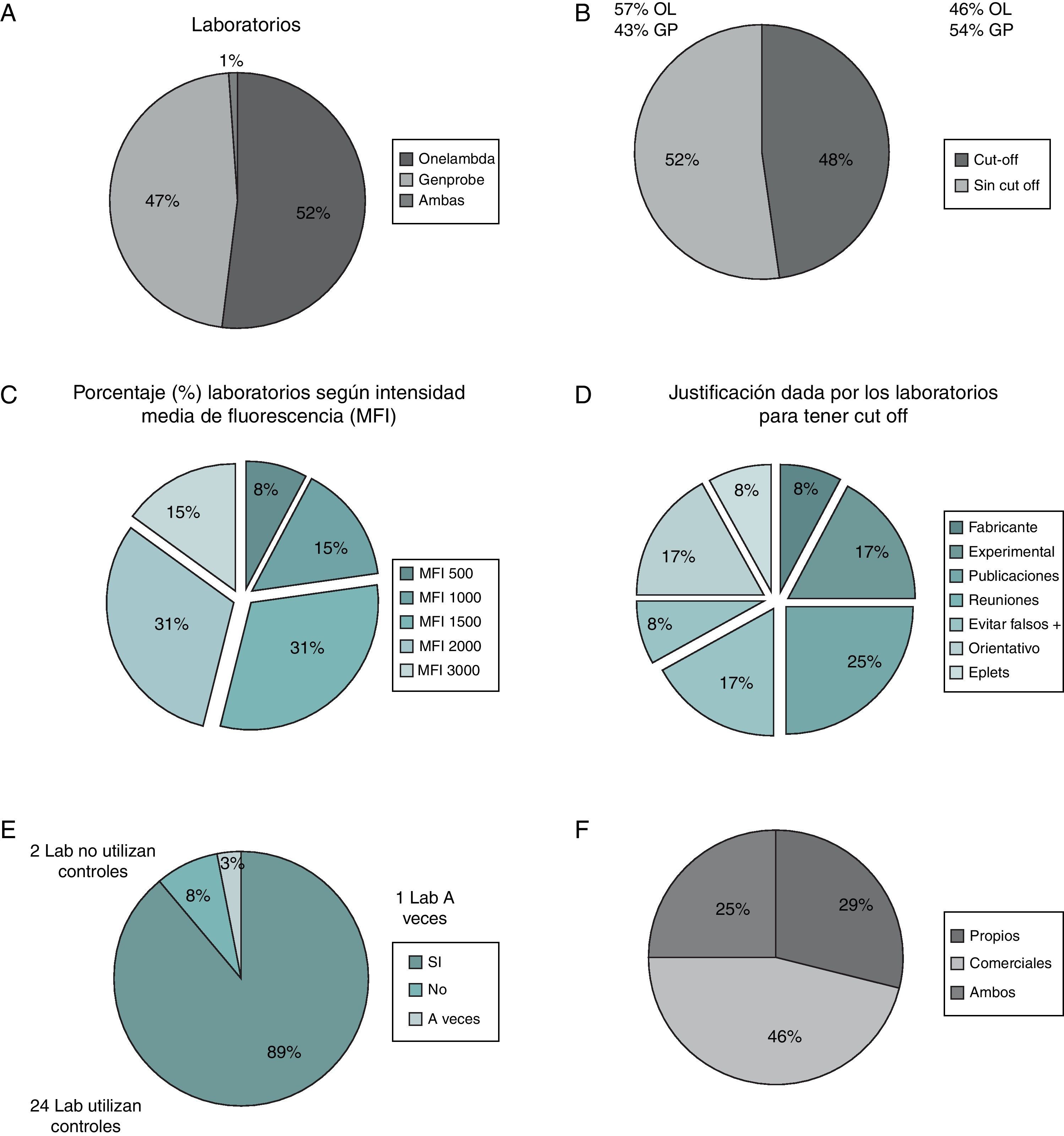
En primer lugar, de las 2 casas comerciales que distribuyen los kits obtuvimos una proporción balanceada en cuanto a la participación en este Taller de Histocompatibilidad 2012, con un 52% utilizando rutinariamente reactivos de OneLambda (OL), 47% utilizando reactivos de GenProbe (GP) y un laboratorio que utiliza las 2 casas comerciales (fig. 1A).
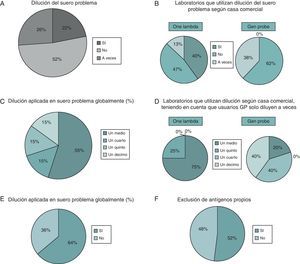
A) Proporción de laboratorios que utilizan las diferentes casas comerciales. B) Porcentaje de laboratorios que tienen un punto de corte fijado (cut-off) en la asignación de anticuerpos anti-HLA. C) Porcentajes de intensidad media de fluorescencia (MFI) de los laboratorios. D) Justificación para ese punto de corte. E) Posibilidad de utilización de controles. F) Procedencia de esos controles utilizados.
En segundo lugar, analizamos qué laboratorios tenían un punto de corte determinado (cut-off) en la asignación de especificidades anti-HLA. La mitad de laboratorios tenían un punto de corte determinado (52 sin punto de corte vs. 48% con dicho punto) (fig. 1B). El resultado respecto a la casa comercial utilizada mostró que, dentro del 52% que no tenían punto de corte, el 57% usaban OL por el 43% de usuarios GP y de los laboratorios con punto de corte el 54% usaban GP y el 46% utilizaban OL.
Analizando el porcentaje de laboratorios que tenían un cut-off o punto de corte determinado (48%), definimos qué nivel o punto de MFI (Intensidad Media de Fluorescencia) referenciaban estos laboratorios. Este punto comprendía el intervalo de MFI entre 500-3.000. En este estudio, el 31% utilizaban un punto de corte de 1.500, 31% usaban 2.000, el 15% 1.000, otro 15% usaban 3.000 y el 8% cortaban en una MFI de 500 (fig. 1C). Por lo tanto, había una preponderancia de laboratorios (62%) que utilizaban un punto de corte entre 1.500-2.000.
En cuanto a la justificación argumentada por cada laboratorio para fijar ese punto de corte concreto, el mayor porcentaje corresponde a criterios resultantes de las publicaciones en revistas científicas (25%), seguido por las reuniones de consenso y congresos (17%) y la experiencia propia de cada laboratorio en el análisis de anticuerpos anti-HLA (17%) (fig. 1D).
La siguiente cuestión planteada fue la relativa a la utilización de controles positivos y negativos en cada determinación rutinaria de anticuerpos (fig. 1E). La gran mayoría (89%) de laboratorios utilizan esos controles en cada ensayo, mientras el 8% nunca los utilizan y el 3% los utilizan a veces. La procedencia de esos controles utilizados es principalmente comercial con un 46% utilizando solo controles comerciales (fig. 1F), el 29% utilizando controles comerciales y propios del laboratorio y el 25% de laboratorios utilizando solo controles propios.
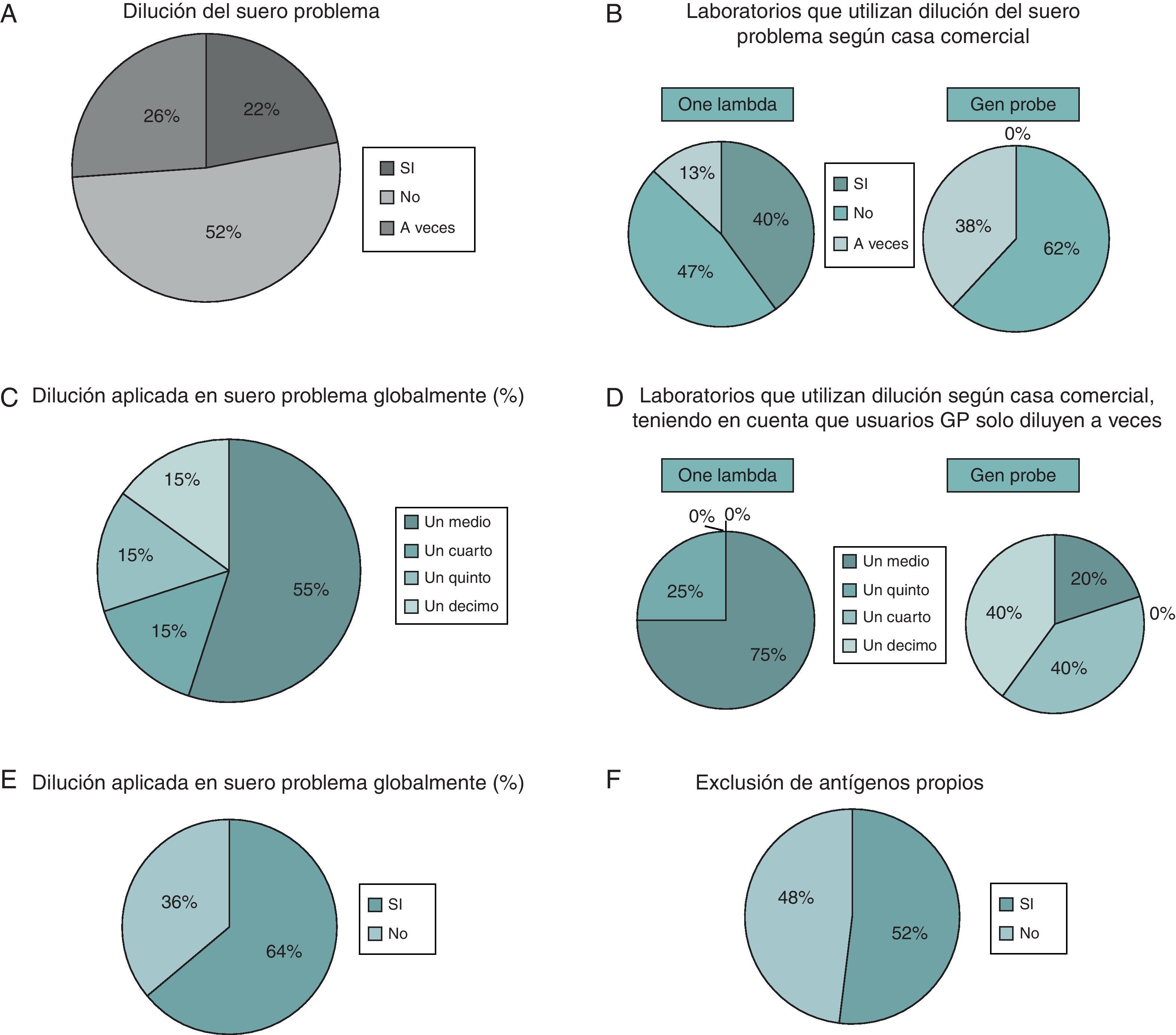
Respecto a la utilización del suero problema neto o aplicando dilución del mismo en el desarrollo de la técnica obtuvimos los siguientes datos: más de la mitad de los laboratorios usan el suero neto (52%) (fig. 2A), 22% hacen siempre dilución del suero y el 26% lo realizan a veces. Los laboratorios que diluyen el suero utilizan OL y suponen el 40% de los usuarios de esta casa comercial (fig. 2B). Los usuarios de GP no diluyen de rutina y solo diluyen a veces el 38% de estos usuarios GP.
A) Proporción de laboratorios que hacen dilución del suero. B) Laboratorios que hacen dilución según la casa comercial utilizada. C) Dilución aplicada globalmente por los laboratorios. D) Dilución aplicada por los usuarios de las diferentes casas comerciales. E) Laboratorios que realizan normalización con w6.32. F) Laboratorios que utilizan exclusión de antígenos propios.
Analizando la proporción de la dilución realizada (fig. 2C), observamos que el mayor porcentaje de laboratorios que diluían el suero (55%) usaban dilución ½, por un 15% de los laboratorios que usaban ¼, 1/5 y 1/10. Si analizábamos estos datos con respecto a los usuarios de las casas comerciales, observamos que los usuarios de OL casi siempre diluían a ½ (75%) y un menor porcentaje a 1/5 (fig. 2D), mientras que los usuarios GP que diluyen solo a veces, cuando realizan esta dilución lo hacen a mayores diluciones, ¼ (40%) y 1/10(40%), que los usuarios de OL.
La normalización con w6.32, disponible solo en los usuarios OL, es aplicada por el 64% de los laboratorios que utilizan dicha casa (fig. 2E).
Por otro lado, la mitad de los laboratorios del Taller utilizan la exclusión de antígenos propios del poseedor del suero (52 vs. 48%) (fig. 2F).
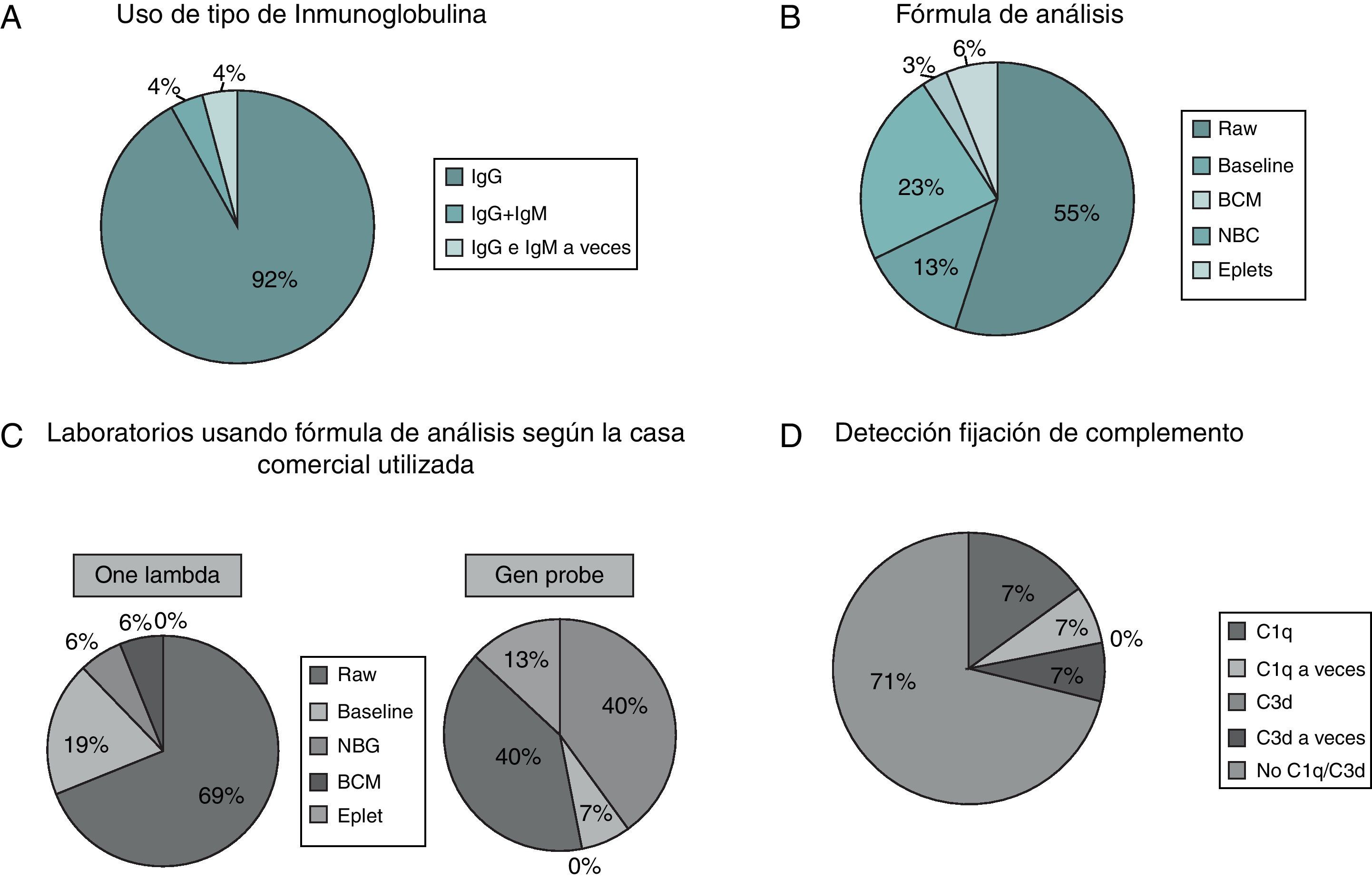
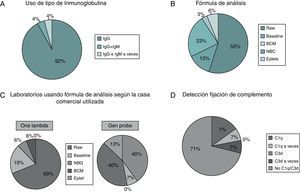
Todos los laboratorios determinan anti-IgG de forma rutinaria (fig. 3A), un laboratorio realiza, además de anti-IgG, determinación de anti-IgM rutinariamente (4%) y otro laboratorio realiza anti-IgG rutinariamente y anti-M a veces (4%).
A) Proporción de laboratorios que utilizan isotipos de inmunoglobulinas IgG y/o IgM. B) Porcentaje de laboratorios que utilizan distintas fórmulas de análisis de resultados. C) Porcentaje de laboratorios que utilizan distintas fórmulas de análisis de resultados según la casa comercial utilizada. D) Laboratorios que utilizan detección de fijación de complemento.
Con respecto a la fórmula de análisis utilizada (fig. 3B), la mayor parte de los laboratorios usan el dato neto de fluorescencia (Raw data) (55%), el 23% BCM, 13% Baseline, 6% eplets y un 3% NBG. Sin embargo, según la casa comercial utilizada, los datos fueron los siguientes: los usuarios OL mayoritariamente (69%) utilizan la fórmula Raw data y un 19% Baseline (fig. 3C). Contrariamente, en los usuarios GP se reparten por igual los laboratorios que usan Raw data y BCM, ambos con un 40%. Reseñable será también que un 13% de los usuarios GP utilizan eplets, opción disponible en el programa de análisis de esta casa comercial.
El uso de técnicas que permitan, mediante tecnología Luminex®, determinar si los anticuerpos detectados pueden o no fijar complemento, fue también analizado. Ambas casas disponen de reactivos para analizar dicha determinación (C3d en la casa GP y C1q en la casa OL). En este sentido, la mayoría de laboratorios no utilizan ninguna de estas determinaciones (71%), 15% usan C1q rutinariamente y un 7% a veces (fig. 3D). Solo un 7% usan determinación de C3d a veces, no rutinariamente.
Al diferenciar respecto a la casa comercial de la cual se trate, el 30% de los usuarios OL usa C1q rutinariamente por el 0% en GP para C3d. Ocasionalmente, C1q lo utiliza el 14% en OL y C3d el 15% de los laboratorios GP (datos no mostrados).
Datos referentes al análisis de los ficheros de sueros enviadosEn el análisis del primer suero enviado (n.°5), anti-B41 fue el único anticuerpo detectado por todos los laboratorios, independientemente de la casa comercial utilizada. Cuatro laboratorios solo detectan e informan este anticuerpo únicamente (2 laboratorios usuarios de OL y 2 laboratorios usuarios de GP), lo cual puede parecer lógico ya que estos informan un punto de corte o cut-off con una MFI mayor de 2.000 en 3 de los laboratorios y el otro informa que no tiene punto de corte definido.
Los anticuerpos anti-B41, -B42 y -B8 son dados también por todos los restantes laboratorios.
Anti-B*67:01, -B*82:01, -A*31:01, -B*50:01 y -B*13:02 en el suero 5 no fue asignado por laboratorios usuarios de GP quizás debido al bajo control positivo en el archivo enviado.
Con respecto al número de anticuerpos detectados por los laboratorios, dependiendo del punto de corte, parece guardar una buena correlación. De esta manera, los laboratorios que informan un punto de corte bajo (MFI=500) llegan a informar entre 25-27 anticuerpos, los laboratorios con punto de corte de MFI=1.000 informan 20-24 anticuerpos y los laboratorios con un punto de corte alto (MFI=3.000) informan entre 9 y 6 anticuerpos. Sin embargo, los laboratorios sin un punto de corte definido informan dicho suero, de manera similar a los laboratorios que informan con punto de corte de MFI entre 1.000-2.000, es decir, 22-25 anticuerpos.
Por otro lado, el análisis de los sueros 6 y 7 arrojó los siguientes resultados: a) anticuerpos anti-B82, -B44, -B41, -B76, -B50, -B60, -B49, -B61, -B47, -B13, -B45 y -A24 fueron informados por todos los laboratorios; b) anti-Cw6 no fue informado por laboratorios usuarios de GP; d) sin embargo, anti-Cw4 y -B78 fue informado por algunos laboratorios usuarios de GP, pero no por los usuarios OL; e) anti-B18 fue informado por 3 laboratorios con punto de corte de MFI muy bajo.
Con respecto al número de anticuerpos detectados por los laboratorios, dependiendo del punto de corte, en estos sueros no parece guardar una correlación directa. De esta manera, los laboratorios que informan un punto de corte bajo (MFI=500) llegan a informar hasta 32 anticuerpos, los laboratorios con punto de corte de MFI=1.000 informan con gran diversidad entre 11-27 anticuerpos y los laboratorios con un punto de corte alto (MFI=3.000) informan entre 12 y 20 anticuerpos. Sin embargo, los laboratorios sin un punto de corte definido informan en estos sueros hasta 27 anticuerpos diferentes.
Conclusiones del TallerLa representación entre los usuarios de las 2 casas comerciales disponibles en el mercado es aparentemente semejante. En caso de establecer un punto de corte o cut-off para la MFI (rangos entre 3.000-500), este sería más idóneo fijarlo en 1.500, siempre dependiendo de la historia de sensibilización del paciente concreto. La mayoría de laboratorios usan controles positivos y negativos, siendo estos de procedencia mayoritariamente comercial. Mayoritariamente los laboratorios no diluyen el suero problema.
Del 26% de laboratorios que diluyen el suero rutinariamente son usuarios todos de OL y además suelen hacerlo a ½. La dilución efectuada por los usuarios GP a veces es a diluciones mayores (1/4 y 1/10) que las rutinarias utilizadas por los usuarios de OL (½). Los usuarios OL suelen utilizar normalización w6.32. La mitad de los laboratorios hacen exclusión de antígenos propios del receptor. La gran mayoría de los laboratorios utilizan solo determinación de IgG. Solo un laboratorio hace rutinariamente IgM y otro a veces. Los usuarios de OL suelen usar Raw data, mientras que los usuarios de GP utilizan a partes iguales Raw data y BCM. El 71% de laboratorios no utilizan fijación de complemento C1q o C3d. El 30% de laboratorios usuarios de OL utilizan en rutina fijación de complemento C1q por el 0% de C3d en los usuarios de GP. Los diferentes antígenos/alelos informados dependen generalmente del nivel de punto de corte o cut-off empleado por cada laboratorio. Algunos laboratorios del Taller no informan los anticuerpos anti-HLA-C.
Con respecto al análisis de los sueros observamos una gran diversidad de anticuerpos informados para el suero 5, desde 27 anticuerpos en laboratorios con MFI=500 hasta 6 anticuerpos en laboratorios con MFI=3.000, pero parece guardar correlación con el punto de corte informado.
Sin embargo, observamos una gran diversidad de anticuerpos informados en los sueros 6 y 7, desde 32 anticuerpos en un laboratorio con punto de corte MFI=500 hasta 12-22 anticuerpos en laboratorios con punto de corte MFI=3.000, pero en este caso no parece guardar correlación con el nivel de MFI informado.
En este sentido, como ejemplo, el laboratorio con menos anticuerpos informados, 11 anticuerpos, tiene un punto de corte de MFI=1.000.
Recomendaciones finalesEl punto de corte de la MFI depende de la experiencia de los laboratorios pero estimamos un nivel de punto de corte definido en 1.500 como estándar. Recomendamos también la fórmula de análisis Raw, como el formato más intercambiable entre los diferentes laboratorios. Además, recomendamos informar los antígenos HLA-C ya que en la bibliografía existen casos de rechazo humoral por dichos anticuerpos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a todos los laboratorios que han podido enviar los resultados y por el tiempo empleado en los análisis, así como por las sugerencias y anotaciones de los mismos. Asimismo, agradecemos las interesantes sugerencias emitidas por los laboratorios. Este trabajo fue realizado, en parte, gracias a la ayuda del proyecto FISPI11/02686. Instituto de Salud Carlos III. Ministerio de Sanidad y Consumo.
El orden de los autores a partir del tercer autor es arbitrario y depende del envío de los resultados del Taller.