El Premio Príncipe de Asturias de Investigación Científica y Técnica 2012 fue concedido por decisión unánime del jurado al biólogo británico Gregory Winter y al patólogo estadounidense Richard A. Lerner por sus contribuciones decisivas al campo de la Inmunología y, más concretamente, por la obtención de anticuerpos de gran valor terapéutico’. El texto íntegro de la concesión puede consultarse en: http://www.fpa.es/es/premios
Desde el descubrimiento de los anticuerpos como antitoxinas por von Behring y Kitasato en sus experimentos con toxinas diftérica y tetánica hace ya más de 100 años (1890)1 hasta las terapias actuales con anticuerpos humanos, numerosos investigadores han trabajado en este campo de la Inmunología. La inmunogenicidad que inducían los antisueros de caballos empleados inicialmente para la terapia infecciosa llevaron a sustituirlos por sueros humanos procedentes de individuos vacunados o que habían superado una infección, y a restringir su uso a situaciones agudas (caso de utilización de gammaglobulinas antitetánicas o anti-Rh). Sin embargo, este tipo de terapias no eran aplicables en procesos autoinmunes o tumorales, ni tampoco se conocían las dianas terapéuticas.
Anticuerpos monoclonales: ¡el sueño de Ehrlich se hace realidad!En 1897 Paul Ehrlich introduce la histórica teoría de la «cadena lateral» para explicar la formación de los anticuerpos2. Poco después, Ehrlich escribió: «El objetivo es (...) encontrar sustancias químicas con una afinidad especial por los organismos patógenos que, como balas mágicas, vayan directas en pos de sus objetivos…»3. El sueño de la «bala mágica» cautivó la imaginación de generaciones de científicos, pero tardó casi un siglo en convertirse en realidad.
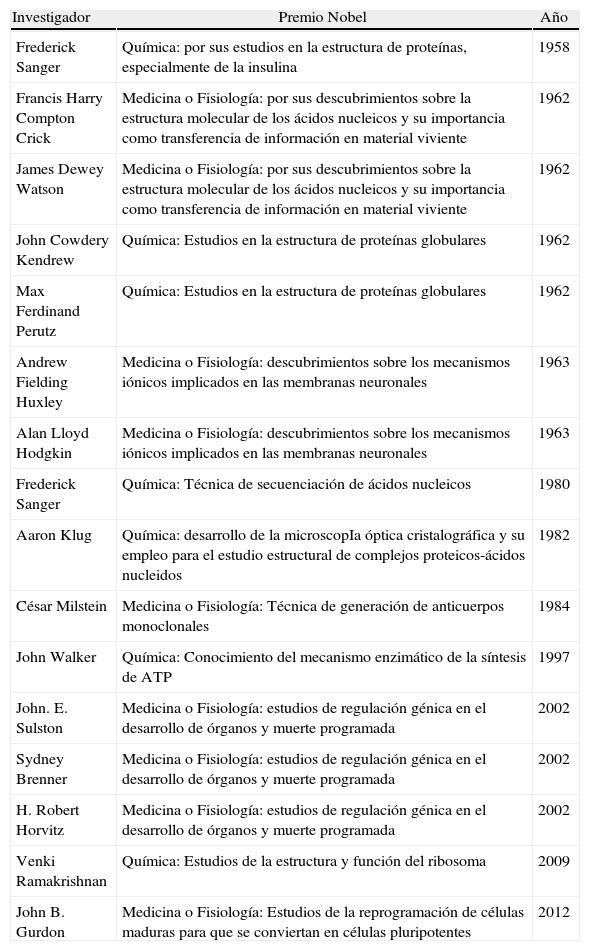
Hay contribuciones que ocurren en ambientes excepcionales, donde un grupo humano encuentra las condiciones adecuadas para desarrollar todo su talento. Una de estas situaciones aconteció en Cambridge (Reino Unido) durante la segunda mitad del siglo xx. Durante esos años, el Medical Research Council (MRC) consiguió reunir en el Laboratorio de Biología Molecular (LMB) un grupo singular de científicos (Sanger, Crick, Watson, Kendrew, Perutz, Klug, Milstein, Brenner), todos ellos ganadores del premio Nobel (tabla 1), que establecieron las bases de la Biología molecular, de la Ingeniería genética y de la moderna Inmunología. Una de las figuras más importantes de este grupo, promotor de una verdadera revolución en el campo de la Inmunología fue la del científico argentino César Milstein, que en 1975 y en colaboración con George Köhler, desarrolló la tecnología que permitió inmortalizar las células productoras de anticuerpos (hibridomas)4. El hibridoma es el resultado de la fusión de un linfocito B de un animal inmunizado con una célula de mieloma, que aporta al hibridoma la capacidad de dividirse indefinidamente. De esta forma se pueden obtener anticuerpos producidos por un clon celular (monoclonales). Estos anticuerpos monoclonales son por tanto homogéneos, específicos de epítopos individuales y se pueden producir en grandes cantidades, lo que los convierte en reactivos perfectamente estandarizados.
Investigadores que trabajaron en Cambridge (Reino Unido) y que fueron galardonados con el premio Nobel
| Investigador | Premio Nobel | Año |
| Frederick Sanger | Química: por sus estudios en la estructura de proteínas, especialmente de la insulina | 1958 |
| Francis Harry Compton Crick | Medicina o Fisiología: por sus descubrimientos sobre la estructura molecular de los ácidos nucleicos y su importancia como transferencia de información en material viviente | 1962 |
| James Dewey Watson | Medicina o Fisiología: por sus descubrimientos sobre la estructura molecular de los ácidos nucleicos y su importancia como transferencia de información en material viviente | 1962 |
| John Cowdery Kendrew | Química: Estudios en la estructura de proteínas globulares | 1962 |
| Max Ferdinand Perutz | Química: Estudios en la estructura de proteínas globulares | 1962 |
| Andrew Fielding Huxley | Medicina o Fisiología: descubrimientos sobre los mecanismos iónicos implicados en las membranas neuronales | 1963 |
| Alan Lloyd Hodgkin | Medicina o Fisiología: descubrimientos sobre los mecanismos iónicos implicados en las membranas neuronales | 1963 |
| Frederick Sanger | Química: Técnica de secuenciación de ácidos nucleicos | 1980 |
| Aaron Klug | Química: desarrollo de la microscopIa óptica cristalográfica y su empleo para el estudio estructural de complejos proteicos-ácidos nucleidos | 1982 |
| César Milstein | Medicina o Fisiología: Técnica de generación de anticuerpos monoclonales | 1984 |
| John Walker | Química: Conocimiento del mecanismo enzimático de la síntesis de ATP | 1997 |
| John. E. Sulston | Medicina o Fisiología: estudios de regulación génica en el desarrollo de órganos y muerte programada | 2002 |
| Sydney Brenner | Medicina o Fisiología: estudios de regulación génica en el desarrollo de órganos y muerte programada | 2002 |
| H. Robert Horvitz | Medicina o Fisiología: estudios de regulación génica en el desarrollo de órganos y muerte programada | 2002 |
| Venki Ramakrishnan | Química: Estudios de la estructura y función del ribosoma | 2009 |
| John B. Gurdon | Medicina o Fisiología: Estudios de la reprogramación de células maduras para que se conviertan en células pluripotentes | 2012 |
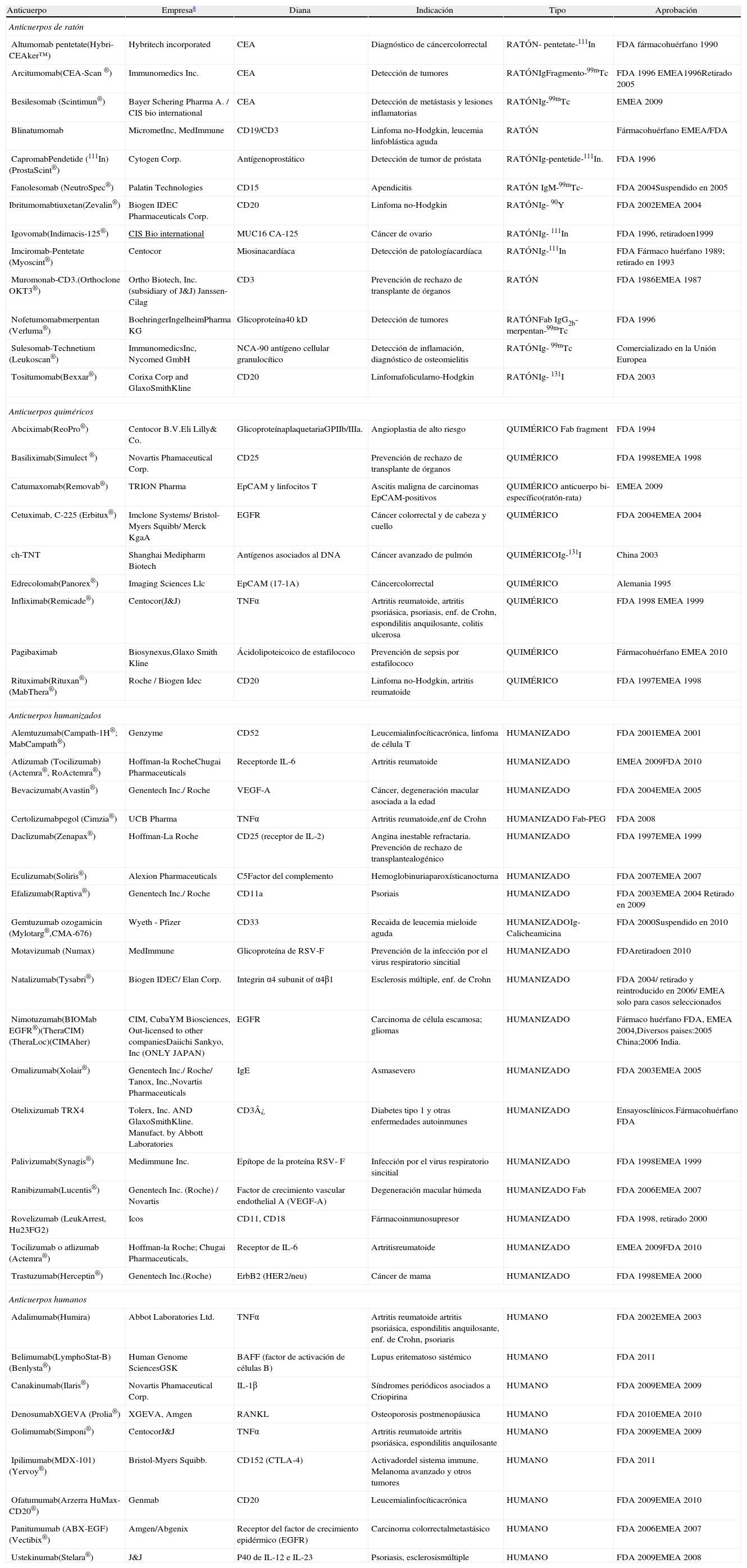
El desarrollo de la tecnología del hibridoma supuso una verdadera revolución en todos los campos de la biomedicina y en muchas otras ciencias. Desde su descripción, los anticuerpos monoclonales generados en roedores han sido ampliamente utilizados en investigación así como soporte para el desarrollo de numerosos procedimientos diagnósticos y cromatográficos. Asimismo, han contribuido a la identificación de numerosas dianas terapéuticas (factores solubles, receptores de membrana, factores de transcripción, hormonas, etc.), abriendo nuevas perspectivas en clínica humana (tabla 2). Sin embargo su aplicación terapéutica se vio limitada debido a problemas inmunológicos derivados de su origen no humano. Una proporción importante de los pacientes tratados con anticuerpos de ratón desarrollan una respuesta de anticuerpos antiinmunoglobulinas murinas (HAMA, del inglés Human Anti-Murine Antibodies)5, provocando en unos casos la pérdida de eficacia, y en otros una reacción inmune generalizada potencialmente grave. Con el objetivo de reducir las respuestas inmunológicas, se han desarrollado diversos métodos, los cuales permiten generar anticuerpos quiméricos, humanizados o completamente humanos.
Relación de anticuerpos monoclonales aprobados por las agencias reguladoras
| Anticuerpo | Empresaa | Diana | Indicación | Tipo | Aprobación |
| Anticuerpos de ratón | |||||
| Altumomab pentetate(Hybri-CEAker™) | Hybritech incorporated | CEA | Diagnóstico de cáncercolorrectal | RATÓN- pentetate-111In | FDA fármacohuérfano 1990 |
| Arcitumomab(CEA-Scan ®) | Immunomedics Inc. | CEA | Detección de tumores | RATÓNIgFragmento-99mTc | FDA 1996 EMEA1996Retirado 2005 |
| Besilesomab (Scintimun®) | Bayer Schering Pharma A. / CIS bio international | CEA | Detección de metástasis y lesiones inflamatorias | RATÓNIg-99mTc | EMEA 2009 |
| Blinatumomab | MicrometInc, MedImmune | CD19/CD3 | Linfoma no-Hodgkin, leucemia linfoblástica aguda | RATÓN | Fármacohuérfano EMEA/FDA |
| CapromabPendetide (111In) (ProstaScint®) | Cytogen Corp. | Antígenoprostático | Detección de tumor de próstata | RATÓNIg-pentetide-111In. | FDA 1996 |
| Fanolesomab (NeutroSpec®) | Palatin Technologies | CD15 | Apendicitis | RATÓN IgM-99mTc- | FDA 2004Suspendido en 2005 |
| Ibritumomabtiuxetan(Zevalin®) | Biogen IDEC Pharmaceuticals Corp. | CD20 | Linfoma no-Hodgkin | RATÓNIg- 90Y | FDA 2002EMEA 2004 |
| Igovomab(Indimacis-125®) | CIS Bio international | MUC16 CA-125 | Cáncer de ovario | RATÓNIg- 111In | FDA 1996, retiradoen1999 |
| Imciromab-Pentetate (Myoscint®) | Centocor | Miosinacardíaca | Detección de patologíacardíaca | RATÓNIg-111In | FDA Fármaco huérfano 1989; retirado en 1993 |
| Muromonab-CD3.(Orthoclone OKT3®) | Ortho Biotech, Inc. (subsidiary of J&J) Janssen-Cilag | CD3 | Prevención de rechazo de transplante de órganos | RATÓN | FDA 1986EMEA 1987 |
| Nofetumomabmerpentan (Verluma®) | BoehringerIngelheimPharma KG | Glicoproteína40 kD | Detección de tumores | RATÓNFab IgG2b- merpentan-99mTc | FDA 1996 |
| Sulesomab-Technetium (Leukoscan®) | ImmunomedicsInc, Nycomed GmbH | NCA-90 antígeno cellular granulocítico | Detección de inflamación, diagnóstico de osteomielitis | RATÓNIg- 99mTc | Comercializado en la Unión Europea |
| Tositumomab(Bexxar®) | Corixa Corp and GlaxoSmithKline | CD20 | Linfomafolicularno-Hodgkin | RATÓNIg- 131I | FDA 2003 |
| Anticuerpos quiméricos | |||||
| Abciximab(ReoPro®) | Centocor B.V.Eli Lilly& Co. | GlicoproteínaplaquetariaGPIIb/IIIa. | Angioplastia de alto riesgo | QUIMÉRICO Fab fragment | FDA 1994 |
| Basiliximab(Simulect ®) | Novartis Phamaceutical Corp. | CD25 | Prevención de rechazo de transplante de órganos | QUIMÉRICO | FDA 1998EMEA 1998 |
| Catumaxomab(Removab®) | TRION Pharma | EpCAM y linfocitos T | Ascitis maligna de carcinomas EpCAM-positivos | QUIMÉRICO anticuerpo bi-específico(ratón-rata) | EMEA 2009 |
| Cetuximab, C-225 (Erbitux®) | Imclone Systems/ Bristol-Myers Squibb/ Merck KgaA | EGFR | Cáncer colorrectal y de cabeza y cuello | QUIMÉRICO | FDA 2004EMEA 2004 |
| ch-TNT | Shanghai Medipharm Biotech | Antígenos asociados al DNA | Cáncer avanzado de pulmón | QUIMÉRICOIg-131I | China 2003 |
| Edrecolomab(Panorex®) | Imaging Sciences Llc | EpCAM (17-1A) | Cáncercolorrectal | QUIMÉRICO | Alemania 1995 |
| Infliximab(Remicade®) | Centocor(J&J) | TNFα | Artritis reumatoide, artritis psoriásica, psoriasis, enf. de Crohn, espondilitis anquilosante, colitis ulcerosa | QUIMÉRICO | FDA 1998 EMEA 1999 |
| Pagibaximab | Biosynexus,Glaxo Smith Kline | Ácidolipoteicoico de estafilococo | Prevención de sepsis por estafilococo | QUIMÉRICO | Fármacohuérfano EMEA 2010 |
| Rituximab(Rituxan®)(MabThera®) | Roche / Biogen Idec | CD20 | Linfoma no-Hodgkin, artritis reumatoide | QUIMÉRICO | FDA 1997EMEA 1998 |
| Anticuerpos humanizados | |||||
| Alemtuzumab(Campath-1H®; MabCampath®) | Genzyme | CD52 | Leucemialinfocíticacrónica, linfoma de célula T | HUMANIZADO | FDA 2001EMEA 2001 |
| Atlizumab (Tocilizumab) (Actemra®, RoActemra®) | Hoffman-la RocheChugai Pharmaceuticals | Receptorde IL-6 | Artritis reumatoide | HUMANIZADO | EMEA 2009FDA 2010 |
| Bevacizumab(Avastin®) | Genentech Inc./ Roche | VEGF-A | Cáncer, degeneración macular asociada a la edad | HUMANIZADO | FDA 2004EMEA 2005 |
| Certolizumabpegol (Cimzia®) | UCB Pharma | TNFα | Artritis reumatoide,enf de Crohn | HUMANIZADO Fab-PEG | FDA 2008 |
| Daclizumab(Zenapax®) | Hoffman-La Roche | CD25 (receptor de IL-2) | Angina inestable refractaria. Prevención de rechazo de transplantealogénico | HUMANIZADO | FDA 1997EMEA 1999 |
| Eculizumab(Soliris®) | Alexion Pharmaceuticals | C5Factor del complemento | Hemoglobinuriaparoxísticanocturna | HUMANIZADO | FDA 2007EMEA 2007 |
| Efalizumab(Raptiva®) | Genentech Inc./ Roche | CD11a | Psoriais | HUMANIZADO | FDA 2003EMEA 2004 Retirado en 2009 |
| Gemtuzumab ozogamicin (Mylotarg®,CMA-676) | Wyeth - Pfizer | CD33 | Recaida de leucemia mieloide aguda | HUMANIZADOIg-Calicheamicina | FDA 2000Suspendido en 2010 |
| Motavizumab (Numax) | MedImmune | Glicoproteína de RSV-F | Prevención de la infección por el virus respiratorio sincitial | HUMANIZADO | FDAretiradoen 2010 |
| Natalizumab(Tysabri®) | Biogen IDEC/ Elan Corp. | Integrin α4 subunit of α4β1 | Esclerosis múltiple, enf. de Crohn | HUMANIZADO | FDA 2004/ retirado y reintroducido en 2006/ EMEA solo para casos seleccionados |
| Nimotuzumab(BIOMab EGFR®)(TheraCIM)(TheraLoc)(CIMAher) | CIM, CubaYM Biosciences, Out-licensed to other companiesDaiichi Sankyo, Inc (ONLY JAPAN) | EGFR | Carcinoma de célula escamosa; gliomas | HUMANIZADO | Fármaco huérfano FDA, EMEA 2004,Diversos paises:2005 China;2006 India. |
| Omalizumab(Xolair®) | Genentech Inc./ Roche/ Tanox, Inc.,Novartis Pharmaceuticals | IgE | Asmasevero | HUMANIZADO | FDA 2003EMEA 2005 |
| Otelixizumab TRX4 | Tolerx, Inc. AND GlaxoSmithKline. Manufact. by Abbott Laboratories | CD3¿ | Diabetes tipo 1 y otras enfermedades autoinmunes | HUMANIZADO | Ensayosclínicos.Fármacohuérfano FDA |
| Palivizumab(Synagis®) | Medimmune Inc. | Epítope de la proteína RSV- F | Infección por el virus respiratorio sincitial | HUMANIZADO | FDA 1998EMEA 1999 |
| Ranibizumab(Lucentis®) | Genentech Inc. (Roche) / Novartis | Factor de crecimiento vascular endothelial A (VEGF-A) | Degeneración macular húmeda | HUMANIZADO Fab | FDA 2006EMEA 2007 |
| Rovelizumab (LeukArrest, Hu23FG2) | Icos | CD11, CD18 | Fármacoinmunosupresor | HUMANIZADO | FDA 1998, retirado 2000 |
| Tocilizumab o atlizumab (Actemra®) | Hoffman-la Roche; Chugai Pharmaceuticals, | Receptor de IL-6 | Artritisreumatoide | HUMANIZADO | EMEA 2009FDA 2010 |
| Trastuzumab(Herceptin®) | Genentech Inc.(Roche) | ErbB2 (HER2/neu) | Cáncer de mama | HUMANIZADO | FDA 1998EMEA 2000 |
| Anticuerpos humanos | |||||
| Adalimumab(Humira) | Abbot Laboratories Ltd. | TNFα | Artritis reumatoide artritis psoriásica, espondilitis anquilosante, enf. de Crohn, psoriaris | HUMANO | FDA 2002EMEA 2003 |
| Belimumab(LymphoStat-B) (Benlysta®) | Human Genome SciencesGSK | BAFF (factor de activación de células B) | Lupus eritematoso sistémico | HUMANO | FDA 2011 |
| Canakinumab(Ilaris®) | Novartis Phamaceutical Corp. | IL-1β | Síndromes periódicos asociados a Criopirina | HUMANO | FDA 2009EMEA 2009 |
| DenosumabXGEVA (Prolia®) | XGEVA, Amgen | RANKL | Osteoporosis postmenopáusica | HUMANO | FDA 2010EMEA 2010 |
| Golimumab(Simponi®) | CentocorJ&J | TNFα | Artritis reumatoide artritis psoriásica, espondilitis anquilosante | HUMANO | FDA 2009EMEA 2009 |
| Ipilimumab(MDX-101)(Yervoy®) | Bristol-Myers Squibb. | CD152 (CTLA-4) | Activadordel sistema immune. Melanoma avanzado y otros tumores | HUMANO | FDA 2011 |
| Ofatumumab(Arzerra HuMax-CD20®) | Genmab | CD20 | Leucemialinfocíticacrónica | HUMANO | FDA 2009EMEA 2010 |
| Panitumumab (ABX-EGF)(Vectibix®) | Amgen/Abgenix | Receptor del factor de crecimiento epidérmico (EGFR) | Carcinoma colorrectalmetastásico | HUMANO | FDA 2006EMEA 2007 |
| Ustekinumab(Stelara®) | J&J | P40 de IL-12 e IL-23 | Psoriasis, esclerosismúltiple | HUMANO | FDA 2009EMEA 2008 |
La comercialización de los anticuerpos por parte de las empresas puede cambiar con el tiempo. Esta tabla tiene información parcial de una más amplia. Fuente: Arruebo M, Vilaboa N, Sáez-Gutierrez B, Lambea, J, Tres A, Valladares M, et al. Assessment of the Evolution of Cancer Treatment Therapies. Cancers. 2011;3:3279-330.
El desarrollo de las técnicas de ingeniería genética propició que los anticuerpos recombinantes se convirtieran, en el último cuarto del siglo pasado, en una sólida plataforma tecnológica para producir moléculas de interés terapéutico. En 1984 el grupo de Sherie L. Morrison desarrolló los anticuerpos quiméricos, unas moléculas artificiales en las que las regiones variables (V) provenían de una inmunoglobulina murina, mientras que las regiones constantes (C) eran de origen humano6. Otros pioneros en obtener anticuerpos quiméricos humano-ratón fueron los investigadores Michael Neuberger y Terrence Rabbits en el LMB de Cambridge, transfiriendo secuencias V murinas en anticuerpos humanos7.
Los objetivos fundamentales de la quimerización son reducir la inmunogenicidad y potenciar las funciones efectoras de la molécula murina, manteniendo la especificidad y la afinidad del anticuerpo monoclonal original. El primer anticuerpo de este tipo autorizado por las agencias reguladoras en 1994 fue el abciximab (ReoPro®). Se trata de un fragmento de anticuerpo o Fab (del inglés fragment antigen binding) que inhibe la agregación plaquetaria al bloquear el receptor GPIIb/IIIa, por lo que está indicado en la prevención de la isquemia cardiaca postangioplastia coronaria. Ejemplos de este y otros anticuerpos quiméricos en terapia humana se muestran en la tabla 2.
Sin embargo, los anticuerpos quiméricos son todavía capaces de inducir respuestas inmunes debido al reconocimiento de epítopos situados en los dominios V murinos. Para reducir la inmunogenicidad de los anticuerpos se desarrollaron las moléculas «humanizadas» o human-like. Esta tecnología fue desarrollada en 1986 en el LMB por Sir Gregory Winter y sus colaboradores8 y consiste en el trasplante de las regiones hipervariables (HV) o determinantes de la complementariedad (CDR) de un anticuerpo murino, entre regiones de entramado humanas. A este proceso se le conoce como CDR grafting. De este modo, se genera un dominio V híbrido ratón-humano y se transfiere una especificidad de reconocimiento determinada a una molécula que es completamente humana en el resto de su secuencia. Estos anticuerpos humanizados tienen casi el 95% de su secuencia humana, por lo que su capacidad inmunogénica es mucho más baja. En el trabajo original, el grupo de Winter utilizó el anticuerpo monoclonal de ratón B1.8 que reconoce una molécula de hapteno8. Poco tiempo después, una colaboración entre los equipos de Greg Winter y Herman Waldmann establece la universalidad del procedimiento, al humanizar un anticuerpo monoclonal de rata con potencial terapéutico9. El anticuerpo CAMPATH-1 reconoce al antígeno CD52 y ha demostrado su utilidad en neoplasias hematológicas10.
Un número sustancial de regiones V procedentes de anticuerpos monoclonales murinos han sido ya humanizadas (ver tabla 2). El primer anticuerpo de este tipo autorizado por las agencias reguladoras en 1996 fue el daclizumab (Zenapax®), un anticuerpo anti-CD25 que inhibe la activación de linfocitos T y está indicado en trasplantes para la prevención del rechazo renal agudo.
Anticuerpos totalmente humanos: la revolución combinatoriaEl siguiente paso para disminuir aún más la inmunogenicidad de los anticuerpos terapeuticos fue la obtención de anticuerpos completamente humanos. La imposibilidad de obtener anticuerpos humanos mediante la tecnología del hibridoma llevó a buscar alternativas empleando técnicas de biología molecular y fagos recombinantes. En este proceso, que fue una auténtica carrera entre los grupos de Greg Winter en Cambridge (Reino Unido) y Richard A. Lerner en Estados Unidos, 1989 fue un año decisivo. En marzo, el equipo de Winter publica un trabajo donde se describe la metodología para la amplificación de regiones V de los anticuerpos mediante la reacción en cadena de la polimerasa (PCR, del inglés Polimerase Chain Reaction) con oligonucleótidos cebadores que hibridan en los extremos relativamente conservados de las regiones de entramado11. Este enfoque tremendamente exitoso ha sido la base para la construcción de repertorios (colecciones de genes) de regiones V de anticuerpos a partir de diversas fuentes: sangre, bazo, amígdalas, ganglios linfáticos, médula ósea, etc. En octubre, el grupo de Greg Winter demuestra que es posible aislar anticuerpos funcionales a partir de repertorios recombinantes de dominios V secretados empleando la bacteria Escherichia coli12.
En diciembre de ese mismo año, el grupo del Lerner demuestra que es posible construir un repertorio de fragmentos Fab empleando un sistema de bacteriófagos lisogénicos (fagos lambda), permitiendo la selección de anticuerpos funcionales sin inmunización previa y en periodos de tiempo muy cortos13. Un año más tarde, el grupo de Cambridge demuestra por primera vez que es posible fusionar repertorios de genes V con genes que codifican proteínas de la envoltura de un bacteriófago filamentoso14. Como resultado de esta combinación se producen fagos recombinantes, exponiendo cada uno de ellos una región humana V diferente en su cápside. Esta combinación representa una asociación física entre fenotipo y genotipo, de relevante importancia práctica.
Esta tecnología (phage display) ha permitido la construcción de amplios repertorios de anticuerpos distintos15 y presenta numerosas ventajas, como son que no requiere el uso de animales, o que puede utilizarse para seleccionar anticuerpos frente a cualquier diana, incluyendo sustancias muy tóxicas o compuestos muy conservados evolutivamente, que no inducirían respuesta inmune in vivo en modelos murinos. A partir de las genotecas de anticuerpos se han generado una gran variedad de anticuerpos terapéuticos totalmente humanos (tabla 2). El primer anticuerpo totalmente humano aprobado por las agencias reguladoras en el año 2002 fue el adalimumab (Humira®), dirigido frente al factor de necrosis tumoral (TNFα), indicado para el tratamiento de pacientes con artritis reumatoide, artritis psoriásica, espondilitis anquilosante y enfermedad de Crohn.
Sir Gregory Winter y César MilsteinLa figura de Greg Winter está íntimamente asociada a la de César Milstein, a quien le unía no solo el trabajar en el mismo centro, sino una afinidad temática (su trabajo en el campo de los anticuerpos), una visión enormemente práctica, y por encima de todo un enorme aprecio16. En el año 1991 ambos autores publicaron en Nature el artículo Man-made antibodies17, donde profecitaban el gran auge de las técnicas de ingeniería genética y su potencial para desarrollar anticuerpos terapéuticos sin necesidad de inmunizar animales. En el sumario (abstract) del trabajo escriben: «How readily can this approach be extended to production of ‘in vitro’ repertoires of variable domain genes, and obviate the immunization of animals?».
EmpresasSir Gregory Winter ha sido, junto con César Milstein y Michael Neuberger, uno de los grandes impulsores del uso y desarrollo de anticuerpos terapéuticos. Se involucró inicialmente en la empresa Celltech, la primera empresa biotecnológica en el Reino Unido, pero su contribución principal fue la puesta en marcha en 1989 de la compañía Cambridge Antibody Technology (CAT) junto con David Chiswell y el MRC, contando con Michael Neuberger y César Milstein como asesores científicos. El espíritu emprendedor de Winter ha sido decisivo en la puesta en marcha de nuevas iniciativas, como las empresas Domantis en el año 2000, y Bicycle Therapeutics en el año 2009. Es también asesor científico de la empresa Covagen.
ConclusiónEl legado de los 2 investigadores galardonados este año 2012 con el “Premio Príncipe de Asturias en Investigación Científica y Técnica» ha sido el contribuir de forma muy importante al uso de los anticuerpos como herramientas terapéuticas, siendo actualmente una realidad en el tratamiento de numerosas patologías como tumores, enfermedades autoinmunes, procesos degenerativos, y en la prevención del rechazo de trasplantes.
A continuación se muestran algunos de los datos biográficos más relevantes, así como sus declaraciones tras conocer la decisión del jurado.
DATOS BIOGRÁFICOS
Sir Gregory Winter(Reino Unido, 1951).
Estudió Ciencias Naturales en el Trinity College de Cambridge, Inglaterra.
Doctor en Ciencias Naturales en el Laboratorio de Biología Molecular (LMB) del Medical Research Council (MRC), Cambridge, Inglaterra.
Subdirector del LMB.
Máster del Trinity College de Cambridge (2011).
Principales logros científicos
Autor de numerosos artículos científicos y posee varias patentes.
- •
Técnicas para la generación de anticuerpos terapéuticos: humanización.
- •
Procedimientos para la construcción de genotecas de anticuerpos, su expresión en bacteria y en bacteriófagos.
- •
Impulsor de empresas tecnológicas para generar anticuerpos terapéuticos. Celltech, Cambridge Antibody Technology (1989), Domantis (2000) y Bicycle Therapeutics (2009).
Reconocimientos
Comandante del Imperio Británico.
Miembro de la Royal Society, de la Academia de Ciencias Médicas del Reino Unido, de la Australiana de Ciencias Tecnológicas e Ingeniería y de la Sueca de Ciencias de la Ingeniería.
Numerosos premios, entre ellos el Premio Louis Jeantet de Medicina (Suiza, 1989), el Emil von Behring (Alemania, 1990), el Premio Milán (Italia, 1990), el Premio Scheele de la Academia Sueca de Ciencias Farmacéuticas (1994), el Premio Internacional Rey Faisal de Medicina (Arabia Saudí, 1995), el Biochemical Society Award (Reino Unido, 2006) y el BioIndustry Award (Reino Unido, 2008).
Declaración de Sir Gregory Winter tras la concesión del Premio Príncipe de Asturias de Investigación Científica y Técnica 2012:
«Los anticuerpos terapéuticos están revolucionando el tratamiento del cáncer y de las enfermedades autoinmunes. Los primeros pasos en esta revolución fueron dados con su trabajo en el Laboratorio de Biología Molecular del MRC de Cambridge por el gran científico argentino Dr. Cesar Milstein, que me enseñó mucho sobre los anticuerpos. Me siento honrado de haber sido elegido para este premio de entre el grupo de científicos que, como César, ayudaron a convertir los anticuerpos en fármacos de uso habitual».http://www.fpa.es/es/premios-principe-de-asturias/premiados/2012-gregory-winter-y-richard-a-lerner.html?texto=declaracion
DATOS BIOGRÁFICOS
Richard Alan Lerner(Chicago, EE. UU., 1938)
- •
Estudió Medicina en Northwestern University (1956-1959) y en la Stanford University Medical School.
- •
Doctor en Medicina por la Stanford University Medical School (1964).
- •
Interno en el Palo Alto Stanford Hospital (1964-1965).
- •
Comienza su trayectoria investigadora y docente en el Departamento de Patología Experimental del Research Scripps Institute de La Jolla (California).
- •
Diversos cargos en dicha institución incluso Presidente entre 1991 y 2012.
- •
Ocupa la cátedra Lita Annenberg Hazen de Inmunoquímica del Departamento de Biología Molecular del Scripps y es miembro del Skaggs Institute de Biología Química.
Principales Logros científicos
Autor de más de 400 artículos científicos.
- •
Creación de genotecas de anticuerpos.
- •
Anticuerpos humanos sin inmunización.
- •
Anticuerpos catalíticos.
Reconocimientos
- •
Doctor honoris causa por 7 universidades de Europa y Estados Unidos.
- •
Numerosos premios, entre ellos el Premio Humboldt Research (Bonn, 1994), el Wolf de Química (Israel, 1995), el William B. Coley Award del Instituto de Investigación del Cáncer (EE.UU., 1999) y el Paul Ehrlich and Ludwig Darmstaedter Prize (Alemania, 2003).
Declaración de Richard A. Lerner tras la concesión del Premio Príncipe de Asturias de Investigación Científica y Técnica 2012:
«Es un honor aceptar este prestigioso premio junto con Sir Greg. Es un reconocimiento estupendo para el campo de la inmunoquímica y las bibliotecas combinatorias de anticuerpos y todo lo que han contribuido a la salud humana».http://www.fpa.es/es/premios-principe-de-asturias/premiados/2012-gregory-winter-y-richard-a-lerner.html?texto=declaracion