Alrededor del 30-40% de la población mundial está afectada por una o más enfermedades alérgicas. La inmunoglobulina E (IgE) fue descubierta en 1967 y reconocida como un mediador fundamental en la alergia. El omalizumab es un anticuerpo monoclonal humanizado que reconoce a la IgE como molécula diana uniéndose a su fracción constante (Fc). Por su acción es capaz de limitar el desencadenamiento de la respuesta alérgica mediada por los anticuerpos IgE. Se trata del único anticuerpo monoclonal del que se dispone en la actualidad para tratar a los pacientes con asma grave refractaria al tratamiento convencional, con excelentes resultados tanto en ensayos clínicos como en pacientes de la vida real. Otras entidades IgE mediadas como la rinitis alérgica, la poliposis nasal, las enfermedades de la vía aérea asociadas a Aspergillus fumigatus y las urticarias crónicas, han mostrado también resultados muy prometedores aunque su uso no esté actualmente autorizado en estas enfermedades. Este artículo revisa el desarrollo del omalizumab, sus mecanismos de acción y los resultados observados en estudios realizados.
Around 30-40% of the world population is affected by one or more allergic diseases. Immunoglobulin IgE (IgE) was discovered in 1967 and recognized as an essential mediator in allergy. Omalizumab is a humanized monoclonal antibody directed towards IgE as a molecular target by binding to the Fc region of circulating IgE, thus preventing IgE-mediated clinical responses. It is currently the only monoclonal antibody to treat severe refractory asthma, with excellent results in clinical trials and in real life patients. Other IgE mediated conditions, such as allergic rhinitis, nasal polyposis, airways diseases associated with Aspergillus fumigatus, and chronic urticaria, also demonstrated promised results, although they are not yet approved in routine clinical practice. This article reviews the development of omalizumab, its mechanisms of action, and results in Spain and other countries.
Se estima que alrededor del 30-40% de la población mundial está afectada por una o más enfermedades alérgicas. Estas enfermedades alteran la salud y la calidad de vida de millones de personas y consumen enormes recursos económicos destinados al cuidado de la salud1. En España, una de cada 4 personas padece algún tipo de trastorno alérgico2. El asma es una de las enfermedades crónicas de mayor prevalencia, que afecta a unos 300 millones de personas en todo el mundo. En gran parte de estos pacientes la enfermedad se puede controlar con los fármacos disponibles (glucocorticoides inhalados, broncodilatadores beta-adrenérgicos, antileucotrienos)3,4. Sin embargo, existe un grupo de pacientes que presentan un asma grave refractaria que no responde al tratamiento convencional. Son pacientes con frecuentes exacerbaciones de la enfermedad que motivan hospitalizaciones repetidas, lo cual ocasiona los mayores gastos en salud derivados del asma3. El avance en la investigación demostró que la inmunoglobulina E (IgE) ocupa un lugar fundamental en la patogenia de la enfermedad alérgica y en otras en las que el mecanismo responsable aún no se conoce bien. La IgE se constituyó así en molécula diana para el desarrollo de un anticuerpo monoclonal anti-IgE dentro de las nuevas terapias biológicas5. El objetivo de esta presentación es revisar el desarrollo y el lugar alcanzado por el omalizumab en las enfermedades mediadas por la IgE.
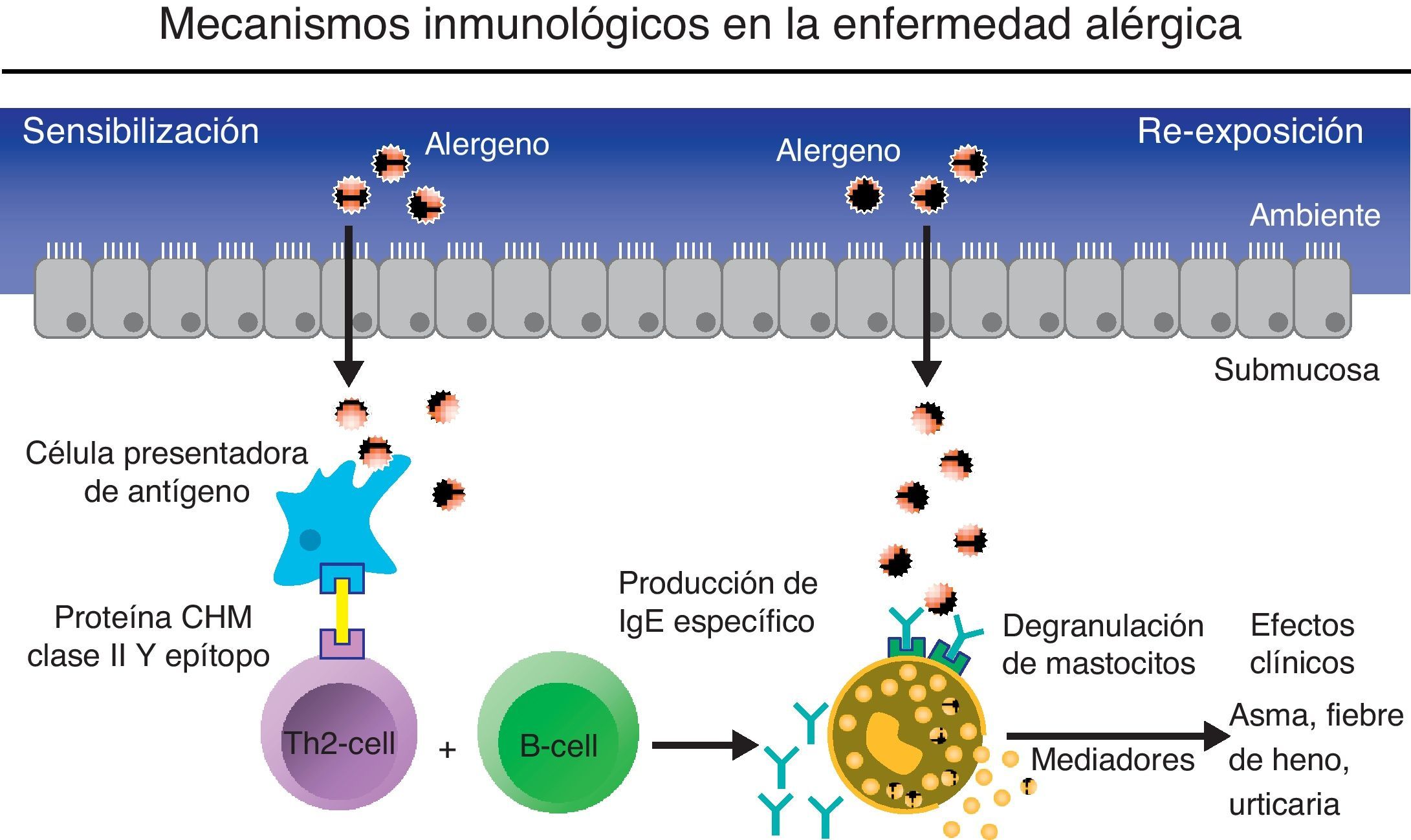
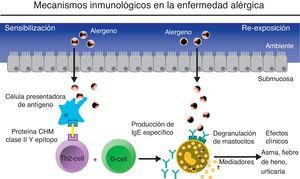
Papel de la inmunoglobulina ELa IgE fue descubierta en 1967 por Johansson6 e Ishizaka7. Las enfermedades alérgicas se definen como reacciones patológicas del sistema inmune ante sustancias inocuas a las que se expone normalmente el ser humano. Mientras que algunas sustancias involucran fundamentalmente a las reacciones de hipersensibilidad ii, iii o iv, la mayoría de las reacciones alérgicas a sustancias inhaladas o digeridas son reacciones de hipersensibilidad tipo i mediadas por la IgE (fig. 1). De estas últimas, las principales son el asma bronquial, la rinitis, la conjuntivitis, las reacciones alérgicas a ciertos alimentos o medicamentos, picaduras de algunos insectos y otras reacciones a diversas sustancias5. También, en otras entidades en las que el proceso inflamatorio alérgico no es aún bien conocido, cabe la posibilidad de que la IgE tenga un papel relevante como es el caso de la poliposis nasal (PN) o del asma llamada «intrínseca» o «no alérgica», como se verá más adelante.
Mecanismo inmunológico en la enfermedad alérgica.
El contacto inicial del individuo atópico con el alérgeno resulta en el proceso de sensibilización. El alérgeno es presentado a las células Th2 por las células presentadoras de antígenos. Las células Th2 pueden evolucionar selectivamente hacia la activación de las células B y la consiguiente producción de IgE específico al antígeno en cuestión. La reexposición al mismo antígeno produce una respuesta aguda desencadenada por una reacción cruzada al unirse el antígeno a los anticuerpos específicos unidos sobre receptores de basófilos y mastocitos. (Adaptado de imágenes cedidas por Novartis y autorizadas para publicar).
Desde su descubrimiento en 1967 hasta los años 80 las investigaciones realizadas fueron demostrando la participación de los mastocitos y los basófilos en los procesos inflamatorios asociados a respuestas alérgicas, así como el papel clave de la IgE en la sensibilización a alérgenos5. Con estos datos la búsqueda de nuevos abordajes terapéuticos capaces de neutralizar o inhibir la síntesis de la IgE parecía una propuesta lógica. A comienzos de los años 80, el Dr. Tse Wen Chang trabajó en la investigación de un anticuerpo monoclonal OKT3 que posteriormente fue aprobado por la US Food and Drug Administration (FDA) en 1986. El OKT3 (CD3) fue el primer anticuerpo terapéutico aprobado para prevenir el rechazo de órganos en el transplante de riñón8. En la primavera de 1987, padeciendo él mismo una rinitis alérgica, Tse Wen Chang se basó en su experiencia con OKT3 para diseñar la idea de desarrollar un anticuerpo anti-IgE. La concentración de IgE en pacientes alérgicos suele ser pequeña, entre 30/1.000UI/ml. Las células B que expresan IgE unidas a la membrana (mIgE) como parte del receptor de las células B también corresponden a una pequeña proporción de linfocitos, pero son esenciales para la producción de la IgE. Tanto la IgE libre como la mIgE se transformaron así en dianas terapeúticas. El diseño del anticuerpo anti-IgE debía contemplar la posibilidad de bloquear a la IgE libre en los fluidos y a la mIgE simultáneamente, pero no debía unirse a la IgE ya unida a los receptores Fc¿RI sobre basófilos o mastocitos para evitar provocar la activación de estas células. Inicialmente, el CGP51901 (anti-IgE quimérico) y el CG56901 (o TNX-901, anti-IgE humanizado) fueron desarrollados en un programa corporativo (Tanox/Novartis). Más tarde, surgió el omalizumab (o E25 anti-IgE humanizado) como producto de otro programa también corporativo (Genentech). En 1996, ambos programas (Genentech/Novartis) se combinaron y el omalizumab fue elegido para continuar su desarrollo debido a la superioridad de su proceso de manufacturación. Pasaron más de 15 años de desarrollo clínico hasta que finalmente fue aprobado por los EE. UU. en 2003 y por la Unión Europea en 2005 para el tratamiento de pacientes con asma moderada/grave de origen alérgico5. A finales del 2011, se estimaba que más de 120.000 pacientes estaban siendo tratados con omalizumab. Con el tiempo, la necesidad de buscar soluciones a otras enfermedades IgE mediadas llevó a que se probaran los efectos del fármaco con autorización por «uso compasivo» (fuera de indicación) en otras enfermedades. Los resultados obtenidos en otras enfermedades diferentes del asma han sido muy prometedores, como se comentará más adelante.
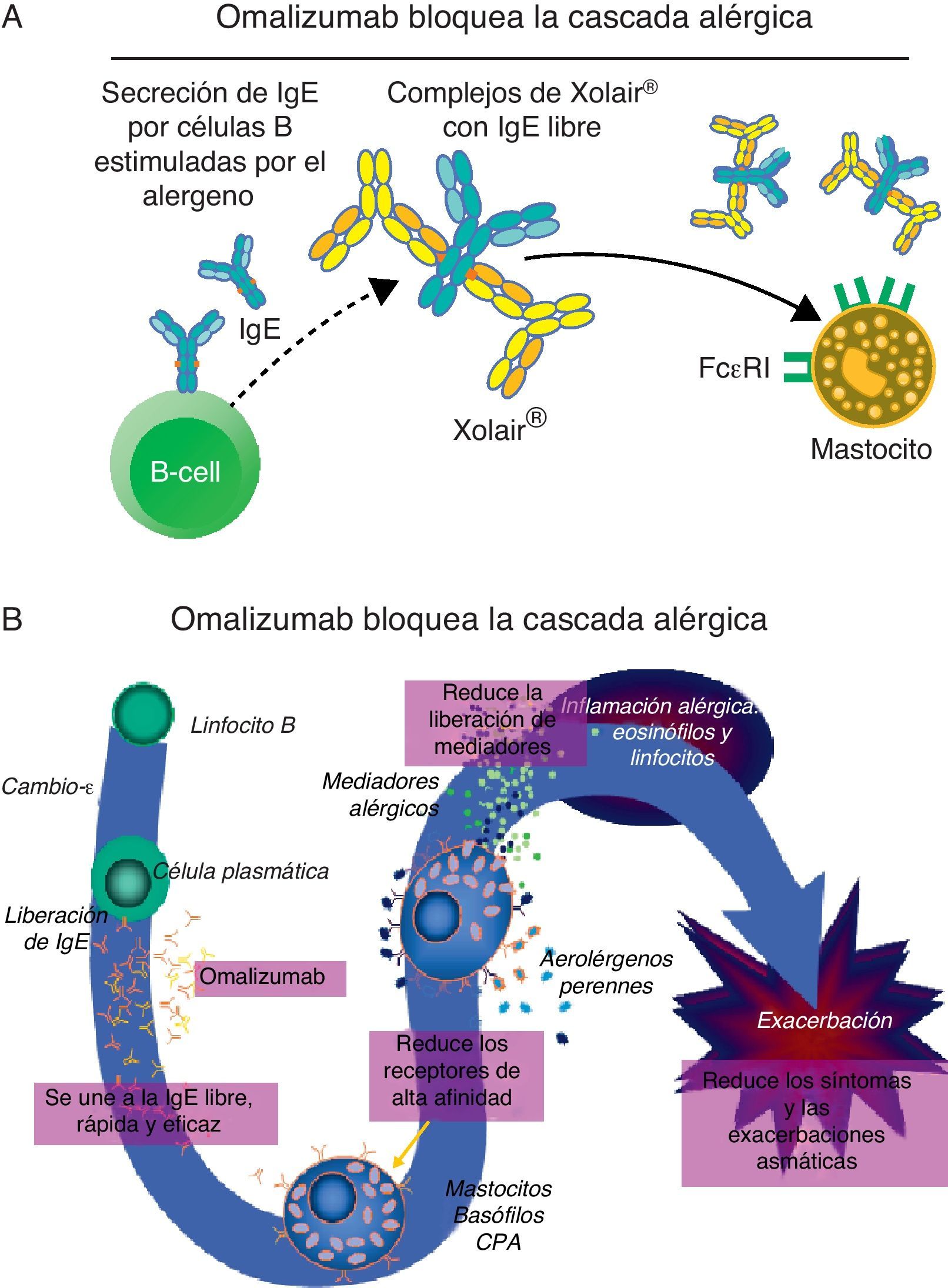
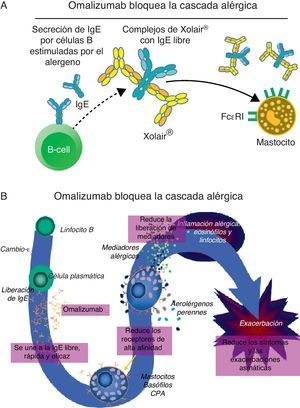
Omalizumab: características y mecanismos de acciónEl omalizumab es un anticuerpo monoclonal humanizado con un 5% de resto murino que reconoce a la IgE como molécula diana, uniéndose a su fracción constante (Fc) (fig. 2). La interacción entre el omalizumab y la IgE impide un paso fundamental en la cascada inflamatoria alérgica, limitando la unión de la IgE a los receptores de alta (Fc¿RI) y baja (Fc¿RII) afinidad, expresados sobre mastocitos, basófilos y células dendríticas. La rápida disminución de la IgE libre circulante lleva a una disminución progresiva y muy significativa de la expresión de los receptores de IgE presentes sobre las células inflamatorias. La reducción de los receptores Fc¿RI en las células dendríticas puede llevar a una disminución de su actividad como células presentadoras de antígenos a los linfocitos T «naive», lo que puede ocasionar una disminución de la diferenciación de estos linfocitos a linfocitos Th2, que a su vez puede contribuir a disminuir la producción y liberación de las citoquinas Th2 (IL-4, IL-5 e IL-13) que son responsables de la activación de los mastocitos y el reclutamiento de los eosinófilos9. Por su capacidad de regular los Fc¿RI y los complejos IgE-Fc¿RI en basófilos y mastocitos, el omalizumab también actúa como un agente estabilizador del mastocito10. La rápida supresión de la IgE en sangre precede a los efectos sobre las manifestaciones clínicas de la enfermedad. La reducción de los receptores de las células efectoras requiere más tiempo. Todo el complejo mecanismo de acción necesita alrededor de 4 meses para lograr los efectos máximos11,12. Sin embargo, en muchos pacientes la mejoría clínica se puede manifestar entre una y 2 semanas después de la primera aplicación del fármaco. Se ha propuesto que los complejos IgE/anti-IgE, si bien no pueden unirse a los receptores, sí pueden capturar alérgenos entrantes, evitando su unión a la IgE ya unida al receptor, colaborando así con el mecanismo en etapas tempranas10,13. La observación de que el omalizumab reduce la expresión del Fc¿RII y la relación confirmada entre el Fc¿RII y la producción de IgE sugieren la posibilidad de que el omalizumab reduzca la producción de IgE después de 5 años de tratamiento14. Además del concepto inicial del omalizumab como bloqueante de la IgE, el resto de los mecanismos de acción del fármaco se han ido descubriendo a medida que se han realizado los ensayos clínicos, aunque es muy posible que queden otros por conocer. Lo cierto es que los beneficios clínicos observados superaron lo esperado en el asma grave, con disminución de exacerbaciones y posiblemente prevención del remodelado bronquial, así también como la evidencia de eficacia en otras entidades IgE mediadas.
A: Al unirse a la IgE libre, el omalizumab previene la unión de la IgE a sus receptores celulares e inhibe la degranulación de mastocitos y basófilos. En este proceso, los receptores de IgE se regulan a la baja ayudando a la estabilización de mastocitos y basófilos.
B: Omalizumab interviene en la modulación del proceso inflamatorio alérgico subyacente en las fases inmediatas y tardías propias de la respuesta alérgica. (Adaptado de imágenes cedidas por Novartis y autorizadas para publicar).
El omalizumab es el único anticuerpo monoclonal anti-IgE (rhuMAb-E25) del que se dispone en la actualidad para tratar a los pacientes con asma grave refractaria al tratamiento15. Su indicación fue autorizada en España en 2006 como tratamiento adicional en pacientes con más de 6 años de edad, con asma alérgica grave persistente, que presentaban pruebas cutáneas positivas o reactividad in vitro a aeroalérgenos perennes y con función pulmonar reducida (FEV1 <80%), así como síntomas frecuentes durante el día o despertares por la noche, y que han presentado múltiples exacerbaciones asmáticas graves, a pesar de utilizar diariamente corticosteroides inhalados a dosis altas junto a un agonista beta-2 inhalado de larga duración. El rango permitido de nivel de IgE total basal es de 30 a 1.500UI/L. La dosis de omalizumab se determina según peso y nivel de IgE, entre 75 y 1.200mg cada 4 semanas16. Los ensayos clínicos mostraron que entre el 30 y el 40% de los pacientes podían no responder. Por eso un interrogante frecuente es saber cuál será el paciente asmático que se podrá beneficiar con el tratamiento. En este sentido, Bousquet et al.12 analizaron múltiples variables previas al tratamiento y demostraron que no había posibilidades de predecir cuál iba a ser el paciente «respondedor». Por lo tanto, todos aquellos con indicación deberían tener la opción de ser tratados y lograron demostrar que la única forma de conocer la respuesta al tratamiento es la llamada «evaluación global de la eficacia terapéutica» (EGET) que tiene en cuenta las exacerbaciones, la medicación rescate, la sintomatología diurna y nocturna y el grado de control del asma, y que se mide utilizando una puntuación de 0-4 (0: si hay empeoramiento; 1: si no hay cambios apreciables; 2: si hay cambios pero limitados; 3: si hay mejoría marcada; y 4: si se detecta un control completo). Los respondedores son los que alcanzan los grados 3 o 4 de la escala EGET12. Los autores concuerdan así y sugieren que todo paciente que cumple los criterios de indicación debe recibir el tratamiento por al menos 4 meses y continuarlo solo si la respuesta es satisfactoria.
La eficacia del omalizumab fue primeramente demostrada en estudios aleatorizados, doble ciego y controlados con placebo11. En esos estudios, el agregado de omalizumab reducía significativamente las exacerbaciones, las visitas a emergencias, los síntomas de asma y mejoraba la calidad de vida de los pacientes. Estos hallazgos fueron confirmados posteriormente en una evaluación conjunta de 7 estudios aleatorizados17 y 8 estudios controlados con placebo18. Sin embargo, es bien sabido que los pacientes seleccionados para un ensayo clínico solamente representan una muy pequeña proporción de pacientes «reales» de la práctica clínica habitual19. Recientemente, Holgate et al.15 y varios estudios observacionales en Europa20–24 confirmaron la utilidad y seguridad del omalizumab en condiciones de la vida real. El porcentaje de pacientes que dejaron el tratamiento fue variable de un estudio a otro, pero en todos ellos la falta de eficacia fue menor al 20%, a diferencia del 30-40% de los ensayos clínicos. Una probable explicación es que los pacientes «reales» son asmáticos más graves y menos seleccionados que los incluidos en los ensayos clínicos, aunque el efecto placebo también puede contribuir a los buenos resultados observados en los estudios abiertos.
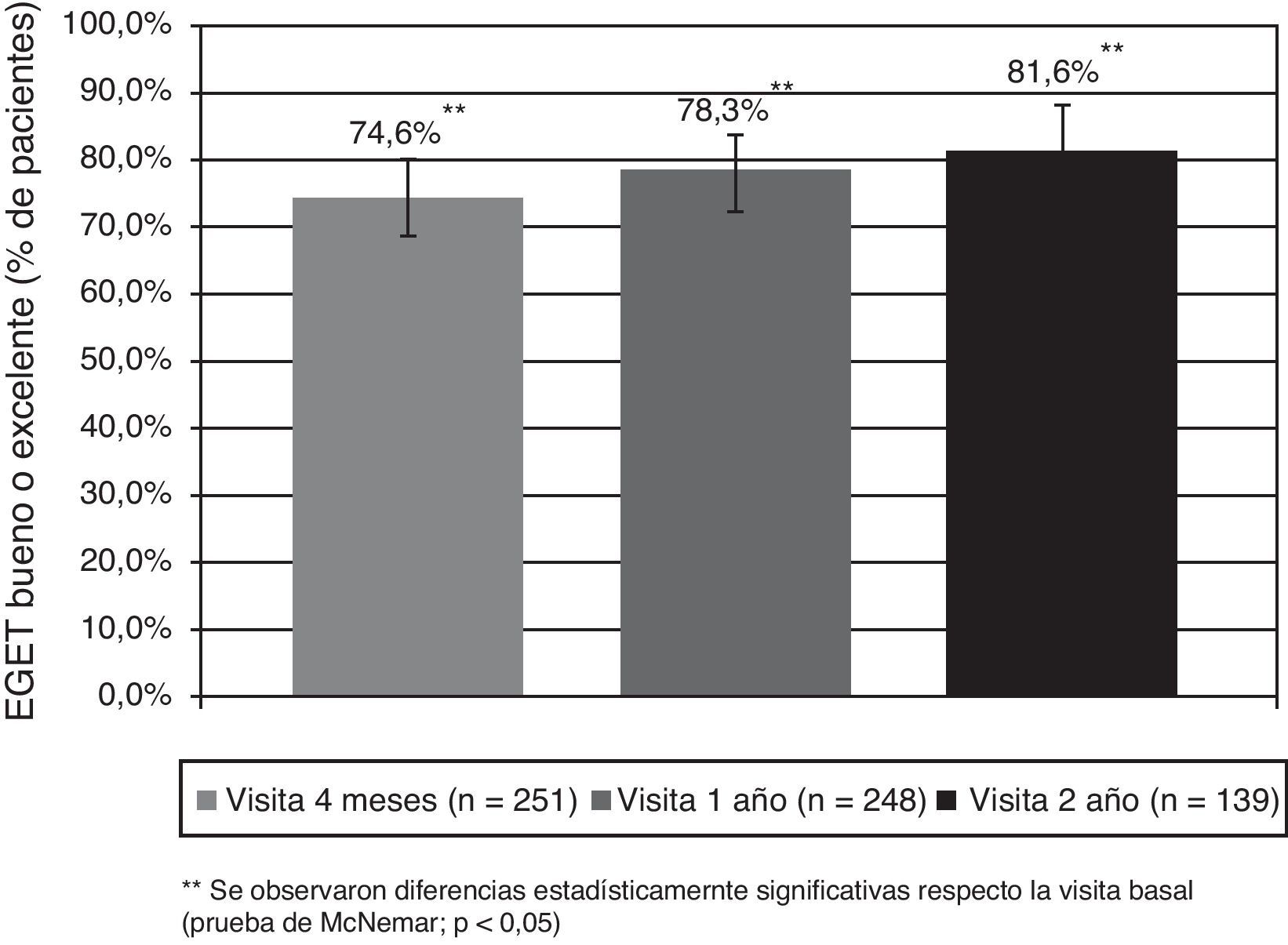
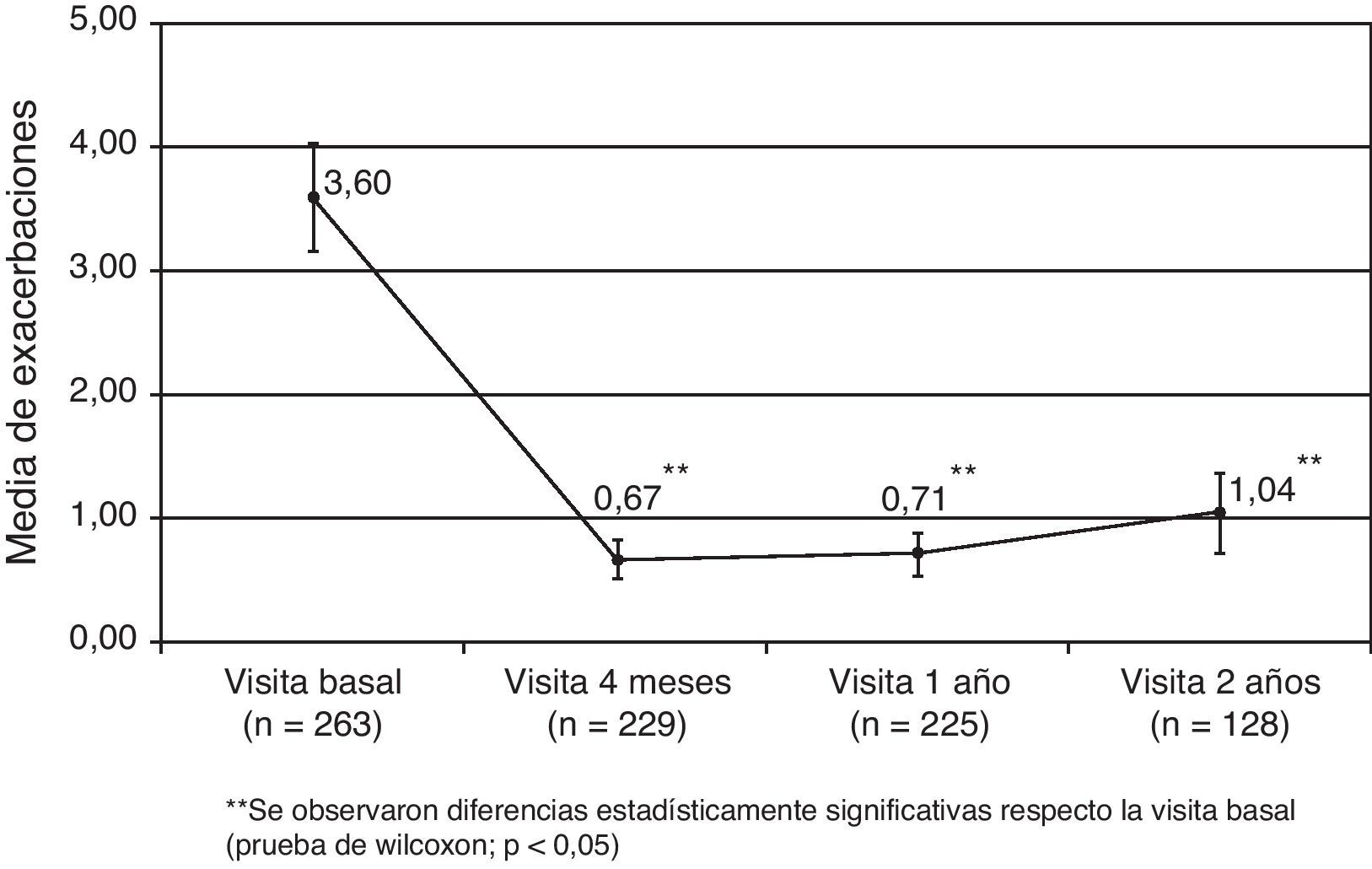
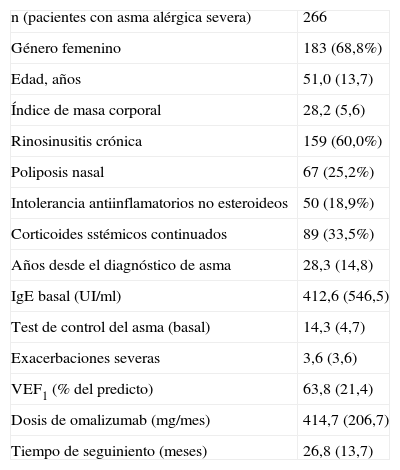
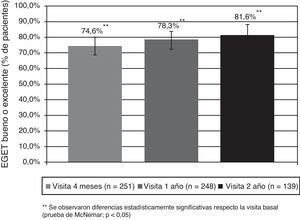
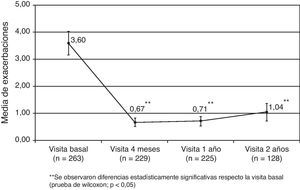
La experiencia en España con 266 pacientes reclutados entre los pacientes tratados con omalizumab en la práctica clínica habitual y con 2 años de seguimiento ha sido recientemente publicada24. Las características demográficas y clínicas basales se observan en la tabla 1. La EGET fue buena o excelente en la mayoría de los pacientes en tratamiento: 74,6% a los 4 meses, alcanzando el 81,6% de pacientes a los 2 años (fig. 3). También se demostró mejoría significativa en el test de control del asma (ACT), en la función pulmonar y en la frecuencia de exacerbaciones (fig. 4). Las dosis de glucocorticoides inhalados disminuyeron de forma significativa desde los 1.676,6 (895,7)μg a los 1.147,4 (674,4) (p<0,05) a los 2 años. De 89 pacientes que requerían glucocorticoides orales de forma continuada o intermitente para tratar las agudizaciones solo 19 los necesitaban después de 2 años de tratamiento con el omalizumab (p<0,05). No hubo diferencias en la eficacia del tratamiento entre los pacientes con IgE superior o inferior a los 700UI/ml (en el momento de la indicación el rango permitido de IgE era entre 30 y 700UI/ml). En relación con los otros estudios de la Unión Europea el estudio español fue el más prolongado. Se observó igual nivel de gravedad basal del asma de los pacientes, se objetivó igual grado de eficacia y la detención del tratamiento por falta de eficacia (10,5%) fue similar a los observados en Bélgica y Alemania.
Características clínicas y demográficas de pacientes reclutados con asma severa tratados con omalizumab
| n (pacientes con asma alérgica severa) | 266 |
| Género femenino | 183 (68,8%) |
| Edad, años | 51,0 (13,7) |
| Índice de masa corporal | 28,2 (5,6) |
| Rinosinusitis crónica | 159 (60,0%) |
| Poliposis nasal | 67 (25,2%) |
| Intolerancia antiinflamatorios no esteroideos | 50 (18,9%) |
| Corticoides sstémicos continuados | 89 (33,5%) |
| Años desde el diagnóstico de asma | 28,3 (14,8) |
| IgE basal (UI/ml) | 412,6 (546,5) |
| Test de control del asma (basal) | 14,3 (4,7) |
| Exacerbaciones severas | 3,6 (3,6) |
| VEF1 (% del predicto) | 63,8 (21,4) |
| Dosis de omalizumab (mg/mes) | 414,7 (206,7) |
| Tiempo de seguiniento (meses) | 26,8 (13,7) |
Los resultados se expresan como media con desviación estándar entre paréntesis o como porcentaje de pacientes.
El proceso inflamatorio bronquial es muy similar en el asma alérgica y no alérgica. Mientras la inflamación en la enfermedad extrínseca está claramente producida por alérgenos externos, en la enfermedad intrínseca el desencadenante permanece desconocido. En este caso, un antígeno exógeno no identificado, un agente infeccioso o un «alérgeno» endógeno podría ser el responsable de activar el mecanismo de la atopia25. El hallazgo de IgE específicas frente a enterotoxinas de Staphylococcus aureus (S. aureus) en pacientes con asma grave, intolerancia a AINEs y PN permitió especular la posibilidad de que fueran susceptibles de tener sus vías aéreas inferiores colonizadas por S. aureus, los cuales a través de la liberación de superantígenos pudieran desencadenar una respuesta inflamatoria con formación local de IgE. La policlonalidad de la IgE en estos casos permitiría que cientos de alérgenos induzcan una degranulación constante de los mastocitos, lo que contribuiría a aumentar la respuesta inflamatoria y al desarrollo del asma grave. Otros autores observaron que la IgE, por su unión a los Fc¿RI, era capaz de inducir la señalización intracelular responsable de la producción de citoquinas (IL-4, IL-6, IL-13, etc.) y estimular la activación de mastocitos por sí misma, sin necesitar para ello su unión con los alérgenos26. Por otro lado, la IgE también puede unirse directamente a los receptores de baja afinidad presentes sobre eosinófilos, neutrófilos y monocitos y activarlos26. Estos hallazgos y la falta de alternativas terapéuticas llevó al uso del omalizumab por «uso compasivo» en estos pacientes. Hasta ahora, sin embargo, solo se conocen casos aislados de pacientes con buena respuesta al tratamiento26–28 y se está a la espera de ensayos clínicos aleatorizados, doble ciego y controlados con placebo para conocer mejor la utilidad real del omalizumab en estos pacientes. En España, Pérez de Llano et al. han confirmado recientemente la eficacia de omalizumab en 29 pacientes «no atópicos» en los cuales la EGET, el ACT, el número de exacerbaciones y la función pulmonar mejoraron significativamente. No hubo diferencias estadísticamente significativas con los 266 pacientes con pruebas cutáneas positivas que habían sido tratados con el fármaco. Si bien a fecha de hoy la experiencia española es la serie más numerosa, son necesarios más estudios que confirmen estos resultados y permitan finalmente autorizar su indicación en este tipo de pacientes (datos no publicados).
Rinitis alérgicaLa rinitis alérgica es altamente prevalente en la población general. Sin ser una enfermedad grave, sus síntomas afectan a la calidad de vida del paciente y es motivo de absentismo laboral o escolar. Actualmente está todavía infradiagnosticada y la eficacia de los tratamientos actuales es limitada en un porcentaje notable de estos pacientes29. Por esta razón, se consideró que el omalizumab podría ser un fármaco indicado en algunos pacientes con rinitis alérgica. En la revisión realizada por Verbruggen et al.30, se resumen los estudios realizados. En todos ellos se observó una reducción de la IgE libre acompañada de la mejoría de los síntomas clínicos, la disminución de la medicación de rescate y la mejoría de la calidad de vida de los pacientes. Actualmente, el omalizumab no está indicado en la rinitis alérgica si no está asociada a un asma grave. La restricción en su uso se debe al hecho de que la rinitis alérgica es una enfermedad que compromete la vida de los pacientes y que afecta a un gran número de personas, por lo que su uso sin restricción no está justificado si se tiene en cuenta el coste-beneficio del tratamiento. Sin embargo, si los avances tecnológicos permitieran reducir de forma marcada el coste de la fabricación de anticuerpos monoclonales podría ser una opción terapéutica para los pacientes con rinitis alérgica grave que responden mal al tratamiento habitual.
Poliposis nasalLa poliposis nasal se puede asociar al asma bronquial con o sin atopia concomitante. En la poliposis nasal la causa del aumento de IgE en la mucosa nasal con o sin elevación de IgE sistémica no está bien establecida. La poliposis nasal suele estar asociada al asma «no alérgica» y con intolerancia a la aspirina. La mayoría de los estudios muestran que en estos pacientes predomina la inflamación eosinofílica asociada con niveles sanguíneos elevados de IgE total y de mastocitos degranulados30. El hallazgo de IgE específicas frente a enterotoxinas de S. aureus policlonal en PN con asma grave permitió evaluar la utilidad del anti-IgE en estos casos30. Penn et al.31 estudiaron 8 pacientes con asma atópico y poliposis nasal tratados con cirugía endoscópica. Cuatro de ellos recibieron tratamiento con omalizumab posterior a la cirugía y 4 fueron controles. Los resultados mostraron mejoría en los hallazgos endoscópicos del grupo tratado frente al control, comparado con el pretratamiento, y disminuyeron las recurrencias en el grupo tratado. Hasta la fecha no hay publicaciones relevantes sobre el omalizumab en poliposis nasal sin asma concomitante. En 2010, un estudio multicéntrico en España describió la evolución de los pólipos nasales de 19 pacientes tratados con omalizumab por su asma grave32, la serie más numerosa hasta ese momento. El tamaño de los PN se redujo en forma significativa en ambas cavidades nasales con respecto al inicio del tratamiento. No debió repetirse cirugía durante el tratamiento y se redujo en un 95% el uso de corticoides tópicos. La poliposis nasal no supone un riesgo vital. Sin embargo, el paciente ve comprometida su calidad de vida, recibe tratamientos prolongados con corticoides o requiere intervenciones quirúrgicas repetidas. Es posible que, como en la rinitis alérgica, el abaratamiento de costos permita considerar al omalizumab como una alternativa terapéutica futura.
Enfermedades de la vía aérea asociadas al Aspergillus fumigatusEl espectro clínico de la enfermedad de la vía aérea asociada al Aspergillus fumigatus incluye el asma con alergia al Aspergillus fumigatus, la aspergilosis broncopulmonar alérgica (ABA) y la granulomatosis broncocéntrica. Hasta ahora estos pacientes solo contaban con los glucocorticoides como tratamiento pero sus conocidos efectos adversos y a veces su poca eficacia llevaron a la búsqueda de otras alternativas terapéuticas33. Se han publicado varios casos de aspergilosis broncopulmoar alérgica tratadas con omlizumab con buenos resultados terapéuticos34–36.
En 2011 se publicó la experiencia multicéntrica realizada en España con 18 pacientes de 11 hospitales37. Los pacientes fueron seguidos durante una media de 36 (28-42) semanas28–41. En esta serie, la más larga hasta ese momento, el omalizumab se mostró eficaz para reducir los síntomas diurnos y nocturnos y las exacerbaciones al tiempo que se observó una mejoría de la función pulmonar a pesar de que el tratamiento con el anti-IgE se asoció a una reducción o detención del tratamiento con glucocorticoides orales. A pesar del éxito global hay que señalar que en 5 pacientes (3%) el tratamiento con omalizumab se suspendió por falta de eficacia.
UrticariasSe considera que la urticaria crónica tiene una base autoinmune hasta en un 45% de los pacientes. La asociación más común es la presencia de un autoanticuerpo inmunoglobulina G (IgG) dirigido a la subunidad-α del receptor de la IgE o bien a la misma IgE. Este autoanticuerpo entrecruza las subunidades-α, produciendo la degranulación de basófilos y mastocitos. Los tratamientos hasta la fecha contemplaban el uso de antihistamínicos, glucocorticoides sistémicos y ciclosporina, con los que se suele obtener resultados terapéuticos escasos, y a los que se les asocia importantes efectos adversos. Debido a que el omalizumab reduce el número de receptores Fc¿RI sobre mastocitos y basófilos se postuló su utilidad en la urticaria crónica. Kaplan et al.38 presentaron en 2008 su experiencia con 12 casos. Observaron una mejoría clínica significativa con importante reducción de la medicación de rescate y sin efectos adversos. Las guías clínicas de EAACI/GA2LEN/EDF/WAO contemplan actualmente el uso de omalizumab en la urticaria crónica refractaria al tratamiento habitual39.
En España, Ferrer et al.40 publicaron recientemente su experiencia en 9 pacientes con urticaria crónica refractaria tratados con omalizumab y autorizados por «uso compasivo». La respuesta clínica fue excelente. La dosificación fue de 300mg independientemente de la IgE basal y del peso. En estos pacientes no se detectó anticuerpo antirreceptor de la IgE ni anti-IgE.
Otras entidadesActualmente, el omalizumab se ha evaluado en otras enfermedades IgE mediadas como alergia alimentaria a diferentes alimentos, con buenos resultados, pero son aún limitadas las referencias bibliográficas. También hay presentaciones de casos clínicos con síndrome de Churg Strauss, pero los resultados son variables aunque la mayoría han sido negativos. Igual situación ocurre con la dermatitis atópica, en la que se han comunicado respuestas muy diversas.
SeguridadEl omalizumab presenta un perfil aceptable de seguridad y tolerabilidad. En una población estimada de 57.300 pacientes tratados, entre junio de 2003 y diciembre de 2006, la frecuencia de anafilaxia atribuida al omalizumab fue menor del 0,2%. No se ha demostrado mayor incidencia de neoplasias malignas que en la población general. Como medidas de seguridad, debido a que el 75% de las reacciones anafilácticas ocurrieron en las primeras 2h después de las primeras 3 inyecciones, el Grupo de Trabajo sobre Seguridad en Omalizumab determinó que la monitorización de 2h posteriores a las 3 primeras inyecciones y media h después de las subsiguientes es adecuado para cubrir el 75% de las posibilidades de reacción en un paciente41. Esta medida preventiva es muy aconsejable. Se han detectado anticuerpos contra el omalizumab en un pequeño número de pacientes en ensayos clínicos, aunque por ahora se desconoce su relevancia clínica.
ConclusionesEl conocimiento de la implicación de la IgE en las enfermedades inflamatorias alérgicas llevó al desarrollo del omalizumab, anticuerpo anti-IgE, en el marco de las nuevas biotecnologías. La introducción del omalizumab como terapia añadida en el asma grave refractaria al tratamiento convencional mostró una eficacia que superó las expectativas. Los resultados mejoraron fundamentalmente la calidad de vida de los pacientes, que hasta ese momento se veían muy limitados o impedidos para el desarrollo de una vida aceptable y no tenían esperanzas de tratamiento adecuado. Además, con el uso, se detectaron otros mecanismos de acción que eran desconocidos cuando se diseñó el desarrollo farmacológico del omalizumab.
El omalizumab es utilizado por los investigadores para estudiar los mecanismos de la alergia, contribuyendo aún más a su conocimiento. Quedan aún aspectos muy importantes por clarificar. Entre los pacientes tratados hay un grupo que no responde sin que se pueda establecer la causa. Es esencial poder conocer cuánto tiempo se deberá administrar el fármaco y si es posible detener el tratamiento sin que la enfermedad reaparezca. Sin lugar a dudas, el omalizumab representa un gran avance para el tratamiento de las enfermedades mediadas por IgE. Estudios actualmente en curso tratan de esclarecer las dudas pendientes. También es muy probable que, con la rapidez en el avance de la biotecnología, aparezca en un futuro próximo un nuevo anti-IgE que supere al actual.
Conflicto de interesesEl Dr. Picado y la Dra. Vennera han recibido aportes de Novartis para la realización de ponencias en eventos científicos.