Las evidencias apoyan la hipótesis de la existencia de las células madre del cáncer (CSC), en donde postulan que estas son responsables de la iniciación, recurrencia, metástasis, resistencia a los tratamientos contra el cáncer, y crean la necesidad de terapias que se dirijan específicamente a estas subpoblaciones de células con características de células madre dentro de la mayor parte de los tumores malignos con fenotipos celulares variados. Desde la aparición de la inmunoterapia se ha usado como un enfoque muy atractivo, debido a las muchas deficiencias de la cirugía convencional, la radioterapia y la quimioterapia en el tratamiento del cáncer. Dentro de los tumores, los subconjuntos de células transformadas neoplásicamente muestran expresión en su superficie de moléculas que no están típicamente presentes en la superficie de las células normales vecinas. En algunos casos, especialmente en melanomas malignos, los linfocitos T citotóxicos (CTL) dirigidos contra tales antígenos asociados a tumores (TAA) se han aislado para crear anticuerpos y, de alguna forma, reducir la enfermedad. El enfoque de vacuna contra el cáncer en la terapia se basa en la idea de que el sistema inmune podría montar una respuesta de rechazo a la fuerza contra el conglomerado de células transformadas neoplásicamente. Sin embargo, debido a la baja inmunogenicidad de los TAA, la baja regulación de las moléculas de MHC, la falta de expresión de una molécula adecuada coestimuladora, la secreción de citocinas inmunoinhibitorias, etc., tales expectativas rara vez se cumplen. Es por eso por lo que actualmente se buscan nuevos marcadores que sean seguros y permitan dirigir la inmunoterapia contra las CSC pero, además, la erradicación del tumor se podría lograr con la combinación de muchas terapias, para así tener un resultado eficiente en el tratamiento de esta enfermedad que afecta al mundo actualmente.
There is evidence that supports the hypothesis of the existence of cancer stem cells (CSC), in which it postulates that these are responsible for the initiation, recurrence, metástasis, and resistance to cancer treatments, thus creating a need for therapies that specifically target these subpopulations of cells with stem cell characteristics in most malignant tumors with mixed cell phenotypes. Since its advent, immunotherapy has been used as an attractive approach due to the many shortcomings of conventional surgery, radiotherapy and chemotherapy in the treatment of cancer. Within tumor subsets neoplastically transformed cells demonstrate surface expression of molecules that are not typically present on the surface of the surrounding normal cells. In some cases, especially in malignant melanoma, the cytotoxic T lymphocytes (CTL) directed against tumor associated antigens (TAA) have been isolated to raise antibodies and somehow reduce the disease. The focus of cancer vaccine therapy is based on the idea that the immune system could mount a rejection response force against conglomerate neoplastically transformed cells. However, due to the low immunogenicity of TAA, down-regulation of MHC molecules, the lack of expression of appropriate co-stimulatory molecule, cytokine secretion inmunoinhibitorias etc., they rarely met expectations. This is why new markers that are not only safe and allow immunotherapy directed against CSC are now being sought, but also tumor eradication could be achieved with the combination of many therapies in order to have an efficient outcome in the treatment of this disease currently affecting the world.
¿Por qué los cánceres no responden a los tratamientos convencionales?, ¿por qué los tumores vuelven a aparecer? ¿Por qué las células cancerosas desarrollan resistencia al tratamiento? Estas y muchas otras cuestiones planteadas pueden ser respondidas por el nuevo concepto de «células madre del cáncer»1(CSC). Las CSC se pueden definir como células que están durante el crecimiento del tumor con la capacidad de generar tumores invasivos. Estas células, al igual que las células normales, tienen la capacidad de perpetuarse para generar células maduras a través de la diferenciación. En comparación con las células madre normales, se cree que las CSC no tienen ningún control en su proliferación debido a mutaciones en ciertas rutas metabólicas. Estas CSC además están en números muy pequeños en el crecimiento del tumor1–9.
La evidencia muestra que la mayoría de los cánceres representan a la progenie de una sola o varias células madre que por mutación dan origen a varios fenotipos que, muchas veces, dificultan el diagnóstico con marcadores de manera precisa, sin embargo, queda mucho por conocer sobre de qué manera estas células tienen la capacidad de «células iniciadoras de tumor» (CIT) y cómo se reconocerían con métodos de diagnóstico convenciones10, especialmente para cáncer de mama, tumores cerebrales1,11, entre otros3–9,12–18.
La inmunoterapia es un término médico definido como «tratamiento de la enfermedad mediante la inducción, la mejora, o supresión de una respuesta inmune. La historia de la inmunoterapia del cáncer tiene una duración de más de 120 años1,11. En 1891, William B. Coley inyectó bacterias en cáncer inoperable (sarcoma óseo) y se observó la reducción del tumor3. A Coley se le reconoce como el «padre de la inmunoterapia». La inmunoterapia del cáncer se basa en la capacidad del sistema inmunitario para reconocer las células cancerosas, afectando su crecimiento y expansión. Aparte del hecho de que las células tumorales son genéticamente distintas de sus homólogas normales, deberían ser reconocidas y eliminadas por el sistema inmune. Los antígenos asociados a tumores (TAA) son a menudo poco inmunogénicos debido a la inmunomodificación. Este proceso permite al tumor evolucionar durante las continuas interacciones con el sistema inmune del huésped y, finalmente, escapar de la vigilancia inmune6–8,11,12. Los mecanismos de evasión son: la liberación de inmunosupresores como IL-6, IL-10, indolamina 2,3-dioxigenasa, factor de crecimiento transformante o factor de crecimiento endotelial vascular. Las interacciones entre el cáncer y las células del estroma crean la red de vías de inmunosupresores, mientras que la activación de la defensa inmune se inhibe. Una clave para el éxito de la inmunoterapia es superar la inmunosupresión local dentro del microambiente tumoral y activar los mecanismos que conducen a la erradicación del tumor. Hay varios enfoques clínicos de la inmunoterapia, uno de ellos es estimular la respuesta inmune con TAA, ya sea de forma no específica a través de agentes immunomoduladores, ya sea específicamente con el empleo de vacunas contra el cáncer4,15.
En este artículo se discute acerca de los antígenos específicos que poseen las CSC, que son de importancia para el tratamiento de la enfermedad con la inmunoterapia, además de sobre algunas diferencias notorias en cuanto a la expresión de determinados marcadores en algunos tipos de cáncer que pueden servir como blanco para el diseño de vacunas para la erradicación de manera no invasiva de algunos tipos de cáncer.
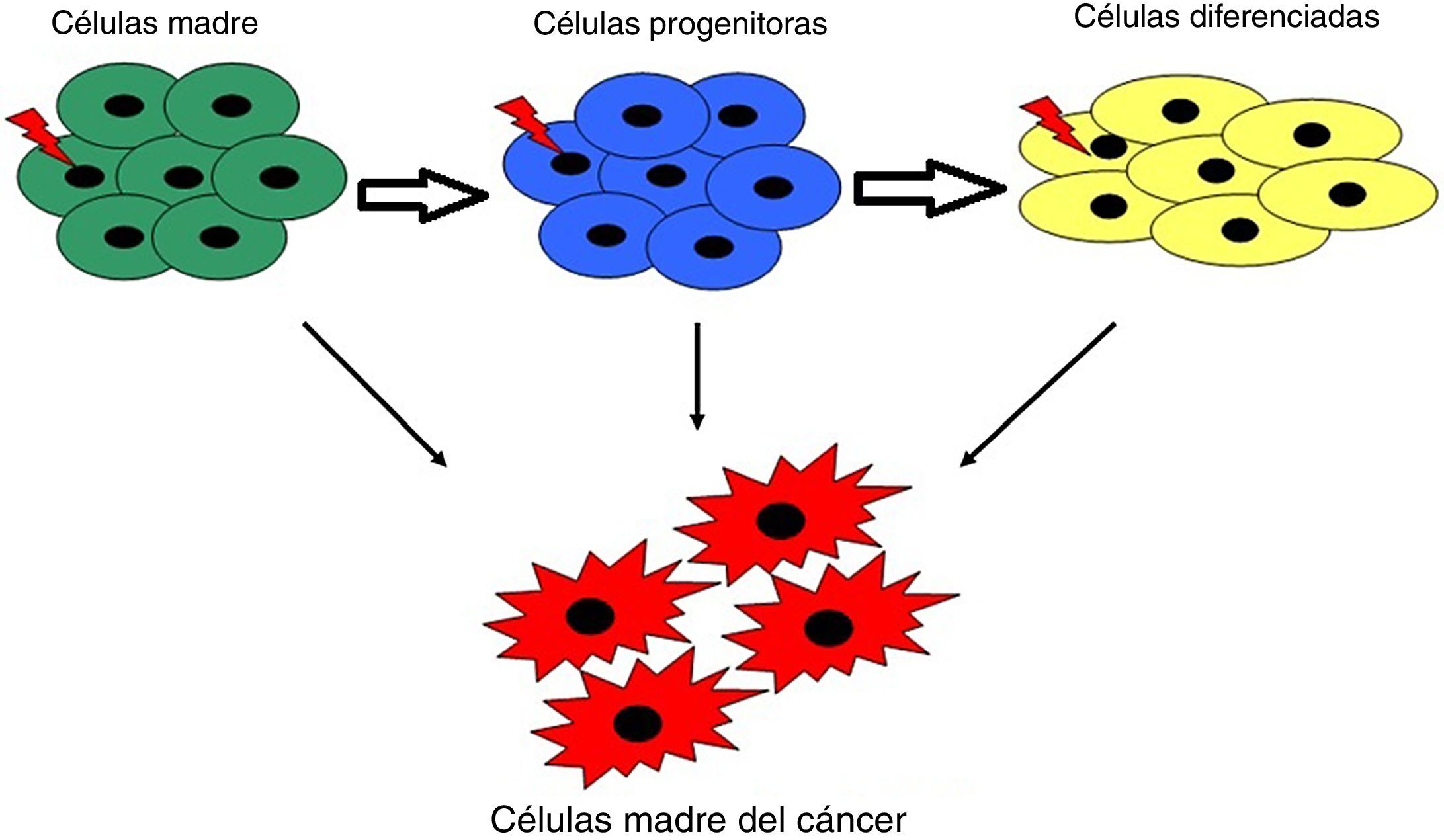
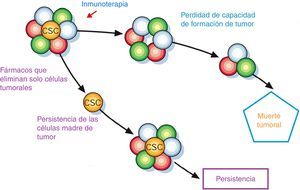
Las células madre del cáncerLas células madre son un componente integral de la fisiología normal de los mamíferos y se han estudiado intensivamente en muchos sistemas3,4. El concepto de que solo una subpoblación de CSC es la responsable del mantenimiento de la neoplasia surgió hace casi 50 años, pero se obtuvieron pruebas concluyentes de la existencia de las CSC muy recientemente (fig. 1)7,8,12–17. Un ejemplo de ello es que la focalización ineficiente de las células madre leucémicas (LSC) se considera responsable de la recaída en los pacientes después de algún tratamiento terapéutico5. Ya que las células iniciadoras de leucemia (LIC) o células madre de la leucemia (CML) forman tumores después del xenotrasplante en ratones inmunodeficientes y parecen ser poco frecuentes en la mayoría de las leucemias en humanos, debido a que estas pequeñas subpoblaciones de células pueden transferir la enfermedad en el trasplante dentro de ratones NOD/SCID, ya se han identificado marcadores que distinguen a las células de cáncer leucemógenas de las poblaciones mayoritarias de células no leucemógenas. Sin embargo, el fenotipo de las LIC es heterogéneo, es decir, variable para los diferentes tipos de leucemias mieloides agudas: células con diferente fenotipo de membrana pueden actuar como LIC en cada leucemia aguda linfoide B3,4,6. Las LIC cambian su fenotipo durante la evolución de la leucemia mieloide crónica a la crónica a la fase aguda7.
Modelo del origen de las células madre de cáncer. Las mutaciones en las células madre, células progenitoras o células diferenciadas pueden dar lugar a células madre del cáncer. El cáncer de células madre resultante ha perdido la capacidad de regular su propia división celular. Estas células representan una población rara responsable de la iniciación, el crecimiento invasivo del tumor y posiblemente la difusión en órganos distantes.
Otro punto importante es la interacción mutua y la interdependencia entre el tumor y su microambiente. Recientemente, se ha informado de que la orientación de los eventos del estroma podría mejorar las eficacias de la terapéutica actuales y prevenir la diseminación metastásica7,15. El microambiente tumoral es una «red compleja» de diferentes tipos de células, factores solubles, moléculas de señalización y los componentes de la matriz extracelular, que orquestan el destino de la progresión del tumor12,19,20. Las CSC están expuestas a factores de estrés ambientales, incluidas las especies reactivas de oxígeno (ROS), en donde, para esto, las CSC han desarrollado un sistema antioxidante para mejorar la capacidad de defensa y adquirir un fenotipo maligno8. Sin embargo, la progresión del tumor depende de la remodelación de la matriz extracelular, los fibroblastos y la activación de los macrófagos en respuesta al estrés oxidativo, así como de la transición epitelial mesenquimal (EMT), señales que inducen muchos cambios a beneficio de la progresión tumoral y la resistencia a las terapias convencionales, ya que se ha demostrado que los nichos de células secretan factores que apoyan la autorrenovación de las CSC12,19.
Por lo tanto, como punto focal para los esfuerzos terapéuticos en la leucemia, las LSC representan un área importante de investigación12, no solo para este tipo de cáncer sino también para una gran cantidad de tumores sólidos, como el melanoma, que posteriormente tienen un potencial metastásico15,21. Debido a que las LSC parecen retener muchas de las características de las células madre hematopoyéticas normales, como se evidencia por un modelo jerárquico de desarrollo, un perfil del ciclo celular principalmente en reposo y un inmunofenotipo muy similar a las células madre hematopoyéticas (HSC), es necesario comprender completamente estas características para poder dirigir anticuerpos, vacunas y otras armas de la inmunoterapia para disminuir la tasa de progresión tumoral13.
Esta hipótesis de que el cáncer es impulsado por las células iniciadoras de tumores (popularmente conocidas como CSC) ha atraído recientemente mucha atención, debido a la promesa de una diana celular novedosa para el tratamiento de tumores malignos hematopoyéticos y sólidos. Además, parece que las células iniciadoras del tumor pueden ser resistentes a muchas de las terapias convencionales contra el cáncer, lo que podría explicar las limitaciones de estos agentes en la curación de enfermedades malignas humanas. Aunque gran parte del trabajo sigue siendo necesario para identificar y caracterizar las células iniciadoras del tumor, los esfuerzos están siendo dirigidos hacia la identificación de las estrategias terapéuticas que se dirigen a estas células14.
Características específicas de las células madre del cáncer1) Solo una pequeña porción de las células tumorales en un tumor tiene potencial tumorigénico cuando se trasplantan en ratones inmunodeficientes. 2) La subpoblación de CSC se puede separar de un tumor mediante clasificación con marcadores de superficie celular distintivos según el tipo y etapa de cáncer. 3) Los tumores que resultan de células madre cancerosas contienen una combinación de células tumorigénicas y no tumorigénicas, lo que dificulta su erradicación. 4) La subpoblación de CSC puede ser trasplantada en serie a través de múltiples generaciones, mostrando que se trata de una población con capacidad de autorrenovación y 5) las CMC tienden a ser resistentes a las terapias convencionales, tales como radiación, hormonas, citocinas y quimioterapia, debido a la señalización y las diferencias de expresión de genes de resistencia de estos tipos de estrés15.
Los estudios sobre diversos tipos de cáncer, incluyendo melanoma, han indicado que solamente las células cancerosas humanas (0,1-0,0001%) forman tumores cuando se trasplantan a ratones diabéticos no obesos con inmunodeficiencia combinada severa (NOD/SCID) que tienen mutaciones en la cadena gamma del receptor de IL-2 (Il2rg(-/-)), este modelo murino se ha convertido en el más adecuado para aumentar la detección de células de melanoma tumorigénicas in vivo15.
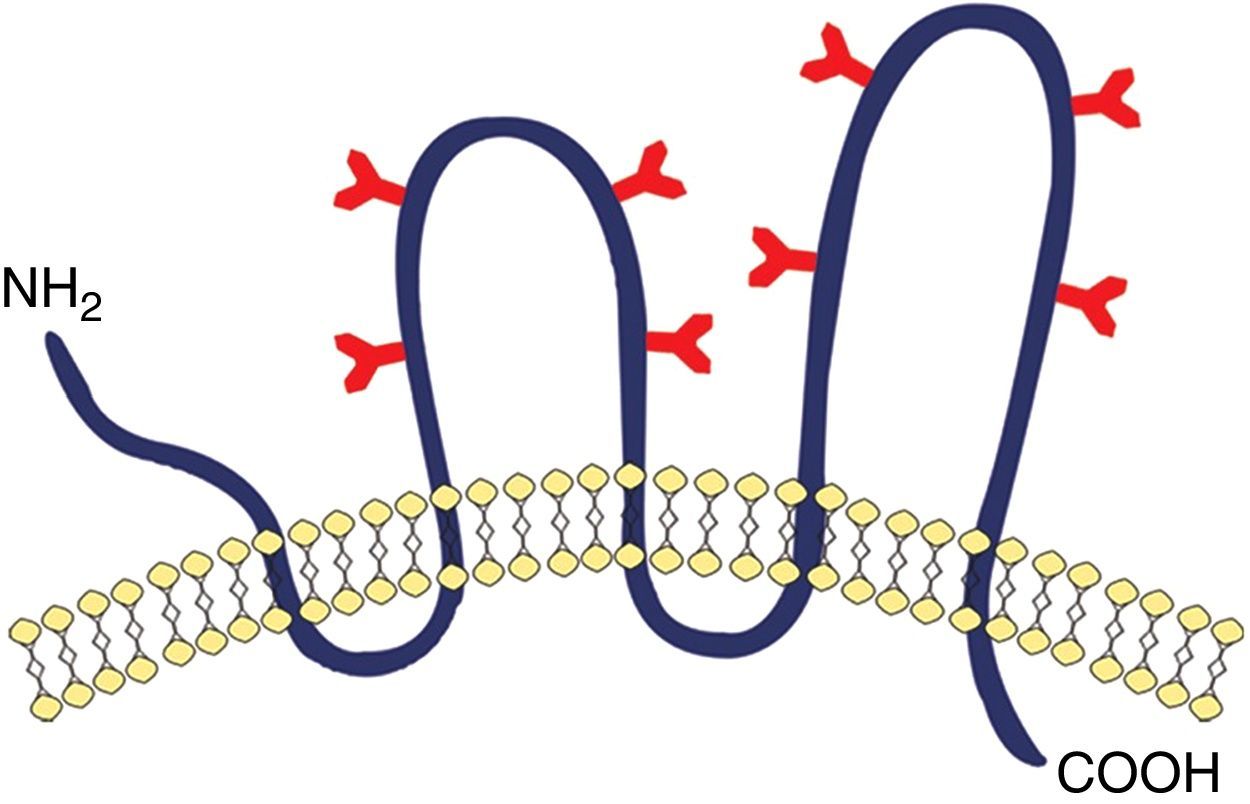
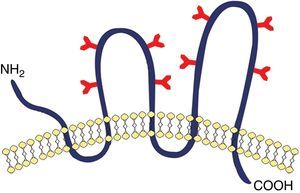
Marcadores específicos de las células madre del cáncerEn diversos tipos de cáncer se han evidenciado diferencias en los perfiles de expresión de marcadores blanco para la inmunoterapia (tabla 1). La expresión de los epítopos (determinante antigénico, es la porción de una macromolécula que es reconocida por el sistema inmunitario) de CD133 (fig. 2), AC133 y AC141, ha demostrado que definen una subpoblación de células tumorales cerebrales significativamente, junto con el aumento de capacidad para la iniciación del tumor en modelos de xenoinjerto9. Tras el descubrimiento de la población AC133/AC141+ de las células madre tumorales cerebrales, los epítopos AC133 y AC141 han sido ampliamente utilizados como marcadores para la purificación de células madre cancerosas en otros tumores sólidos. Hay, sin embargo, varios problemas asociados con el uso de los epítopos AC133 y AC141, CD133 como marcadores de células madre cancerosas, los anticuerpos utilizados habitualmente para la purificación de las células AC133 y AC141 positivas. Los epítopos pueden estar ausentes a pesar de la presencia de la proteína CD133. Además, la expresión de CD133 se ha demostrado recientemente que es modulada por los niveles de oxígeno18,22. Estos factores, en combinación con el papel biológico incierto de CD133, indican que el uso de la expresión de CD133 como marcador de células madre cancerosas se debe evaluar críticamente en cada nuevo sistema experimental y ponen de relieve la necesidad de busqueda de nuevos marcadores de superficie de CSC adicionales que esten directamente involucrados en el mantenimiento de las propiedades de las CSC17. El CD133 también es un marcador de células madre cancerosas en glioblastoma multiforme (GBM), aunque también CSC CD133− tumorigénicas han sido aisladas. Esto quiere decir que las CSC de GBM presentan diferentes fenotipos y niveles variables de expresión de CD1339,18,23 (fig. 3).
Las células madre del cáncer y sus marcadores específicos
| Tipo de cáncer | Marcador específico | Referencia |
| Leucemia mieloide aguda | CD34+ CD38− Lin−, CD123+, CD47+ | 114 |
| Cáncer de mama | CD24− CD44+ Lin−, ALDH1+ | 24,25,33,34,53 |
| Tumores cerebrales | CD133+ | 17,27 |
| Glioblastoma | SSEA−1+, A2B5+ | 9,18,99 |
| Cáncer de próstata | α2 β1hiCD133+, Lin−Sca−1+ CD49f | 27 |
| Cáncer de vejiga | ALDH1+ | 32,33,53 |
| Cáncer de pulmón | SP−C+CCA+, CD133+, ALDH1+ | 17,27,29–32 |
| Melanoma | MDR1+, ABCG5+, CD271+, JARID1B+ | 12 |
| Cáncer de colon | CD133+, Lgr5+, ALDH1+ | 9,27,33,37–39 |
| Cáncer colorrectal | CD44+ ESAhiCD166+, CD26+ | 36–38 |
| Cáncer intestinal | Lgr5+, CD133+ | 9,17–18 |
| Cáncer pancreático | CD44+CD24+ESA+, CD133+, Nestina | 25,55,70 |
| HNSCC | CD44+, ALDH1+ | 25,33,53 |
| Leucemia linfoide aguda precursora de células B | CD34+CD38+CD19+; CD34+CD38− CD19+ | 115 |
| Osteosarcoma | Oct−4+ | 116 |
| Cáncer gástrico | CD44+, Sox2, Oct3/4, NANOG | 25,59 |
| Carcinomas renales | CD105+, ALDH+ | 117 |
| Cáncer de hígado | CD90+, CD133+, EpCAM+ | 18,27,50,57 |
| Cáncer de ovario | CD44+ CD117+; CD133+ | 18 |
| Tumores endometriales | CD133+ | 9,27 |
A2B4: marcador progenitor glial; ABCG: transportador de farmacorresistencia; ALDH: aldehído deshidrogenasa; CD: cúmulo de diferenciación; hi: elevado; HNSCC: carcinoma de células escamosas de cabeza y cuello; JARID1B+: desmetilasa específica de lisina 5B o desmetilasa histona; MDR: resistencia a múltiples fármacos; SSEA: antígeno específico de etapa embrionaria.
Representación esquemática de la glucoproteína transmembrana, CD133. Un modelo de estructura de CD133 propuesto por Miraglia et al. Esta proteína tiene un extremo N-terminal extracelular, un C-terminal citoplasmático, 2 pequeños bucles ricos en cisteína citoplásmicos y 2 bucles extracelulares muy grandes cada uno de los cuales contiene 4 sitios potenciales para la glucosilación N-enlazada.
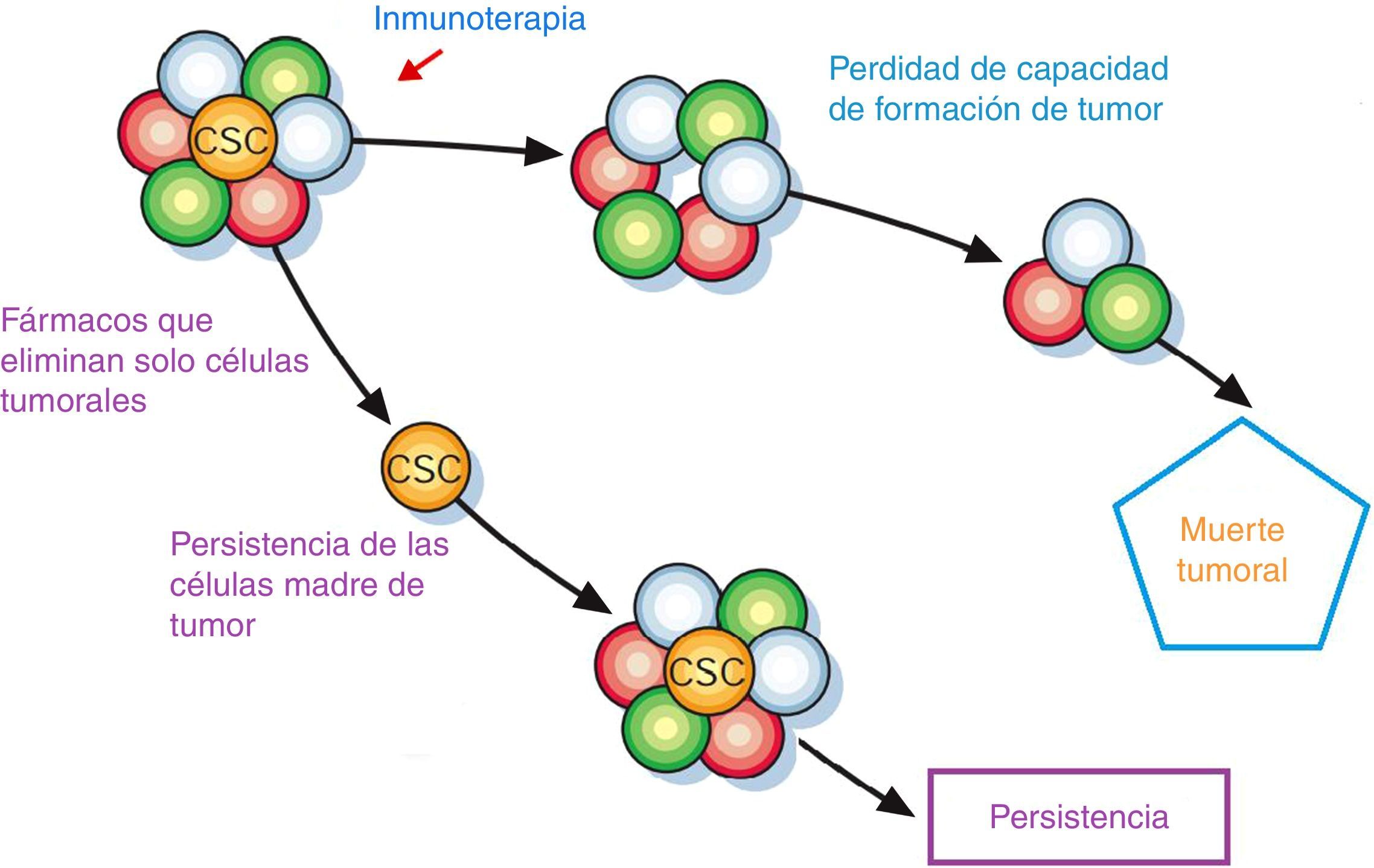
Se muestra las células madre de cáncer (CSC) que se encuentran en su «nicho», en donde proliferan y mantienen la estabilidad del tumor, independientemente de los tratamientos que se usen, pero uno de los grandes objetivos de la inmunoterapia es diseñar anticuerpos específicos hacia estas células, para así evitar la reaparición de varios tipos de cáncer.
La heterogeneidad intratumoral en el cáncer de mama está bien documentada. Aunque los mecanismos que conducen a esta heterogeneidad no se comprenden del todo, pero se sabe que una subpoblación de células cancerosas, las CSC, tienen algunas similitudes fenotípicas con las células madre de tejidos adultos. Se ha postulado que estas células madre cancerosas son inactivas y, en virtud de su baja actividad proliferativa y la capacidad para excluir las toxinas intracelulares, son resistentes a la quimioterapia y la terapia de radiación. Estas células se aislaron inicialmente sobre la base de la presencia de marcadores tales como CD44, CD24 y ALDH1, con una caracterización adicional, usando el trasplante en ratones inmunodeficientes. Pero ¿cómo es que surge el cáncer en las células madre mamarias normales?, ¿o es realmente que algunas células malignas adquieren un fenotipo de CSC a través de la evolución clonal? La evidencia muestra que las células madre cancerosas se encuentran en diferentes subtipos moleculares según el tipo de cáncer, haciendo que tengan propiedades distintas en función del subtipo. El fenotipo de CSC refleja además la plasticidad y la naturaleza dinámica de algunas células cancerosas, pero ¿cómo estas células adquieren comportamiento invasivo, ya que pasan de la EMT y luego vuelven a su fenotipo epitelial en los sitios de metástasis en respuesta a señales específicas?24. Esta interrogante es uno de los puntos clave para aplicar inmunoterapia, ya que se requiere saber específicamente qué marcadores expresan en estas transacciones para que así puedan diseñarse anticuerpos monoclonales que disminuyan la enfermedad de manera no invasiva25–32.
Pero a pesar de que el estudio de la expresión de CD44/CD24 y ALDH1 es el método más preciso para identificar CSC a partir de poblaciones de cáncer de mama, la superposición entre CSC con fenotipo CD44+ CD24(−/bajo) y ALDH1 (alta) en el cáncer de mama parece ser muy pequeño, así como su distribución entre subtipos de cáncer de mama. Los fenotipos CD44+ CD24 (−/bajo) y ALDH1+ parecen identificar las CSC con distintos niveles de diferenciación, y esto hace que el método y los biomarcadores sean de suma importancia para la identificación de las CSC de mama25.
En melanoma se ha identificado una subpoblación de células iniciadoras definidas por la expresión del mediador de quimiorresistencia ABCB5, y que una orientación específica a esta población minoritaria tumorigénica inhibe el crecimiento del tumor. En experimentos de xenotrasplante en serie de humano a ratón, las células de melanoma ABCB5+ poseen más capacidad tumorigénica que las poblaciones ABCB5−, a pesar de que en seguimientos in vivo las subpoblaciones ABCB5+ generan tanto progenie ABCB5+ y ABCB5−. El diseño de un anticuerpo monoclonal dirigido a ABCB5 muestra efectos inhibitorios contra estos tumores. Las CSC de mama expresan niveles elevados de la aldehído deshidrogenasa 1 (ALDH1) también se describen subpoblaciones CSC con ALDH1+, CD44+, CD24− en donde muestran un alto potencial tumorigénico en ratones NOD/SCID. La hipótesis de CSC para la heterogeneidad tumoral plantea 3 preguntas importantes. En primer lugar, en los estudios de expresión de genes no relacionados, los cánceres de mama se han clasificado en 5 subtipos intrínsecos: tipo luminal A, tipo luminal B, tipo basal, ErbB2/HER2− positivo y similar al norma. En segundo lugar las CSC ALDH1+ o CD44+/CD24− se originan en las células normales del mismo fenotipo o las células cancerosas diferenciadas pueden adquirir el estado ALDH1 o CD44+/CD24− debido a los eventos mutagénicos. En tercer lugar, las CSC con perfil ALDH1+, ALDH1−, CD44+/CD24− y no CD44+/CD24− difieren en su capacidad de hacer metástasis y responder a la quimioterapia26.
En otros tumores, un subconjunto único de CSC con capacidad de metástasis muestran ser CD133+ CXCR4+ (no en las células CD133+ CXCR4−). En este marco, la inhibición de la señalización CXCR4 reduce profundamente el potencial metastásico en el cáncer de páncreas sin alterar su potencial tumorigénico. Estas CSC metastásicas pueden haber evolucionado a partir del tumor primario alternativamente. La delimitación de grupos funcionalmente distintos de células madre cancerosas en última instancia requerirá un rastreo celular en los estudios in vivo, a través de modelos de ratón correspondientes a enfermedades humanas. El seguimiento de las células tumorales en la circulación también proporcionan información sobre las CSC metastásicas19. En el carcinoma hepatocelular (HCC), CD133ha llamado la atención significativa como marcador de CSC, donde también tiene implicaciones para el pronóstico27.
La expresión de 9 marcadores de CSC de tiroides (CD13, CD15, CD24, CD44, CD90, CD117, CD133, CD166, y CD326) y actividad ALDH se ha encontrado en líneas celulares (FRO, KTC1/2/3, TPC1, WRO, ACT1, y 8505C). Pero a pesar de que son muy buenos indicadores de neoplasia, no son universales del todo: otros marcadores tales como CD326 que regulan las propiedades diferentes de las CSC de tiroides pueden existir28.
Cáncer de pulmónLas células CD133 positivas actúan como iniciadoras de tumor; aumentan notablemente cuando las células, aisladas a partir de muestras de cáncer de pulmón no microcítico (NSCLC), se cultivan en forma de esferas en condiciones de cultivo no adherentes29. La expresión elevada de CD133 se asocia con la etapa, el tamaño del tumor y la diferenciación de NSCLC, además otros marcadores como el factor de transcripción de unión a octámero 4 (OCT4A), NANOG y MDR1 también se pueden encontrar30. Marcadores tales como la ESA, CXCR4, ALDH y ABCG2 se han utilizado con CD133 para el aislamiento de CSC en este tipo de cáncer31,32.
Cáncer de mamaLa expresión de CD44/CD24 y ALDH1 es el método más preciso para identificar CSC a partir de poblaciones de cáncer de mama. Sin embargo, la superposición entre CSC con fenotipo CD44+ CD24 (−/bajo) y ALDH1 (alta) en el cáncer de mama puede darse. Los fenotipos CD44+ CD24 (−/bajo) y ALDH1 (+) parecen también identificar CSC con distintos niveles de diferenciación25 y también muestran un potencial tumorigénico más alto en ratones NOD/SCID26. La evidencia reciente sugiere que la actividad de ALDH es una característica de las CSC medibles mediante el ensayo de aldeflúor. ALDH1A1 y ALDH1A3, unas de las 19 ALDH isoformas expresadas en los seres humanos, se cree que son responsables de la actividad de las CSC33. El fenotipo comúnmente encontrado en las CSC de esta tipo de cáncer es CD44+/CD24−, estas células expresan niveles elevados de factores proangiogénicos en comparación con las células CD44+/CD24+34. Aunque, anteriormente, Liu et al.35 caracterizaron a las CSC de mama por la presencia de los marcadores ESA y CD44 y la ausencia de la expresión del marcador CD24.
La transición epitelial-mesenquimal (EMT) se da por la interconversión regulada por micro-ARN (mi-ARN). Las CSC similares a las del EMT están en gran parte en reposo, de forma invasiva y caracterizadas por la expresión de los marcadores de CSC: CD24−, CD44+, CD49f+ y son EpCAM−, teniendo en cuenta que en la EMT se caracteriza por activa autorrenovación y la expresión de marcadores de las CSC ALDH, EpCAM+, D49f+. Una subpoblación de células que expresan CD24− además de CD44+ y ALDH, puede representar las células en la transición entre estos estados35.
Cáncer colorrectalEn el cáncer colorrectal, un subconjunto de células CD26+ residentes en tumores primarios y tumores metastásicos mostraron la propagación del tumor y quimiorresistencia, lo que sugiere que la presencia el marcador CD26+ en tumores primarios también se podría usar para predecir la metástasis en pacientes con cáncer en diferentes etapas22. Aunque la mayoría de las células de cáncer de colon expresan niveles moderados de CD133, CD44 y CD16636–38. Las células CD133+ tienen un contenido de ADN mayor39 y llegan a convertirse en CD133− durante la metástasis, pero tanto las CSC CD133+ como las CD133− inician tumores en ratones NOD/SCID40.
Cáncer gástricoA pesar de que CD133+ y CD133+/CD44+ se detectan en GC primarios, no poseen propiedades de células madre ni exhiben propiedades de células iniciadoras de tumores en experimentos de trasplante de xenoinjertos41. Aunque otros estudios indican que pacientes CD133− positivos de cáncer gástrico tienen peor pronóstico42.
Cáncer de próstataSe prevé que las CSC pueden representar también las «semillas» letales para una posterior metástasis43. Subconjuntos con capacidades de diferenciación distintas dentro del epitelio basal (CD49f+ Trop-2+ CD24− y CD49f+ Trop-2+ CD24+ se pueden distinguir en la próstata humana). CD24 es un marcador expresado sobre las células de transición y puede desempeñar un papel en la diferenciación y migración de las CSC a la capa luminal42. Aunque las CSC con fenotipo CD133 (alto)/CD44 (alto) tiene capacidad de iniciar tumores en ratones NOD/SCID44.
Cáncer de hígadoEl CD133 está presente en las CSC de hígado45, aunque también es posible encontrar el fenotipo CD133+/ALDH+46 y, dado que el virus de la hepatitis puede promover la expresión de CD133 en las CSC del carcinoma hepatocelular, CD133+ puede estar junto a los marcadores EpCAM, CD24, CD44, CD90 y OV6 en etapas tempranas o en metástasis47–50.
Cáncer de cuello uterinoVarios antígenos de superficie celular tales como CD44, CD117, CD133 y MYD88 se han utilizado para aislar CSC de ovario51.
La nestina es una proteína de filamento intermedio expresada en la proliferación de células durante el desarrollo embrionario del sistema nervioso central y se considera marcador de células madres neuronales. Ya se ha investigado la diferencia de expresión de nestina entre el precáncer y el cáncer de cuello uterino invasivo, en donde la expresión de la nestina parece participar en el paso de la iniciación del cáncer y, potencialmente, podría ser un marcador útil en la detección temprana de cáncer de cuello uterino52.
MelanomaLa aldehído deshidrogenasa 1 (ALDH1, ALDH1A1), enzima responsable de la oxidación de aldehídos intracelulares, ha demostrado tener una función en la diferenciación temprana de las células madre. Su actividad muestra un potencial prometedor como unos marcadores universales para la identificación y el aislamiento de las células madre normales y CSC de múltiples fuentes en una variedad de tipos de tejidos53. A pesar de todos los esfuerzos, una población pura CSC no se ha aislado y actualmente in vivo se encuentran varias poblaciones de células en marcadores contradictorios de superficie54.
El adenocarcinoma ductal pancreático (PDAC) tiene como marcadores específicos de CSC: CD133, CD24, CD44, CXCR4, EpCAM, ABCG2, c-Met, ALDH1 y nestina55.
Señalización en las células madre de cáncerEn las células madre de melanoma (MSC) CD133+ la resistencia a la apoptosis inducida por «taxol» es notoria, a diferencia de las células CD133−, en donde no se muestra resistencia56. Las vías IL-857, mTOR, PI3K y MAPK se activan preferentemente en estas células CD133+58.
Los factores de «troncalidad» Sox2, Oct3/4 y Nanog, además de estar relacionados con las células madre pluripotentes inducidas, también tienen un papel muy importante en el mantenimiento de CSC59. Pero, además, la inducción aberrante por Helicobacter pylori60 con los factores de transcripción, CDX1 y CDX2 también juega un papel importante en esta modificación. Hay algunos genes que se activan directamente por CDX1 en el cáncer gástrico y factores de reprogramación relacionados, tales como SALL4 y KLF561.
Un número de marcadores de superficie celular tales como CD44, CD24, CD133 se utilizan a menudo para identificar y enriquecer las células madre cancerosas. Una red de regulación que consiste en micro-RNA y Wnt/β-catenina, Notch y Hedgehog vías de señalización controlan las propiedades de las CSC62.
La señalización de Wnt desempeña un papel crítico en la regulación de las células madre/progenitoras en la glándula mamaria, así como otros compartimentos de tejido. Por otra parte, existe una fuerte evidencia que sugiere que la activación defectuosa de la señalización de Wnt induce tumores de mama a partir de células madre/progenitoras y que ejerce sus efectos oncogénicos a través de la activación mediada por LRP5/6 de la beta-catenina y las vías de mTOR. Los retrovirus aviar se ha demostrado que introducen oncogenes en un pequeño subconjunto de células mamarias somáticas, transformando preferentemente a las células madre/progenitoras, lo que indica que las células madre/progenitoras en la glándula mamaria pueden ser especialmente susceptibles a la transformación oncogénica63.
Las β-catenina también desempeñan papeles importantes en el desarrollo y la tumorigénesis mamaria a través de sus funciones en la adhesión celular, la transducción de señales y la regulación de contexto de células específicas de la expresión génica. Los estudios en ratones han puesto de relieve el papel fundamental de la señalización de β-catenina en la biología de células madre en varias etapas de desarrollo mamario. Esta expresión desregularizada de la señalización β-catenina perturba la dinámica de las células madre y células progenitoras, induciendo tumores mamarios tanto en ratones como en humanos64.
La activación constitutiva de la vía Wnt conduce a la formación de adenoma, un paso necesario hacia el cáncer intestinal. En vista del papel establecido de Wnt en la regulación de la troncalidad, se han aislado CSC de tumores intestinales mutantes Apc y Apc/KRAS. Mientras que las CSC están presentes en tumores KRAS/Apc, parecen ser muy raras (<106) en los adenomas mutantes Apc. En contraste, la subpoblación de células de adenocarcinoma Lin− CD24 (alta) CD29+ parece ser enriquecida en las células madre cancerosas con el aumento de los niveles de β-catenina activa65.
Las CSC expresan CD133 y transportadores de casete de unión a ATP, por el cual las células pueden bombear colorantes específicos de fluorescencia, tales como Hoechst3334265.
La señalización de Notch se ha destacado como una vía implicada en el desarrollo de la mama y frecuentemente se desregula en el cáncer de mama invasivo, lo que podría representar nuevas dianas terapéuticas para prevenir la recurrencia del cáncer de mama preinvasivo e invasivo48–52,66. Esta vía de señalización Notch es una cascada de señalización intercelular conservada evolutivamente67. Se propone que la vía de señalización Notch puede representar nueva diana para el cáncer. Desempeña un papel importante en el desarrollo y la determinación del destino celular, y está desregulado en malignidades hematológicas y tumores sólidos humanos. Ya se han probado anticuerpos monoclonales (mAbs) que interfieren con la interacción ligando-receptor. Los mAbs ya están siendo probados en los ensayos clínicos de varios tipos de cáncer68.
Piwil2, un miembro de la familia de genes Ago/Piwi, se demostró que se expresa ectopicamente (cuando el producto de un gen se expresa en un lugar en el que normalmente no lo hace) en diferentes células de cáncer, en especial su notable expresión en las CSC, y también se sabe que es esencial para autorrenovación de las células madre de la línea germinal en diversos organismos69.
La señalización Notch es una vía intercelular evolutivamente conservada, implicada en muchos aspectos del desarrollo y la renovación de los tejidos en varios órganos. La importancia de la señalización de Notch en el desarrollo de algunos órganos y la morfogénesis está bien establecida. Sin embargo, el papel posnatal de Notch en la reparación de tejidos o regeneración actualmente empieza a ser dilucidado. A pesar de la simplicidad de la activación de esta vía, se requiere una regulación estricta para evitar efectos patológicos como cáncer70,71. En este sentido, Notch3 y Jagged2 (receptor de Notch) se evidenció que participan en el desarrollo de cáncer gástrico72, cáncer de mama, carcinoma urotelial, cáncer colorrectal y otros tipos de tumores70,73,74.
Las fibulinas (FBLN) son una familia de proteínas de la matriz extracelular, actúan como supresores de tumor o activadores en diferentes tipos de cáncer, y los mecanismos moleculares subyacentes de su acción en el cáncer siguen sin estar claros. La expresión de FBLN3 es suprimida por promotores de hipermetilación asociada con la invasividad y agresividad en el NSCLC. En este estudio se evaluaron las funciones y mecanismos de señalización de FBLN3 en las CSC de pulmón. La expresión forzada de FBLN3 suprime la invasión y la migración de las células de adenocarcinoma de pulmón y la disminución de la expresión de los activadores de la EMT, incluyendo N-cadherina, factor de crecimiento similar a la insulina (IGF1R) y los factores de troncalidad (propiedad de dar origen a otras células, actuando como células madre) Sox2 y β-catenina75.
La EMT desempeña un papel crítico en la invasión y la metástasis de cáncer, por estar asociada con las propiedades de las CSC76. Esta transición es dada por SAIL y CCL2 (ligando de quimiocina 2) que mejoran el triple su capacidad de formación de tumores in vitro, con propiedades de evasión al sistema inmunitario. Otros reportes indican que CCL2 y LCN2 (lipocalina 2) incrementan las células dentríticas reguladoras (DCreg) con actividad supresiva acompañada por la baja expresión de moléculas coestimuladoras tales como HLA-DR77–79.
La regulación epigenética por la modificación de las histonas, específicamente a través de las proteínas del grupo Polycomb (PCG) como EZH2 y el BMI-1, son el motor importante en la biología de células madre, que a su vez se correlaciona con mal pronóstico en muchos tipos de tumores, ayudando a mantener su fenotipo. En líneas celulares de cáncer de páncreas y de mama hay elevados niveles de EZH2 en comparación con las células no-CSC que, cuando se interrumpen, se reduce significativamente la frecuencia de células madre cancerosas80. Esta regulación negativa de BMI-1 se da con el uso del regulador Mel-1881.
Antígenos de las células madre de cáncer como blancos en la inmunoterapiaHay varias inmunoterapias dirigidas a un número de antígenos de tumor de próstata que están actualmente en desarrollo. Sin embargo, las respuestas clínicas en este entorno son inconsistentes, y se cree que el fracaso para lograr la erradicación del tumor completo y permanente se debe a las CSC76.
Recientemente se han identificado y caracterizado molecularmente muchos TAA asociados a tumores humanos. Cuando se unen a moléculas del complejo principal de histocompatibilidad, péptido de TAA son reconocidos por las células T. Por lo tanto, los estudios clínicos han sido iniciados para evaluar el potencial terapéutico de la inmunización activa o la vacunación con péptidos de TAA en los pacientes con cáncer metastásico. Hasta el momento, solo un número limitado de péptidos de TAA, en su mayoría los reconocidos por las células T CD8+ en pacientes con melanoma, han sido clínicamente probados. En algunos ensayos clínicos, se ha observado la regresión del tumor parcial o completa en aproximadamente 10-30% de los pacientes. No se han reportado efectos secundarios graves82.
Mucha atención se ha centrado en CD133 como marcador de células cancerosas en varias neoplasias humanas; su expresión parece predecir el pronóstico desfavorable. A partir de las características que poseen, es concebible que solo la erradicación de células madre cancerosas pueda conducir a la cura del cáncer83. Este marcador ha sido identificado en tumores cerebrales malignos84. Sin embargo, CD133 se expresa en las células epiteliales diferenciadas en varios órganos y las células CD133− también se encuentran en los tumores85,86. Es por eso por lo que las células CD133+ podrían ser objetivos potenciales de la terapia antitumoral en el futuro87.
El CD133 es un marcador de las CSC; también se relaciona con la regresión de carcinoma de cabeza y cuello de células escamosas (HNSCC) in vivo. Waldron et al.88 caracterizaron una toxina biespecífica compuesta de 2 fragmentos de anticuerpo y una toxina de proteína catalítica lo que permite que se una a 2 marcadores de las CSC, eliminando subpoblaciones resistentes. Este biespecífico inhibe potentemente la traducción de proteínas y la proliferación in vitro en 3 tipos diferentes de carcinoma, garantizando un terapia eficaz para el carcinoma.
En una población de CSC y en una población de no-CSC derivadas de adenocarcinoma de pulmón LHK2, células de adenocarcinoma de colon SW480 y células de adenocarcinoma de mama MCF-7, usando RT-PCR y PCR en tiempo real, los genes (MAGEA2, MAGEA3, MAGEA4, MAGEA6, MAGEA12, MAGEB2, GAGE1, GAGE8, SPANXA1, SPANXB1, SPANXC, XAGE2, SPA17, BORIS, PLU-1, SGY-1, TEX15 y CT45A1) mostraron mayores niveles de expresión en la población con CSC y 10 genes (BAGE1, BAGE2, BAGE4, BAGE5, XAGE1, LIP1, D40, HCA661, TDRD1 y TPTE) mostraron similar expresión en ambos grupos89.
Dado que en el cáncer hay una desregulación en el ciclo celular, las proteínas que cambian su expresión pueden ser usadas como blancos inmunoterapéuticos, como por ejemplo es el caso de los antígenos relacionados con el ciclo G2/M (Birc5, Aurka, Nke2 y Plk1) en células específicas del cáncer. Esta expresión de antígenos relacionados con este ciclo de la mitosis se investigó en CSC/células iniciadoras de tumores (CITs) para verificar la diferencia en el efecto antitumoral. Se aislaron las CSC utilizando colorante Hoechst 33342 a partir de líneas de células CT 26 y se encontró que Birc5 y Aurka se expresan tanto en las CSC/CITs y en las no-CSC/CICs, mientras que Nek2 y Plk1 se expresan preferentemente en no-CSC/CICs (antígenos no-CSC)90, diferencias cruciales para ser específicos al buscar nuevos enfoques para la aplicación clínica.
El anticuerpo TAB 004 se está investigando como un agente diana terapéutica para las CSC en PC. El TAB 004 EIA detecta MUC1 circulantes de una manera dependiente de la fase de enfermedad en pacientes con PC y también es potencial en la fase de diagnóstico en cualquier etapa de este tipo de cáncer91.
Las proteínas de choque térmico son normalmente inducidas bajo estrés ambiental, para servir como chaperonas para el mantenimiento de plegamiento de las proteínas correctas, pero a menudo se sobre expresan en muchos tipos de cáncer, incluyendo el cáncer de mama. La expresión de Hsp27, una pequeña proteína de choque térmico independiente de ATP, se asocia con la migración celular y la resistencia a fármacos de las células de cáncer de mama. Hsp27 regula el proceso de la EMT y la actividad del factor nuclear kappa B (NF-kB) para contribuir al mantenimiento de las CSC de mama, considerándose como una nueva estrategia en la terapia del cáncer de mama92. Aunque hay ensayos clínicos de inhibidores de Hsp90 en la terapia del cáncer de mama en curso, el efecto de focalización de las CSC de mama de ellos sigue siendo poco claro. La geldanamicina (GA) es un inhibidor de Hsp90 que podría suprimir células de cáncer de mama ALDH+ de una manera dependiente de la dosis. En combinación con quercetina o KNK437 BCSC potenciadas sirve como una solución potencial para prevenir la resistencia a los fármacos y evitar la toxicidad de altas dosis de inhibidores de Hsp90 en la aplicación clínica93.
Terapias combinadasUna de las razones principales de los tratamientos contra el cáncer ineficaces es la falta de eficiencia en la eliminación de las CSC. Por lo tanto, la combinación de varios agentes contra las células CSC puede ofrecer mejores beneficios terapéuticos. Varias moléculas contra las CSC han sido objeto de evaluaciones preclínicas. Sin embargo, su baja solubilidad y toxicidad no específica limitan su traducción clínica94. Pero además de los antígenos específicos de estas CSC que pueden ser blanco de anticuerpos que se diseñen para aplicarse en vacunas o algún otro método inmunoterapéutico, se plantea que la radioterapia, la quimioterapia, podrían tener un bajo porcentaje de recaídas en los pacientes.
Dentro de los blancos más conocidos de las CSC es el CD133+, receptor de endotelina-A (ETRA) el que juega un papel importante en la migración de las células del tumor, la metástasis, y la proliferación. El receptor de la endotelina B (ETRB) está relacionado con la angiogénesis y la inhibición del reclutamiento de células inmunitarias antitumorales. Así el doble bloqueo de ETRA y ETRB podría tener efectos antitumorales significativos. El bloqueo de estos receptores se ha dado en combinación con la quimioterapia y ha tenido resultados significativos95. Pero como se sabe que los cánceres pueden escapar al reconocimiento inmune por medio de la evasión del complejo mayor de histocompatibilidad clase I (MHC) mediado por el reconocimiento por los linfocitos T citotóxicos (CTL), queda mucho por investigar ya que las estrategias de inmunización dirigidas a antígenos específicos asociados a tumores no se han caracterizado extensamente en modelos murinos de varios tipos de cáncer96.
No solo los clústeres de diferenciación son muy buenos blancos, ya que en cáncer de pulmón los ensayos clínicos recientes han proporcionado pruebas de los beneficios de ciertas formas de inmunoterapia. Las células T γδ constituyen 2-10% de los linfocitos T en la sangre humana y juegan un papel en la vigilancia inmune contra los patógenos microbianos y posiblemente cáncer. Estas células T reconocen fosfoantígenos través de los receptores polimórficos γδ de células T receptoras, así como el complejo mayor de histocompatibilidad (MHC) de clase i89.
De acuerdo con la teoría de las CSC, las terapias que no están orientadas a las CSC podrían no ser tan eficaces en el tratamiento del cancer. Los CTL tienen el potencial de reconocer y destruir las células neoplásicas individuales dentro de un tejido, ya sea mediante la vacunación con CSC u algún otro mecanismo inmune, y no está comprendido del todo. Pero existe evidencia experimental que muestra que las líneas de CSC establecidas a partir de un adenocarcinoma transgénico de la próstata de ratón (TRAMP) expresan antígenos asociados con el cáncer, las moléculas de MHC de clase I y II, así como ligandos para los receptores de las células NK. En efecto, las CSC son objetivos para la citotoxicidad mediada por las células NK y CTL, tanto in vitro como in vivo. La administración de células dendríticas (DC) pulsadas con CSC irradiadas induce a una respuesta inmune específica de tumor que es más notoria que la inducida por las DC pulsadas con células tumorales diferenciadas, retrasando el crecimiento del tumor en ratones expuestos con células madre cancerosas de próstata y causa la regresión del tumor en ratones TRAMP. Por lo tanto, las CSC son el blanco de la respuesta inmune innata y adaptativa97.
Existe una gran necesidad insatisfecha de agentes rentables y ampliamente disponibles antineoplásicos inmunoterapéuticos con buenos resultados. Los mi-ARN que regulan la inmunosupresión mediada por tumores pueden inducir fuertes respuestas inmunes terapéuticas, lo que indica que los mi-ARN, en última instancia, pueden formar parte de las múltiples opciones para reforzar la inmunoterapia contra el cáncer98. Por ejemplo en los gliomas, a pesar de todos los esfuerzos de la cirugía citorreductora en combinación con la quimioterapia intensa, el glioblastoma multiforme (GBM, glioma de grado IV) todavía tiene un pronóstico sombrío. La investigación actual se centra en la orientación molecular para superar la resistencia a la terapia convencional. Los mi-ARN traen grandes esfuerzos de investigación que apuntan hacia el potencial terapéutico, con el objetivo de sensibilizar a las células de glioma a la quimioterapia o radioterapia99,100.
Los pacientes con melanoma con frecuencia tienen niveles séricos elevados de interleucina-6 (IL-6), que es correlacionado con un mal pronóstico. La IL-6 activa la fosforilación de STAT3, la inducción de la transcripción de los genes que regulan la proliferación de células tumorales y antiapoptóticas. Además, la evidencia reciente indica que la IL-6 induce la EMT y aumenta la invasividad de las células tumorales de origen epitelial. Sin embargo, se desconoce si la IL-6 afecta a las células tumorales mesenquimales. Se han examinado los efectos de la IL-6 en las células del melanoma, encontrándose que la IL-6 puede aumentar su potencial metastásico mediante la regulación de la expresión de Twist y N-cadherina. Se confirma que los tejidos de melanoma humano expresan IL-6 (especialmente en el sitio de la lesión), el receptor de IL-6, N-cadherina y Twist (regulador genético) nucleares. La IL-6 induce la fosforilación de STAT3 en células de melanoma humano WM-266-4, que resulta el alza transitoria de Twist, que es un regulador clave de la metástasis. Es importante destacar que la expresión de N-cadherina, una proteína de Twist, también se incrementa en la superficie celular después del tratamiento con IL-6. Estas células muestran una mayor invasividad, formando nódulos más metastásicos en los pulmones de los ratones NOD/SCID después de una inyección intravenosa. Es importante destacar que las células del melanoma con eliminación de N-cadherina forman menos nódulos pulmonares en comparación con el control en el modelo ratón NOD/SCID. Estos datos sugieren que el aumento de IL-6 en suero en pacientes con cáncer podría aumentar la invasividad de las células de melanoma y acelerar la metástasis. El bloqueo de IL-6 en el microambiente del melanoma puede, por lo tanto, inhibir la progresión de la enfermedad21.
Se han explorado diversos enfoques que van desde el uso de la irradiación de las vacunas de células enteras inactivadas derivadas de tumores autógenos y alogénicos (incluso líneas celulares tumorales) hasta versiones modificadas genéticamente de tales vacunas celulares que tienen como objetivo la corrección de la disfunción coestimuladora o la alteración del ambiente humoral in situ para facilitar el reconocimiento inmune y la activación. Vacunas antiidiotipo, basadas en idiotipos asociados a células de cáncer, también se ha explorado que apuntan a aumentar la inmunogenicidad a través de la generación in vivo de la respuesta inmune. Las vacunas de células dendríticas (DC) tratan de mejorar la presentación de TAA a los linfocitos T vírgenes. Desafortunadamente, siempre existe la posibilidad de que la presentación defectuosa de antígenos dé como resultado la inducción de tolerancia a los antígenos contenidos en la vacuna, y la posterior progresión rápida del tumor. Los modelos animales, aunque muy artificiales, han dado resultados prometedores. Los ensayos clínicos en seres humanos no han sido tan buenos. Aunque la activación inmunológica, en general, dirigida contra los antígenos diana contenidos dentro de la vacuna contra el cáncer ha sido documentada en la mayoría de los casos, la reducción en la carga tumoral no se ha observado con frecuencia, y la progresión tumoral y la metástasis generalmente perduran, posiblemente después de un período ligeramente prolongado de remisión. El fracaso de las vacunas contra el cáncer es debido a la misma relación entre el huésped y el tumor: a través de un proceso de selección natural el anfitrión conduce al enriquecimiento selectivo de clones altamente agresivos de células transformadas neoplásicamente, que aparentemente son tan indiferenciados que ya no expresan moléculas específicas de células cancerosas101.
El llamado «microambiente del tumor» (TME) es aquel en el que existe asociación recíproca entre las células cancerosas, las células del sistema inmune y las células del estroma. El TME, como un intrincado ambiente, también se compone de las CSC que pueden resistir contra las quimioterapias. En tumores sólidos, el metabolismo y la vascularización parecen ser aberrantes y los fluidos intersticiales del tumoral (TIF) son la barrera fisiológica. Por lo tanto, la quimioterapia, la inmunoterapia y la terapia génica a menudo no proporcionan resultados clínicos convincentes67,78.
El uso de los genes asociados con el cáncer de próstata descubiertos a través de estudios de genética implica la construcción de vacunas con el uso de vectores recombinantes de virus de plásmidos que codifican estos nuevos TAA para inducir respuestas inmunes específicas a TAA para la prevención o la terapia de cáncer de próstata102.
La inyección de la proteína recombinante FBLN3 en xenoinjertos subcutáneos establecidos con CSC ALDH+ suprime significativamente el crecimiento y la progresión del tumor75, lo que indica que se podría usar con ayuda de otros fármacos anticancerígenos para una mejora significativa, especialmente para cánceres con células madre con este fenotipo específico.
El antígeno NY-ESO-1 es un objetivo de la vacuna en el cáncer epitelial de ovario (EOC), pero su expresión limitada es un obstáculo para la eficacia de la vacuna. Dado que NY-ESO-1 se regula por la metilación del ADN, la hipótesis de que los inhibidores de la ADN metiltransferasa (DNMT) podría aumentar la efectividad de las terapias con vacunas hacia este antígeno. En torno a esto, la hipometilación global de ADN en EOC se asocia con la presencia de anticuerpos circulantes contra NY-ESO-1. En ensayos previos, la estabilización de la enfermedad o la respuesta clínica parcial ocurrieron en 6/10 pacientes evaluadas. Sobre la base de estos resultados alentadores, se justifica la evaluación de los regímenes de quimioinmunoterapia combinatorios en este y otros tipos de tumores103.
En otros campos como la nanomedicina se ha buscado también una alternativa para combatir a las CSC. Este es el caso de las nanopartículas multifuncionales que pueden integrar diversos componentes clave, tales como medicamentos, genes y ligandos que, dirigidos utilizando plataformas de entrega únicas, serían más eficientes en el tratamiento de cánceres resistentes a múltiples fármacos104.
Vacunación de células madre de cáncer en la reducción del cáncer y metástasisLa mayoría de los estudios de las CSC implican la inoculación de las células de tumores humanos en ratones inmunosuprimidos. La vacunación con poblaciones de células tumorales y CSC son más inmunogénicas y más eficaces como una fuente de antígeno e inducen a protección antitumoral, esto es evidenciado con los altos niveles de IgG en el suero que se unían a células madre cancerosas con su posterior lisis en presencia del complemento105.
Las DC son las células más eficaces presentadoras de antígeno en el sistema inmunitario humano. Se ha tratado a pacientes con cáncer de melanoma y próstata tratados previamente con DC transfectadas con ARNm de líneas de células alogénicas o autólogas106. El sistema nervioso central se considera que es inmunológicamente privilegiado debido a la barrera hematoencefálica. Datos más recientes, sin embargo, soportan un alto nivel de interacción celular y molecular entre los tumores cerebrales y del sistema inmunológico. El uso de las DC para apuntar a las células madre de cáncer de glioblastoma ha sido explorado en modelos animales, para el control tumoral superior en comparación con los enfoques que utilizan células tumorales a granel107. Dado que las CSC en varios tipos de cáncer poseen el marcador CD133, están sirviendo como fuente de antígenos para tratar el cáncer.
Está bien establecido que CD133 se expresa en la población de células tumorales de GBM que representan CSC. Esto planteó la posibilidad de que CD133 podría servir como un objetivo potencial para dirigir a las células T citotóxicas (CTL) hacia las CSC de glioblastoma106,108. Dos epítopos CD133 potenciales de antígeno leucocitario humano (HLA), ILSAFSVYV (CD133-405) y YLQWIEFSI (CD133-753) muestran una unión fuerte a moléculas. En los estudios de inmunogenicidad in vitro generaron CTL CD8+ específicos hacia las CSC. Este estudio demostró el procesamiento natural y la posterior presentación de estos epítopos en células madre cancerosas de GBM y la capacidad de los CTL para matar células madre cancerosas que llevan el antígeno109,110.
Estudios de inmunización en ratones utilizando epítopos CD133 demostraron inmunogenicidad en ausencia de daño autoinmune. Los resultados presentados en este estudio apoyan el uso de vacunas de epítopo de CD133− específicos para apuntar células madre cancerosas en el glioblastoma y otros cánceres. En el año 2013 comenzó un ensayo clínico de la vacuna de CD CD133 en glioblastoma recurrente; este estudio evaluará un tipo de inmunoterapia en el que se estimula la respuesta inmunitaria del paciente para destruir las células tumorales. La vacuna de DC de CD133 se hizo a partir de células blancas de la sangre del paciente110,111.
Las células madre mesenquimales (MSC) no han sido excepción para este tipo de vacunas, debido a que son progenitoras pluripotentes adultas de múltiples linajes mesenquimales y tienen un tropismo inusual a las lesiones tumorales. Tanto las MSC, como las CSC o poblaciones de CIT también pueden tener inmunogenicidad similar78,112.
Duarte et al., en 2013113, aislaron una población enriquecida con CSC de rata con carcinoma de colon para usarla como fuente de antígenos. Aunque no se observó ninguna diferencia significativa en la aparición del tumor entre el control y los grupos vacunados, el 50% de los animales vacunados con CSC se hizo resistente al desarrollo de tumores. Además, la vacunación a base de CSC indujo a una reducción de 99,5% en el volumen del tumor en comparación con el grupo de control. Este estudio constituye uno de los primeros trabajo en donde se analizó el potencial de una vacuna a base de CSC para prevenir el desarrollo de metástasis hepática.
ConclusiónLa inmunoterapia del cáncer es el uso del sistema inmune para tratar el cáncer. El objetivo de este tratamiento es atacar a las células tumorales malignas que son responsables de la enfermedad, pero específicamente los avances se centran en las CSC donde se ya se ha planteado la hipótesis de que son responsables de la progresión de la enfermedad. Aunque las células cancerosas son menos inmunogénicos que los agentes patógenos, el sistema inmune es claramente capaz de reconocer y eliminar las células tumorales. El desafío para la inmunoterapia consiste en utilizar los avances en inmunología celular y molecular para desarrollar estrategias que con eficacia y seguridad aumenten la respuesta antitumoral. La existencia de múltiples estados de células madre sugiere la necesidad de desarrollar estrategias terapéuticas capaces de dirigir con eficacia CSC en todos estos estados. Utilizando la inmunoterapia junto con los mi-RNA, radioterapia y quimioterapia, se puede reducir la enfermedad de manera no invasiva en modelos experimentales y humanos. Esta estrategia tiene muchos desafíos para tener posteriormente un tratamiento efectivo contra esta enfermedad.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.