Las lesiones en la piel producidas por el LE constituyen una de las manifestaciones más visibles y frecuentes de esta enfermedad. Estas lesiones muestran una gran variabilidad, tanto en su expresión clínica como microscópica, lo que dificulta su comprensión y estudio. Los pacientes que expresan enfermedad en la piel no tienen, en su mayoría, complicaciones sistémicas graves pero sí importante morbilidad dada la extensión, cronicidad, riesgo de cicatrices y desfiguramiento de la apariencia física que las lesiones cutáneas pueden ocasionar. Los mecanismos patogénicos exactos que conducen al desarrollo de lesiones cutáneas en el LE no se conocen pero probablemente la radiación ultravioleta juega un papel importante. La apoptosis de los queratinocitos inducida por esta radiación y los estímulos proinflamatorios que se desencadenan como consecuencia del déficit en la eliminación de estas células apoptóticas constituyen probablemente los pilares en los que se basa la etiopatogenia de esta enfermedad en la piel. Sin embargo, restan múltiples interrogantes aún por dilucidar. El tratamiento se basa en la fotoprotección, la aplicación tópica de corticoides y la administración oral de antipalúdicos.
Skin lesions are the most visible and frequent symptoms in lupus erythromatosus (LE). These lesions vary greatly in their clinical as well as microscopic features, which difficults the understanding and study of LE. Most of the patients that express skin disease do not suffer from serious systemic complications, but from important morbidity given the extension, chronicity, chances of scarring and disfigurement that skin lesions may cause. The exact pathogenic mechanisms that induce the development of skin lesions in LE are unknown at present; however, ultraviolet (UV) radiation could play an important role. UV- induced keratinocyte apoptosis as well as proinflammatory stimuli release because of uncomplete apoptotic cell clearance may be the pillars of the etiology of this skin disease. Nonetheless, there are still many questions to answer. The treatment consists of photoprotection, topical administration of corticoids as well as oral administration of antimalarial drugs.
El lupus eritematoso (LE) es una enfermedad autoimmune cuyo espectro clínico es amplio y heterogéneo, tanto en lo que hace referencia a la semiología como al pronóstico. En un extremo se encuentran aquellos pacientes que desarrollan manifestaciones potencialmente letales cumpliendo criterios de lupus eritematoso sistémico (LES) y en el otro, los pacientes con lupus eritematoso cutáneo (LEC), que presentan únicamente manifestaciones cutáneas sin complicaciones en otros órganos. En este caso, el riesgo para la vida del paciente es mínimo pero no debe olvidarse la morbilidad que las lesiones cutáneas de LE pueden ocasionar por su extensión, cronicidad, riesgo de cicatrices y desfiguramiento de la apariencia física. Por otra parte, la existencia de lesiones de LEC no excluye la posibilidad de que el paciente pueda desarrollar enfermedad sistémica en algún momento de su evolución.
NOMENCLATURA Y CLASIFICACIÓNLas lesiones cutáneas del LE constituyen una de las manifestaciones más visibles y frecuentes de esta enfermedad. Estas lesiones muestran una gran variabilidad, tanto en su expresión clínica como microscópica, lo que confiere cierta dificultad a la hora de clasificarlas y facilita el uso de una prolífica terminología, en muchas ocasiones, mal aplicada(1). En la tabla I se recoge una propuesta personal de su clasificación que se basa en la experiencia propia y la extraída de la literatura(1,2). En un primer grupo se englobarían todas aquellas lesiones cutáneas específicas de la enfermedad que traducen, desde el punto de vista microscópico, la presencia de una dermatitis de la interfase como cambio más prominente. Cualquiera de estas lesiones permiten establecer por sí mismas el diagnóstico de lupus eritematoso y se identifican bajo el término genérico de lupus eritematoso cutáneo (LEC). A su vez, en el LEC se distinguen tres subgrupos importantes -el lupus eritematoso cutáneo crónico (LECC), el lupus eritematoso cutáneo subagudo (LECS) y el lupus eritematoso cutáneo agudo (LECA)-que se definen por las características clínicas y evolutivas de las lesiones cutáneas; dentro de cada sub- grupo se identifican distintas variantes. Un segundo grupo está constituido por un número amplio de lesiones cutáneas muy polimorfas, que no son exclusivas del LE ya que pueden verse en el contexto de otras enfermedades autoinmunes, y no permiten por sí solas establecer el diagnóstico de LE. Se engloban bajo el término genérico de lesiones cutáneas inespecíficas y en la microscopia de las mismas no es posible observar una dermatitis de la interfase como es característico en las lesiones cutáneas específicas del primer grupo. Finalmente, consideraremos un tercer grupo provisional de lesiones cutáneas de difícil clasificación, entendiendo como tal aquéllas lesiones para las que no existe, hasta el momento, unanimidad a la hora de decidir en cuál de los grupos anteriores deberían incluirse. En esta revisión nos centraremos en la descripción de las lesiones cutáneas específicas y de alguna de las entidades incluida en este último grupo que nos parece de mayor interés.
Manifestaciones cutáneas del lupus eritematoso
Lesiones cutáneas específicas o lupus eritematoso cutáneo (con dermatitis de la interfase en la microscopia)
|
Lesiones cutáneas inespecíficas (sin dermatitis de la interfase en la microscopia):
|
Lesiones cutáneas de difícil clasificación:
|
El LE es una enfermedad multisistémica que puede afectar a varios órganos o localizarse exclusivamente en la piel. Su etiopatogenia es compleja y se ve influenciada por factores genéticos, ambientales y hormonales. Por otra parte, los mecanismos patogénicos que inducen la lesión de uno u otro órgano probablemente no sean idénticos.
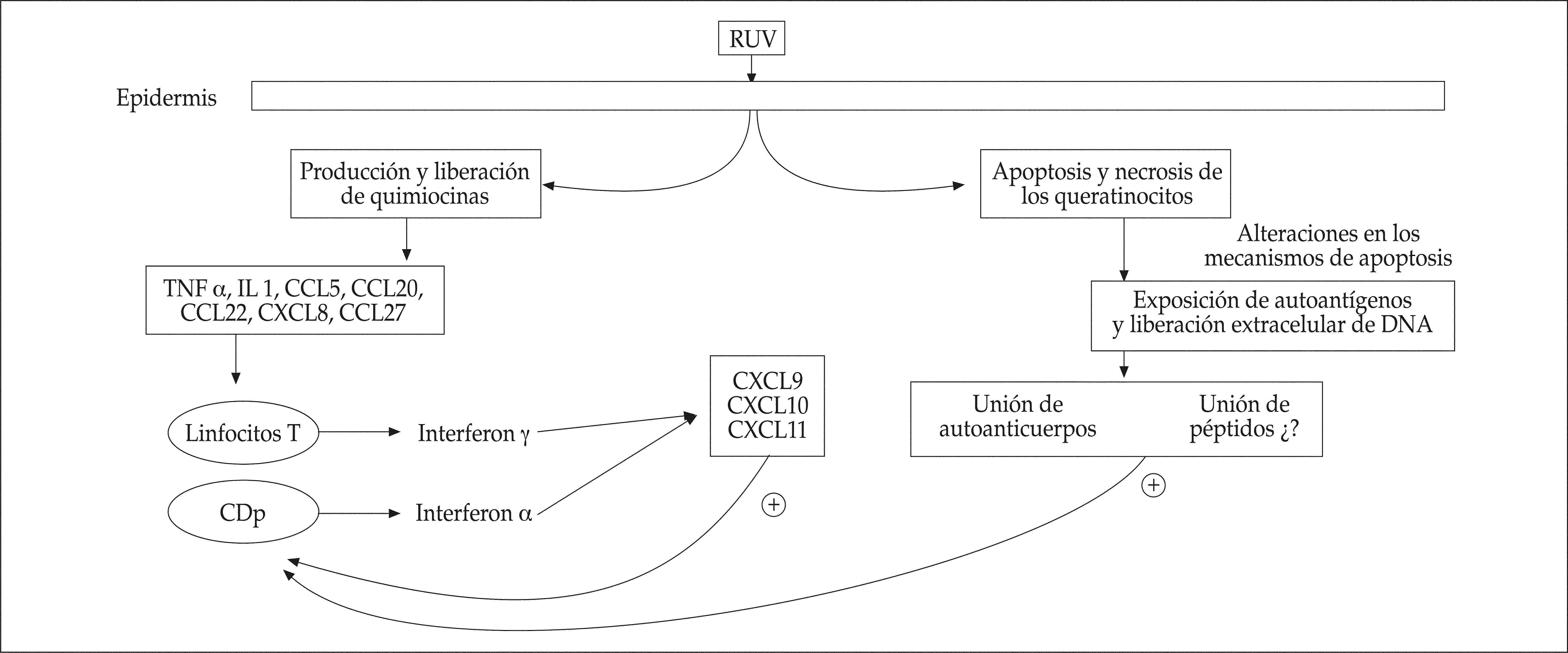
Por lo que respecta a las manifestaciones cutáneas del LE, la fotosensibilidad tiene un papel central en la etiopatogenia. Por otro lado, la luz solar, además de provocar dichas lesiones, es posible que también pueda jugar un papel como desencadenante de las manifestaciones sistémicas del LES(3,4). Los mecanismos que median entre la exposición a la radiación ultravioleta (RUV) y la aparición de lesiones no han sido aún completamente dilucidados, aunque se ha avanzado sustancialmente en su conocimiento. Los principales eventos que podrían intervenir en el mecanismo patogénico de las lesiones cutáneas de LE se representan en la figura 1.
De forma general, la RUV a dosis intermedias o altas conduce a la liberación por parte de las células epidérmicas de citocinas como el TNF-α y la IL-1 que a su vez desencadenan la síntesis de otras citocinas proinflamatorias. Esto conlleva la activación de los linfocitos y la expresión de moléculas de adhesión en las células endoteliales y los queratinocitos (p.e. ICAM- 1)(5). Por otra parte, la RUV induce la apoptosis de los queratinocitos y la expresión de autoantígenos en su superficie(6).
En condiciones normales, las células apoptóticas son eliminadas de forma rápida del organismo para evitar la liberación de las enzimas intracelulares y la exposición de autoantígenos. Posibles anomalías en la eliminación de las células apoptóticas han adquirido relevancia como posible origen de las manifestaciones en el LE, tanto en el LES como en el LEC(7,8). De esta forma, la RUV, a través de la apoptosis celular que provoca en los queratinocitos, sería el principal desencadenante de las lesiones cutáneas. No obstante, no está claro si el fallo radica en un déficit en los mecanismos de eliminación de las células apoptóticas con el consiguiente acumulo de las mismas(9), o en una eliminación "inflamatoria"(10,11). Por otra parte, no se conoce el motivo por el cual los pacientes con LE presentarían esta anomalía en estos mecanismos de eliminación de las células apoptóticas o de la respuesta inflamatoria. Si bien en el LES existen alteraciones que lo podrían justificar, como el déficit en el sistema del complemento(12), éste no se da en la gran mayoría de casos de LE con afectación exclusivamente cutánea.
En cualquier caso, parece evidente el papel de las células apoptóticas como iniciadoras de la respuesta autoinmune. Como consecuencia de los déficits en su procesamiento, las células apoptóticas sufren una necrosis secundaria y se desencadenan estímulos proinflamatorios. Este proceso conduce a la exposición de autoantígenos en la superficie celular(7,13), los cuales a su vez sufren modificaciones durante la apoptosis (oxidación, fosforilación o citrulinación) que los hacen más inmunogénicos(14). La unión de autoanticuerpos a estos antígenos daría lugar a una respuesta inflamatoria y la consiguiente producción de citocinas(13,15,16). De estos autoanticuerpos, los anti-Ro son los más conocidos y han sido los más estudiados en relación a la fotosensibilidad. Se ha demostrado que la RUV puede inducir la expresión de antígenos Ro/SS-A en la superficie celular(17) y la posterior unión de los anticuerpos anti-Ro a la superficie de los queratinocitos(18,19). Por otro lado, es bien conocida la relación entre la presencia del anticuerpo anti- Ro en la sangre periférica y el desarrollo de enfermedad, fundamentalmente cutánea y cardiaca, en el lupus neonatal como consecuencia del paso transplacentario de anti-Ro desde una madre portadora al feto(20). No obstante, no se ha podido demostrar in vivo en los pacientes con LE una relación directa entre la presencia de estos anticuerpos y la fotosensibilidad, por lo que el papel de estos autoanticuerpos sigue siendo un tema controvertido(21). Además, como se mencionará más adelante, no todos los pacientes con lesiones cutáneas de LE, en especial las formas de LECC y lupus eritematoso tumidus (LET) (Tabla I), se asocian a la presencia de autoanticuerpos en sangre. De hecho, esto es así tan sólo en el LES y el LECS y, por tanto, sería en estas formas donde la participación de los autoanticuerpos, al menos de los que se conocen hasta el momento actual, podría jugar un papel en el desarrollo de la enfermedad.
No obstante, la RUV genera respuestas proinflamatorias por mecanismos alternativos a la unión de los autoanticuerpos a las células. La RUV puede inducir la producción de quimiocinas por parte de los queratinocitos (CCL5, CCL20, CCL22 y CXCL8), además de IL-1 y TNF- α. Por otra parte, de forma secundaria a su apoptosis, las células de la capa basal epidérmica liberan quimiocinas homeostásicas (CCL27) hacia la dermis. Todas estas quimiocinas constituyen probablemente la señal para el reclutamiento de los primeros linfocitos T, productores de interferón γ, y células dendríticas plasmacitoides (CDp), a su vez productoras de interferón α(22).
Las CDp constituyen un tipo de precursor de las células dendríticas cuya función principal es la secreción de grandes cantidades de interferón tipo I (interferón α y β)(23) en respuesta a las infecciones virales. Estas células reconocen el DNA o RNA viral a través de unos receptores endosómicos llamados TLR7 y 9(24). Estudios recientes han demostrado que las CDp también tienen un papel central en la fisiopatología del LE. Se ha demostrado su presencia en las lesiones cutáneas de LE, tanto de pacientes con lesiones cutáneas exclusivamente(22,25–27) como de pacientes con lesiones cutáneas y enfermedad sistémica (LES)(22,25,26,28). De la misma manera, los niveles de interferón α se encuentran elevados en la sangre periférica de los pacientes con LES(29) y en la piel se ha encontrado aumentada la expresión de MxA, una proteína que es inducida por el interferón α(26–28). El interferón α, junto con el interferón γ producido por los linfocitos T, induce la producción de una serie de quimiocinas (CXCL 9, 10 y 11) por parte de las células estructurales de la piel (queratinocitos, células endoteliales y fibroblastos), que a su vez atraen a más linfocitos T y CDp. De esta manera se establecería un sistema de amplificación de la respuesta inflamatoria(22).
Sin embargo, dentro de esta hipótesis queda una pregunta importante por resolver, que es cómo se activan las CDp. Se ha propuesto que en los pacientes con LES se formarían inmunocomplejos que serían internalizados en las CDp a través del receptor FcγRIIa y, de esta manera, se unirían al receptor TLR intracelular(30). Se ha demostrado también que las células apoptóticas y necróticas liberan material que, unido a IgG de pacientes con LES, induce la producción de interferón α por las CDp(31). Pero una vez más este mecanismo no es extrapolable a las formas de LEC que cursan sin autoanticuerpos en sangre como el LECC o el LET. En este sentido, se ha propuesto en el LEC(32) un mecanismo de activación de las CDp similar al descrito por Lande et al.(33) en la psoriasis. Estos autores identificaron un péptido antimicrobiano llamado LL37 capaz de formar complejos con DNA autólogo que son internalizados en las CDp para activar el receptor TLR 9(33).
En cuanto al LET, se han publicado hasta la fecha dos estudios dirigidos a investigar el papel de estas células. Obermoser et al.(34) hallaron CDp, interferón α y MxA tanto en lesiones espontáneas como en lesiones fotoprovocadas de forma experimental, con una disposición perivascular y perianexial, en concordancia con la localización del infiltrado inflamatorio en el LET. Muy interesantes han sido también los resultados obtenidos por Wackernagel et al.(35). Estos autores observaron la presencia de CDp en varias formas de LEC, incluyendo el LET, y su ausencia en las lesiones de erupción polimorfa lumínica (EPL) (ver más adelante), lo que apoyaría por un lado, la existencia de mecanismos patogénicos completamente diferentes en ambas entidades (LET y EPL) y, por otro, el origen lúpico del LET, un aspecto clave que, como se comentará más tarde, ha sido cuestionado por algunos autores.
MANIFESTACIONES CUTÁNEAS ESPECÍFICAS DEL LUPUS ERITEMATOSO O LUPUS ERITEMATOSO CUTÁNEOLupus eritematoso cutáneo crónicoDefinen a este grupo de lesiones el carácter crónico de las mismas y la tendencia a dejar algún tipo de cicatriz cuando curan(36). La variante más común de LECC es el llamado lupus eritematoso discoide (LED). A su vez, estos pacientes se dividen en aquéllos que presentan lesiones limitadas a la cabeza y el cuello (LED localizado), y los que desarrollan, además, lesiones en otras localizaciones (LED generalizado). Otras formas de LECC menos frecuentes son la variante hipertrófica o verrucosa y el LE profundo o paniculitis lúpica (Tabla I).
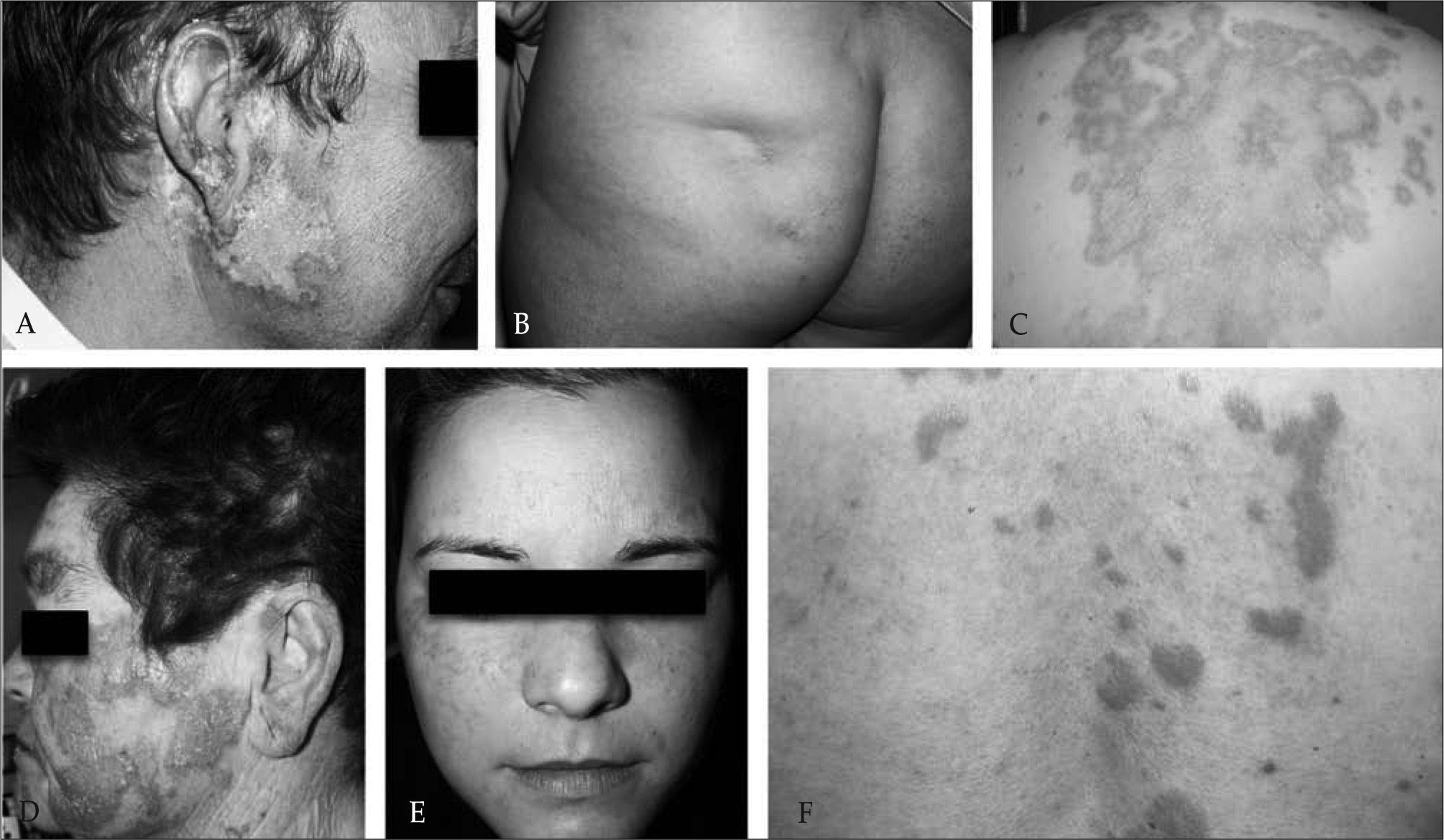
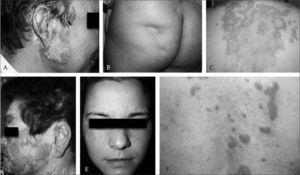
El lupus eritematoso discoide se caracteriza por pápulas o placas bien delimitadas, muchas veces redondeadas, eritematosas, cubiertas por una descamación adherida, de intensidad variable; en ocasiones, es posible observar los tapones córneos formados por pequeños cúmulos de queratina en el interior del ostium folicular (Fig. 2A). Estas lesiones siguen una evolución tórpida dejando en su zona central áreas de despigmentación, telangiectasias y atrofia o cicatriz. Esta apariencia clínica permite sospechar el diagnóstico con facilidad, si bien los hallazgos microscópicos permiten confirmarlo. Entre ellos destacan la degeneración vacuolar o hidrópica de la capa basal, cierto grado de atrofia de la epidermis y un infiltrado compuesto por linfocitos, dispuesto de manera parcheada alrededor de los vasos y los anejos(37). Todo ello hace que sea innecesario realizar, en la mayoría de las ocasiones, un estudio de inmunofluorescencia directa (IFD) para establecer el diagnóstico(38). La luz solar puede exacerbar las lesiones o, incluso, en algunos pacientes inducirlas, pero raramente el paciente relaciona la aparición de las mismas con la exposición a la radiación ultravioleta.
A. LECC. Lesión tipo lupus eritematoso discoide; B: Paniculitis lúpica. Depresión cutánea por atrofia del panículo adiposo; C: LECS anular. Lesiones de morfología anular en la espalda; D: LECS psoriasiforme. Placas eritematoescamosas en la cara; E: Pápulas y maculas eritematosas en el dorso de la nariz y las mejillas configurando el clásico rash malar; F: Lupus túmido. Pápulas y placas eritematosas infiltradas en la espalda.
La distinción entre LED localizado (lesiones limitadas al polo cefálico) y LED generalizado (lesiones extensas que pueden afectar cualquier zona del tegumento) tiene su interés desde el momento en que difieren en cuanto a su comportamiento clínico y pronóstico. En la forma generalizada menos del 10% de los pacientes llegarán a tener enfermedad inactiva, es más frecuente que afecte a los varones, hasta en el 30% pueden presentar ANA o alguna anomalía hematológica acompañante y pueden desarrollar lesiones en las palmas y las plantas, localización que genera una importante incapacidad funcional.
Las lesiones de LED pueden asentar en el cuero cabelludo u otras zonas pilosas, dejando como consecuencia de la inflamación una alopecia cicatrizal. También pueden localizarse en las mucosas o semimucosas, con más frecuencia en la semimucosa labial, dando lugar a unas lesiones muy similares en la clínica y la microscopia al LED cutáneo. Deben distinguirse de las ulceraciones orales y nasales, inespecíficas desde el punto de vista clínico y microscópico, que pueden verse en el lupus eritematoso sistémico (LES), en general, activo(39).
En el lupus eritematoso discoide hipertrófico, la escama gruesa y adherida se ve reemplazada por una hiperqueratosis masiva que confieren a la lesión un aspecto parecido al de una verruga o, incluso, un carcinoma epidermoide. Afortunadamente, suelen acompañar a otras lesiones típicas de LED, lo que facilita el diagnóstico. Si bien son lesiones que tienen una evolución muy tórpida y responden con dificultad al tratamiento, raramente se acompañan de enfermedad sistémica(40).
El lupus eritematoso profundo o paniculitis lúpica es una variante de LECC poco frecuente, que se caracteriza por la inflamación del panículo adiposo dando lugar, desde el punto de vista microscópico, a una paniculitis de tipo lobulillar. Afecta con más frecuencia a las mujeres en la edad media de la vida y es clásico que se inicie o agrave tras un traumatismo, ya sea la biopsia de la lesión, la punción de electrodos al realizar un electromiograma, una inyección o una cicatriz de cualquier causa(41). En la clínica, aparecen unos nódulos o placas de aspecto inflamatorio, a veces, dolorosos, indistinguibles de una paniculitis de cualquier otro tipo. La piel suprayacente puede ser normal, mostrar un leve eritema o presentar lesiones típicas de LED, necrosis o ulceración(42). Dos datos permiten sospechar el origen lúpico de una paniculitis; por un lado, la localización de las lesiones ya que tienen predilección por la región proximal de las extremidades, los hombros, las nalgas, la cara y, con menos frecuencia, el tronco, el cuero cabelludo, las mamas o, inclusive, la región periorbitaria(43–46); por otro, el desarrollo de profundas depresiones en la piel afecta como consecuencia de la desaparición del panículo adiposo tras la curación del proceso inflamatorio (Fig. 2B). Es por ello que estas lesiones pueden resultar muy deformantes a la vez que difíciles de tratar. El diagnóstico diferencial debe hacerse con otras paniculitis, lo cual no resulta difícil en la mayoría de las ocasiones si se hace una correcta correlación clínico-microscópica(47,48). La mayor parte de los pacientes con una paniculitis lúpica tienen enfermedad limitada a la piel y sólo algunos de ellos presentan otras complicaciones viscerales y cumplen criterios de LES(49,50).
Lupus eritematoso cutáneo subagudoEl término LECS describe un grupo de lesiones cutáneas específicas de LE caracterizadas por la aparición de brotes de lesiones máculo-papulosas, eritematosas, que afectan a la parte superior del tórax, el escote y la espalda, el cuello, la zona de extensión de brazos, antebrazos, el dorso de las manos respetando los nudillos, y raramente a la cara. Estas lesiones son recurrentes, habitualmente desencadenadas por la exposición al sol y curan sin dejar cicatriz atrófica permanente. Las lesiones, una vez iniciadas, pueden evolucionar hacia el desarrollo de dos aspectos morfológicos distintos: 1) las que muestran una extensión periférica con curación central por lo que adoptan una morfología anular (LECS-anular) (Fig. 2C); o 2) las que conforman pápulas o placas uniformemente papuloescamosas o psoriasiformes (LECS-papuloescamoso o psoriasiforme) (Fig. 2D). Los pacientes exhiben, en general, un tipo u otro de lesiones, pero en algunos casos pueden coexistir en un mismo paciente(51).
Este tipo de LEC es más frecuente en mujeres, predominantemente entre los 18 y los 40 años. Además del sol, entre los factores desencadenantes se encuentra un amplio listado de fármacos, la mayoría de ellos con acción fotosensibilizante (tiacidas, bloqueadores de los canales del calcio, captopril, antiinflamatorios no esteroideos, hipolipemiantes, griseofulvina, terbinafina, entre otros)(52,53).
Los cambios microscópicos en el LECS son similares a los ya comentados en el LECC; sin embargo, en esta forma de LEC predominan los cambios en la epidermis como son la vacuolización intensa de las células de la capa basal y la presencia de numerosos queratinocitos necróticos(54,55). En algunos casos la lesión de la epidermis es tan intensa que puede provocar necrosis de la totalidad de la misma o la formación de ampollas, también clínicamente visibles, por la extensa vacuolización de la capa basal y el edema subepidérmico, con aparición de un cuadro clínico similar a la necrólisis epidérmica tóxica (NET)(56). La IFD puede mostrar el depósito granular de IgG a lo largo de la membrana basal así como un depósito en forma de pequeños puntos fluorescentes (dust-like pattern) en las células de la capa basal(57).
El 70% aproximadamente de los pacientes con LECS son portadores de anticuerpos anti-Ro/SSA y anti-La/SSB. Los anticuerpos anti-DNA de doble cadena, anti-Sm y anti-RNP son poco frecuentes es este grupo de LEC(58). La misma proporción de pacientes pertenecen a un fenotipo de HLA coincidente, el haplotipo HLA-A1, B8, DR3(59) y presentan un predominio del polimorfismo -308a en el gen del TNF alfa. Algunos de los pacientes presentan además déficit de los factores del complemento C2, C4 o C1q(60).
Con el paso de los años, un porcentaje elevado de estos pacientes (45%) desarrollan xerostomía, xeroftalmía y otros signos compatibles con síndrome de Sjogren(61), enfermedad que comparte el mismo patrón inmunogenético. Todo ello ha permitido considerar que el término LECS no describe sólo un determinado tipo de lesiones cutáneas sino que describe también un subtipo clínico de LE con un comportamiento evolutivo muy característico y unas bases inmunológicas y genéticas muy homogéneas.
Lupus eritematoso cutáneo agudoCorresponde al clásico rash malar o eritema en alas de mariposa que consiste en máculas y pápulas eritematosas, confluentes, a veces acompañadas de edema, distribuidas de forma bilateral y simétrica en las mejillas y el dorso de la nariz (Fig. 2E). En ocasiones, esta erupción puede ser más extensa, afectando otras áreas de la cara como el mentón y la frente, o inclusive el tronco y las extremidades(2). En cualquier caso, son lesiones de aparición aguda, en numerosas ocasiones fotoinducidas, y evolución fugaz ya que suelen resolverse en pocas semanas sin dejar la más mínima cicatriz, en especial, si se instaura el tratamiento adecuado de la enfermedad sistémica, la cual está presente casi siempre cuando aparece este tipo de lesiones cutáneas. Se desarrollan con frecuencia en el transcurso de un LES ya diagnosticado, aunque en ocasiones pueden constituir la primera manifestación de la enfermedad.
En la microscopia pueden observarse los cambios propios de las lesiones cutáneas específicas de LE pero suelen ser más sutiles y, a veces, de más difícil interpretación(37,55). Puede ser útil, en estos casos, la realización de una IFD tanto en la piel enferma como sana ya que la probabilidad de identificar depósitos de inmunoglobulinas en la membrana basal es elevada en este contexto. Se prefiere la utilización de piel no fotoexpuesta para evitar los falsos positivos(62). Se ha demostrado que estos depósitos en la piel sana no fotoexpuesta correlacionan bien con la enfermedad renal activa; sin embargo, es una técnica engorrosa para el paciente y resulta innecesaria para este fin ante la disponibilidad de otras pruebas serológicas de fácil realización.
MANIFESTACIONES CUTÁNEAS DE DIFÍCIL CLASIFICACIÓNLupus eritematoso tumidusEl término "lupus eritematoso tumidus" (LET) fue acuñado en la literatura por primera vez en 1930(63) por Gougerot y Burnier cuando describieron a cinco pacientes que desarrollaron unas lesiones eritematosas, infiltradas, lisas sin descamación ni otro cambio en la superficie. Sin embargo, cuando a finales de la década de los años 70 Gilliam et al.(2) propusieron una innovadora clasificación de las lesiones cutáneas de LE en la que se distinguía básicamente los tres tipos de lesiones específicas descritas en los párrafos previos (LECC, LECS y LECA), el LET no se contempló de forma explícita como un tipo más sino que se incluyó como una variante o subgrupo del LECC. Ello favoreció que durante años no adquiriera el protagonismo que le correspondía si atendemos a su frecuencia real en la práctica diaria. De hecho, estudios recientes evidencian que la frecuencia del LET ha sido subestimada(64,65), en parte debido a este desconocimiento y porque en la práctica los pacientes con este tipo de lesiones eran diagnosticados de LECC.
En los últimos 10 años varios autores, tras recoger un número considerable de casos y analizar las características clínicas y microscópicas de las lesiones que desarrollaban, han rescatado el término LET para identificar a este subgrupo de pacientes y considerarlos un grupo distinto al clásico LECC. De hecho, desde el punto de vista clínico, las lesiones de LET no comparten ninguno de los rasgos clínicos que definen al LECC como son, en esencia, su carácter persistente y tendencia a dejar cicatriz cuando cura. En el LET las lesiones consisten en pápulas o placas eritematosas, de aspecto suculento, que a diferencia de lo que ocurre en el LECC, no presentan descamación, tapones foliculares ni atrofia y curan sin dejar cicatriz alguna (Fig. 2F)(63–71). Por otro lado, dichas lesiones aparecen en forma de brotes, casi siempre en relación con la exposición solar en primavera y verano, de forma predominante en las zonas de piel más fotoexpuestas como el escote, los hombros, la cara o los brazos. En el LECC, si bien las lesiones pueden empeorar con el sol, su inicio y desarrollo suele ser independiente de la exposición solar y, como ya se ha comentado, persisten durante meses y años tanto en verano como en invierno.
Desde el punto de vista sistémico, el LET sí que guarda una gran similitud con el LECC ya que en ambos grupos el riesgo de desarrollar enfermedad visceral de LE es muy pequeño. Los pacientes con LET no suelen presentar alteraciones analíticas propias del LES, como leucopenia o alteración de la función renal. Tampoco suelen asociar títulos elevados de anticuerpos antinucleares (ANA) ni tienen anticuerpos anti-Ro ni anti-DNA positivos(64, 65 67–70). De la misma manera, es excepcional que los pacientes con LET cumplan criterios de LES.
Si atendemos al carácter fotosensible del LET, es importante mencionar que las lesiones no aparecen de forma inmediata tras la exposición solar, sino tras un tiempo de latencia que varía entre las 24h y varias semanas(67,68,71,72). Este comportamiento, unido a la persistencia de los brotes a lo largo de todo el periodo estival, permite diferenciar el LET de una entidad también fotoinducida, idiopática, denominada erupción polimorfa lumínica (EPL), que puede ser muy similar, si no indistinguible, tanto desde el punto de vista clínico como microscópico, al LET(73).
Uno de los aspectos más controvertidos del LET es la definición de sus características microscópicas. En concreto, existe diversidad de opiniones en cuanto a la afectación o daño de la epidermis. Si bien algunos trabajos han extendido la idea de que en el LET la epidermis se encuentra intacta(68,74), otros autores hallan en la mayoría de sus pacientes cambios epidérmicos (atrofia, degeneración vacuolar, hiperqueratosis, taponamiento folicular) en grado leve o moderado(65). Este es un dato importante ya que la completa ausencia de daño en la epidermis podría ser suficiente para cuestionar, según algunos autores, la verdadera relación del LET con el lupus eritematoso(75). En cuanto a los hallazgos en la dermis, el LET presenta un infiltrado linfocitario perivascular y perianexial, igual que el resto de formas de LEC, y depósito abundante de mucina(65,68,74).
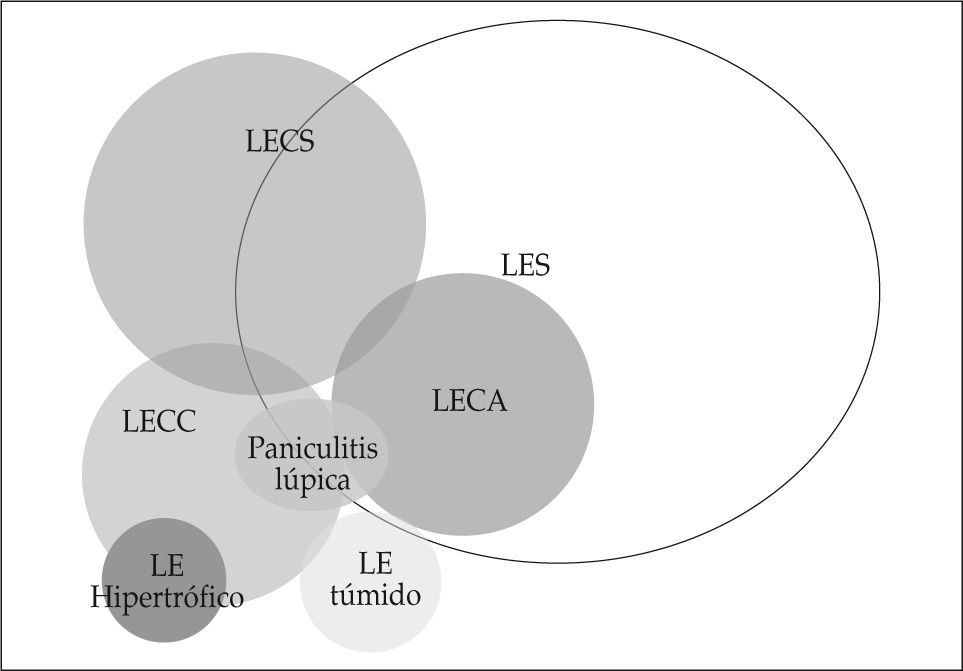
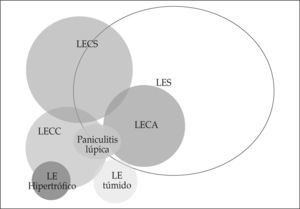
RELACIÓN DEL LUPUS ERITEMATOSO CUTÁNEO Y LA ENFERMEDAD SISTÉMICAEl LEC puede constituir la única manifestación clínica de la enfermedad. Sin embargo, se debe tener siempre en cuenta que en cualquier momento pueden aparecer síntomas de enfermedad visceral. El riesgo de que ello ocurra es muy variable y depende del tipo de lesión cutánea que el paciente desarrolle. En el LECC las complicaciones viscerales son raras; sólo entre un 5 y 10% de los pacientes pueden en algún momento cumplir 4 o más de los criterios de la AAR para el diagnóstico de LES y, en general, éstos son los pacientes que desarrollan lesiones extensas de LECC (LECC generalizado). En el LECS, alrededor del 50% de los enfermos cumplen estos 4 criterios, lo que indica una mayor probabilidad de hallar afección visceral o trastornos inmunológicos acompañantes. Sin embargo, esta actividad visceral no suele ser grave y, en general, se manifiesta en forma de complicaciones músculoarticulares; sólo en el 10% de los casos cabe esperar complicaciones renales o neurológicas graves(61,76). En el LECA, las lesiones cutáneas constituyen, en general, una manifestación clínica más y con poca repercusión dentro de la constelación de síntomas que presentan los pacientes con afección sistémica y en la mayor parte de los casos se trata de pacientes con LES grave. En la figura 3 se representa de una forma gráfica el espectro de la actividad sistémica de un paciente con lesiones cutáneas de LE.
TRATAMIENTOLa finalidad del tratamiento del LEC es, ante todo, mejorar la apariencia del paciente y prevenir el desarrollo de cicatrices, atrofia o trastornos de la pigmentación. Con el objeto de medir o cuantificar la actividad y las secuelas del LEC, así como la respuesta al tratamiento, recientemente se ha propuesto el sistema CLASI (del inglés, cutaneous lupus erythematosus disease area and severity index)(77).
Entre las recomendaciones generales, en primer lugar, es necesario excluir la posibilidad de que se trate de un LEC inducido por fármacos (ver en el apartado LECS). En segundo lugar, es importante recomendar a los pacientes fumadores con un LEC, que abandonen este hábito ya que el tabaco podría actuar como un agravante de las lesiones cutáneas o bien interferir en el mecanismo de acción de los fármacos antipalúdicos.
Los tres pilares del tratamiento del LEC son la fotoprotección, los corticoides tópicos y los antipalúdicos de síntesis(78,79). La fotosensibilidad es un fenómeno frecuente en los pacientes con LEC y los estudios de fotoprovocación han demostrado que el espectro de radiación ultravioleta (UV) capaz de desencadenar lesiones de LE incluye a los UVA, UVB y, a veces, la luz visible. Por tanto, el uso de fotoprotectores resulta fundamental en el tratamiento de estos pacientes y el fotoprotector ideal debería ser de amplio espectro y resistente al agua. Además, es importante recomendar otras medidas de fotoprotección como evitar la exposición solar entre las 10 de la mañana y las tres de la tarde, y utilizar prendas de vestir no excesivamente escotadas.
La aplicación tópica de corticoides resulta muy útil cuando las lesiones son escasas y están limitadas a una pequeña área de piel, como ocurre con frecuencia en el LECC y el LE túmido. Cuando las lesiones no responden al tratamiento tópico o, por su extensión, éste resulta insuficiente, el tratamiento sistémico de primera línea son los antipalúdicos de síntesis. Se pueden utilizar tres antipalúdicos: sulfato de hidroxicloroquina, fosfato de cloroquina y mepacrina (o quinacrina en USA). Dado que sulfato de hidroxicloroquina parece tener menos riesgo de toxicidad ocular respecto a fosfato de cloroquina, suele indicarse aquél como el de primera elección. Si en un plazo de 2–3 meses no se obtiene una respuesta favorable, puede substituirse por fosfato de cloroquina. Mepacrina o quinacrina, que no está comercializada en nuestro país, puede ser una alternativa en caso de falta de respuesta a los anteriores. No se aconseja su prescripción aislada sino en asociación con alguno de los otros dos antipalúdicos.
Los glucocorticoides orales resultan poco eficaces en el tratamiento del LECC y sólo tienen cierta utilidad en el tratamiento de las formas agudas e intensas del LECS, el
LECA y en las lesiones de vasculitis que pueden verse en un LE complicado. En caso de prescribirse es recomendable hacerlo junto con los antipalúdicos y a dosis bajas o intermedias. En general, debería evitarse el uso crónico de glucocorticoides orales o intramusculares a menos que sea necesaria su administración por la enfermedad sistémica. En cuanto a la posología, con el objeto de reducir al máximo el riesgo de retinopatía, se recomienda no sobrepasar las dosis de mantenimiento que corresponden a algo menos de 4 mg/kg/día de cloroquina y 6,5 mg/kg/día de hidroxicloroquina, calculando en relación al peso ideal, y siempre que la función renal y hepática del paciente sea normal.
El resto de fármacos propuestos en el tratamiento del LEC tienen una utilidad limitada(80). El acitretino, un retinoide oral, puede ser eficaz en los pacientes que desarrollan un LECC hipertrófico o cuando las lesiones asientan en las palmas y las plantas(81). La talidomida se ha demostrado, en diversos estudios abiertos, que resulta altamente eficaz en el tratamiento del LEC, pero es un fármaco teratogénico, los efectos secundarios son frecuentes y la recaída tras dejar el fármaco la norma(82). La lenalidomida, un derivado de talidomida con menos efectos secundarios, sobre todo neurológicos, podría ser una alternativa. Los agentes inmunosupresores se han descrito útiles en el tratamiento del LEC recalcitrante. La azatioprina es uno de los más utilizados, pero quizás metotrexato y micofenolato mofetilo sean de los más beneficioso . Respecto a los fármacos biológicos existe muy escasa experiencia en el tratamiento del LEC y, por el momento, ninguno de ellos ha demostrado eficacia y seguridad en esta enfermedad.
CONSIDERACIONES FINALESAunque desde un punto de vista general algunos de los mecanismos etipoatogénicos del LE han sido ampliamente estudiados, es posible que existan modificaciones en estos mecanismos patogénicos que contribuyan a la inducción de lesiones en uno u otro órgano. La definición precisa de estos mecanismos así como de los componentes celulares responsables en cada caso contribuirán sin duda a un mejor diagnóstico y tratamiento de cada una de las entidades enunciadas.