El sistema inmunológico (SI) es una exquisita maquinaria implicada en el mantenimiento de la integridad del organismo y en la regulación de su propia función, para adaptar sus estrategias de reconocimiento molecular en un contexto dinámico. Estas estrategias son moduladas por la naturaleza del estímulo antigénico, el estado interno de sus componentes y el microambiente local, que determinarán una respuesta de tolerancia o de inmunidad efectora. A lo largo de la historia de la inmunología se ha mantenido el término arquetípico «propio-no propio» como axioma del reconocimiento inmunológico, en clara alusión a la identidad del individuo que, sin embargo, debería ser desplazado por sus numerosas excepciones. Presentamos aquí una revisión sobre los modelos teoréticos del funcionamiento del SI desde la perspectiva de su propiedad básica de reconocimiento antigénico, así como una reflexión sobre la necesidad de desarrollar nuevos modelos que permitan entender el funcionamiento del SI como un sistema integrado indisoluble de los sistemas psiconeurológico y endocrino.
The immune system (IS) is an exquisite machine involved in the maintenance of the integrity of the organism, and in the regulation of its own function to adapt its diverse strategies of molecular recognition within a dynamical framework. These strategies are modulated by the nature of the antigenic stimulus, the internal status of its components, and the local microenvironment, which will determine an immune response of immunity or tolerance. Throughout the history of Immunology, the archetypical «self/non-self» axiom of the immune recognition, in direct reference to the identity of the individual, has been consistently used, which should be nevertheless displaced by its numerous exceptions. We present a review of the theoretical models of the IS functioning from its basic property of antigenic recognition. We discuss the need to develop new models that enable to comprehend the IS functioning as an indissoluble integrated system with psychoneurological and endocrine systems.
Una cuestión esencial de la inmunología es comprender qué desencadena la respuesta inmunológica y cómo se desarrolla, lo que continúa siendo en la actualidad sujeto de intenso debate1,2. La función central del sistema inmunológico (SI) consiste en su capacidad de reconocimiento y mantenimiento de la integridad biológica del organismo como unidad y su defensa frente a agresiones externas en forma de patógenos y toxinas, fundamentalmente. La generación de una respuesta inmunológica eficiente frente a antígenos extraños debe acompañarse necesariamente de una regulación rigurosa de la activación inmunológica para prevenir daños colaterales. La actividad reguladora evita tanto una respuesta inmunológica frente a antígenos propios, como una respuesta exagerada a patógenos que induciría daño tisular y esta constituye el segundo brazo del SI que se denomina tolerancia. Por tanto, la función primaria básica de la respuesta inmunológica corresponde al reconocimiento del antígeno extraño junto con la tolerancia frente a lo propio. Sin embargo, veremos que la frontera que separa lo propio de lo no propio no es siempre nítida, debido, entre otros factores, a la naturaleza dinámica de lo propio.
Lo propio se define actualmente desde la perspectiva del modelo dinámico, de un sistema abierto con múltiples interacciones que ocurren simultáneamente. Este vendría representado por la reciprocidad entre moléculas internas, fisiológicas, de nuestro organismo que se generan a lo largo del desarrollo con aquellas moléculas con las que entramos en contacto cada día, desde el aire en los pulmones, los alimentos, la flora bacteriana, hasta el otro extremo representado por el contacto con antígenos propios modificados (no fisiológicos) por infecciones y tumores3. En el contexto de esta visión dinámica de lo propio, han ido surgiendo varias excepciones o imprecisiones sobre la insuficiencia de la visión arquetípica de lo propio/no propio en el marco del reconocimiento inmunológico4,5. Existen diversas e importantes excepciones al concepto de que el SI reacciona frente a lo no propio, como son la tolerancia materna frente al embrión, la existencia de quimerismo o la tolerancia a injertos4. En un primer análisis se desprende que, a diferencia de lo que postula el modelo propio-no propio, las categorías de «inmunogénico» y «exógeno» parecen no ser equivalentes2. Por otra parte, también existen excepciones a la reacción frente a lo no propio y así existe un consenso actual que considera la microbiota como un componente esencial de nuestro organismo y parte integrante en la tolerancia y en la homeostasis del SI. La microbiota constituye un órgano en sí mismo, tanto por su característica de barrera física frente a la entrada y colonización por patógenos o moléculas extrañas, como funcional a través de la secreción de diversos neurotransmisores y citocinas, o la producción de vitaminas K y del grupo B.
Otra importante excepción al axioma de no reacción frente a lo propio sería existencia de células autorreactivas naturales. En efecto, los linfocitos T que presentan una reactividad débil frente a autoantígenos son seleccionados positivamente en el timo. La existencia de una autoinmunidad natural requiere además que los linfocitos autorreactivos sean regularmente estimulados para su supervivencia. En el extremo opuesto, patológico, de esta autorreactividad se situarían las enfermedades autoinmunes. A lo largo del aprendizaje tímico de los linfocitos de estirpe T se produce la selección de una ínfima subpoblación del total de 109 a 1015 posibles clones de linfocitos. Esto implica que fueron seleccionados positivamente durante el desarrollo del SI mediante la presentación de autoantígenos, constituyendo de esa manera la paradoja existente de que el reconocimiento posterior de lo no propio depende del reconocimiento previo de lo propio. Por último, la existencia de numerosas subpoblaciones linfocitarias reguladoras, que estructuran el desarrollo de la tolerancia periférica del SI, no ha sido incluida en ningún modelo teorético de la inmunología6. Se ha descrito un defecto funcional en estas poblaciones reguladoras de la inmunidad como un posible factor desencadenante en la fisiopatología de la enfermedad autoinmune7,8.
El objetivo de este artículo es presentar una revisión actualizada sobre las teorías más recientes del SI desde la perspectiva de su propiedad básica de reconocimiento antigénico y se exponen argumentos que apoyan la necesidad de desarrollar nuevos modelos que permitan entender el funcionamiento del SI como un sistema integrado indisoluble o metasistema funcional con los sistemas psiconeurológico y endocrino.
Recorrido histórico de la evolución de las diferentes teorías sobre el reconocimiento inmunológicoLa historia de las ideas en inmunología ha seguido un curso no siempre acorde con el orden de adquisición de funciones a lo largo de la evolución natural (tabla 1), sino que, paradójicamente, los primeros modelos teoréticos se postularon sobre el reconocimiento antígeno-específico del SI adaptativo, mientras que el descubrimiento sobre los mecanismos de reconocimiento del SI innato de patrones conservados en los patógenos a lo largo de la evolución, función más antigua en la escala filogenética, se ha producido en fechas relativamente recientes y se adivina un largo camino aún por recorrer.
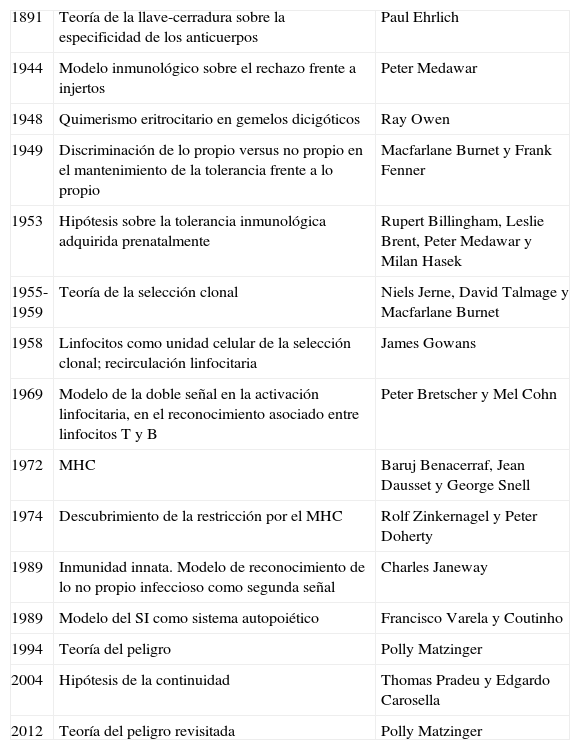
Etapas clave sobre las teorías sobre el reconocimiento inmunológico
| 1891 | Teoría de la llave-cerradura sobre la especificidad de los anticuerpos | Paul Ehrlich |
| 1944 | Modelo inmunológico sobre el rechazo frente a injertos | Peter Medawar |
| 1948 | Quimerismo eritrocitario en gemelos dicigóticos | Ray Owen |
| 1949 | Discriminación de lo propio versus no propio en el mantenimiento de la tolerancia frente a lo propio | Macfarlane Burnet y Frank Fenner |
| 1953 | Hipótesis sobre la tolerancia inmunológica adquirida prenatalmente | Rupert Billingham, Leslie Brent, Peter Medawar y Milan Hasek |
| 1955-1959 | Teoría de la selección clonal | Niels Jerne, David Talmage y Macfarlane Burnet |
| 1958 | Linfocitos como unidad celular de la selección clonal; recirculación linfocitaria | James Gowans |
| 1969 | Modelo de la doble señal en la activación linfocitaria, en el reconocimiento asociado entre linfocitos T y B | Peter Bretscher y Mel Cohn |
| 1972 | MHC | Baruj Benacerraf, Jean Dausset y George Snell |
| 1974 | Descubrimiento de la restricción por el MHC | Rolf Zinkernagel y Peter Doherty |
| 1989 | Inmunidad innata. Modelo de reconocimiento de lo no propio infeccioso como segunda señal | Charles Janeway |
| 1989 | Modelo del SI como sistema autopoiético | Francisco Varela y Coutinho |
| 1994 | Teoría del peligro | Polly Matzinger |
| 2004 | Hipótesis de la continuidad | Thomas Pradeu y Edgardo Carosella |
| 2012 | Teoría del peligro revisitada | Polly Matzinger |
MHC: complejo mayor de histocompatibilidad.
Adaptada de Greenberg9.
Paul Ehrlich (1854-1915) es considerado uno de los principales padres de la inmunología. Erlich postuló una primera teoría sobre el reconocimiento inmunológico antígeno-específico propio de la inmunidad adaptativa, denominada teoría de la cadena lateral de la relación toxina-antitoxina. Ehrlich fue probablemente también el primer científico que introdujo el concepto de discriminación entre lo propio-no propio, mecanismo que prevendría la producción por el organismo de amborreceptores (anticuerpos) o cadenas laterales dirigidos frente a sus propios tejidos, acuñando el concepto de «horror autotoxicus», en un contexto amplio de regulación de la defensa9. Cada uno de los amborreceptores se consideraba específico para una toxina particular.
En la primera mitad del s. xx se desconocía cómo se generaba la diversidad de anticuerpos, asumiendo que estos no podían estar preformados, sino generados a demanda según la exposición al antígeno. En 1956, Sir Macfarlane Burnet publicó un libro en el que mantenía que era el antígeno quien dirigía la formación del anticuerpo específico. Posteriormente, Burnet propuso el modelo de discriminación entre lo propio-no propio como la base evolucionista del SI en su libro publicado en 1969, Propio y no-propio: inmunología celular. Libro primero, donde lo definió como un axioma de su teoría de la selección clonal.
Algunos años después, 3 científicos −Niels Kaj Jerne, David Talmage y el mismo Burnet− desarrollaron de forma independiente la teoría de la selección clonal. En 1955, Jerne publicó un artículo que sería seminal en la historia de la inmunología, en el que defendía la hipótesis de que cada animal tenía un amplio conjunto de globulinas naturales que se habían diversificado por un mecanismo desconocido o teoría de la selección natural de la formación de anticuerpos10. La función de un antígeno según su teoría sería la de combinarse con dichas globulinas sirviendo como transporte de globulinas seleccionadas a células productoras de anticuerpos, lo que induciría una producción de copias idénticas de las globulinas presentadas a las mismas. Esta publicación se seguiría de las de Talmage11 y Burnet12. Según la teoría de la selección clonal, los animales contienen numerosas células denominadas linfocitos, y cada linfocito responde a un antígeno particular en virtud de moléculas receptoras específicas de superficie. Tras el contacto con el antígeno, se induce la estimulación del linfocito a proliferar (expansión clonal) y a diferenciarse. El clon expandido sería el responsable de la respuesta secundaria, mientras que las células diferenciadas (efectoras) secretarían los anticuerpos. Su visionaria teoría de la selección clonal tuvo un papel fundacional en la inmunología y resolvía el dilema de Ehrlich, prediciendo un proceso de aleatorización por el cual se generaban los repertorios de anticuerpos, si bien no explicaba cómo se producía el reconocimiento del antígeno13.
Por otra parte, ya existía la observación clínica de que los injertos cutáneos tenían una elevada tasa de fracaso si provenían de otro individuo (aloinjertos). El Consejo Británico de Médicos asignó a un joven zoólogo formado en Oxford llamado Peter Medawar la tarea de investigar sobre la causa del rechazo del injerto. En 1943, Medawar y Gibson publicaron un artículo sobre la evolución de los injertos basado en un solo paciente con quemaduras que había recibido numerosos injertos de piel14. Ambos concluyeron que los autoinjertos no se rechazaban, mientras que los aloinjertos fracasaban y que la destrucción de la epidermis se debía un mecanismo de inmunización activa. Medawar demostró posteriormente en modelos animales que el rechazo del injerto era un fenómeno inmunológico15.
Burnet y Medawar compartieron el premio Nobel en 1960 por sus estudios proponiendo que la tolerancia inmunológica está inducida por los antígenos tisulares que están presentes durante el desarrollo del SI en el periodo embrionario y neonatal.
Jerne, a su vez, recibe también el premio Nobel en 1984 por su teoría de la red, en la cual relaciona la producción de anticuerpos con la especificidad en el desarrollo y control del SI, que sería la base para la generación posterior de anticuerpos monoclonales. Jerne fue además el primero en sugerir la existencia de una red funcional basada en el reconocimiento de patrones de los idiotipos presentados por los linfocitos, que es responsable de la regulación interna del SI. Solo el 15-20% de los linfocitos estarían disponibles en el repertorio inmunológico para participar en esta red funcional, mientras que el resto estarían disponibles para responder frente al antígeno.
Nuevos hallazgos sobre el reconocimiento del antígeno por el SI se produjeron a partir de 2 fuentes distintas: estudios sobre genética tumoral en ratones, desarrollados por Snell en 1930, que observó que los injertos tumorales eran aceptados entre ratones inbred pero no entre los ratones de diferentes cepas y que acuñó el concepto de genes de histocompatibilidad. Snell estableció que el locus principal era idéntico al locus que codificaba el antígeno ii, que denominó como locus de histocompatibilidad 2, o H-2. Análogamente, estudios de aglutinación de los leucocitos de la sangre por el suero de pacientes transfundidos, realizados por Dausset en los años 1950 en colaboración con Peter Gorer, permitieron la observación de que los pacientes que recibían numerosas transfusiones producían anticuerpos capaces de aglutinar leucocitos del donante, pero no los del propio paciente. Estudios posteriores en familias indicaban la existencia de un sistema determinado genéticamente, de los denominados antígenos de histocompatibilidad (HLA), que era ortólogo al H-2 del ratón. La investigación en ratones y hombres era complementaria y Dausset, Snell y Benaceraff fueron galardonados con el premio Nobel en 1980.
El primer modelo teorético sobre tolerancia al trasplante se debe a Ray Owen, un genetista de la Universidad de Wisconsin que estudiaba la herencia de los antígenos eritrocitarios en el ternero. En 1945 describió un modelo de quimerismo en gemelos dicigóticos bovinos, que compartían circulación placentaria, lo que conducía al intercambio de células madre hematopoyéticas durante la vida embrionaria y el establecimiento de un estado de quimerismo hematopoyético sin rechazo mutuo. Junto con Rupert Billingham, desarrolló una serie de experimentos con injertos que demostraba el concepto de la tolerancia del trasplante adquirida durante la etapa neonatal. Unos años más tarde, Burnet y Fenner reconocieron la importancia de los hallazgos de Owen en su libro The production of antibodies, que condujo a Burnet al modelo de reconocimiento inmunológico de lo no propio y la existencia de una tolerancia adquirida a constituyentes no propios por exposición a los mismos en la etapa prenatal o perinatal. Postularon además que el proceso de reconocimiento de lo propio tendría lugar durante el desarrollo embrionario.
El descubrimiento de la restricción por el MHC como base genética del modelo de reconocimiento de lo propio-no propio llegaría en 1974, cuando Peter Doherty y Rolf Zinkernagel investigaban el papel de la respuesta inmunológica de los linfocitos T en el modelo de la coriomeningitis viral16. Demostraron que la destrucción de las células del cerebro en esta enfermedad era causada por la respuesta inmunológica frente al virus. Para confirmar esta teoría, mezclaron células de ratón infectadas por el virus con linfocitos T de otros ratones infectados. Los linfocitos T destruyeron las células infectadas, pero solo si estas provenían de una cepa de ratón idéntica y sorprendentemente los linfocitos T «ignoraban» las células infectadas por el virus que provenían de otra cepa de ratón distinta. Una década se necesitó para descubrir que el antígeno en cuestión era un péptido unido a la molécula del MHC. Por tanto, la identidad de la estructura molecular que constituía lo propio venía dada por la molécula del MHC. Adicionalmente, el hecho de que las moléculas del MHC posean el mayor grado de polimorfismo genético del organismo parecía indicar que la intensidad de la respuesta inmunológica estaría determinada por el alelo del MHC específico seleccionado.
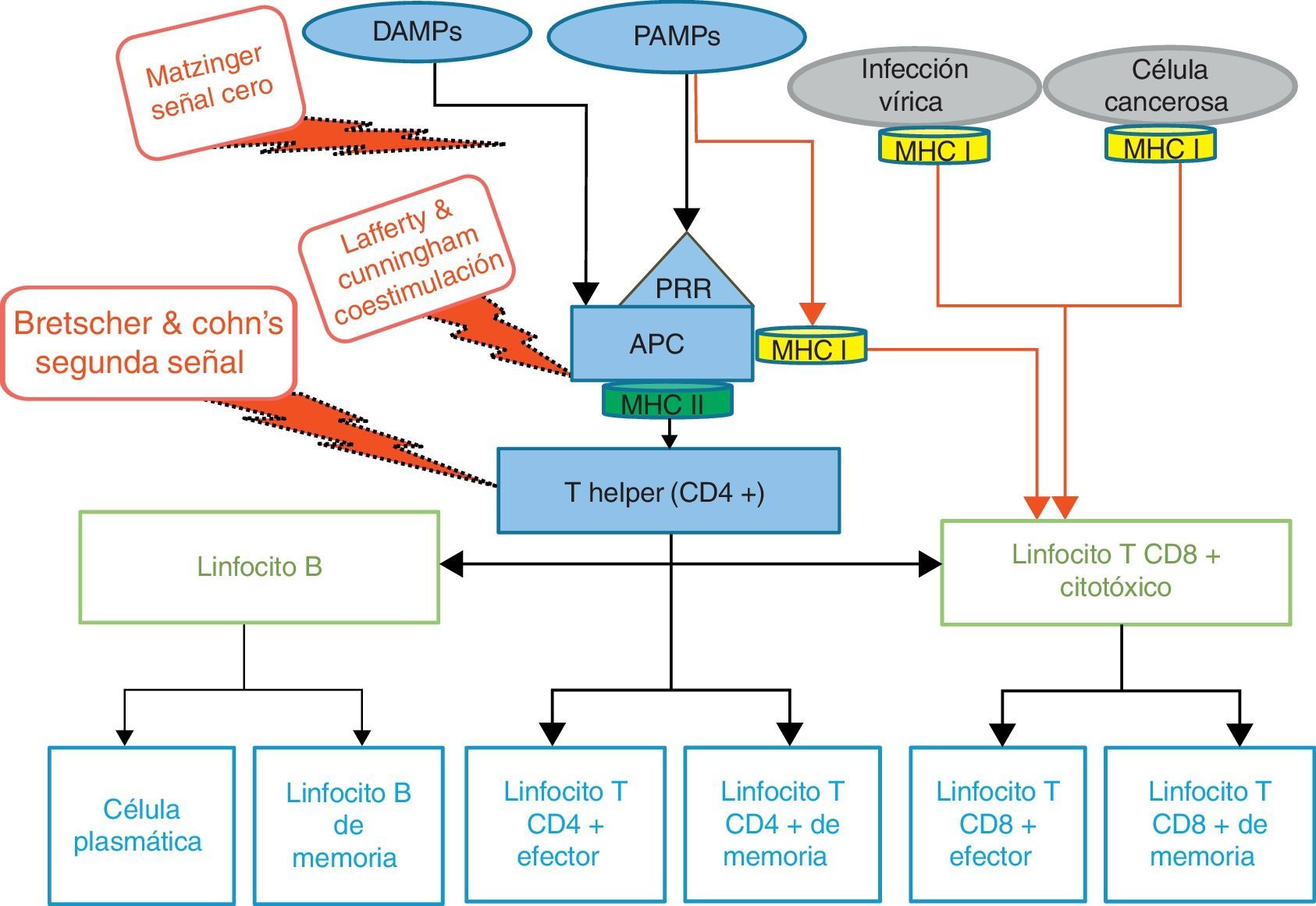
Burnet propuso un modelo teorético sobre la activación de los linfocitos T antes de que se conocieran las señales de coestimulación en la sinapsis inmunológica. El modelo de la segunda señal en la activación linfocitaria fue postulado por Peter Bretscher y Melvin Cohn en 196817, en el que señalaron que la activación de un linfocito T colaborador requería una primera señal constituida por la interacción del receptor del linfocito B con el antígeno (receptor antibody of the antigen-sensitive cell) y una segunda señal accesoria inducida por moléculas menos específicas (carrier antibody). Este modelo fue posteriormente modificado por los estudios de Kevin Lafferty y Alistair Cunningman, en 1975, en el que la primera señal era provista por el linfocito T tras reconocer al antígeno y la segunda señal dependía de la célula presentadora del antígeno (APC). Clásicamente se consideraba que los linfocitos T CD4+ helper y T CD8+ solo podían reconocer el antígeno cuando este era presentado por una molécula del MHC tras ser procesado en el interior de la célula, antígenos exógenos vía MHC de clase ii (MHCII) a los linfocitos T CD4+ y antígenos endógenos vía MHC de clase i (MHCI) a los linfocitos T CD8+, mecanismo denominado restricción MHC. Pero, en 1976, Michael J. Bevan demostró que la dicotomía funcional de la presentación antigénica endógena, característica de MHCI y la presentación antigénica exógena característica de los MHCII no es absoluta18. Dado que la totalidad de las células nucleadas expresan MHCI, pueden actuar como presentadoras a los linfocitos T CD8+. Sin embargo, solo las APC que expresan constitutivamente MHCIII pueden activar los linfocitos T CD4+. Hoy sabemos que, en ciertas circunstancias, determinadas subpoblaciones de células dendríticas (DC) tienen la capacidad de presentar antígenos exógenos en el contexto de MHCI por un proceso denominado presentación cruzada, lo que supone una ventaja para inducir respuestas T CD8+ citotóxicas eficientes en infecciones virales o ante la presencia de células cancerígenas (fig. 1), aunque dependiendo del ambiente se pueden también inducir respuestas de tolerancia a través de la presentación cruzada de antígenos exógenos19–21.
Visión esquemática de la respuesta inmunológica. Clásicamente los antígenos extracelulares son presentados por las células presentadoras de antígenos a través del CMHII y los antigenos intracelulares (células infectadas por virus o células cancerosas) a través de CMHI (línea gris). A la izquierda (líneas negras), las APC estimuladas a través de los receptores de reconocmiento de patrones (PRR) por antígenos exógenos (no intracelulares), que corresponde a la señal 0 (PAMP, DAMP), presenta el péptido proveniente de la degradación del antígeno a través del CMHII a la célula T helper, o señal 1. Para que se genere la activación y la proliferación del linfocito T es necesaria una señal coestimuladora, o señal 2. Esto dará lugar a una respuesta celular (célulasT efectoras), humoral (células B) y de memoria (T&B).
A la derecha (líneas rojas) se esquematiza la presentación cruzada, mediante la cual antígenos extracelulares son presentados a los linfocitos T citotóxicos por determinadas APC a través de CMHI. La presentación cruzada puede desencadenar tolerancia o bien inmunidad.
Hasta 1989 no se avanzó en el paradigma sobre los mecanismos de reconocimiento de la inmunidad innata. Charles Janeway propuso un modelo de reconocimiento en el que el SI reconoce lo no propio infeccioso y lo concilió con el modelo de la segunda señal, en este caso constituida por una APC activada por estructuras muy conservadas y repetitivas en los patógenos y ausentes en el hospedador, los denominados «patrones moleculares asociados a patógenos» (PAMP). Acuñó el término «receptores de reconocimiento de patrones» (PRR) para un tipo de moléculas no clonales presentes en las APC, que reconocen los PAMP22. Los componentes de la inmunidad innata actúan precozmente en la respuesta inmunológica, respondiendo cuando son estimulados de una forma estereotipada que inicia la respuesta inmunológica, carecen de memoria inmunológica y tienen un origen evolutivo mucho más antiguo que el SI adaptativo. En 1997, Iwasaki y Medzhitov identificaron el homólogo humano de una proteína transmembrana en la Drosophila, los receptores de tipo Toll (TLR), que se unían a los lipopolisacáridos, un componente de la pared de las bacterias gramnegativas23. Más aún, la expresión ectópica de este receptor resultaba en la secreción de citocinas proinflamatorias y en la regulación al alta de moléculas coestimuladoras capaces de desencadenar la activación de los linfocitos T. Su modelo explicaba muy bien el inicio de la respuesta inmunológica frente a patógenos, pero no frente a células tumorales y alogénicas24.
Para resolver este vacío, Polly Matzinger plantea en 1994 un «modelo del peligro», que proporciona un mecanismo conceptualmente distinto por el que el SI discrimina un antígeno por dañino/no dañino independientemente de su origen25. Matzinger postula que las APC, más que ser estimuladas por los PAMP, son estimuladas por el reconocimiento de señales de «peligro» emitidas por las células lesionadas o necróticas, es decir, que el SI discriminaría entre lo dañado/no lesionado para inducir una respuesta inmunológica, visión igualmente dicotómica y que sitúa el inicio de la activación en la APC, y que depende de los receptores de alarma en el tejido diana26. Las diversas moléculas liberadas por las células lesionadas, entre las cuales las más importantes son las proteínas de choque térmico, han demostrado estimular las CPA27. En los últimos años se ha observado que existen diversas moléculas endógenas que pueden actuar como señales de peligro y ser reconocidas por los TLR, induciendo la activación de la respuesta inmunológica. Según la revisión actual de la teoría postulada por Matzinger, cada órgano educa al SI de forma particular28. Por ejemplo, las proteínas de la familia del colágeno C1q, las lectinas de unión al manano (MBL) o las ficolinas, todas ellas moléculas de reconocimiento de patrones de hidratos de carbono, se expresan de forma diferencial en diversos tejidos, modulando el tipo y extensión de la respuesta inmunológica según la diferente percepción del peligro.
Francisco Varela y Antonio Coutihno postularon una nueva hipótesis sobre el funcionamiento del SI como continuación a las teorías de Jerne sobre la red idiotípica, en la que el SI no representaría tanto la metáfora de un sistema de defensa, sino la misma identidad somática del individuo, un «sistema autopoiético multicelular de mantenimiento», o sistema autorregulado de intercomunicaciones moleculares y celulares que actúa como un verdadero sistema cognitivo del organismo29,30. Varela aporta a este modelo la visión de que la capacidad de estímulo de un antígeno no está determinada por el antígeno en sí, es decir, no viene impuesta desde el exterior, sino por la interacción del antígeno con el SI en unas condiciones del entorno fisicoquímicas determinadas entendidas como un todo, interpretación innovadora que aleja por primera vez el factor determinista externo de la respuesta inmunológica, equilibrándola con factores internos31.
Más recientemente, Thomas Pradeu y Edgardo Carosella han propuesto una hipótesis alternativa a la teoría del reconocimiento de lo propio-no propio como criterio de inmunogenicidad la denominada «teoría de la continuidad»4. Parten del concepto de que la identidad del individuo se desarrolla en un proceso de «interacción constructivista», constituida no solamente por nuestro patrimonio genético en influencia recíproca con el entorno, sino que se construye dinámicamente por la integración o asimilación «del otro» en nosotros32. La aportación de la teoría de la continuidad consiste en proponer un nuevo criterio de inmunogenicidad que no se basa en el origen exógeno del antígeno, sino en «la expresión de patrones moleculares inusuales fuertemente modificados, en condiciones que determinan la transición de las reacciones inmunitarias normales continuas a un nivel superior de reactividad que conduce a una respuesta inmunológica», es decir, los mecanismos desencadenantes de la activación se entienden como una ruptura de la continuidad.
En la frontera. Reflexión sobre el reconocimiento inmunológicoEl SI es capaz de reconocer todo tipo de antígenos existentes, incluso frente a moléculas a las que no ha estado expuesto previamente. No obstante, el reconocimiento de lo no propio como hemos visto no implica necesariamente el desencadenamiento de una respuesta inmunológica efectora. Debido a que las posibilidades de error son también grandes, existen mecanismos ultraespecíficos junto con otros menos específicos para eliminar los excesos de respuesta hacia lo propio, bien como una reacción autoinmune exagerada o bien en el contexto de daño colateral en una respuesta inflamatoria excesiva. Además, existen limitaciones en el proceso de reconocimiento, a través de las cuales los agentes infecciosos son capaces de evadir el SI e infiltrarse en el organismo. Por tanto, los sistemas de regulación y de control de calidad son enormemente importantes y desde una perspectiva evolucionista es en los que se han producido más cambios y adquisiciones genéticas. El equilibrio entre inmunidad y tolerancia es necesario para el mantenimiento de la integridad durante todo el proceso del desarrollo, desde la organogénesis y para vigilar la retrodiferenciación de las células somáticas33,34.
La homeostasis se define como la capacidad del SI de alcanzar y mantener un estado de equilibrio de la función interna del organismo en un entorno en permanente cambio. Para ello, el SI actúa en conjunción con los sistemas psiconeurológico y endocrino, de los cuales es indisoluble si se pretende entender su función. El SI se adapta en cada momento a los cambios internos del organismo a lo largo del desarrollo, como también a los cambios externos, como por ejemplo todos aquellos que se inducen a través de la interacción con los microorganismos patógenos. Los microorganismos, patógenos y no patógenos, son los factores externos que más han influido y condicionado la evolución de nuestro SI, seleccionando por presión aquellas mutaciones más adaptadas a la supervivencia celular.
La interacción entre patógeno y hospedador se reconoce como un fenómeno omnipresente en todas las formas de vida y se expresa mediante una gran diversidad de estrategias de defensa bilaterales, en un proceso dinámico denominado coevolución. En este contexto coevolutivo, los virus y las bacterias son capaces de multiplicarse exponencialmente, mutar rápidamente frente a los mecanismos de defensa del hospedador; frente a ellos, los organismos más complejos como los vertebrados superiores adquirieron un sistema de defensa ultrasofisticado a través de un SI adaptativo, que les permitiera a través de sus células inmunes ser capaces de una proliferación y respuesta específica y plástica frente a casi un número ilimitado de patógenos, mediante un sistema con niveles de complejidad creciente perfectamente coordinados entre sí y con un elevado grado de redundancia en los mecanismos.
El neodarwinismo como teoría científica enfatiza la competición entre especies como el motor del cambio evolutivo a través de la selección natural por los recursos y en un entorno determinado. La simbiosis, fenómeno que describe la coevolución de 2 especies diferentes desde una perspectiva de cooperación con beneficio mutuo, es sin duda mucho más frecuente que la competición en la relación entre 2 especies, incluso como motor de la evolución. En palabras de Lynn Margulis, la simbiosis es la regla de la naturaleza35,36. De la misma manera que si consideramos las innumerables interacciones que tiene un individuo cada instante de su vida con los millones de microorganismos potencialmente patógenos con los que convive, la infección, entendida como competición y victoria del patógeno, es la excepción. En la novela Alicia en el país de las maravillas (1865) del matemático Lewis Carroll, la Reina Roja le dice a Alicia que debe correr tanto como pueda para mantenerse en el mismo lugar. La denominada «teoría de la Reina Roja» se utiliza desde la perspectiva evolucionista para explicar la permanente variación al azar que necesitan los microorganismos en su interrelación necesaria para mantener su statu quo en términos coevolutivos. Resulta evidente que las especies, desde una perspectiva evolucionista, no se pueden separar del ambiente en el que están inmersas. Sin embargo, durante muchos años se ha obviado el efecto de flora bacteriana normal o microbiota sobre las interacciones con patógenos potenciales u obligados y la potencial selección ejercida en la evolución sobre nuestro SI37.
Las mucosas en el organismo cubren un área aproximada de 200-400 m2, que contiene 15.000-36.000 especies y 1.800 géneros diferentes de microbiota. El número total de células procariotas simbiontes en el organismo excede en más de 10 veces el número total de células eucariotas. Con toda esta carga biológica, nuestra microbiota desempeña un papel esencial en nuestra fisiología y homeostasis. Como ejemplo, en nuestro tracto gastrointestinal la densidad de bacterias aumenta progresivamente del intestino delgado (104UFC/g) hasta el colon (1012UFC/g) y hasta un 60% de la masa fecal está constituida por bacterias. Las especies mutualistas en la microbiota intestinal favorecen la ingestión de alimentos por el hospedador, así como compiten con cepas virulentas que pueden causar efectos nocivos para la supervivencia del hospedador38. Esta microbiota presente en el tracto gastrointestinal está sometida a una fuerte presión selectiva, ya sea por el mismo hospedador, como por los microorganismos competidores. A lo largo del desarrollo del individuo y hasta la edad adulta, la microbiota intestinal modela los tejidos, las células y el perfil molecular de nuestra inmunidad gastrointestinal. Esta colaboración, forjada tras millones de años de coevolución, se basa en un intercambio molecular, que implica señales bacterianas que son reconocidas por receptores del hospedador y que median beneficios mutuos para los microbios y para el hombre39. Se han definido 3 perfiles bacterianos definidos o enterotipos fundamentales. Además, existen microorganismos que se encuentran en pequeñas concentraciones pero cumplen funciones esenciales, como los metanógenos40. Una alteración de este equilibrio entre las diferentes partes resulta en enfermedad. Un reciente trabajo destaca la importancia de los linfocitos T reguladores (TReg) de origen tímico en la tolerancia a la microbiota intestinal y en la prevención de las enfermedades autoinmunes41.
Metasistema psiconeuroendocrino-inmunológicoDurante muchos años se consideró a los sistemas nervioso e inmunológico como 2 sistemas compartimentalizados e independientes. Recientemente se ha demostrado que ambos sistemas no solo comparten moléculas sino también mecanismos de funcionamiento similar42 y algunos autores señalan al SI como el segundo cerebro43,44. El SI comparte con el sistema neurológico una propiedad intrínseca esencial, que es su gran plasticidad, pero además un alto grado de diversificación, especialización y capacidad de almacenamiento de información y memoria. Si el cerebro encierra la esencia de la identidad personal, al SI le correspondería por una parte mantener la integridad orgánica del sujeto y de sus interrelaciones con el medio. Numerosas evidencias han ido poniendo de manifiesto el diálogo a 3 bandas entre los sistemas inmunológico, neurológico y endocrino, sistemas todos ellos de relación, en una red multidireccional de comunicación a través de moléculas que no son exclusivas de un solo sistema. Los trabajos pioneros de Besedowsky pusieron de manifiesto la importancia de las hormonas y citocinas en este triángulo, como la activación inmunológica a través de citocinas como la principal vía de activación del eje hipotálamo-hipófiso-suprarrenal, proceso a su vez dependiente de prostaglandinas45. Las citocinas, transmisores moleculares esenciales para el SI, pueden ser también secretadas por células propias del SNC, inducidas por señales provenientes tanto del SI como del propio SNC, relevantes tanto en el aprendizaje como en la memoria46. Diversas células inmunológicas son capaces de secretar TSH, CRH y GnRH, modulando a su vez la actividad inmunológica47. Numerosos neurotransmisores y factores neurotróficos y sus receptores se han descrito en las células de SI, señalando su papel relevante en la regulación inmunológica48. Más aún, numerosas evidencias ponen de relieve la comunicación bidireccional entre nuestro cerebro y la microbiota intestinal a través de numerosas moléculas y células, desde neurotransmisores como el ácido gammaaminobutírico (GABA) producido por la microbiota hasta el efecto modulador sobre la virulencia microbiana por las células enterocromafines49. Un claro ejemplo de ello lo constituye la demostración reciente del papel que desempeñan los anticuerpos naturales (en su mayoría de isotipo IgM, de baja afinidad y autoanticuerpos) en el proceso de remielinización50,51, redundando en el concepto de un SI integrado con los sistemas neurológico y endocrino e implicado no solo en los procesos inflamatorios sino también en los procesos reparadores, con las importantes potenciales aplicaciones terapéuticas que ello implica52. Otro ejemplo es la observación clínica de que los procesos depresivos se asocian con alteraciones inmunológicas, recientemente demostrada en relación con las citocinas proinflamatorias53,54 y que influyen sin duda en la respuesta del sujeto a un estímulo determinado. Los pacientes que presentan depresión mayor tienen elevación de marcadores inflamatorios en sangre periférica, en especial citocinas de tipo Th1, que acceden al cerebro e interactúan con el metabolismo de los neurotransmisores como el glutamato, función neuroendocrina y plasticidad neuronal. Otro ejemplo sería la inmunomodulación por las hormonas sexuales, con relevancia clínica como desencadenante de autoinmunidad55,56, entre otras, o los numerosos trabajos recientes sobre el papel de la vitamina D sobre la respuesta inmunológica.
En la terminología inmunológica se emplean conceptos que evocan a sus referentes al SNC, metáforas que aluden al SI como un sistema de inteligencia del organismo, en tanto que permite al individuo predecir y enfrentarse a la incertidumbre del ambiente57. Entre los numerosos términos que aluden a este paralelismo cognitivo se encuentran el «reconocimiento», «aprendizaje», «memoria» y, a nivel molecular, «sinapsis inmunológica»; como en términos metafóricos de comportamiento «tolerancia», «defensa», «ataque inmunológico», que no aparecen entre la terminología de otros órganos o sistemas, siendo probablemente el más interesante el de lo propio en tanto que alude de manera directa a la identidad del individuo57. En palabras de Pradeu y Carosella, la inmunidad es la respuesta a la identidad biológica del organismo1.
El estudio del SI como sistema adaptativo complejo requiere la integración con otras disciplinas, como la biología evolutiva, la biología celular y molecular, la psicología, la neurología y la endocrinología, para entender su funcionamiento real. El SI forma junto con el sistema psiconeuroendocrino una unidad funcional de mayor complejidad actuando como modeladores inseparables del SI en respuesta a los requerimientos internos y externos del entorno. En cada momento y en cada compartimento, el equilibrio homeostático del SI, fundamentalmente supeditado a las influencias psiconeuroendocrinológicas, son determinantes en la respuesta inmunológica. En los modelos teoréticos de la inmunología previamente presentados no entran en consideración estas premisas. La disección del SI, aunque sin duda ha permitido conocer y avanzar sobre mecanismos inmunológicos, no deja de ser un artefacto experimental que puede conducir a resultados divergentes con la realidad.
Conclusiones y proyección futuraLas interacciones psiconeuroendocrino-inmunológicas constituyen el marco real de funcionamiento integrado en un metasistema que no puede ser diseccionado artificialmente si queremos entender cómo funciona realmente el SI. Una aproximación integrada, pluridimensional, mejorará el conocimiento actual de cómo el SI se ha coadaptado a lo largo de la evolución y qué mecanismos determinan el resultado de la respuesta inmunológica. La inmunidad representa una forma de inteligencia en cuanto que permite predecir la incertidumbre del entorno, favorecer las interacciones simbióticas con otros microorganismos y mejorar nuestra adaptación dinámica al medio. Además, el estudio de las interacciones con la microbiota que cohabita nuestro organismo va a ser fundamental para entender la evolución del SI y en especial de los mecanismos fisiopatológicos de la enfermedad, debido a su papel clave en la homeostasis inmunológica. Podemos decir que la inmunidad es la identidad del individuo, de su historia y de su potencialidad futura.
FinanciaciónEste trabajo ha sido financiado gracias a ayudas del Fondo de Investigación Sanitaria (proyecto FIS#12/2759), de la Fundación Alicia Koplowitz y de la Fundación Salud 2000.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.