Los objetivos del presente taller se han centrado en el estudio de anticuerpos anticitoplasma de neutrófilo (ANCA) en 2 aspectos:
1. El abordaje de los anticuerpos asociados a enfermedad inflamatoria intestinal, concretamente a la colitis ulcerosa.
Por un lado se ha tratado el tema de los ANCA con patrón atípico, que constituyen un aspecto no muy bien definido por los consensos internacionales1,2. Presentan además la dificultad de su distinción de los distintos anticuerpos antinucleares o anticitoplásmicos concomitantes y han sido objeto de distintas aproximaciones3–5. Recientes trabajos han caracterizado sus antígenos diana, especialmente en hepatopatías autoinmunes y colitis ulcerosa3,6,7, y se ha descrito la asociación de colitis ulcerosa a anticuerpos específicos de vasculitis asociados a ANCA8. Ello puede contribuir al diagnóstico diferencial entre colitis ulcerosa y enfermedad de Crohn, en el que la determinación de ANCA juega un papel importante y puede afectar a la especificidad de los ANCA para el diagnóstico de vasculitis.
2. La comparación de distintas técnicas, en general cuantitativas, para la determinación de anticuerpos antimieloperoxidasa y antiproteinasa3.
Las distintas sensibilidad y especificidad de dichas técnicas puede determinar su valor diagnóstico y su aplicación en el seguimiento de las vasculitis asociadas a ANCA. Se pretende conocer qué tipos de técnicas se utilizan en los laboratorios que determinan ANCA y comparar los resultados en una serie de casos concretos que pueden ser interesantes por sus características clínicas, de laboratorio o ambas. Una comparación estadística exhaustiva de los métodos no es el objeto de este taller, por el número reducido de pacientes estudiado para cada tipo de patología y por la falta de una técnica gold standard, lo que nos impide una comparación objetiva.
IntroducciónPatrones de inmunofluorescencia indirecta de anticuerpos anticitoplasma de neutrófiloConsenso internacionalEl consenso internacional sobre anticuerpos anticitoplasma de neutrófilo (ANCA) acordado en 1991 y su adenda de 2002 propusieron la siguiente nomenclatura para los patrones de inmunofluorescencia indirecta (IFI) de ANCA:
- •
C-ANCA: patrón clásico de fluorescencia granular con acentuación central o interlobular.
- •
C-ANCA atípico: patrón difuso flat, sin acentuación interlobular.
- •
P-ANCA: patrón perinuclear, con o sin extensión nuclear; incluye ANA específicos de granulocito.
- •
ANCA atípico: incluye todos los otros patrones IFI de reactividad específica para neutrófilos o monocitos. Con frecuencia se trata de una combinación de fluorescencia citoplásmica y perinuclear.
En esta nomenclatura se distingue entre patronesC y C atípico y no entre P y P atípico para evitar que un patrónC se atribuya a vasculitis sistémica, si se emite el informe antes de la realización del ELISA para antiproteinasa3 (a-PR3). La extensión nuclear en los P-ANCA no se considera siempre útil para distinguir los que corresponden a antimieloperoxidasa (a-MPO) o no. La intensidad de la fluorescencia debe graduarse como negativa, positiva débil o positiva intensa, solo sobre la base de la dilución de cribado. Para seguimiento se recomienda no utilizar los títulos de IFI sino las técnicas cuantitativas para a-MPO y a-PR3. El informe debe indicar si el laboratorio no puede confirmar un P-ANCA, debido a un ANA concomitante, y que serán realizadas técnicas cuantitativas para a-MPO y a-PR3.
Respecto a los patrones atípicos de ANCA, se considera que no existe aún una prueba satisfactoria para detectar ANCA en enfermedad inflamatoria intestinal o hepatopatías autoinmunes (colangitis esclerosante o hepatitis autoinmune). En general, serán aquellos en los que se obtiene positividad para cualquiera de los 4patrones descritos en la tabla 1 pero que no correspondan a a-MPO o a-PR3. La IFI obtenida en etanol desaparece, en la mayoría de casos, en los portas fijados con formalina, aunque pueden obtenerse resultados poco consistentes en muestras individuales. Por ello, el uso de portas fijados con formalina se deja a la elección del laboratorio. No se recomienda, por el momento, la utilización de técnicas ELISA para antígenos distintos de MPO y PR3.
Otras propuestas de definición de patrones ANCA
| Patrón | Tinción sobre portas etanol | Tinción sobre portas formalina |
| C-ANCA | Citoplásmica fina granular acentuada entre los lóbulos | Citoplásmica fina granular raramente acentuada entre los lóbulos |
| P-ANCA | Fina, homogénea y en reborde, del citoplasma perinuclear | Citoplásmica fina granular raramente acentuada entre los lóbulos |
| P-ANCA atípico tipo A | Amplia, no homogénea y en reborde, del citoplasma perinuclear, con múltiples puntos intranucleares | Fina, no homogénea y en reborde del citoplasma perinuclear, con múltiples puntos intranucleares |
| P-ANCA atípico tipo B | Amplia, no homogénea y en reborde del citoplasma perinuclear, con múltiples puntos intranucleares junto a patrón citoplásmico difuso | Fina, no homogénea y en reborde del citoplasma perinuclear, con múltiples puntos intranucleares junto a patrón citoplásmico difuso |
Algunos autores han propuesto patrones distintivos para los patrones ANCA atípicos, como el patrón «very p», sin extensión nuclear, aunque, como ya se ha dicho, no es aceptado por el consenso internacional por su inconsistencia para distinguir entre sueros a-MPO positivos o negativos1,2, y el patrón mixto, por combinación de C-ANCA y P-ANCA, denominado «snow-drift like»5. Por último, Terjung et al.3 propusieron, en 2001, la clasificación de patrones ANCA basada en la presencia o no de puntos intranucleares y en los patrones IFI obtenidos en portas fijados con etanol o formalina (tabla 1). Este mismo grupo y otros, en sucesivas publicaciones6,7, han caracterizado a los antígenos que dan lugar a este patrón p atípico, asociado a colitis ulcerosa y hepatitis autoinmune, como constituyentes de la membrana nuclear.
Métodos para la determinación de anticuerpos antiproteinasa3 y antimieloperoxidasaRecomendaciones internacionales y del Grupo Español de AutoinmunidadEl consenso internacional sobre determinación de ANCA aconseja realizar, en las muestras positivas por IFI, una confirmación por técnica ELISA para anticuerpos a-PR3 y a-MPO. Para el seguimiento de pacientes positivos se recomienda usar los niveles obtenidos por ELISA y no los títulos de IFI, ya que la correlación no es buena entre los resultados obtenidos por ambas técnicas1,2. El protocolo del Grupo Español de Autoinmunidad (GEAI) indica también la necesidad de realizar determinación de anticuerpos a-PR3 y a-MPO en muestras positivas por IFI, y para el seguimiento se recomienda método cuantitativo9.
MétodosLa sensibilidad y la especificidad de las técnicas ELISA para a-MPO y a-PR3 ha ido aumentando desde los ELISA directos, técnicas de primera generación en las que los antígenos se fijan directamente a la placa, a los ELISA de captura, en los que se evitan cambios conformacionales, en PR3 o MPO, utilizando un anticuerpo fijado a la placa que une el antígeno por epítopos distintos a los de los autoanticuerpos (técnicas de segunda generación).
Los ELISA de tercera generación, o de alta sensibilidad, utilizan una proteína como anchor o puente entre el antígeno y la placa. Estos últimos se postulan como un sistema que aún preserva mejor las características antigénicas de PR3 y MPO10, aunque existen estudios que les atribuyen una sensibilidad similar a los ELISA de captura11. Algunos trabajos han detectado incluso una mejor capacidad diagnóstica de las técnicas de primera generación para a-MPO, mientras que las de segunda o tercera generación siguen siendo consideradas las más adecuadas para a-PR311.
Recientemente han aparecido técnicas de quimioluminiscencia que, en algunos casos, combinan técnicas con antígenos unidos directamente a la placa con otras tipo anchor. Estas técnicas se han descrito equiparables a las técnicas ELISA de última generación y presentan, junto a los ELISA fluorescente de pocillo individual, la ventaja de la rapidez en la obtención de resultados y de permitir carga continua de muestras. De todas formas, su implantación es muy reciente y se requieren más estudios para confirmar su utilidad.
Existen también en el mercado distintos métodos cualitativos, como dot-blot o inmunofluorescencia, para el cribado de a-MPO y a-PR3.
MétodosPara el taller de autoinmunidad de la SEI 2013 se enviaron muestras de suero de 10pacientes (cuya historia clínica aparece resumida en la tabla 2), con el objetivo del estudio de ANCA. Los parámetros informados por los participantes fueron: patrón y título por IFI en portas de neutrófilos fijados con etanol, formalina y metanol; ANA por IFI en células Hep2Hep2 o por ELISA; determinación de MPO, PR3 y otros antígenos asociados a ANCA (panel ANCA); anti-membrana basal glomerular (AMBG), y anti-Sacharomyces cerevisiae (ASCA).
Resumen de historias clínicas de los pacientes
| Número de paciente | Resumen historia clínica |
| 1 | Varón de 71 años, afecto de hipertensión arterial, DM tipo2, hiperuricemia y cardiopatía isquémica. Tras ingreso en urgencias por ITU se diagnostica, por TAC abdominal y colonoscopia, de CU. Durante el ingreso se produce cuadro de bacteriemia por Klebsiella pneumoniae, que se trata con antibiótico de amplio espectro. Recibe, además, tratamiento con Linagliptina, Micardis, alopurinol, Sintrom, pantoprazol y Dacortin |
| 2 | Mujer de 33 años. Diagnosticada de nefritis lúpica y gromerulonefritis rápidamente progresiva por inmunocomplejos, demostrada por biopsia renal percutánea. Antecedente de toxemia gravídica y rinitis alérgica. Presenta el comienzo de LES en el posparto. Recibe bolos de corticoides y rituximab. En el momento actual se encuentra en tratamiento por hemodiálisis |
| 3 | Mujer de 68 años diagnosticada de GP con afectación pulmonar (biopsia compatible). Presenta hipertensión arterial, alergia a trimetoprim-sulfametoxazol, DM tipo2, dislipidemia y síndrome ansioso-depresivo. En el momento de la toma de muestra se encuentra ingresada por ITU debida a Klebsiella pneumoniae, que se resuelve con tratamiento con amoxicilina-clavulámico. Su tratamiento habitual incluye Dacortin, esomeprazol, Novomix 30/70 Flexpen, Metformina, AAS, candesartán, simvastatina, fenofibrato, tramadol, bromazepam, duloxetina, calcio VitD y bifosfonatos |
| 4 | Mujer de 32 años, diagnosticada de CU, con colonoscopia compatible. Presenta antecedente previo de infección por Dientaomeba fragilis (1mes antes de la toma de muestra del taller), ya erradicada. Actualmente en tratamiento con Dacortín, Pentasa, Kilor y omeprazol |
| 5 | Mujer de 33 años, diagnosticada de CU, con colonoscopia compatible. En marzo de 2012 sufre hepatitis aguda con serologías virales negativas. Actualmente en tratamiento con mesalazina |
| 6 | Mujer de 39 años que acude a urgencias por pielonefritis aguda tratada con clavulánico. Tras la suspensión del mismo comienza con tos no productiva y dolor torácico de características pleuríticas, disnea de esfuerzo y fiebre. En la radiografía de tórax se aprecia infiltrado en la base izquierda con derrame pleural e imágenes nodulares en hemitórax derecho. En la analítica se constata VSG120, Hb10,8, leucocitosis (15.300) con eosinofilia y sedimento de orina patológico sin síntomas miccionales. IgE318, IgA944, IgE frente a Aspergillus negativa. Estudio de parásitos en heces: negativo. Serología HIV y estudio microbiológico en orina: negativo. La TAC torácica indica afectación parenquimatosa con nódulos y masas bilaterales. Presenta también adenopatías mediastínicas y parahiliares. Se realiza fibrobroncoscopia, lavado broncoalveolar (BAL) y biopsia transtorácica y pleural. En el BAL se obtiene cociente CD4/CD8>3,5 y eosinofilia del 1%. La histología objetiva fibrosis pulmonar, granulomatosis necrosante con granulomas en empalizada y en uno de los informes se objetiva granuloma de aspecto necrótico claramente caseoso. En todos los casos las tinciones para bacterias y hongos son negativas y no hay signos de vasculitis |
| 7 | Varón de 79 años. Diagnosticado de GP en 2003, tras estudio de cuadro tóxico en el que se evidenció patrón radiológico compatible con nódulos pulmonares bilaterales y bronquiectasias. Presenta además: enfermedad renal crónica, estenosis bilateral de carótidas, dislipidemia, calcificación de aorta abdominal, tiroidopatía y bradicardia sinusal. En tratamiento con doxazosina, Dacortin, omeprazol, Esertia, Adiro, Plusvent, atorvastatina, Kilor, Duphalac |
| 8 | Mujer de 57 años. Diagnosticada de LES en 1993, con sintomatología cutánea, articular y renal. La biopsia renal indicó nefritis lúpica proliferativa focal tipoiii. En 2010 se evidencian, por RMN, lesiones en sustancia blanca y presencia de anticuerpos antifosfolípido a título moderado, por lo que se diagnostica de SAP secundario a LES. Actualmente en tratamiento con omeprazol, calcio, AAS, amlodipinio, aliskiren, ezetimiba, micofenolato, ácido risedrónico, lormetazepam, citalopram, prednisona |
| 9 | Mujer de 65 años. Diagnosticada de colitis crónica. En el momento actual, por clínica y biopsia de muestra endoscópica, se diagnostica de CU severa con marcada actividad. Presenta, además: varices, obesidad, necrosis avascular de cabeza de fémur e insuficiencia mitral. Recibe tratamiento con ramipril, bisoprolol, torasemida, Sintrom, simvastatina |
| 10 | Paciente con esclerosis sistémica difusa y vasculitis necrosante, con afectación del sistema nerviosos periférico y vascular confirmada por biopsia del nervio sural y muscular |
CU: colitis ulcerosa; DM: diabetes mellitus; GP: granulomatosis con poliangiitis; ITU: infección del tracto urinario; LES: lupus eritematoso sistémico.
El número de laboratorios participantes es de 48 (tabla 3), aunque no todos participan en todas las determinaciones y algunos presentan más de una determinación por parámetro y suero, con distintos fabricantes. Se analizaron todos los resultados informados en este taller, con las siguientes excepciones:
- •
IFI-METANOL: el escaso número (4) y la diversidad de resultados hacen que no se considere esta técnica en el análisis de resultados.
- •
AMBG: todos los sueros son negativos para los 11laboratorios que informan esta técnica.
- •
ASCA: solo hay un resultado por suero, excepto para el n.o 5, que hay 2 (uno positivo y otro negativo). No se considera esta técnica en el análisis de resultados.
- •
ANA: se ha alcanzado consenso en todos los sueros analizados. Dado que los anticuerpos antinucleares no son el objeto de este taller, sino una herramienta para resolver las posibles interferencias con los ANCA, no se considerará esta técnica en el análisis de resultados.
- •
PANEL ANCA: a pesar de que se ha alcanzado consenso en todos los sueros analizados, no se considerará esta técnica en el análisis de resultados dado el bajo número de laboratorios que informan y la falta de concreción de los antígenos que incluye cada fabricante en este panel.
Hospital/Responsable participantes en el taller
| Nombre del hospital | Responsable |
| Clínica Universidad de Navarra | Alfonso Sánchez Ibarrola |
| Complejo Hospitalario de Jaén | Esther Ocaña Pérez |
| Consorcio Hospital General de Valencia | Goitzane Marcaida Benito/Juana Rodríguez Delgado |
| Fundación Jiménez Díaz | María José Martínez Becerra |
| Hospital Clínico Universitario de Valencia | Paz Laporta Martín |
| Hospital San Pedro de Alcántara | Luis Fernández Pereira |
| Hospital Universitario de Cruces | María Aránzazu Pacho de Lucas |
| Hospital Central de la Defensa «Gómez Ulla» | Carmen Jiménez Garófano |
| Hospital Clínic de Barcelona | Odette Vinyas Gomis/Mila Garcia |
| Hospital Clínico de San Carlos | Romina Dieli Crimi |
| Hospital Clínico Universitario Santiago de Compostela | Pablo Eiras Martínez |
| Hospital de Bellvitge | Jordi Bas |
| Hospital de la Princesa | Cecilia Muñoz Calleja/Margarita García Marcos |
| Hospital de León | Sara Calleja Antolín |
| Hospital Universitario Marqués de Valdecilla | Marcos López Hoyos |
| Hospital de Mérida SES | Manuel Espárrago Rodilla |
| Hospital de Sant Pau | Carmen Gelpí Sabater |
| Hospital Donostia | Álvaro Prada Iñurrategui/Raquel Sáez |
| Hospital General de Albacete | Jesús Ontañón Rodríguez |
| Hospital Infanta Cristina | M. Inmaculada Alcalá Peña/M. Luisa Vargas Pérez |
| Hospital Infanta Margarita | Aurora Jurado Roger |
| Hospital Infanta Sofía | Alexandru Vlagea |
| Hospital Joan XXIII | Rosa María Pastor Barellas |
| Hospital Ramón y Cajal | Angela Carrasco Sayalero/Garbiñe Roy Ariño |
| Hospital Severo Ochoa | Juana Jiménez Jiménez |
| Hospital Torrecárdenas | Francisco Javier Muñoz Vico |
| Hospital Universitari Germans Trias i Pujol | Eva M. Martínez Cáceres |
| Hospital Universitari Son Espases | M. Rosa Julià Benique/Eduardo Villegas Martín |
| Hospital Universitario La Paz | Dora Pascual-Salcedo Pascual/Rita Álvarez Doforno |
| Hospital Universitario 12 de Octubre | Antonio Serrano/Estela Paz Artal |
| Hospital Universitario A Coruña «Teresa Herrera» | Silvina Torio Gómez/José Javier Cid Fernández |
| Hospital Universitario Central de Asturias | Lourdes Mozo Avellaned |
| Hospital Universitario de Canarias | Yvelise Barrios del Pino |
| Hospital Universitario de Gran Canaria Dr. Negrín | Inmaculada Alarcón Torres |
| Hospital Universitario Gregorio Marañón | Margarita Rodríguez Mahou |
| Complejo Hospitalario Universitario Insular Materno Infantil | Olga Montes Ares/Alberto Torio Ruiz |
| Hospital Universitario Nuestra Señora de la Candelaria | Delia Almeida González |
| Hospital Universitario Puerta de Hierro | Aresio Plaza López |
| Hospital Universitario Puerta del Mar | Carmen Rodríguez Hernández |
| Complejo Asistencial Universitario Salamanca | María Belén Aparicio Hernández |
| Hospital Universitario Vall d’Hebron | Ana Marín Sánchez |
| Hospital Universitario Virgen de la Arrixaca | Pedro Martínez García/José Marcos García Pacheco |
| Hospital Universitario Virgen del Rocío | Marco Antonio Montes Cano |
| Hospital Virgen de la Macarena | Concepción González Rodríguez |
| Hospital Virgen de las Nieves | Laura Jaimez Gámiz |
| Hospital de Jerez | Juan Francisco Rodríguez Gutiérrez |
| Catlab. Parc Logístic de Salut | Montserrat Alsina Donadeu/Francisco Pujalte Mora |
| UDIAT-CD Corporació Parc Taulí | María José Amengual Guedan |
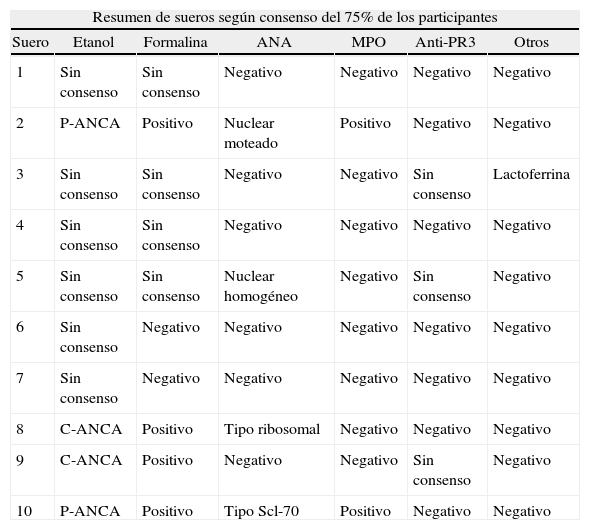
En la tabla 4 se muestra el resumen de los resultados según el consenso alcanzado por los 3/4 (75%) o por los 2/3 (66,6%) de los participantes (tabla 4).
Consenso sueros
| Resumen de sueros según consenso del 75% de los participantes | ||||||
| Suero | Etanol | Formalina | ANA | MPO | Anti-PR3 | Otros |
| 1 | Sin consenso | Sin consenso | Negativo | Negativo | Negativo | Negativo |
| 2 | P-ANCA | Positivo | Nuclear moteado | Positivo | Negativo | Negativo |
| 3 | Sin consenso | Sin consenso | Negativo | Negativo | Sin consenso | Lactoferrina |
| 4 | Sin consenso | Sin consenso | Negativo | Negativo | Negativo | Negativo |
| 5 | Sin consenso | Sin consenso | Nuclear homogéneo | Negativo | Sin consenso | Negativo |
| 6 | Sin consenso | Negativo | Negativo | Negativo | Negativo | Negativo |
| 7 | Sin consenso | Negativo | Negativo | Negativo | Negativo | Negativo |
| 8 | C-ANCA | Positivo | Tipo ribosomal | Negativo | Negativo | Negativo |
| 9 | C-ANCA | Positivo | Negativo | Negativo | Sin consenso | Negativo |
| 10 | P-ANCA | Positivo | Tipo Scl-70 | Positivo | Negativo | Negativo |
| Resumen con el consenso del 66,6% y resolviendo los ANCA-atípicos por IFI en etanol | ||||||
| Suero | Etanol | Formalina | ANA | MPO | Anti-PR3 | Otros |
| 1 | P-ANCA | Positivo | Negativo | Negativo | Negativo | Negativo |
| 2 | P-ANCA | Positivo | Moteado | Positivo | Negativo | Negativo |
| 3 | C-ANCA | Positivo 64% | Negativo | Negativo | Positivo 63% | Lactoferrina |
| 4 | P-ANCA | Negativo | Negativo | Negativo | Negativo | Negativo |
| 5 | P-ANCA | Positivo 64% | Homogéneo | Negativo | Negativo | Negativo |
| 6 | P-ANCA | Negativo | Negativo | Negativo | Negativo | Negativo |
| 7 | Negativo | Negativo | Negativo | Negativo | Negativo | Negativo |
| 8 | C-ANCA | Positivo | Ribosomal | Negativo | Negativo | Negativo |
| 9 | C-ANCA | Positivo | Negativo | Negativo | Positivo | Negativo |
| 10 | P-ANCA | Positivo | Tipo Scl-70 | Positivo | Negativo | Negativo |
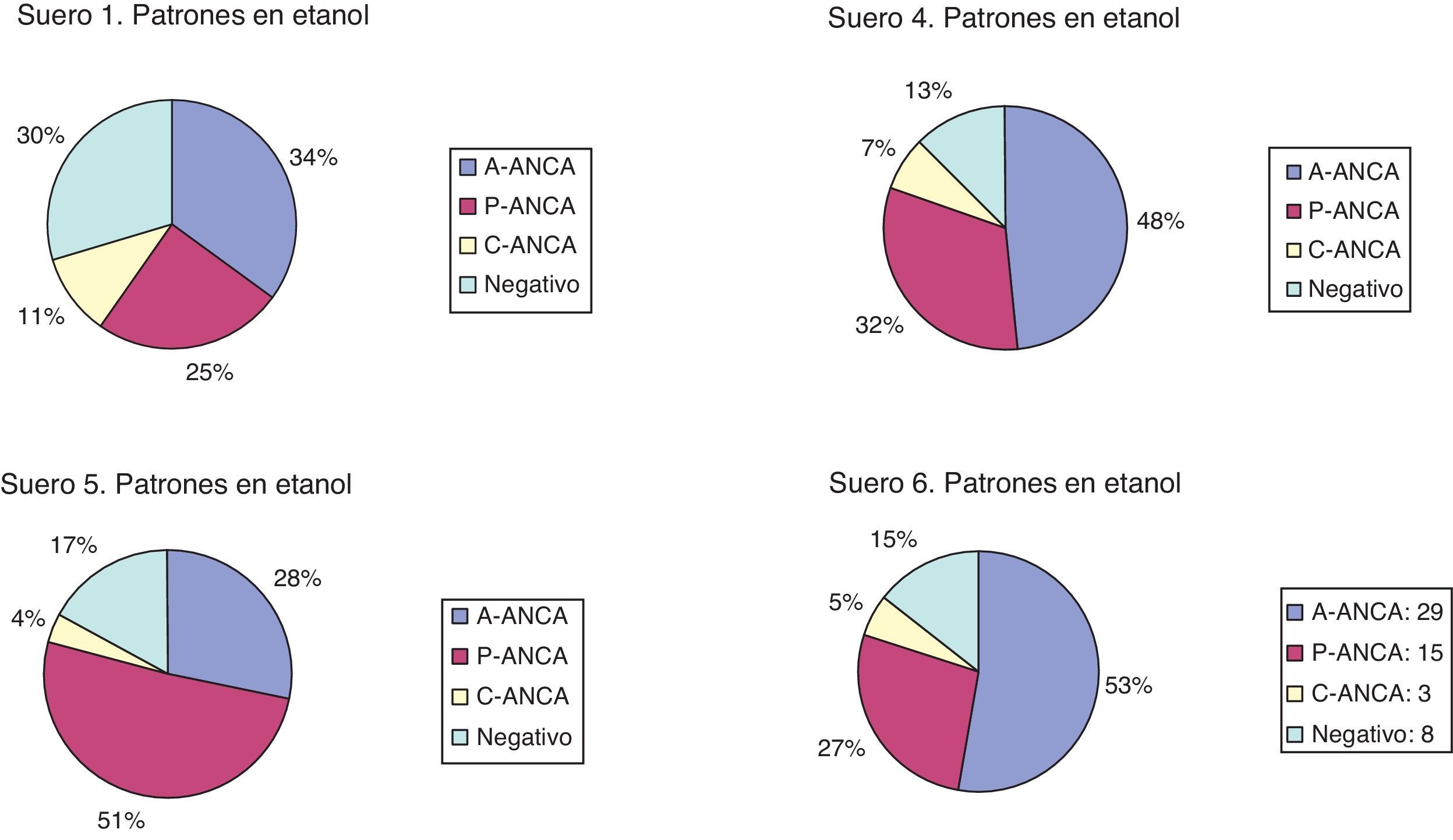
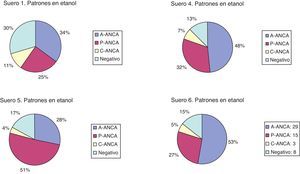
1. La nomenclatura de los participantes para sueros P-ANCA positivos en etanol y negativos en formalina varía prácticamente al 50% entre A-ANCA y P-ANCA. (fig. 1). Sería conveniente unificar criterios en cuanto a este tema (tabla 4).
2. La positividad, tanto en portas fijados en etanol como en portas fijados en formalina y el tipo de patrón informado, según la IFI en portas etanol, no dependen del origen de los portas (tipo de fabricante) sino de los laboratorios participantes.
3. El hecho de utilizar una dilución de cribado de 1/10, 1/20 o 1/40 tampoco condiciona la positividad o negatividad en etanol y formalina.
4. Los participantes no han descrito la presencia o ausencia de puntos intranucleares en sueros P-ANCA positivos. En nuestra experiencia, la detección de puntos intranucleares en sueros P-ANCA positivos de pacientes con colitis ulcerosa no es siempre positiva por microscopia de fluorescencia, por lo que su observación no es útil, en general. Además, en sueros con P-ANCA debidos a anticuerpos a-MPO pueden hallarse también anticuerpos dirigidos a estructuras de la membrana nuclear que den dichos puntos en IFI, como ocurre con el suero10 del taller.
5. En la mayoría de casos, la IFI sobre portas fijados con formalina es más sensible que la IFI sobre portas fijados con etanol.
6. La presencia de anticuerpos dirigidos contra antígenos del citoplasma (antiproteínas ribosomales, por ejemplo) puede dar lugar a patrones C-ANCA, difíciles de distinguir de los dirigidos a proteínas específicas de los neutrófilos, como ha ocurrido con el suero8 del taller en el que se ha obtenido consenso cono C-ANCA positivo.
7. La absorción con pellet de células Hep2 puede ayudar a distinguir los ANA de los ANCA atípicos, como ocurre en el suero6; sin embargo, solo un laboratorio ha informado la utilización de esta técnica.
8. La mayoría de laboratorios no han utilizado portas fijados con metanol, por lo que no es posible deducir conclusiones válidas sobre los resultados obtenidos con los sueros del taller. Los 2 sueros a-MPO positivos presentan además antinucleares, por lo que también han sido informados como positivos en metanol. Los sueros A-ANCA positivos correspondientes a pacientes con colitis ulcerosa han sido informados positivos en portas fijados con metanol por los laboratorios que han utilizado este sustrato.
Técnicas de determinación de antimieloperoxidasa y antiproteinasa31. El 12% de laboratorios utiliza técnicas cualitativas para detección de a-PR3 y a-MPO. En algunos laboratorios no se constata técnica cuantitativa de confirmación, necesaria además para un correcto seguimiento de los pacientes, según recomendaciones nacionales e internacionales1,2,9.
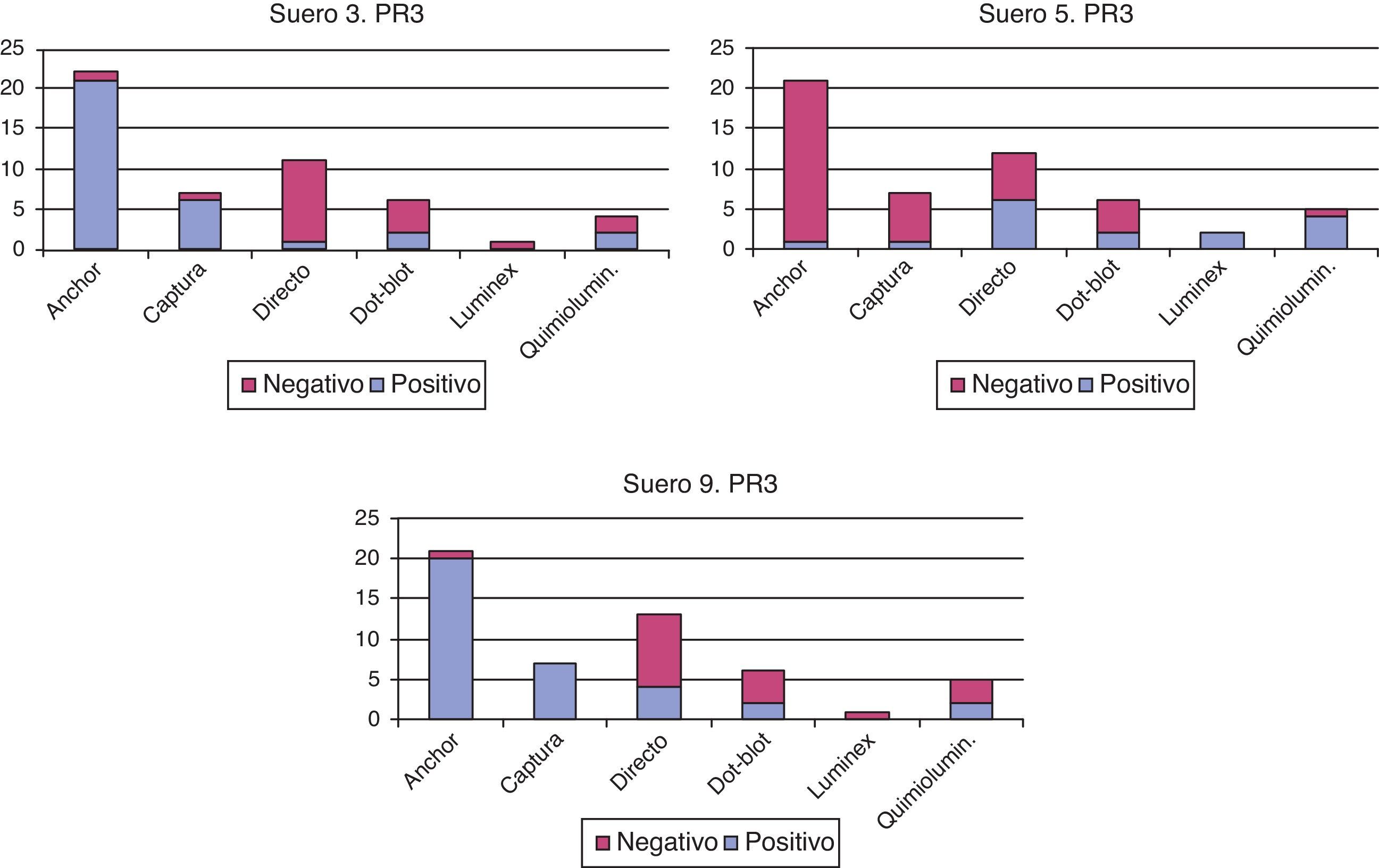
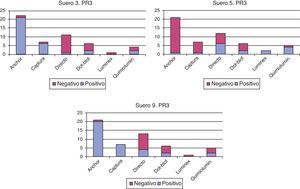
2. Tal como refleja la literatura sobre el tema, existen diferencias en la sensibilidad de las distintas técnicas de detección de a-PR3. Respecto a los sueros n.o3 y 9, las distintas técnicas se comportan de forma similar en ambos: la mayoría de ELISA directos dan negativos, mientras que las técnicas anchor y de captura son positivas. Las 2 técnicas de quimioluminiscencia utilizadas se comportan de forma opuesta, aunque hay pocos laboratorios que las usan (fig. 2). Estos sueros corresponden a un paciente no activo con granulomatosis con poliangiitis (anteriormente denominada granulomatosis de Wegener) (suero3) y a un paciente con colitis ulcerosa (suero9). Este último caso apoya recientes publicaciones sobre la asociación entre a-PR3 y colitis ulcerosa y la utilidad en su diagnóstico diferencial8. En ambos casos hay concordancia entre los patrones IFI y los ELISA, ya que la mayoría de los laboratorios que dan IFI positiva les atribuyen un patrón C-ANCA, característico de PR3.
El problema en el paciente3 (positivo para PR3 en el 49% de determinaciones) es que no está activo, aunque la persistencia de un valor positivo de a-PR3 podría indicar la necesidad de un seguimiento estrecho, para evitar recaída, según postulan algunos autores12. Otros trabajos describen que el exceso de sensibilidad de algunas técnicas ELISA de última generación puede crear confusión en este tipo de pacientes13. El suero5, que corresponde a un paciente con colitis ulcerosa, solo en el 30% de las determinaciones ha dado a-PR3 positivo y no corresponde a patrón C-ANCA por IFI, por lo que la positividad a-PR3 es discutible. En este caso las técnicas que dan resultado positivo se encuentran dentro de los ELISA directos, dot-blot, quimioluminiscencia y técnica multiplex. Para la determinación de a-MPO hay algunos laboratorios que utilizan técnica directa (mientras que usan una de última generación para a-PR3), de acuerdo con algunos autores11.
3. En cuanto a los 2 pacientes a-MPO positivos, hay muy buena concordancia entre laboratorios (100% los dan a-MPO positivos) y entre el patrón P-ANCA por IFI y la positividad para a-MPO. Se trata de 2 pacientes que presentan una conectivopatía: en el primer caso se trata de un lupus eritematoso sistémico, y en el otro, de una esclerosis sistémica. El primero no presenta clínica de vasculitis y la biopsia renal tampoco es compatible con vasculitis necrosante, mientras que el segundo sí que es una vasculitis sistémica. Estos resultados apoyan el hecho de que la presencia de estos anticuerpos en enfermedades autoinmunes sistémicas no va siempre asociada a vasculitis sistémica.
4. La introducción del recientemente aparecido estándar internacional para a-PR3 y a-MPO de los Centers for Disease Control and Prevention (CDC) de Atlanta puede contribuir a una mayor concordancia de las distintas técnicas, a pesar de que se ha descrito muy variable binding de distintos estándares a los diferentes kits14. La utilización del estándar internacional podría ser de gran utilidad en la optimización de las técnicas con menor sensibilidad.
5. La detección de antígenos distintos de MPO y PR3 se ha realizado por una minoría de laboratorios. En los sueros de pacientes con colitis ulcerosa (n.o1, 4 y 5) no se ha detectado, mayoritariamente, positividad para estos antígenos minor, de acuerdo con la literatura15.
Recomendaciones finalesEn la sesión dedicada al taller en el Congreso de la SEI de 2013 se propuso orientar las peticiones según el probable diagnóstico de los pacientes: vasculitis sistémica versus hepatopatía/enfermedad inflamatoria intestinal.
Así, en el primer caso, la prioridad sería detectar la presencia de anticuerpos a-PR3 o a-MPO en el contexto de un patrón compatible y determinarlos por técnica cuantitativa. En el segundo, ante la presencia de ANCA atípicos junto a anticuerpos contra antígenos nucleares o citoplásmicos, que puedan dar falsos positivos en la IFI sobre neutrófilos fijados con etanol, procedería absorber el suero con botón obtenido por centrifugación de células de estirpe no mieloide, como las células Hep2. También se recomienda observar, en la IFI de cribado, si los linfocitos contaminantes presentan o no positividad, ya que si no la presentan, es muy probable que la tinción sea específica de neutrófilo.
El orden de los autores, a partir del cuarto autor, es arbitrario y depende del orden alfabético del hospital.