Poco se sabe aún de la relevancia del polimorfismo y la función del HLA-DP. La leucemia linfoide aguda (LLA) es el cáncer más frecuente en niños y adolescentes en la población zuliana de Venezuela. La leucemia mieloide crónica (LMC) afecta igualmente a niños, jóvenes y adultos. Varios estudios epidemiológicos revelan la presencia de ciertos factores asociados con la susceptibilidad. El locus HLA-DPA1*, alelos HLA-DPA1*01, *02, *03 y *04, se estudiaron utilizando los estuches PCR Olerup SSPTM (Genovision), en una población de 48 pacientes con LLA, 48 con LMC y 48 controles sanos provenientes del Banco de Sangre del Estado Zulia, Venezuela, mestizos no relacionados. El análisis estadístico de las frecuencias se determinó por recuento directo; la comparación de las frecuencias alélicas se realizó con la prueba de χ2 corregida por Yates y los valores de p < 0,05 se consideraron estadísticamente significativos. Los riesgos relativos (RR) > 2,5 se consideraron asociaciones positivas y los < 1, negativas. Se obtuvieron asociaciones positivas entre DPA1*01:05 (RR = 3,65; p ≤ 0,05), DPA1*01:06 (RR = 13,88; p ≤ 0,05) y DPA1*01:07 (RR = 10; p ≤ 0,05) con la LLA. El DPA1*01:03:01-01:03:02 (RR = 0,46; p ≤ 0,05) y DPA1*02:01:01-02:01:06 (RR = 0,29; p ≤ 0,05) mostraron asociación negativa con la LLA. No se observaron asociaciones positivas entre el DPA1* y la LMC. DPA1*01:05 (RR = 0,08, p ≤ 0,05), DPA1*01:08 (RR = 0,06; p ≤ 0,05) y DPA1*01:09 (RR = 0,14; p ≤ 0,05) mostraron asociaciones negativas con la LMC. Curiosamente, el genotipo DPA1*01:03:01-01:03:02/02:01:01-02:02:06 mostró una frecuencia del 40,4% en controles, el 8,5% en pacientes LLA y el 64,6% en pacientes con LMC, aparte de otras notables diferencias genotípicas. Las marcadas discrepancias en la distribución de las frecuencias de los alelos y genotipos DPA1* en pacientes con LLA y el escaso polimorfismo mostrado por la región DPA1* en pacientes LMC probablemente revelan diferencias notables en la patogenia de ambos tipos de leucemia.
Little is known about the relevance of the polymorphisms in the function of HLA-DP. Acute lymphoblastic leukemia (ALL) is the most frequent cancer in children and adolescents in Zulia population. Chronic myeloid leukemia (CML) is similar in adolescents, young adults and mild adults. The epidemiologic studies suggest the presence of several factors related to the susceptibility. Forty-eight patients with ALL and 48 with CML, were compared with 48 controls from The Blood Bank of Zulia State, Venezuela, all of them unrelated racially mestizos. To evaluate the positive and negative associations between HLA allele and leukemias, the HLA-DPA1 locus and HLA-DPA1*01,*02,*03 and *04 alleles were studied using PCR Olerup SSPTM (Genovision). HLA-DPA1*01:05 (RR = 3.65; P ≤ .05) and DPA1*01:06 (RR = 13.88; P ≤ .05) alleles showed a positive association with ALL. Furthermore, HLA-DPA1*01:03:01-01:03:02 (RR = 0.46; P ≤ .05), DPA1*01:07 (RR = 10; P ≤ .05) and DPA1*02:01:01-02:01:06 (RR = 0.29; P ≤ .05) were negatively associated with ALL. Moreover, HLA-DPA1*01:05 (RR = 0.08; P ≤ .05), DPA1*01:08 (RR = 0.06; P ≤ .05) and DPA1*01:09 (RR = 0.14; P ≤ .05) showed a negative association with CML. Curiously, the genotype HLA-DPA1*01:03:01-01:03:02/02:01:01-02:02:06 showed a frequency of 40.4% in controls, 8.5% in ALL patients and 64.6% in CML patients. These marked differences in the frequency of distribution of HLA-DPA1* alleles and genotypes in CML and ALL patients, probably reveals a important pathogenic differences for the two types of leukemia.
Se conoce poco sobre la relevancia del polimorfismo en la función de la región HLA-DP, y su participación en la respuesta inmunitaria no ha sido elucidada. Se desconoce la participación de la molécula HLA-DP en la respuesta inmunitaria; sin embargo, se han descrito algunas asociaciones con enfermedades y los alelos HLA-DP han sido señalados como posible blanco de células T aloespecíficas en el contexto de la enfermedad de injerto contra el huésped1. Algunas enfermedades ya han sido asociadas a esta región del HLA de clase II. El genotipo DPA1*01-DPB1*02:02:02 fue el único genotipo asociado significativamente con diabetes mellitus insulinodependiente (DMID) en una población venezolana2. En estudios familiares, el alelo DPB1*03:01 haplotipo DPA1*01:03-DPB1*03:01 se encontró asociado con susceptibilidad, mientras que el DPB1* haplotipo DPA1*01:03-DPB1*04:02 y el haplotipo DPA1*01:03-DPB1*01:01 resultaron de protección en la DMID 3. Los genotipos DPA1*02:02-DPB1*05:01 y DPA1*02:02:02-DPB1*03:01, respectivamente, se asociaron fuertemente con el riesgo de infección persistente con el virus de la hepatitis B en asiáticos4,5. El alelo DPA1*02:02:02 se asoció positivamente con hiperseropositividad de niveles de anticuerpo después de la vacunación antisarampionosa en niños escolares en Estados Unidos6. La leucemia linfoide aguda (LLA) es el cáncer más frecuente en niños y adolescentes en la población zuliana. La leucemia mieloide crónica (LMC) es similar en adolescentes, adultos jóvenes y adultos maduros. Los estudios epidemiológicos indican la presencia de varios factores relacionados a la susceptibilidad a sufrir ambos tipos de leucemia7,8. Pawelec et al9, utilizando a 254 pacientes con diferentes tipos de leucemias, fueron de los primeros en señalar la influencia de la región DP en la susceptibilidad o resistencia a la LLA, mostrando una asociación positiva con el DPw2 y DPw5 y ninguna con la LMC. Previamente, en un grupo de 24 pacientes zulianos con LLA y LMC, el alelo DPA1*01:05 mostró una asociación positiva con la LLA, observándose los alelos DPA1*01:03:01-01:03:02 y HLA-DPA1*02:01:01-02:01:06 asociados negativamente10. Más recientemente, el gen HLA-DRB1*15 se ha señalado como factor de riesgo en niños con LLA11. Se especula que la molécula HLA-DPB1*06:01 puede estar funcionalmente involucrada en leucemias infantiles.1 Ciertas hipótesis se han tejido en torno a la posibilidad de participación de estas moléculas del complejo mayor de histocompatibilidad en la patogenia de las leucemias12. Todos estos antecedentes apuntan a que la región DP, conformada por los alelos HLA-DPB1* y HLA-DPA1*, ambas cadenas con diferentes polimorfismos, aparecen involucradas en la patogenia de las leucemias. El estudio molecular detallado de ambos polimorfismos nos permitirá dilucidar el grado de asociación positiva o negativa de los alelos DP por separado y de los haplotipos al concluir la investigación. Por ahora, mostramos los resultados obtenidos con el estudio de la región HLA-DPA1*. Los alelos HLA-DPA1*01,*02,*03 y *04 se estudiaron usando PCR Olerup SSP™ (Genovision), según instrucciones del fabricante, en una población representativa de 48 pacientes con LLA, 48 con LMC y 48 controles del Banco de Sangre del Estado Zulia, Venezuela, todos mestizos racialmente no relacionados, con su debido consentimiento. El análisis estadístico de los alelos HLA-DPA1* se determinó por recuento directo. Las comparaciones de las frecuencias alélicas se realizaron usando la prueba de la χ2 corregida por Yates. Los valores de p < 0,05 se consideraron estadísticamente significativos. La fuerza de asociación se expresó como riesgo relativo (RR) > 2,5 para una asociación positiva y < 1 para una asociación negativa. En los 48 pacientes con LLA evaluados se confirmaron las asociaciones positivas con el alelo DPA1*01:05 (RR = 3,65; p ≤ 0,05) y negativa con el alelo DPA1*01:03:01-01:03:02 (RR = 0,46; p ≤ 0,05) observadas en el estudio preliminar en grupos de 24 pacientes LLA y LMC (10). Además, resultaron asociados positivamente los alelos DPA1*01:06 (RR = 13,88; p ≤ 0,05) y DPA1*01:07 (RR = 10; p ≤ 0,05) con la LLA. El alelo DPA1*02:01:01-02:01:06 (RR = 0,29; p ≤ 0,05) se reveló asociado negativamente con la LLA. No hubo asociación positiva entre HLA-DPA1* y la LMC, dato que se obtuvo igualmente en el estudio preliminar 10. Los alelos DPA1*01:05 (RR = 0,08; p ≤ 0,05), DPA1*01:08 (RR = 0,06; p ≤ 0,05) y DPA1*01:09 (RR = 0,14; p ≤ 0,05) resultaron asociados negativamente con la LMC (tabla 1). Curiosamente, el genotipo HLA-DPA1*01:03:01-01:03:02/02:01:01-02:02:06 presentó frecuencias significativamente diferentes (p < 0,05) en el 40,4 % de los controles, el 8,5 % de los pacientes LLA y el 64,6 % de los pacientes LMC, entre otras notables variaciones (tabla 2). Estos patrones disímiles de la distribución de las frecuencias de los alelos y genotipos HLA-DPA1* en pacientes LMC y LLA con respecto a los controles y el escaso polimorfismo de las moléculas DPA1* observado en los pacientes con LMC probablemente revelan patogenias contrarias para estos dos tipos diferentes de leucemia. Al completar el estudio del polimorfismo, la región HLA-DPB1* en estos pacientes, podremos establecer las posibles relaciones con esta importante región de clase II y compararlas con varios estudios previamente divulgados.
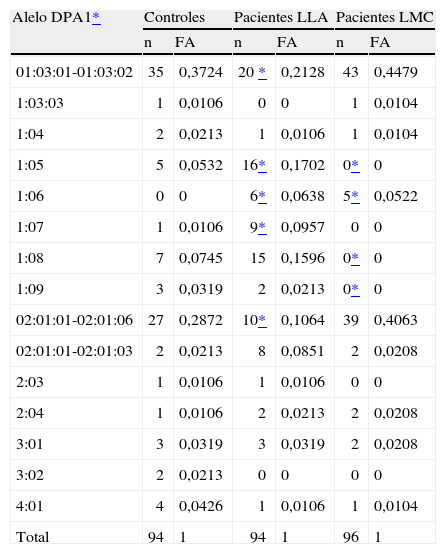
Frecuencias alélicas (FA) HLA-DPA1* en pacientes con leucemia linfoide aguda (LLA) y leucemia mieloide crónica (LMC)
| Alelo DPA1* | Controles | Pacientes LLA | Pacientes LMC | |||
| n | FA | n | FA | n | FA | |
| 01:03:01-01:03:02 | 35 | 0,3724 | 20 * | 0,2128 | 43 | 0,4479 |
| 1:03:03 | 1 | 0,0106 | 0 | 0 | 1 | 0,0104 |
| 1:04 | 2 | 0,0213 | 1 | 0,0106 | 1 | 0,0104 |
| 1:05 | 5 | 0,0532 | 16* | 0,1702 | 0* | 0 |
| 1:06 | 0 | 0 | 6* | 0,0638 | 5* | 0,0522 |
| 1:07 | 1 | 0,0106 | 9* | 0,0957 | 0 | 0 |
| 1:08 | 7 | 0,0745 | 15 | 0,1596 | 0* | 0 |
| 1:09 | 3 | 0,0319 | 2 | 0,0213 | 0* | 0 |
| 02:01:01-02:01:06 | 27 | 0,2872 | 10* | 0,1064 | 39 | 0,4063 |
| 02:01:01-02:01:03 | 2 | 0,0213 | 8 | 0,0851 | 2 | 0,0208 |
| 2:03 | 1 | 0,0106 | 1 | 0,0106 | 0 | 0 |
| 2:04 | 1 | 0,0106 | 2 | 0,0213 | 2 | 0,0208 |
| 3:01 | 3 | 0,0319 | 3 | 0,0319 | 2 | 0,0208 |
| 3:02 | 2 | 0,0213 | 0 | 0 | 0 | 0 |
| 4:01 | 4 | 0,0426 | 1 | 0,0106 | 1 | 0,0104 |
| Total | 94 | 1 | 94 | 1 | 96 | 1 |
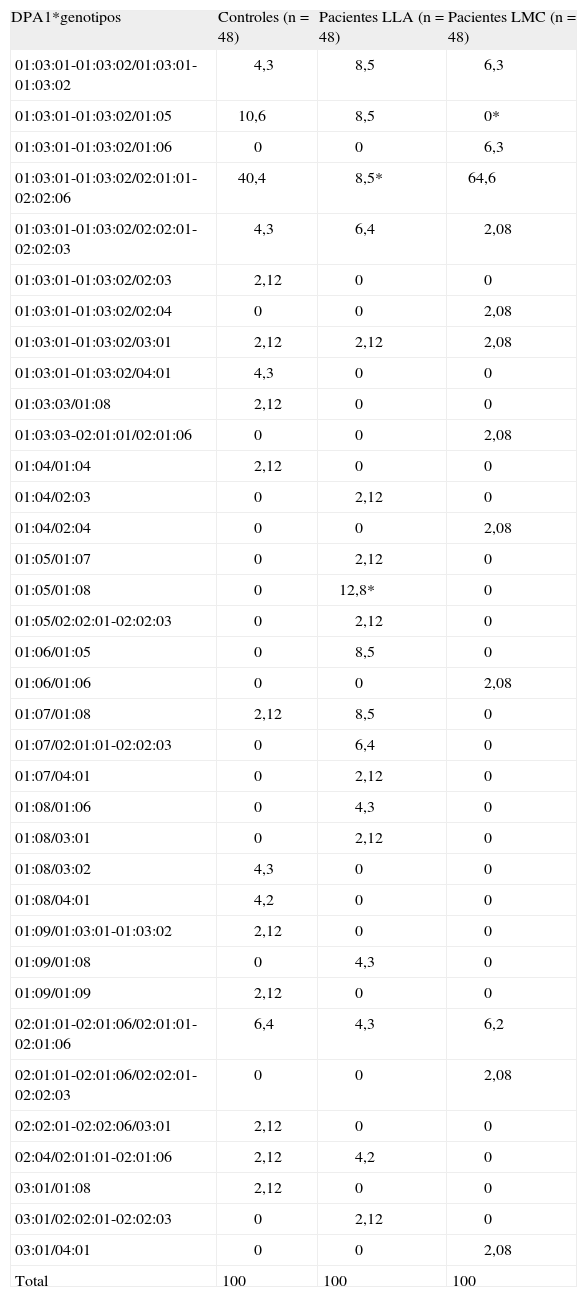
Distribución de genotipos HLA-DPA1*/100 pacientes con leucemia linfoide aguda (LLA) y leucemia mieloide cronica (LMC)
| DPA1*genotipos | Controles (n = 48) | Pacientes LLA (n = 48) | Pacientes LMC (n = 48) |
| 01:03:01-01:03:02/01:03:01-01:03:02 | 4,3 | 8,5 | 6,3 |
| 01:03:01-01:03:02/01:05 | 10,6 | 8,5 | 0* |
| 01:03:01-01:03:02/01:06 | 0 | 0 | 6,3 |
| 01:03:01-01:03:02/02:01:01-02:02:06 | 40,4 | 8,5* | 64,6 |
| 01:03:01-01:03:02/02:02:01-02:02:03 | 4,3 | 6,4 | 2,08 |
| 01:03:01-01:03:02/02:03 | 2,12 | 0 | 0 |
| 01:03:01-01:03:02/02:04 | 0 | 0 | 2,08 |
| 01:03:01-01:03:02/03:01 | 2,12 | 2,12 | 2,08 |
| 01:03:01-01:03:02/04:01 | 4,3 | 0 | 0 |
| 01:03:03/01:08 | 2,12 | 0 | 0 |
| 01:03:03-02:01:01/02:01:06 | 0 | 0 | 2,08 |
| 01:04/01:04 | 2,12 | 0 | 0 |
| 01:04/02:03 | 0 | 2,12 | 0 |
| 01:04/02:04 | 0 | 0 | 2,08 |
| 01:05/01:07 | 0 | 2,12 | 0 |
| 01:05/01:08 | 0 | 12,8* | 0 |
| 01:05/02:02:01-02:02:03 | 0 | 2,12 | 0 |
| 01:06/01:05 | 0 | 8,5 | 0 |
| 01:06/01:06 | 0 | 0 | 2,08 |
| 01:07/01:08 | 2,12 | 8,5 | 0 |
| 01:07/02:01:01-02:02:03 | 0 | 6,4 | 0 |
| 01:07/04:01 | 0 | 2,12 | 0 |
| 01:08/01:06 | 0 | 4,3 | 0 |
| 01:08/03:01 | 0 | 2,12 | 0 |
| 01:08/03:02 | 4,3 | 0 | 0 |
| 01:08/04:01 | 4,2 | 0 | 0 |
| 01:09/01:03:01-01:03:02 | 2,12 | 0 | 0 |
| 01:09/01:08 | 0 | 4,3 | 0 |
| 01:09/01:09 | 2,12 | 0 | 0 |
| 02:01:01-02:01:06/02:01:01-02:01:06 | 6,4 | 4,3 | 6,2 |
| 02:01:01-02:01:06/02:02:01-02:02:03 | 0 | 0 | 2,08 |
| 02:02:01-02:02:06/03:01 | 2,12 | 0 | 0 |
| 02:04/02:01:01-02:01:06 | 2,12 | 4,2 | 0 |
| 03:01/01:08 | 2,12 | 0 | 0 |
| 03:01/02:02:01-02:02:03 | 0 | 2,12 | 0 |
| 03:01/04:01 | 0 | 0 | 2,08 |
| Total | 100 | 100 | 100 |
LLA: DPA1*01:05/01:08 (RR = 13,8; p < 0,005); DPA1*01:03:01-01:03:02/02:01:01-02:01:06 (RR = 0,137; p < 0,05).
LMC: DPA1* 01:03:01-01:03:02/*01:05 (RR = 0,085; p < 0,05); DPA1*01:03:01-01:03:02/*02:01:01-02:01:06 (RR = 2,692; p < 0,05).
Se establecieron asociaciones positivas y negativas entre los alelos y genotipos HLA-DPA1* con las LLA y LMC. No se detectaron asociaciones positivas entre alelos HLA-DPA1* y las LMC.
El polimorfismo de los alelos y genotipos HLA-DPA1* varía considerablemente comparando los controles y pacientes LLA con los pacientes LMC, en los que es bastante restringido.
Estas diferencias en los patrones de distribución del HLA-DPA1* en ambos tipos de leucemia indican, probablemente, que las patogenias de estas enfermedades son diferentes, y apunta en las LMC hacia deficiencias en la presentación antigénica.
FinanciaciónEstudio financiado por CONDES LUZ Proyecto No.CC-0776-07.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.