La enfermedad granulomatosa crónica (EGC) es una inmunodeficiencia primaria por defectos en la explosión respiratoria de los fagocitos cuyas manifestaciones clínicas más frecuentes son los granulomas y las infecciones recurrentes por gérmenes encapsulados.
ObjetivoEstandarizar en Colombia la técnica de dihidrorodamina (DHR) para diagnóstico de EGC con el propósito de evaluar la explosión respiratoria en neutrófilos y monocitos de sangre periférica (SP) humana después de ser activados in vitro.
MétodosLos leucocitos de SP de 10 individuos sanos fueron activados utilizando varias concentraciones de PMA, evaluando la explosión respiratoria por citometría de flujo. Adicionalmente, se obtuvieron los patrones de oxidación de la DHR de estas células en EGC ligada al X, portadoras de este defecto, y en EGC autosómica recesiva.
ResultadosLas mejores concentraciones de PMA para evaluar el estallido respiratorio tanto en neutrófilos como en monocitos se encontraron entre 0,2 y 5μg/ml. Se establecieron parámetros de normalidad de la prueba en neutrófilos en nuestra población. Adicionalmente, los patrones de oxidación de la DHR en monocitos no siempre fueron los mismos a aquellos de los neutrófilos.
ConclusionesLa técnica de DHR por citometría de flujo es un método de cribado que identifica con facilidad, sensibilidad y a bajo costo los diferentes fenotipos de la EGC. Sin embargo, se deben establecer en cada laboratorio los parámetros de normalidad que permiten realizar con certeza la caracterización inicial de esta condición y evaluar diferentes tipos celulares teniendo en cuenta que la expresividad del defecto puede ser específica de ciertas poblaciones celulares.
Chronic granulomatous disease (CGD) is a primary immunodeficiency caused by defects in the respiratory burst of phagocytes. Affected patients often suffer from granulomas and recurrent infections, mainly due to encapsulated bacteria.
AimTo standardize the dihydrorhodamine test (DHR) in Colombia used for the diagnosis of CGD by evaluating the respiratory burst in human blood neutrophils and monocytes after in vitro activation.
MethodsPhagocyte respiratory burst in peripheral blood samples from 10 healthy controls was evaluated by flow cytometry after leukocyte activation with several concentrations of phorbol myristate acetate (PMA). The different oxidation patterns of DHR in X-linked or autosomal recessive CGD were also obtained.
ResultsThe most suitable concentrations of PMA for the evaluation of the respiratory burst in peripheral blood were 0.2 to 5μg/ml. Reference values for this test in neutrophils from our population were established. It was shown that the oxidation patterns of DHR in monocytes were not always identical to those observed in neutrophils.
ConclusionThe evaluation of DHR oxidation by flow cytometry is a screening method that easily identifies the different phenotypes of CGD, with good sensitivity and at a lower cost. However, it is crucial that every laboratory establishes its own normal range for this test, in order to achieve the accurate characterization of this condition. DHR oxidation patterns may be also evaluated in different blood cells, since cell type-specific defects have also been reported.
La enfermedad granulomatosa crónica (EGC) es una inmunodeficiencia primaria que afecta la explosión respiratoria en las células fagocíticas1. Esta enfermedad se caracteriza principalmente por infecciones recurrentes y/o severas e inflamación crónica con formación de abscesos y granulomas desde muy temprana edad. En el mundo se calcula la frecuencia de EGC en aproximadamente 1/250.000 individuos2. Aunque en Colombia se desconoce la epidemiología de esta inmunodeficiencia primaria, según los estudios realizados por el Grupo de Inmunodeficiencias Primarias de la Universidad de Antioquia, desde el año 1994 hasta 2013 se ha realizado el diagnóstico clínico de EGC en 22 pacientes; 6 de ellos cuentan con diagnóstico genético, todos con mutaciones en la proteína gp91phox. Las infecciones recurrentes que se presentan con más frecuencia en los pacientes diagnosticados con EGC en Colombia incluyen formación de abscesos en piel y órganos del sistema retículoendotelial, dermatitis, neumonías y osteomielitis. Estas infecciones son causadas generalmente por bacterias tales como Staphylococcus aureus, Burkholderia cepacia, Serratia marcescens, Nocardia y hongos tales como Aspergillus sp. y Candida sp.3.
La explosión respiratoria en las células fagocíticas humanas es inducida por proteínas tanto de membrana como citoplasmáticas, en conjunto conocidas como sistema NADPH oxidasa. Las proteínas p22phox y gp91phox constituyen las 2 subunidades del flavocitocromo b558, el componente de membrana de este sistema. Después de la activación celular durante el proceso de fagocitosis, se fosforilan las proteínas citoplasmáticas p47phox, p67phox y p40phox, un proceso que provoca cambios conformacionales y favorece la unión de estas proteínas al flavocitocromo b558 en la membrana celular. Seguidamente ocurre la activación y unión de GTPasas (Rac1 o Rac2) al complejo, lo que permite la activación de la oxidasa. Una vez esta enzima es activada, se produce la transferencia de electrones al oxígeno molecular para así formar radicales libres derivados del oxígeno, un fenómeno conocido como el «estallido respiratorio». Estos radicales son capaces de interactuar con el ion potasio y las enzimas lisosomales, que en conjunto destruyen proteínas, polisacáridos, lípidos, ADN y ARN de los microorganismos fagocitados, contribuyendo de una manera importante a la eliminación de los agentes infecciosos4,5.
El 65% de los defectos genéticos asociados a EGC tienen un patrón de herencia ligado al cromosoma X y son ocasionados por mutaciones en el gen CYBB que codifica para la proteína gp91phox. De manera interesante, ahora se conoce que algunas mutaciones en el gen CYBB confieren específicamente susceptibilidad a infecciones micobacterianas sin otros rasgos de EGC6. Por otra parte, se calcula que alrededor del 25% de todos los pacientes con ECG presentan deficiencias de la proteína P47phox con un patrón de herencia autosómico recesivo, mientras que el porcentaje restante está distribuido entre las deficiencias de p67phox o p22phox7,8. Hasta la fecha, solo un paciente con deficiencia en la proteína P40phox asociada a una colitis granulomatosa no severa ha sido reportado en la literatura9.
Hasta hace algunos años, la técnica estándar para el cribado inicial de la EGC era la prueba de reducción del azul de tetrazolio. Sin embargo, este método es solo cualitativo, ya que se basa en la inspección microscópica de los precipitados de formazán, producto de la reducción del azul de tetrazolio por los metabolitos derivados del oxígeno, en un número limitado de neutrófilos en placa. Adicionalmente, esta prueba puede presentar resultados falsos negativos, principalmente en los casos de deficiencias en p47phox10. Con el advenimiento de la citometría de flujo, la prueba de reducción del azul de tetrazolio se ha reemplazado por ensayos que son más rápidos, sensibles, multiparamétricos y que además permiten el estudio de subpoblaciones celulares dentro de una única y pequeña muestra de sangre11. En 1983, Bass y colaboradores describieron por primera vez el uso del fluorocromo 2′7′-diacetato de diclorofluoresceína para detectar la generación de especies reactivas del oxígeno usando citometría de flujo10. Sin embargo, su variabilidad y su baja fluorescencia hacen difícil distinguir entre las células normales y las defectuosas. Fue así como se propuso una nueva molécula, la dihidrorodamina123 (DHR), que es permeable a la membrana de la célula, donde es oxidada a rodamina123 por los peroxinitritos formados como resultado de la activación del sistema NADPH oxidasa en fagocitos12.
El objetivo del presente estudio es validar la prueba de DHR para diagnóstico de EGC en Colombia usando un citómetro digital de última generación y establecer los valores normales de oxidación de esta molécula en células polimorfonucleares (PMN) de individuos sanos, lo que permitirá cribar pacientes con sospecha de EGC de una manera más confiable en nuestro país. Adicionalmente, basados en las evidencias que indican que algunos defectos en el sistema NADPH oxidasa pueden afectar linajes celulares específicos6, se pretende investigar si el análisis de la explosión respiratoria de los monocitos de sangre periférica es informativo en la búsqueda de defectos en componentes de este sistema.
Materiales y métodosRecolección de muestras de sangre periféricaSe obtuvo sangre total fresca de 10 voluntarios sanos (4 hombres y 6 mujeres, mediana 26años, min-máx: 20-45años) que al momento de la toma de la muestra no habían presentado infecciones recurrentes o severas y no tenían ninguna sospecha clínica de alteración funcional en sus neutrófilos. Adicionalmente se incluyeron 2 pacientes con sospecha de EGC, uno con un patrón ligado al X (EGC-LX) y el otro con un patrón autosómico recesivo (EGC-AR). Las muestras fueron anticoaguladas con heparina usando el sistema Vacutainer® para ser procesadas inmediatamente.
Todos los individuos ingresaron en este estudio previa firma del consentimiento informado. El trabajo fue aprobado por el comité de bioética de la Sede de Investigación Universitaria de la Universidad de Antioquia, Medellín-Colombia.
Prueba de dihidrorodaminaLa prueba de DHR se realizó acorde al protocolo previamente descrito por Vowells et al.10. Brevemente, luego de lisar los glóbulos rojos (en 400μl de sangre) con una solución tamponada de cloruro de amonio, la muestra de cada individuo se dividió en 2 tubos: uno para las células sin estímulo y otros para las células estimuladas con acetato de forbol miristato (del inglés phorbol myristate acetate [PMA], SIGMA). Después de lavar los glóbulos blancos con buffer HBSS (Hank's Buffered Salt Solution, GIBCO, Grand Island, NY), estos fueron expuestos a la DHR (Invitrogen, Eugene, OR) a 37°C durante 5min en presencia de catalasa (SIGMA, St. Louis, MO). Posteriormente las células se incubaron en buffer HBSS, en presencia o no de PMA a diferentes concentraciones, en baño de agua a 37°C durante 14min e inmediatamente fueron analizadas ya que in vitro, usando tiempos mayores de incubación, los PMN sin estímulo tienden a presentar ruido en cuanto al estallido respiratorio. La lectura de la muestra se realizó en el citómetro de flujo FACSCantoII (Beckton Dickinson, BD, San José, CA). Se colectaron todas las células y se analizaron 20.000 células en la región de los PMN y en la región de los monocitos (seleccionados por los parámetros de tamaño y granularidad en el citómetro). La producción de radicales libres de oxígeno se midió en unidades arbitrarias de la intensidad media de fluorescencia (IMF) en el canal de fluorescencia FL2 (585nm). Posteriormente se calculó el índice de estimulación (IE) de las células de los individuos, dividiendo la media geométrica de la IMF de las células estimuladas con PMA sobre la media geométrica de la IMF de las células no estimuladas. Adicionalmente se analizó el porcentaje de las células que se activaron ante el estímulo y el coeficiente de variación (CV) de cada histograma como un indicador de la variabilidad en la intensidad de fluorescencia dentro de la población seleccionada.
Cálculos y análisis estadísticosSe usó la desviación estándar (DE) como medida de dispersión de los datos. El test de Kruskal-Wallis con el post-test de Dunn’ se utilizó para comparar la IMF, el CV y el IE con diferentes dosis de PMA (0,02, 0,2, 2 y 5μg/ml) en el programa Graphpad Prism version 5.0 para Mac (GraphPad Software, San Diego, CA). Valores de p<0,05, p<0,01 y p<0,001 se consideraron significativos.
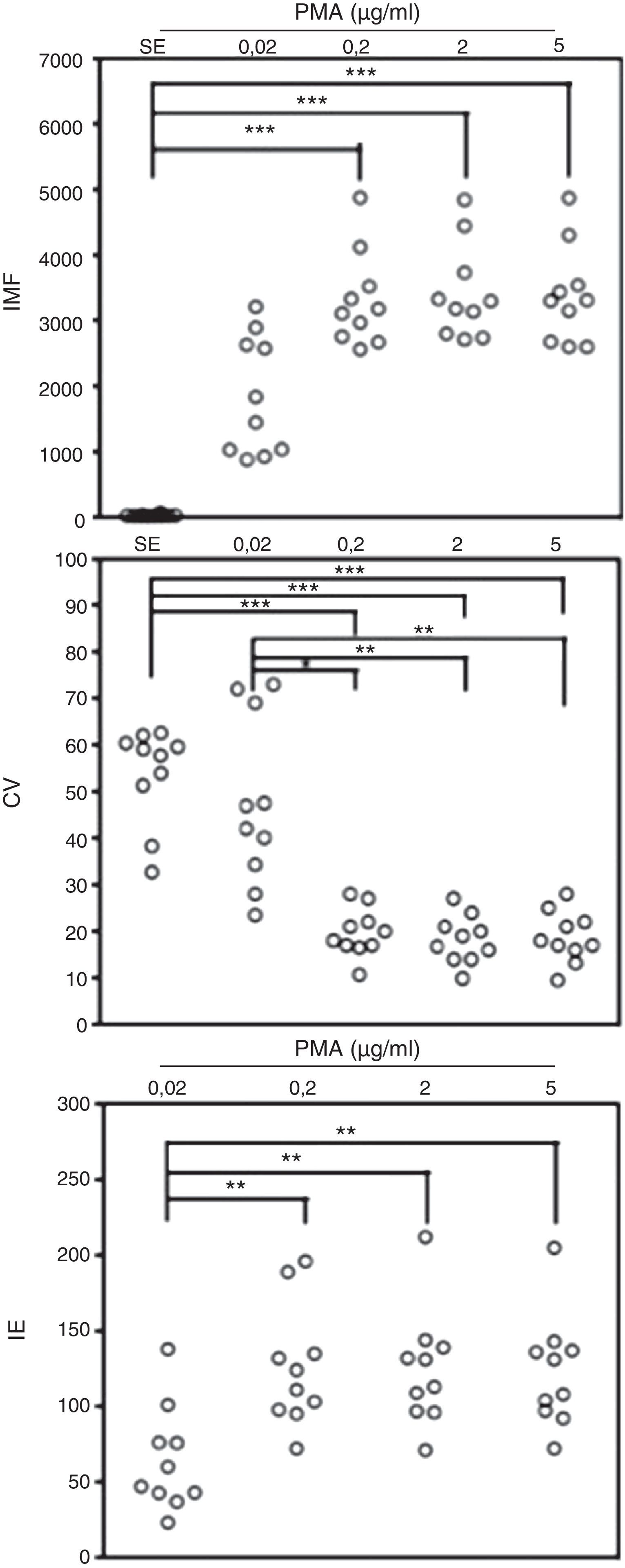
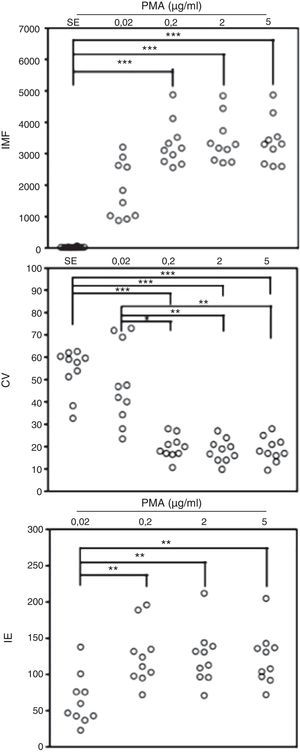
ResultadosEvaluación por citometría de flujo de la oxidación de la dihidrorodamina por granulocitos de sangre periférica de individuos sanos activados con diferentes dosis de PMACon el fin de validar la prueba de DHR en un citómetro de última generación, se evaluó la fluorescencia emitida por los PMN provenientes de sangre periférica de 10 individuos sanos, luego de exponerlos a la DHR y estimularlos o no con diferentes dosis de PMA. Al realizar el análisis con los parámetros de IMF y CV de los histogramas que genera el citómetro de flujo, observamos que todas las concentraciones usadas de PMA indujeron un incremento en la IMF de los PMN marcados con DHR, en comparación con las mismas células no estimuladas (fig. 1). Al comparar las diferentes concentraciones de PMA utilizadas, se observó que al exponer los PMN de sangre periférica marcados con DHR de los individuos sanos a la concentración más baja de PMA (0,02μg/ml), la IMF de estas células no difiere significativamente de la IMF de estas mismas células no estimuladas (fig. 1). Por el contrario, se observó una diferencia significativa entre la IMF emitida por las células estimuladas con 0,2, 2 y 5μg/ml de PMA y las células sin estímulo (p<0,05). No se observaron diferencias significativas entre la IMF de las células expuestas a 0,2, 2 o 5μg/ml de PMA (fig. 1).
Oxidación de la DHR en neutrófilos de sangre periférica de controles sanos activados in vitro. Se presentan, en unidades relativas, los valores de la intensidad media de fluorescencia (IMF) y el coeficiente de variación (CV) de los histogramas determinados por citometría de flujo y, adicionalmente, el índice de estimulación (IE) de los neutrófilos en 10 controles sanos en respuesta a diferentes concentraciones de PMA.
*p<0,05; **p<0,01; ***p<0,001.
Adicionalmente se evaluó el CV de los histogramas de IMF de los PMN que oxidaron la DHR, como un indicador de homogeneidad de la respuesta de estas células al estímulo con PMA. El CV fue significativamente mayor en PMN no estimulados o aquellos estimulados con una concentración de 0,02μg/ml comparado con el CV de la IMF en los PMN estimulados con 0,2, 2 o 5μg/ml de PMA. No hubo diferencias significativas entre el CV de la IMF de los PMN no estimulados y el de los estimulados con 0,02μg/ml de PMA. Tampoco se observaron diferencias significativas entre el CV de la IMF de las células expuestas a 0,2, 2 o 5μg/ml de PMA (fig. 1).
Con el objetivo de normalizar los valores de IMF obtenidos en los PMN activados durante la prueba de DHR en relación con este valor en estas células en reposo, se calculó el IE de estas células en sangre periférica de 10 individuos sanos luego del estímulo con diferentes concentraciones de PMA, como se explica en la sección de materiales y métodos. En la figura 1, se observa que el IE es significativamente menor cuando se usa la menor concentración de PMA (0,02μg/ml) comparado con este dato usando las dosis mayores de PMA. Sin embargo, no existe ninguna diferencia entre los IE de los PMN usando las concentraciones de PMA de 0,2, 2 y 5μg/ml. Teniendo en cuenta estos datos, se establecieron en este estudio valores permisibles de IE para los PMN de individuos sanos entre 72 y 205, cuando se estimulan con 5μg/ml de PMA en la prueba de DHR, para 2μg/ml de estímulo de 71 a 212 y para 0,2μg/ml entre 72 y 196. Finalmente, los valores permisibles de CV para los PMN de individuos sanos estimulados con 5μg/ml de PMA es de 9,5 a 28, para 2μg/ml de 9,9 a 27, y para 0,2μg/ml entre 10,7 y 28.
Debido a que no se observó una respuesta de oxidación de la DHR en los PMN dependiente de la dosis de PMA cuando esta fue utilizada entre 0,2 y 5μg/ml, procedimos a realizar una titulación de este reactivo con dosis entre 0,02 y 0,2μg/ml en 4 controles sanos con el fin de conocer si la técnica propuesta podría usarse de una manera cuantitativa realizando curvas dosis-respuesta. Observamos que dosis de 0,05, 0,1 y 0,2μg/ml de PMA inducen una respuesta comparable de oxidación de DHR en PMN evaluada como la IMF de estas células, el CV de la IMF y el IE. Sin embargo, estos valores fueron estadísticamente significativos a dosis de 0,2μg/ml de PMA comparados con estos datos en las células sin estímulo. A dosis de 0,02μg/ml de PMA se observó una disminución abrupta de la IMF y el IE de los PMN cuando se comparan con las otras dosis de PMA usadas. Por su parte, el CV de la IMF de la rodamina en PMN estimulados con 0,02μg/ml de PMA se incrementa a niveles comparables a los de las células sin estímulo (datos no mostrados).
Estos resultados demuestran que la PMA a dosis entre 0,2, 2 y 5μg/ml puede usarse como estímulo para evaluar el estallido respiratorio de los PMN marcados con DHR en el citómetro de flujo y establece valores permisibles de IE y CV para esta prueba con base en los histogramas de los granulocitos estimulados de individuos sanos dependiendo de la concentración de PMA usada. No se observó una respuesta dependiente de la dosis del estímulo.
Evaluación por citometría de flujo de la oxidación de la dihidrorodamina por monocitos de sangre periférica de individuos sanos activados con diferentes dosis de PMAAdicionalmente a las células PMN, los monocitos también pueden inducir la explosión respiratoria producida por radicales libres de oxígeno aunque en menor nivel que las primeras, oxidando la DHR, de tal manera que esta función efectora puede ser detectada por el citómetro de flujo.
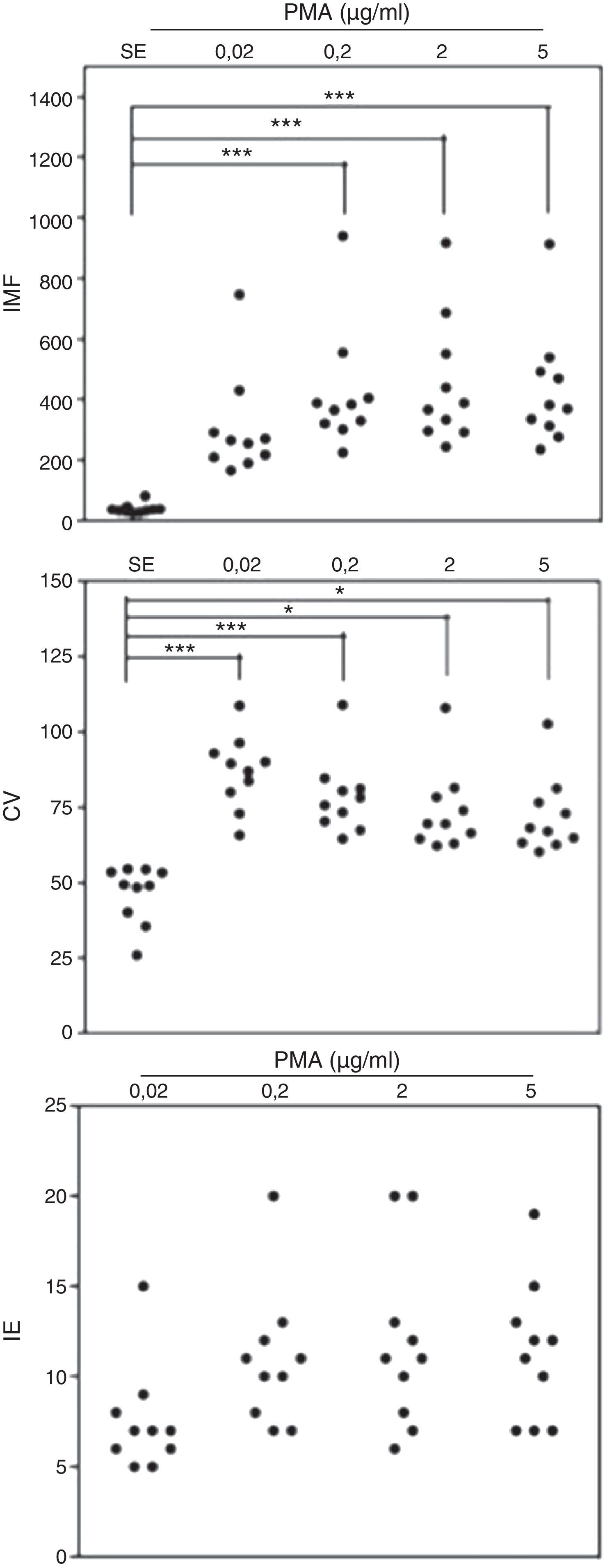
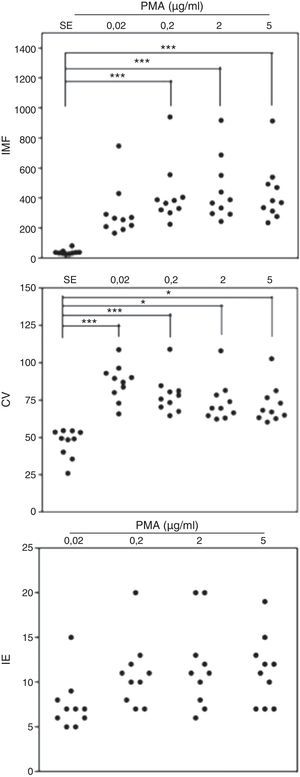
Al realizar el análisis por citometría de flujo de la IMF en monocitos expuestos a diferentes dosis de PMA, se observó que a todas las concentraciones usadas del estímulo se indujo un incremento en la IMF de los monocitos marcados con DHR, en comparación con las mismas células no estimuladas (fig. 2). Cuando se compararon las diferentes concentraciones de PMA utilizadas, se observó que al estimular los monocitos marcados con DHR de los individuos sanos a la concentración más baja de PMA (0,02μg/ml) no hay diferencias significativas en la IMF de estas células comparadas con la IMF de estas mismas células no estimuladas (fig. 2). Sin embargo, se observaron diferencias estadísticamente significativas entre la IMF emitida por las células estimuladas con 0,2, 2 y 5μg/ml de PMA comparadas con las células sin estímulo (p<0,05). No se observaron diferencias significativas entre la IMF de las células expuestas a 0,2, 2 o 5μg/ml de PMA (fig. 2).
Oxidación de la DHR en monocitos de sangre periférica de controles sanos y en respuesta a diferentes concentraciones de PMA. Se presentan, en unidades relativas, los valores de la intensidad media de fluorescencia (IMF) y el coeficiente de variación de los histogramas (CV) determinados por citometría de flujo y, adicionalmente, el índice de estimulación (IE) de los monocitos en 10 controles sanos en respuesta a las diferentes concentraciones de PMA.
*p<0,05; ***p<0,001.
Al evaluar el CV de estos histogramas en los monocitos, se observó que este parámetro fue significativamente menor en monocitos no estimulados comparado con el CV de la IMF en los monocitos estimulados con 0,02, 0,2, 2 o 5μg/ml de PMA. No hubo diferencias significativas entre el CV de la IMF de los monocitos expuestos a 0,02, 0,2, 2 o 5μg/ml de PMA (fig. 2).
Finalmente el análisis del IE en los monocitos no reveló diferencias significativas en este parámetro cuando se compararon las diferentes dosis de PMA usadas para inducir la explosión respiratoria en estas células.
De manera importante, se observó una marcada disminución en los niveles de oxidación de la DHR en monocitos comparado con los PMN (al comparar IMF e IE en las figs. 1 y 2) mientras que el CV aumentó en los monocitos activados comparado con este parámetro en estas mismas células sin estímulo, un fenómeno opuesto a lo observado para los PMN. Esto indica que los monocitos activados con PMA responden de manera más heterogénea que los PMN en lo que respecta a la explosión respiratoria y a la formación de peroxinitritos.
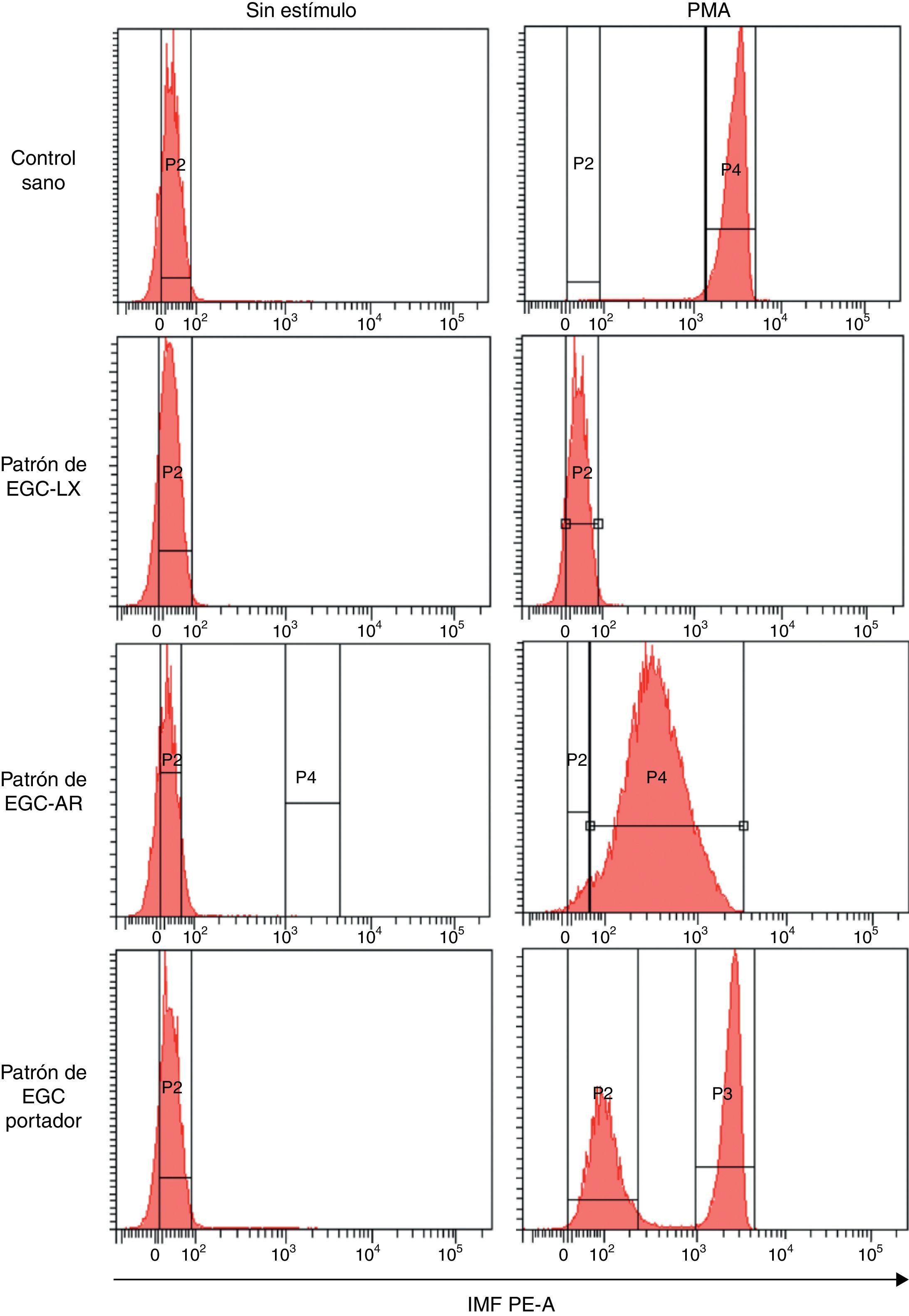
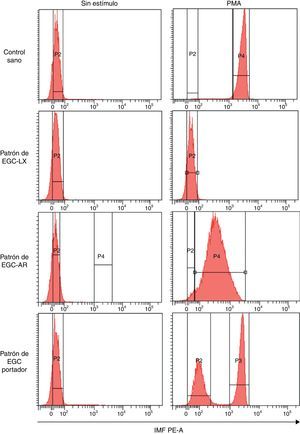
Patrones de oxidación de la dihidrorodamina por PMN de sangre periférica de individuos con sospecha de enfermedad granulomatosa crónicaComo se mencionó con anterioridad, la prueba de la DHR usando la citometría de flujo es una prueba utilizada para el diagnóstico de EGC. Por consiguiente, nuestro propósito final fue evaluar si la técnica de DHR estandarizada en nuestro grupo podía identificar los diferentes patrones de oxidación de la DHR por PMN de individuos sospechosos a presentar estos defectos. La figura 3 muestra los histogramas representativos de los diferentes patrones de oxidación de DHR generados por los PMN de diferentes individuos en el citómetro de flujo. Se observa que, en un individuo sano, los PMN sin estímulo se pueden discriminar de aquellos estimulados con PMA a 5μg/ml por un aumento en la IMF de estas células marcadas con DHR. Por su parte, cuando se analiza los PMN marcados con DHR de un individuo con sospecha de EGC-LX (fig. 3), se observa que no existen diferencias en la IMF de los PMN activados con PMA en comparación con aquellos sin estímulo, lo que sugiere defectos en el estallido respiratorio. Adicionalmente, en un paciente con sospecha de EGC-AR se observa oxidación de la DHR por parte de los PMN estimulados con PMA. Sin embargo, el IMF de estas células es mucho menor que el observado en un control sano pero mayor que en el paciente con sospecha de EGC-LX. De manera interesante, el CV de los PMN estimulados con PMA de este paciente muestra que la respuesta de sus granulocitos es mucho más heterogénea que aquella en el individuo sano. Por otra parte, se presenta el patrón de oxidación de la DHR de los PMN de una portadora de EGC-LX. Cuando estos PMN se estimulan con PMA, se observan 2 subpoblaciones de granulocitos: una que oxida deficientemente la DHR, lo cual indica una producción de niveles reducidos de peróxido de hidrógeno por parte del sistema NADPH oxidasa, y otra que oxida la DHR a niveles normales tras el estímulo, comparado con el control sano. Por consiguiente, la prueba de DHR realizada en nuestro laboratorio detecta de manera confiable aquellos individuos que presentan alteraciones en el estallido respiratorio y permite discriminar los diferentes fenotipos (defectos severos, defectos parciales y madres portadoras de defectos en el estallido respiratorio de los PMN). En el transcurso de la realización de esta técnica por citometría digital se han detectado 3 pacientes con alteraciones en el estallido respiratorio que sugieren una EGC-LX y 2 madres portadoras del defecto en una muestra de 129 pacientes sospechosos evaluados. En uno de ellos y su madre ya se ha confirmado el defecto molecular en el gen CYBB (comunicación personal del Laboratorio Asistencial Grupo de Inmunodeficiencias Primarias).
Patrones de oxidación de la DHR en neutrófilos de sangre periférica en diferentes fenotipos de EGC. Patrones representativos de la explosión respiratoria evaluada por la prueba de DHR tras estimulación con 5μg/ml de PMA en neutrófilos de un control sano, en un individuo con sospecha de EGC ligada al X (EGC-LX), en otro con sospecha de EGC autosómica recesiva (EGC-AR) y en una madre portadora de EGC (EGC-Portador). Se presentan los ejes que delimitan los histogramas que sirven como referencia para el cálculo de las variables evaluadas (IMF, CV e IE).
IMF PE-A: intensidad media de fluorescencia correspondiente a la longitud de onda 585nm en el parámetro de área; P2: histograma de las células sin estímulo; P3 y P4: histograma de las células estimuladas.
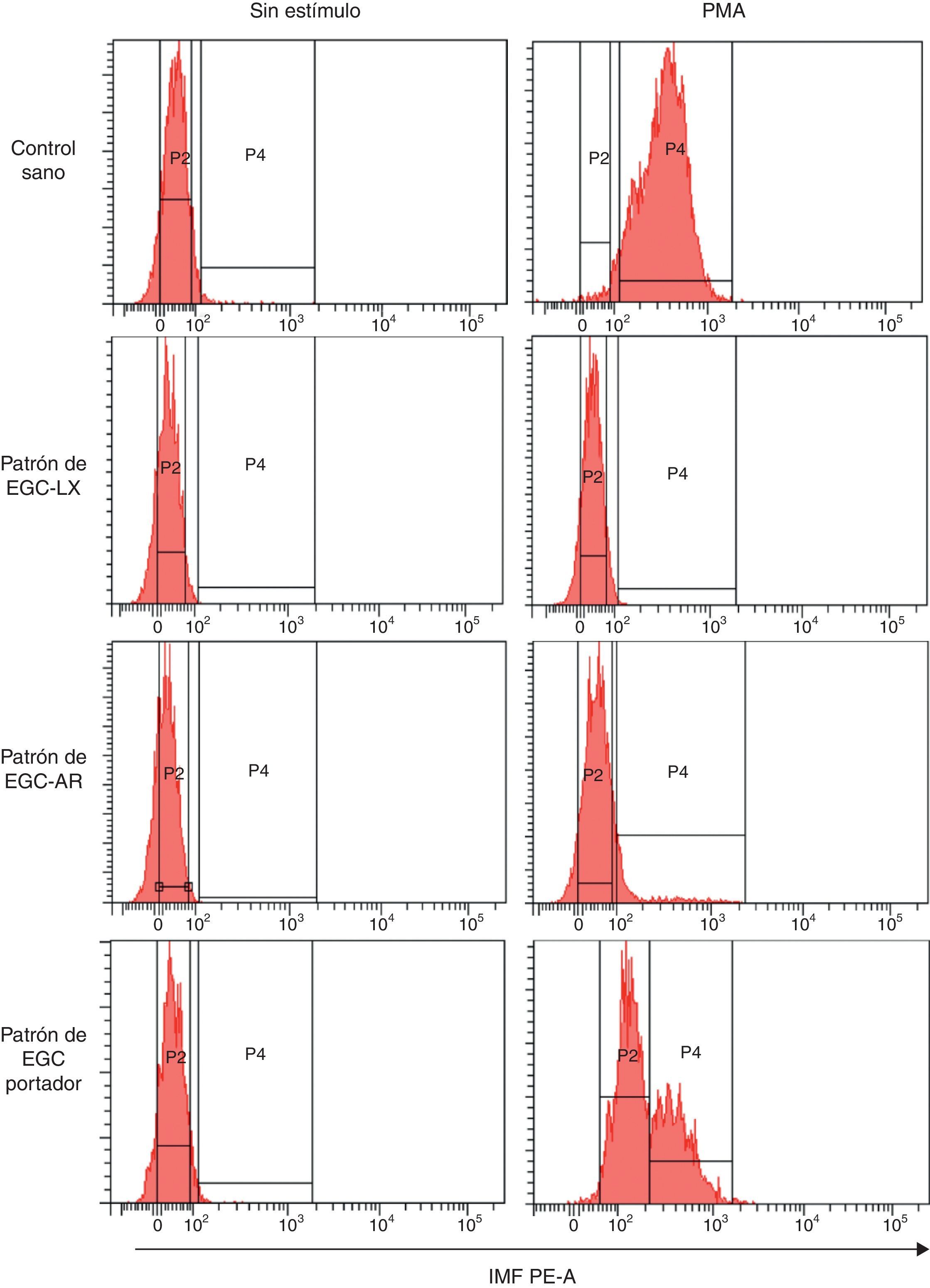
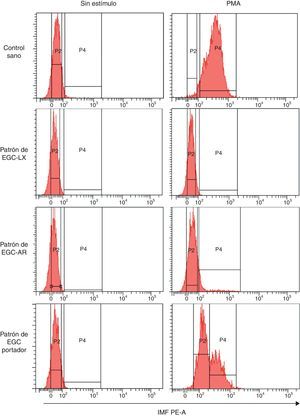
Como se mencionó con anterioridad, al evaluar su explosión respiratoria con DHR los monocitos activados con PMA responden de manera más heterogénea que los PMN. Teniendo en cuenta las evidencias que indican que algunos defectos en el sistema NADPH oxidasa pueden afectar linajes celulares específicos, pretendemos evaluar mediante la técnica de DHR si los patrones de oxidación de la DHR por los monocitos de sangre periférica de individuos con sospecha de EGC son similares a los de sus neutrófilos. La figura 4 muestra los histogramas representativos de los diferentes patrones de oxidación de DHR generados por los monocitos de los diferentes individuos en el citómetro de flujo. Se observa que los monocitos sin estímulo de un individuo sano se pueden discriminar de los estimulados con PMA a una dosis de 5μg/ml por un ligero aumento en la IMF de estas células marcadas con DHR; sin embargo, este incremento en la IMF es mucho menor que el observado en los PMN (fig. 3). Por otra parte, cuando se analizan los monocitos marcados con DHR de un individuo con sospecha de EGC-LX (fig. 4), se observa que no existen diferencias en la IMF de los monocitos activados con PMA en comparación con aquellos sin estímulo, como se había observado en los PMN de este individuo. Esto sugiere defectos en el estallido respiratorio también de los monocitos de este individuo. Adicionalmente, en un paciente con sospecha de EGC-AR no se observa oxidación de la DHR por parte de los monocitos estimulados con PMA, un hallazgo diferente a lo observado en los PMN de individuos con sospecha de este mismo defecto (fig. 3). Por otra parte, se presenta el patrón de oxidación de la DHR de los monocitos de una portadora de EGC-LX. Cuando estos monocitos se estimulan con PMA, se observa 2 subpoblaciones: una que oxida deficientemente la DHR y otra que oxida la DHR a niveles comparables al control sano. Por lo tanto, el patrón de oxidación de la DHR en monocitos es similar al de los PMN en individuos sanos, en aquellos con sospecha de EGC-LX y en madres portadoras de este defecto. Sin embargo, en pacientes con sospecha de EGC-AR se observa un defecto más severo en el patrón de oxidación de la DHR en los monocitos comparado con los PMN.
Patrones de oxidación de la DHR en monocitos de sangre periférica en diferentes fenotipos de EGC. Patrones representativos de la explosión respiratoria evaluada por la prueba de DHR tras estimulación con 5μg/ml de PMA en monocitos de un control sano, en un individuo con sospecha de EGC ligada al X (EGC-LX), en otro con sospecha de EGC autosómica recesiva (EGC-AR) y en una madre portadora de EGC (EGC-Portador). Se presentan los ejes que delimitan los histogramas que sirven como referencia para el cálculo de las variables evaluadas (IMF, CV e IE).
IMF PE-A: intensidad media de fluorescencia correspondiente a la longitud de onda 585nm en el parámetro de área; P2: histograma de las células sin estímulo, P4: histograma de las células estimuladas.
En este estudio nosotros presentamos la estandarización de la técnica de DHR utilizando un citómetro digital de última generación, basados en el protocolo descrito por Vowells et al.10. Actualmente, la citometría de flujo como técnica de análisis celular es ampliamente utilizada en los centros de investigación y laboratorios de diagnóstico a nivel mundial, debido a que es una herramienta rentable, reproducible, con un requerimiento mínimo de tiempo y de fácil manejo. Adicionalmente, avances tecnológicos en el software de los citómetros de flujo han permitido implementar una amplia variedad de opciones para el manejo, el almacenamiento y la evaluación de los datos que han sido cruciales para desarrollar diferentes enfoques en diversas patologías tales como el cáncer, y en el entendimiento y la medición de funciones biológicas de muchos tipos celulares, tales como los neutrófilos13,14. Los citómetros de última generación pueden evaluar diferentes aspectos de la activación de los neutrófilos en pequeñas muestras de sangre total tales como: fagocitosis, explosión respiratoria (generación de anión superóxido y producción de peróxido de hidrógeno intracelular), pH intracelular, polimerización de la actina, agregación y expresión de marcadores de superficie, entre otros15,16.
Nosotros usamos la técnica de DHR por citometría de flujo para evaluar el estallido respiratorio en células PMN de sangre periférica de 10 individuos sanos, utilizando diferentes concentraciones de PMA. Esto nos permitió establecer los valores de referencia para el IE entre 72 y 212, con un CV de 9,5 a 28 en PMN estimulados con dosis entre 0,2 a 5μg/ml de PMA en individuos sanos de nuestra población. Estos hallazgos son similares a los descritos previamente por Vowells et al.17, quienes demostraron que el IE de los PMN de 26 controles sanos fue de 85,2 a 264,6, con un CV entre 11,4 y 41,1. Sin embargo, nuestros resultados difieren de los reportados por Corrochano et al., quienes observaron un IE entre 32 y 300 (promedio de 149) en 6 individuos sanos18. Así pues, esta diferencia de IE reportados en población sana sugiere la importancia de que cada laboratorio establezca sus propios valores de referencia haciendo uso adecuado de las muestras durante su procesamiento.
Interesantemente, los fagocitos no son las únicas células que presentan alteraciones genéticas que afectan su sistema NADPH oxidasa. Bustamante et al.6 recientemente reportaron pacientes con un fenotipo limitado a infecciones micobacterianas asociado a mutaciones de línea germinal del gen CYBB, que codifica para la cadena β del flavocitocromo b558. Como se mencionó anteriormente, esta molécula se constituye en un elemento esencial del sistema NADPH oxidasa, presente no solo en neutrófilos, monocitos y macrófagos, sino también en menor medida en células dendríticas y linfocitosB. De manera interesante, estas mutaciones en el gen CYBB resultan en un defecto mas no en la ausencia total del ensamble del flavocitocromo b558, específicamente en macrófagos derivados de monocitos y en líneas de célulasB inmortalizadas con VEB pero no en granulocitos o monocitos. Por consiguiente, es importante considerar, en un paciente con alta sospecha clínica de EGC, evaluar no solo la explosión respiratoria en neutrófilos sino también en otras poblaciones celulares que posean esta maquinaria microbicida como líneas celulares de LB transformadas con VEB y en macrófagos derivados de monocitos. El mecanismo por el cual las mutaciones de línea germinal en este gen afectan específicamente a los LB y a los macrófagos está relacionado con las diferencias en la expresión de gp91phox específico de cada célula, con el umbral de expresión de gp91phox necesario para el ensamble del flavocitocromo b558 y finalmente con el umbral del complejo ensamblado b558 necesario para la actividad oxidasa NADPH6.
La evaluación de la DHR ha demostrado ser una técnica rápida y sencilla utilizada para apoyar el diagnóstico clínico de pacientes con alta sospecha de EGC18. Sin embargo, se debe tener en cuenta que esta prueba puede generar resultados transitoriamente anormales debido a que existen factores inherentes al paciente tales como las infecciones recurrentes o el tratamiento con algunos antibióticos que pueden interferir con las funciones celulares de los fagocitos que incluyen la quimiotaxis, la fagocitosis y la producción de especies reactivas de oxígeno19,20. Wenisch et al.21 evaluaron el efecto de la dosis oral de la azitromicina y claritromicina en la función de los PMN expuestos a E.coli en 12 voluntarios sanos por citometría de flujo, y reportaron que una dosis oral de azitromicina de 8 a 12mg/kg produce una disminución en la fagocitosis y altera significativamente la capacidad de los PMN de producir radicales libres de oxígeno, en contraste con la claritromicina, la cual no produce ningún efecto sobre el «estallido respiratorio» en estas células. Adicionalmente, Shalekoff et al.22 evaluaron la función de los granulocitos en una cohorte de pacientes seropositivos para HIV tipo1 y otros con tuberculosis pulmonar, demostrando una capacidad fagocítica deficiente y una disminución en el estallido respiratorio en estos individuos. Este estallido, evaluado específicamente con la prueba de DHR, también se ha visto disminuido en neonatos sépticos o pretérmino, y de manera importante en pacientes deficientes de mieloperoxidasa23,24. Por lo tanto, en pacientes que presenten condiciones transitorias que afecten el resultado de la prueba de DHR es recomendable volver a realizar la prueba una vez el paciente mejore su condición20. En las otras situaciones (pacientes HIV+ o con sospecha de otras deficiencias en las células fagocíticas) cobra importancia el análisis de expresión de las proteínas implicadas en el sistema NADPH por Western blot y diagnóstico genético17, que serían la herramientas de elección que permitirían definir si los defectos en la moléculas encargadas de la explosión respiratoria son las responsables del fenotipo clínico o si, por el contrario, están afectadas como consecuencia de los continuos retos antigénicos u otros defectos en las células fagocíticas. Además, la prueba de DHR no provee una clasificación definitiva del genotipo EGC, dado que algunos pacientes con EGC-LX tienen una ligera actividad de su sistema NADPH oxidasa similar al de pacientes con EGC-AR. La correcta caracterización del genotipo de la enfermedad es importante adicionalmente para soportar decisiones terapéuticas y para realizar consejería genética.
En conclusión, este estudio valida la técnica de DHR en un citómetro de última generación, como una prueba reproducible y confiable no solo para evaluar la producción de radicales libres de oxígeno en neutrófilos y monocitos de pacientes con alta sospecha de EGC, sino también como cribado inicial para sugerir el posible genotipo de la enfermedad. Finalmente, este estudio nos permitió establecer por primera vez en nuestro país valores de referencia para el IE en la prueba de DHR en PMN estimulados con diferentes dosis de PMA en individuos sanos. La implementación de métodos diagnósticos para este tipo de enfermedades raras contribuye a mejorar la morbimortalidad y la calidad de vida de estos pacientes educando al personal médico para así establecer protocolos que optimicen los recursos destinados por el sistema de salud al manejo de estas enfermedades en Colombia.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEstrategia de sostenibilidad 2011-2012 Universidad de Antioquia y Programa de Joven Investigador de COLCIENCIAS, Convocatoria 525 de 2011.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Dr. Mauricio Rojas López, Director de la Unidad de Citometría, Sede de Investigación Universitaria, Universidad de Antioquia, Medellín-Colombia, por su colaboración en la lectura y el análisis de los datos.