La presencia de hipertensión arterial se asocia con peor pronóstico en pacientes con COVID-19, y se ha sugerido que el uso de inhibidores del eje renina-angiotensina puede influir en el pronóstico de los pacientes.
MétodosRegistro observacional de 921 pacientes consecutivos ingresados por infección respiratoria COVID-19 entre el 1 de marzo y el 30 abril de 2020 en el Hospital General Universitario de Ciudad Real. Se registraron datos clínicos y analíticos, intervenciones terapéuticas y desarrollo de eventos durante el ingreso hospitalario.
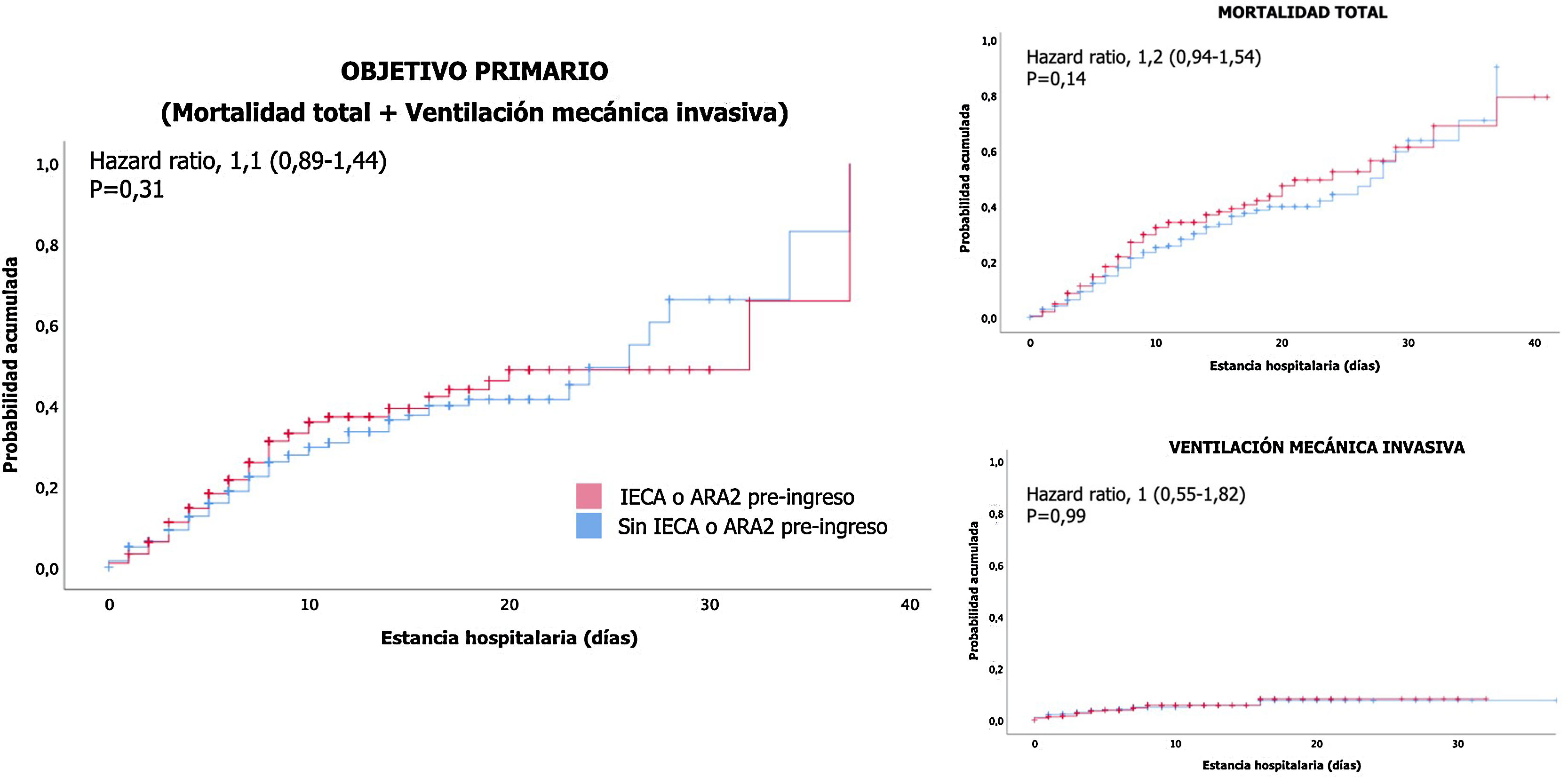
ResultadosLa mediana de edad fue de 78años y el 59,2% tenían hipertensión arterial. Aunque el perfil clínico fue más desfavorable en el grupo de pacientes con prescripción previa de IECA o ARA2 respecto al resto, los primeros presentaron menor riesgo de desarrollo del evento primario combinado (mortalidad total o necesidad de soporte ventilatorio invasivo). Asimismo, el empleo previo al ingreso o durante el mismo de estos fármacos mostró un efecto neutro sobre la mortalidad total y sobre la necesidad de ventilación mecánica invasiva. En el análisis de supervivencia no se observó mayor riesgo de presentar más precozmente ninguno de los eventos registrados.
ConclusionesLa prescripción previa al ingreso por infección respiratoria COVID-19 de inhibidores del eje renina-angiotensina se asoció a un menor riesgo de desarrollo del evento primario combinado y a un efecto neutro sobre la mortalidad total y sobre la necesidad de ventilación mecánica invasiva.
Hypertension has been associated with worse outcomes in patients with COVID-19 infection, so concerns have been raised about the possibility that inhibitors of the renin-angiotensin system (RAS) could influence the prognosis of these patients.
MethodsThis is an observational study of 921 consecutive patients admitted with COVID-19 respiratory infection to Hospital General Universitario Ciudad Real from March 1 to April 30, 2020. Following data were collected including patient demographic information, medical history, clinical characteristics, laboratory data, therapeutic interventions during the hospitalization and clinical outcomes.
ResultsThe mean age was 78years, and 59.2% of patients had a history of hypertension. Patients with previous treatment with RAS inhibitor (42.4%) showed lower risk of the primary composite endpoint (mortality or need for invasive mechanical ventilation). Treatment with RAS inhibitor (both outpatient treatment and during hospitalization) had neither effect on mortality nor need for invasive ventilation. There were no differences in time-to-event analysis between groups.
ConclusionsRAS inhibitor treatment prior to admission in patients with COVID-19 respiratory infection was associated with lower risk of the primary composite endpoint and did not show neither impact on mortality nor need for invasive mechanical ventilation, even if these drugs were prescribed during hospitalization.
La comunidad internacional asiste a una situación de alerta sanitaria por la pandemia originada por un nuevo tipo de coronavirus, descubierto y aislado por primera vez en diciembre de 2019 en Wuhan (China): el coronavirus-2 del síndrome respiratorio agudo grave (SARS-CoV-2)1. La afectación clínica por dicho germen recibe la denominación COVID-19. Los síntomas más frecuentes son fiebre, tos, disnea o mialgias. Entre las complicaciones más graves que pueden motivar el ingreso en unidades hospitalarias de cuidados críticos destacan el síndrome de distrés respiratorio agudo (SDRA), la lesión cardíaca y la sobreinfección secundaria1,2.
La fisiopatología de este virus continúa siendo desconocida. Uno de los mecanismos que mayor interés y controversia suscita es la relación especial entre el SARS-CoV-2 y el sistema renina-angiotensina-aldosterona (SRAA), y concretamente con la enzima conversora de angiotensina (ECA) 2, una de sus enzimas reguladoras. Esta proteína, presente en la superficie de células epiteliales pulmonares (entre otras localizaciones)3, se postula como mecanismo de entrada para la infección por el virus, viéndose reducida la expresión celular de la ECA2 una vez infectadas dichas células4-6. Dado que se han propuesto funciones contrapuestas entre la ECA2 y la ECA original (o ECA1)2,6,7, la inhibición de esta última (bien mediante fármacos directos —inhibidores de la ECA [IECA]—, bien mediante medicamentos que bloquean los efectos de su metabolito, la angiotensina2 —antagonistas del receptor de angiotensina2 [ARA2]—) derivaría en un aumento de la expresión de la ECA2 en el epitelio respiratorio, favoreciendo la infección por SARS-CoV-2 y pudiendo agravarla8-11. Ya que tanto IECA como ARA2 constituyen fármacos de primera línea en el tratamiento de la hipertensión arterial2, podrían explicarse los resultados de estudios llevados a cabo en población asiática, en los que destaca el efecto pronóstico adverso de la hipertensión arterial en pacientes con COVID-192,12-14.
Sin embargo, tomando como base los resultados de estudios previos en animales en los que se demuestra el efecto protector de la ECA2 sobre el daño pulmonar agudo15-17, otras publicaciones postulan el posible efecto beneficioso (o, al menos, no perjudicial) de IECA o ARA24,5,18,19. Así, al reducirse la expresión de ECA2 tras producirse la infección por SARS-CoV-2, la angiotensina2 quedaría sin oposición, ejerciendo efectos proinflamatorios en diversos tejidos (incluido el pulmón)6; por el contrario, al incrementarse la expresión de ECA2 con el empleo de IECA o ARA2 se favorecería el efecto vasodilatador y antiinflamatorio de los metabolitos resultantes de la acción de esta enzima4,6,20. Este argumento, unido a la escasa evidencia científica disponible hasta la fecha, ha llevado a diferentes sociedades internacionales a recomendar no suspender el tratamiento con estos fármacos en pacientes con COVID-1921-22.
España constituye uno de los países con mayores tasas de infección y mortalidad por COVID-19, habiéndose comunicado más de 243.000 casos confirmados y 27.136 fallecidos (a fecha de 12 de junio de 2020), y la provincia de Ciudad Real es la que ha presentado la mayor tasa de mortalidad en el país (200,9 decesos por cada 100.000 habitantes)23. Aunque se estima una prevalencia de HTA alrededor del 43% (16,5 millones de personas, aproximadamente)24, hay poca evidencia del efecto de esta comorbilidad y del empleo de fármacos como IECA o ARA2 en el pronóstico de población española ingresada por COVID-19.
Con el presente trabajo se pretende evaluar la influencia de los fármacos IECA y ARA2 (prescritos previo al ingreso y/o administrados durante la hospitalización) sobre el pronóstico de los pacientes ingresados por COVID-19 con afectación respiratoria en el Hospital General Universitario de Ciudad Real (HGUCR), España, centro de referencia provincial.
MétodosDiseño del estudio y poblaciónEstudio unicéntrico observacional de cohortes de una serie consecutiva de pacientes ingresados por COVID-19 en el HGUCR. El protocolo del estudio fue aprobado por el comité ético de investigación clínica del centro sanitario. Se obtuvo el consentimiento informado para el uso de los datos, y la confidencialidad se garantizó según la Ley de Protección de Datos Personales y garantía de los derechos digitales realizando una base de datos anonimizada y disociada.
Se incluyó a los pacientes con edad igual o superior a 18años ingresados en planta de hospitalización o en unidad de cuidados intensivos del HGUCR entre el 1 de marzo y el 30 de abril de 2020 con resultado positivo de la prueba de reacción en cadena de la polimerasa (PCR) para el SARS-CoV-2 y semiología clínica y/o radiológica de afectación respiratoria. Se excluyó a los pacientes ingresados en dicho centro que presentasen resultado negativo de PCR para SARS-CoV-2 o que, con resultado positivo, ingresasen sin afectación respiratoria.
Recogida de datosSe realizó recogida de variables (demográficas, clínicas, comorbilidades, analíticas, radiológicas y terapéuticas) de los pacientes ingresados en el periodo descrito y se analizó el desarrollo de eventos clínicos durante el ingreso hospitalario. Se recogieron de la historia clínica las variables demográficas (edad, sexo), clínicas (sintomatología principal, frecuencia respiratoria, presión arterial, deterioro del nivel de conciencia) y las comorbilidades (hipertensión arterial, diabetes mellitus, tabaquismo activo o previo, obesidad, síndrome de apnea obstructiva del sueño, enfermedad pulmonar obstructiva crónica, enfermedad renal crónica, cardiopatía isquémica, insuficiencia cardíaca, fibrilación auricular, enfermedad autoinmune, trasplante de órgano sólido), y se registraron los eventos clínicos acontecidos durante el ingreso hospitalario (muerte por cualquier causa, necesidad de ventilación mecánica invasiva). El tratamiento domiciliario previo al ingreso se consultó en el sistema informatizado de prescripción del Sistema de Salud de Castilla-La Mancha. Los hallazgos radiológicos (presencia de infiltrado o consolidación, y su lateralidad —unilateral o bilateral—) y las variables analíticas (recuento leucocitario, dímero-D, fibrinógeno, proteínaC reactiva, lactato deshidrogenasa, urea, creatinina, troponinaI ultrasensible, ferritina y niveles de interleucina-6) se obtuvieron del sistema informatizado de pruebas complementarias del centro. La medicación hospitalaria administrada se obtuvo del registro electrónico de prescripción hospitalaria.
DefinicionesLa variable principal se definió como la compuesta por la mortalidad por cualquier causa y/o la necesidad de soporte ventilatorio mecánico invasivo durante el ingreso hospitalario. Se estableció como fecha de inicio del seguimiento de cada paciente la fecha de ingreso hospitalario, y como fecha fin de seguimiento, el primer evento acontecido durante el ingreso (necesidad de ventilación mecánica invasiva o muerte por cualquier causa) o, en caso de no producirse evento, la fecha de alta hospitalaria.
Se elaboró un protocolo de manejo clínico en el que la decisión de ingreso hospitalario se basó en criterios publicados por el Ministerio de Sanidad de España, que incluían: insuficiencia respiratoria (definida como saturación de oxígeno <90% o presión arterial de oxígeno <60mmHg); frecuencia respiratoria >30 respiraciones por minuto, respirando aire ambiente; anomalías radiológicas (por radiografía o tomografía computarizada de tórax) compatibles con neumonía (neumonía bilateral, o neumonía unilateral con afectación de diferentes lóbulos pulmonares) asociada a COVID-19; o afectación clínica relevante de otros sistemas.
Se registraron como fármacos antihipertensivos: IECA, ARA2, antagonistas del receptor de mineralocorticoides, calcioantagonistas, diuréticos, betabloqueantes y fármacos alfabloqueantes con indicación cardiovascular. Se definió la exposición previa a fármacos antihipertensivos en base a los datos de prescripción farmacológica activos hasta un mes antes del comienzo del seguimiento. Para el análisis primario se estableció una variable con categorías excluyentes entre sí: uso de IECA o ARA2 y no uso de IECA o ARA2. Asimismo, se analizó el efecto de cada grupo farmacológico por separado. Finalmente, se diferenció entre si la prescripción de IECA o ARA2 era previa o se realizó durante el ingreso.
Análisis estadísticoLas variables cuantitativas se presentan mediante estadísticos de tendencia central (media para las variables con distribución normal y mediana para las variables continuas de distribución no gaussiana) y estadísticos de dispersión (desviación típica acompañando a la media para variables con distribución normal, y la amplitud intercuartílica acompañando a la mediana para el resto de variables cuantitativas). Las variables cualitativas se presentan como frecuencias y porcentajes. La normalidad de las distribuciones se contrastó mediante la prueba de Kolmogorov-Smirnov. Para el contraste de hipótesis, cuando la comparación se realizó en una variable cuantitativa se empleó como prueba paramétrica la t de Student para muestras independientes, y como test no paramétrico la U de Mann-Whitney. Para la comparación de variables categóricas se utilizó la prueba chi-cuadrado, y si el número de efectivos era inferior a 5, la prueba exacta de Fisher. La relación entre múltiples variables se estudió aplicando modelos de regresión logística para evaluar variables dependientes cualitativas dicotómicas, introduciendo en la ecuación las variables independientes que mostraron significación estadística en el análisis univariado. El tiempo hasta los eventos se analizó siguiendo un modelo de Kaplan-Meier, y los grupos se compararon usando la prueba log-rank. Para todos los contrastes se seleccionó un riesgo alfa del 5% (asumiendo significación estadística si p<0,05). Todos lo intervalos se muestran con un grado de confianza del 95%. Todos los análisis estadísticos se realizaron con el software Statistics (versión 25.0, IBM, Nueva York, Estados Unidos).
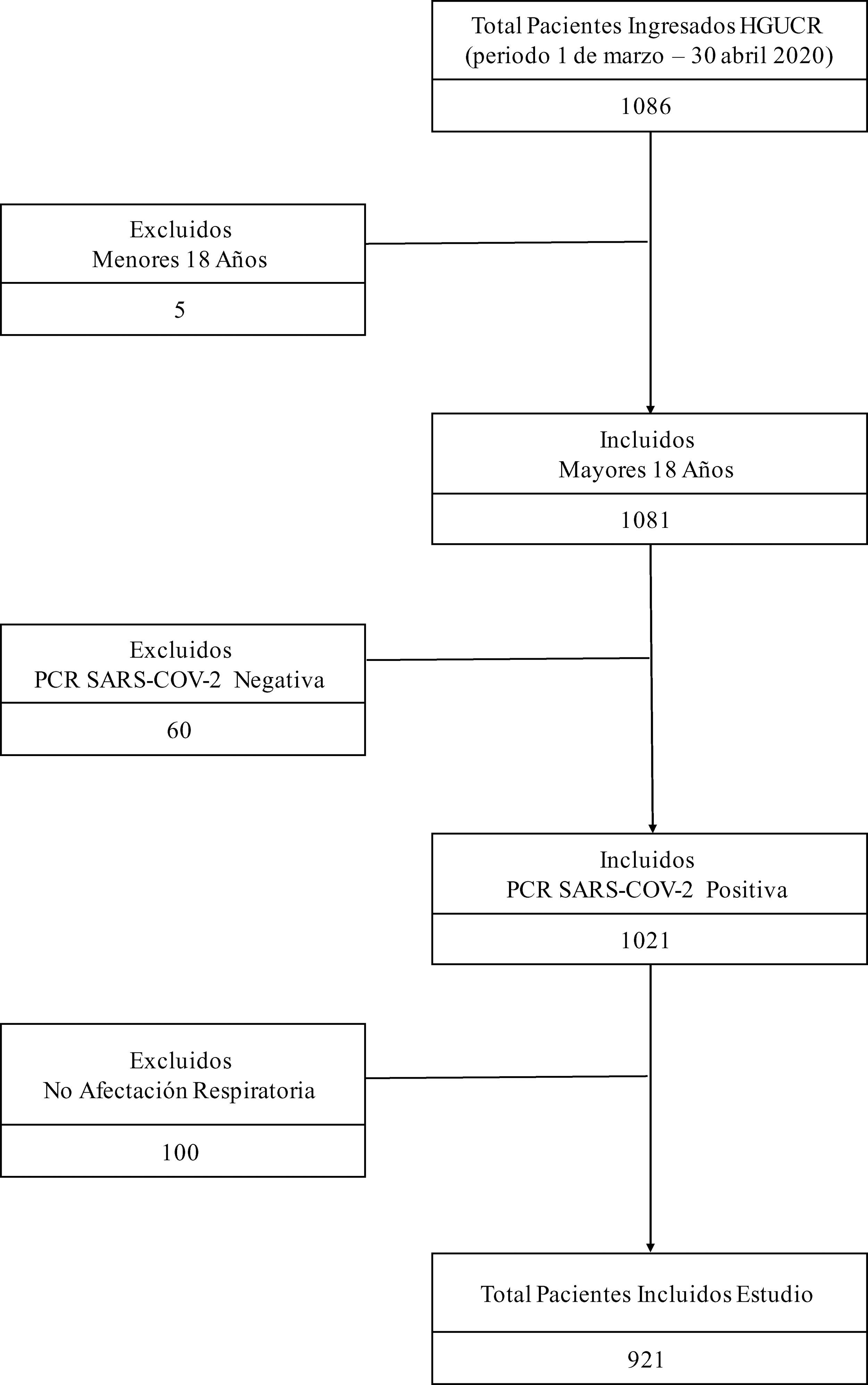
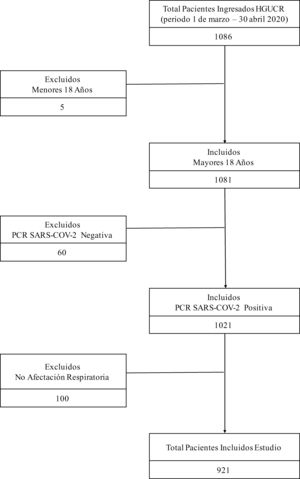
ResultadosPoblación del estudioEntre el 1 de marzo y el 30 de abril de 2020, 1.086 pacientes ingresaron en nuestro centro con infección COVID-19. Se excluyeron del estudio 5pacientes menores de 18años, 60 pacientes con resultado negativo de PCR para SARS-CoV-2 y 100 pacientes que, aunque tenían resultado positivo por PCR para SARS-CoV-2, no presentaban afectación clínica ni radiológica a nivel respiratorio. La muestra finalmente analizada quedó constituida por 921 pacientes, de los cuales 400 tenían prescritos IECA o ARA2 previamente al ingreso, y 521 pacientes no (fig. 1). La mediana de edad de la cohorte de estudio fue de 78años (rango intercuartílico 68-85años). El factor de riesgo cardiovascular más prevalente fue la hipertensión arterial (545pacientes, 59,2%), la mayoría bajo tratamiento con algún IECA o ARA2 (400pacientes, 42,2%). El periodo medio de seguimiento fue de 8,8 (6,5) días. En la tabla A.1 se recogen otras características clínicas de la cohorte de estudio.
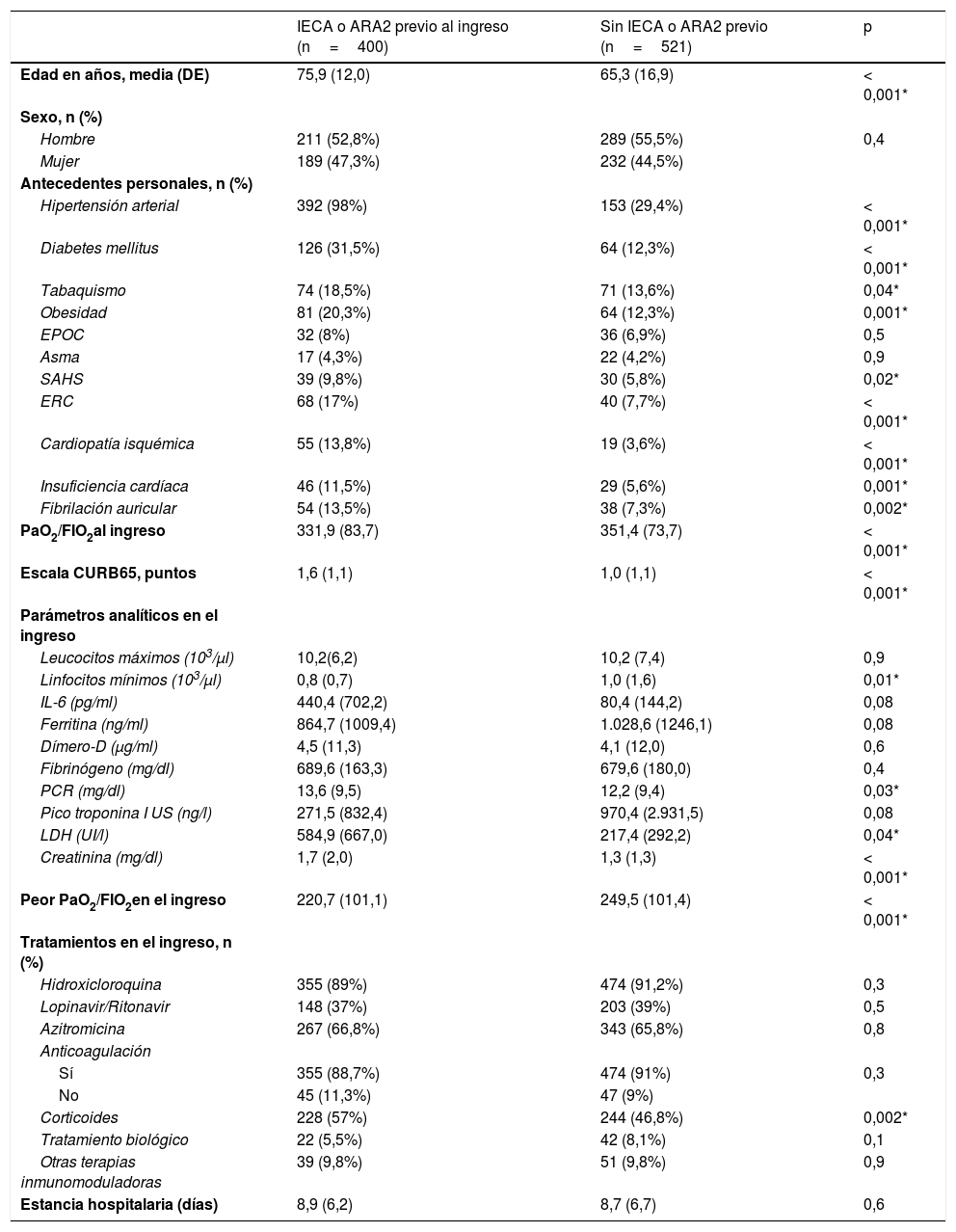
Los pacientes con prescripción previa de IECA o ARA2 presentaron mayor edad media en comparación con la cohorte de pacientes sin uso previo de estos fármacos (75,9 [12,0] vs 65,3 [16,9] años, p<0,001). Asimismo, la prevalencia de factores de riesgo y enfermedad cardiovascular establecida fue mayor en el grupo con empleo previo de IECA o ARA2. Además, este grupo de pacientes presentó peor índice de Kirby (relación entre la presión arterial de oxígeno y la fracción inspirada de oxígeno [PaO2/FiO2]), tanto al ingreso como durante la evolución, así como linfopenia más acusada y elevación de parámetros analíticos inflamatorios, en comparación con el grupo sin tratamiento previo con IECA o ARA2. En cuanto al tratamiento intrahospitalario, no se observaron diferencias entre ambos grupos en relación con el tratamiento antiviral, si bien la prescripción de corticoterapia sistémica fue más frecuente en los pacientes con prescripción previa de IECA o ARA2 (tabla 1).
Características clínicas basales y manejo intrahospitalario
| IECA o ARA2 previo al ingreso (n=400) | Sin IECA o ARA2 previo (n=521) | p | |
|---|---|---|---|
| Edad en años, media (DE) | 75,9 (12,0) | 65,3 (16,9) | < 0,001* |
| Sexo, n (%) | |||
| Hombre | 211 (52,8%) | 289 (55,5%) | 0,4 |
| Mujer | 189 (47,3%) | 232 (44,5%) | |
| Antecedentes personales, n (%) | |||
| Hipertensión arterial | 392 (98%) | 153 (29,4%) | < 0,001* |
| Diabetes mellitus | 126 (31,5%) | 64 (12,3%) | < 0,001* |
| Tabaquismo | 74 (18,5%) | 71 (13,6%) | 0,04* |
| Obesidad | 81 (20,3%) | 64 (12,3%) | 0,001* |
| EPOC | 32 (8%) | 36 (6,9%) | 0,5 |
| Asma | 17 (4,3%) | 22 (4,2%) | 0,9 |
| SAHS | 39 (9,8%) | 30 (5,8%) | 0,02* |
| ERC | 68 (17%) | 40 (7,7%) | < 0,001* |
| Cardiopatía isquémica | 55 (13,8%) | 19 (3,6%) | < 0,001* |
| Insuficiencia cardíaca | 46 (11,5%) | 29 (5,6%) | 0,001* |
| Fibrilación auricular | 54 (13,5%) | 38 (7,3%) | 0,002* |
| PaO2/FIO2al ingreso | 331,9 (83,7) | 351,4 (73,7) | < 0,001* |
| Escala CURB65, puntos | 1,6 (1,1) | 1,0 (1,1) | < 0,001* |
| Parámetros analíticos en el ingreso | |||
| Leucocitos máximos (103/μl) | 10,2(6,2) | 10,2 (7,4) | 0,9 |
| Linfocitos mínimos (103/μl) | 0,8 (0,7) | 1,0 (1,6) | 0,01* |
| IL-6 (pg/ml) | 440,4 (702,2) | 80,4 (144,2) | 0,08 |
| Ferritina (ng/ml) | 864,7 (1009,4) | 1.028,6 (1246,1) | 0,08 |
| Dímero-D (μg/ml) | 4,5 (11,3) | 4,1 (12,0) | 0,6 |
| Fibrinógeno (mg/dl) | 689,6 (163,3) | 679,6 (180,0) | 0,4 |
| PCR (mg/dl) | 13,6 (9,5) | 12,2 (9,4) | 0,03* |
| Pico troponina I US (ng/l) | 271,5 (832,4) | 970,4 (2.931,5) | 0,08 |
| LDH (UI/l) | 584,9 (667,0) | 217,4 (292,2) | 0,04* |
| Creatinina (mg/dl) | 1,7 (2,0) | 1,3 (1,3) | < 0,001* |
| Peor PaO2/FIO2en el ingreso | 220,7 (101,1) | 249,5 (101,4) | < 0,001* |
| Tratamientos en el ingreso, n (%) | |||
| Hidroxicloroquina | 355 (89%) | 474 (91,2%) | 0,3 |
| Lopinavir/Ritonavir | 148 (37%) | 203 (39%) | 0,5 |
| Azitromicina | 267 (66,8%) | 343 (65,8%) | 0,8 |
| Anticoagulación | |||
| Sí | 355 (88,7%) | 474 (91%) | 0,3 |
| No | 45 (11,3%) | 47 (9%) | |
| Corticoides | 228 (57%) | 244 (46,8%) | 0,002* |
| Tratamiento biológico | 22 (5,5%) | 42 (8,1%) | 0,1 |
| Otras terapias inmunomoduladoras | 39 (9,8%) | 51 (9,8%) | 0,9 |
| Estancia hospitalaria (días) | 8,9 (6,2) | 8,7 (6,7) | 0,6 |
ARA2: antagonista del receptor de angiotensina2; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; FiO2: fracción inspirada de oxígeno; IECA: inhibidor de la enzima conversora de angiotensina; IL-6: interleucina 6; LDH: lactato deshidrogenasa; PaO2: presión arterial de oxígeno; PCR: proteína C reactiva; SAHS: síndrome apnea-hipopnea del sueño; US: ultrasensible.
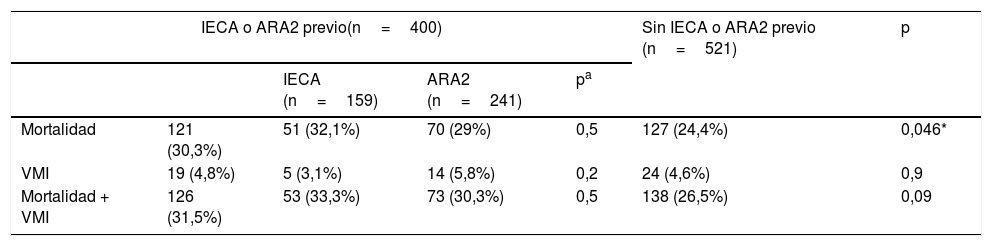
Durante el periodo de seguimiento, 264 individuos (28,7%) presentaron el evento primario compuesto (mortalidad por cualquier causa o necesidad de ventilación mecánica invasiva). Un total de 248 (26,9%) pacientes fallecieron durante el ingreso hospitalario, mientras que 43 (4,7%) pacientes requirieron soporte ventilatorio invasivo. En la tabla 2 se muestran las incidencias y las diferencias en las mismas respecto de cada uno de los eventos registrados en relación con la prescripción de IECA o ARA2.
Incidencia de eventos intrahospitalarios
| IECA o ARA2 previo(n=400) | Sin IECA o ARA2 previo (n=521) | p | ||||
|---|---|---|---|---|---|---|
| IECA (n=159) | ARA2 (n=241) | pa | ||||
| Mortalidad | 121 (30,3%) | 51 (32,1%) | 70 (29%) | 0,5 | 127 (24,4%) | 0,046* |
| VMI | 19 (4,8%) | 5 (3,1%) | 14 (5,8%) | 0,2 | 24 (4,6%) | 0,9 |
| Mortalidad + VMI | 126 (31,5%) | 53 (33,3%) | 73 (30,3%) | 0,5 | 138 (26,5%) | 0,09 |
| IECA o ARA2 en hospitalización (n=145) | Sin IECA o ARA2 en hospitalización (n=776) | p | |||||||
|---|---|---|---|---|---|---|---|---|---|
| IECA o ARA2 mantenido (n=121) | Retirada del fármaco (n=279) | pb | IECA (n=60) | ARA2 (n=85) | pc | ||||
| Mortalidad | 39 (26,9%) | 32 (26,4%) | 89 (31,9%) | 0,3 | 14 (23,3%) | 25 (29,4%) | 0,4 | 209 (26,9%) | 0,9 |
| VMI | 10 (6,9%) | 7 (5,8%) | 12 (4,3%) | 0,5 | 2 (3,3%) | 8 (9,4%) | 0,2 | 33 (4,3%) | 0,2 |
| Mortalidad + VMI | 44 (30,3%) | 35 (28,9%) | 91 (32,6%) | 0,5 | 15 (25%) | 29 (34,1%) | 0,2 | 220 (28,4%) | 0,6 |
ARA2: antagonistas del receptor de angiotensina2; IECA: inhibidores de la enzima conversora de angiotensina; VMI: ventilación mecánica invasiva.
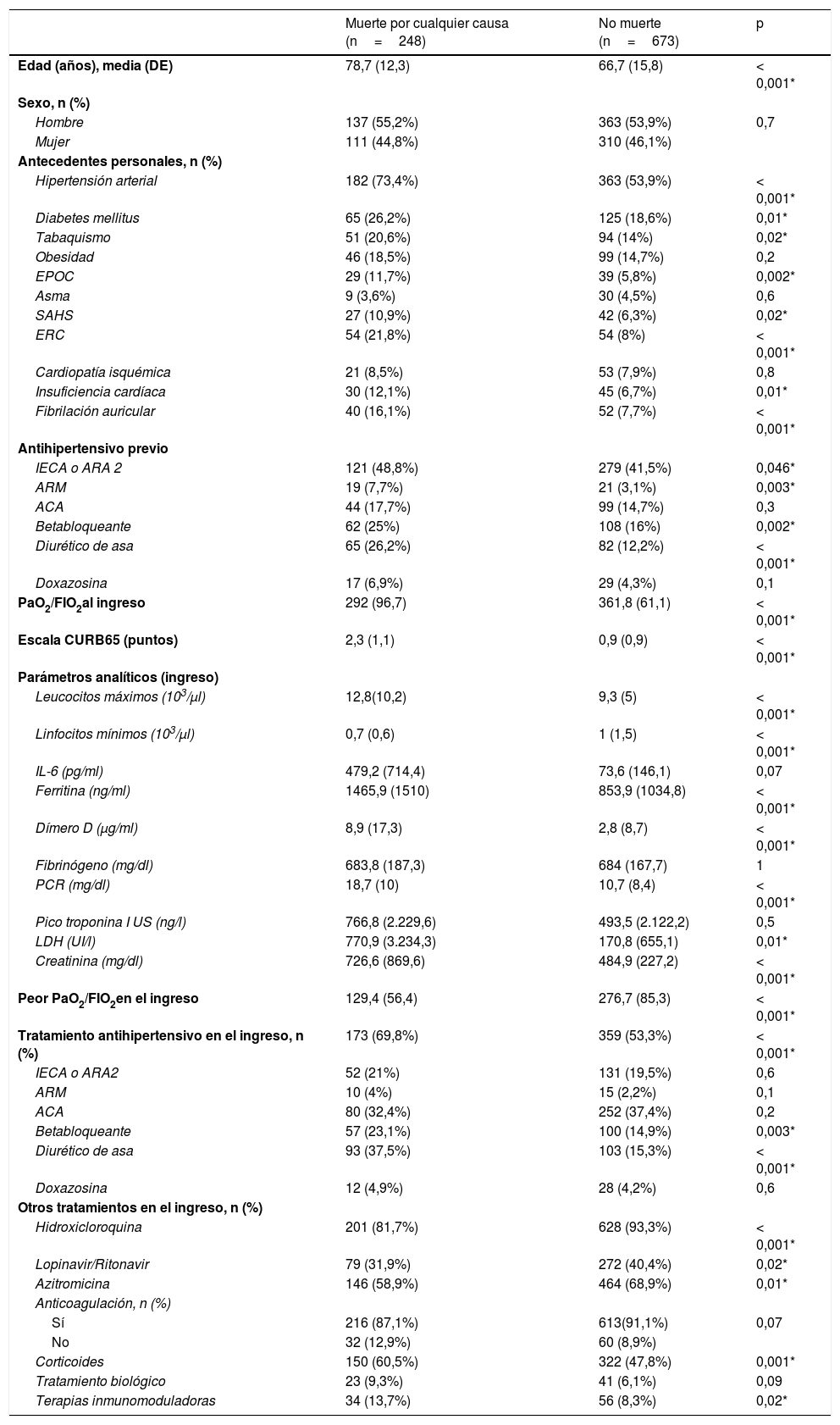
Los pacientes que fallecieron durante la estancia hospitalaria tenían mayor edad y presentaron mayor prevalencia de hipertensión arterial, diabetes mellitus, tabaquismo, enfermedad pulmonar obstructiva crónica, enfermedad renal crónica, insuficiencia cardíaca y fibrilación auricular, en comparación con los pacientes que se mantenían vivos al alta. También presentaron peor PaO2/FiO2 (tanto al ingreso como en la evolución), así como mayor elevación de parámetros analíticos de inflamación. Respecto del tratamiento dirigido a la infección COVID-19, se observaron mayores tasas de prescripción de hidroxicloroquina, de la combinación de lopinavir/ritonavir y de azitromicina en los pacientes que no fallecieron; no obstante, estos resultados deben interpretarse con precaución, pues el diseño del estudio no estaba dirigido a estudiar las diferencias en la administración de tratamientos dirigidos contra la infección COVID-19, siendo posible que se considerase no administrar estos fármacos a los pacientes que fallecieron como una medida de limitación del esfuerzo terapéutico, dadas las citadas diferencias en términos de edad entre ambos grupos (tabla 3).
Comparación de características clínicas basales, analíticas y terapéuticas en función de la mortalidad hospitalaria
| Muerte por cualquier causa (n=248) | No muerte (n=673) | p | |
|---|---|---|---|
| Edad (años), media (DE) | 78,7 (12,3) | 66,7 (15,8) | < 0,001* |
| Sexo, n (%) | |||
| Hombre | 137 (55,2%) | 363 (53,9%) | 0,7 |
| Mujer | 111 (44,8%) | 310 (46,1%) | |
| Antecedentes personales, n (%) | |||
| Hipertensión arterial | 182 (73,4%) | 363 (53,9%) | < 0,001* |
| Diabetes mellitus | 65 (26,2%) | 125 (18,6%) | 0,01* |
| Tabaquismo | 51 (20,6%) | 94 (14%) | 0,02* |
| Obesidad | 46 (18,5%) | 99 (14,7%) | 0,2 |
| EPOC | 29 (11,7%) | 39 (5,8%) | 0,002* |
| Asma | 9 (3,6%) | 30 (4,5%) | 0,6 |
| SAHS | 27 (10,9%) | 42 (6,3%) | 0,02* |
| ERC | 54 (21,8%) | 54 (8%) | < 0,001* |
| Cardiopatía isquémica | 21 (8,5%) | 53 (7,9%) | 0,8 |
| Insuficiencia cardíaca | 30 (12,1%) | 45 (6,7%) | 0,01* |
| Fibrilación auricular | 40 (16,1%) | 52 (7,7%) | < 0,001* |
| Antihipertensivo previo | |||
| IECA o ARA 2 | 121 (48,8%) | 279 (41,5%) | 0,046* |
| ARM | 19 (7,7%) | 21 (3,1%) | 0,003* |
| ACA | 44 (17,7%) | 99 (14,7%) | 0,3 |
| Betabloqueante | 62 (25%) | 108 (16%) | 0,002* |
| Diurético de asa | 65 (26,2%) | 82 (12,2%) | < 0,001* |
| Doxazosina | 17 (6,9%) | 29 (4,3%) | 0,1 |
| PaO2/FIO2al ingreso | 292 (96,7) | 361,8 (61,1) | < 0,001* |
| Escala CURB65 (puntos) | 2,3 (1,1) | 0,9 (0,9) | < 0,001* |
| Parámetros analíticos (ingreso) | |||
| Leucocitos máximos (103/μl) | 12,8(10,2) | 9,3 (5) | < 0,001* |
| Linfocitos mínimos (103/μl) | 0,7 (0,6) | 1 (1,5) | < 0,001* |
| IL-6 (pg/ml) | 479,2 (714,4) | 73,6 (146,1) | 0,07 |
| Ferritina (ng/ml) | 1465,9 (1510) | 853,9 (1034,8) | < 0,001* |
| Dímero D (μg/ml) | 8,9 (17,3) | 2,8 (8,7) | < 0,001* |
| Fibrinógeno (mg/dl) | 683,8 (187,3) | 684 (167,7) | 1 |
| PCR (mg/dl) | 18,7 (10) | 10,7 (8,4) | < 0,001* |
| Pico troponina I US (ng/l) | 766,8 (2.229,6) | 493,5 (2.122,2) | 0,5 |
| LDH (UI/l) | 770,9 (3.234,3) | 170,8 (655,1) | 0,01* |
| Creatinina (mg/dl) | 726,6 (869,6) | 484,9 (227,2) | < 0,001* |
| Peor PaO2/FIO2en el ingreso | 129,4 (56,4) | 276,7 (85,3) | < 0,001* |
| Tratamiento antihipertensivo en el ingreso, n (%) | 173 (69,8%) | 359 (53,3%) | < 0,001* |
| IECA o ARA2 | 52 (21%) | 131 (19,5%) | 0,6 |
| ARM | 10 (4%) | 15 (2,2%) | 0,1 |
| ACA | 80 (32,4%) | 252 (37,4%) | 0,2 |
| Betabloqueante | 57 (23,1%) | 100 (14,9%) | 0,003* |
| Diurético de asa | 93 (37,5%) | 103 (15,3%) | < 0,001* |
| Doxazosina | 12 (4,9%) | 28 (4,2%) | 0,6 |
| Otros tratamientos en el ingreso, n (%) | |||
| Hidroxicloroquina | 201 (81,7%) | 628 (93,3%) | < 0,001* |
| Lopinavir/Ritonavir | 79 (31,9%) | 272 (40,4%) | 0,02* |
| Azitromicina | 146 (58,9%) | 464 (68,9%) | 0,01* |
| Anticoagulación, n (%) | |||
| Sí | 216 (87,1%) | 613(91,1%) | 0,07 |
| No | 32 (12,9%) | 60 (8,9%) | |
| Corticoides | 150 (60,5%) | 322 (47,8%) | 0,001* |
| Tratamiento biológico | 23 (9,3%) | 41 (6,1%) | 0,09 |
| Terapias inmunomoduladoras | 34 (13,7%) | 56 (8,3%) | 0,02* |
ACA: calcioantagonista; ARA2: antagonista del receptor de angiotensina2; ARM: antagonista del receptor de mineralocorticoides; EPOC: enfermedad pulmonar obstructiva crónica; ERC; enfermedad renal crónica; FiO2: fracción inspirada de oxígeno; IECA: inhibidor de la enzima conversora de angiotensina; IL-6: interleucina6; LDH: lactato deshidrogenasa; PaO2: presión arterial de oxígeno; PCR: proteína C reactiva; SAHS: síndrome apnea-hipopnea del sueño; US: ultrasensible.
En cuanto al desarrollo el evento primario durante el ingreso, los que lo presentaron tenían mayor edad, así como mayor prevalencia de factores de riesgo y enfermedad cardiovascular. Cabe destacar que se observó una mayor afectación respiratoria (tanto al ingreso como durante la evolución) y peores parámetros analíticos (mayor linfopenia, mayores cifras de parámetros inflamatorios y de deterioro de función renal) en estos pacientes, en comparación con los que no desarrollaron el evento primario. Estas últimas diferencias fueron similares a las observadas en la comparación entre los que requirieron soporte ventilatorio invasivo respecto a los que no. El análisis comparativo de las características clínicas basales, parámetros analíticos y terapias recibidas durante el ingreso en función del desarrollo del evento primario combinado o de necesidad de ventilación mecánica invasiva se muestra en las tablas A.2 y A.3, respectivamente.
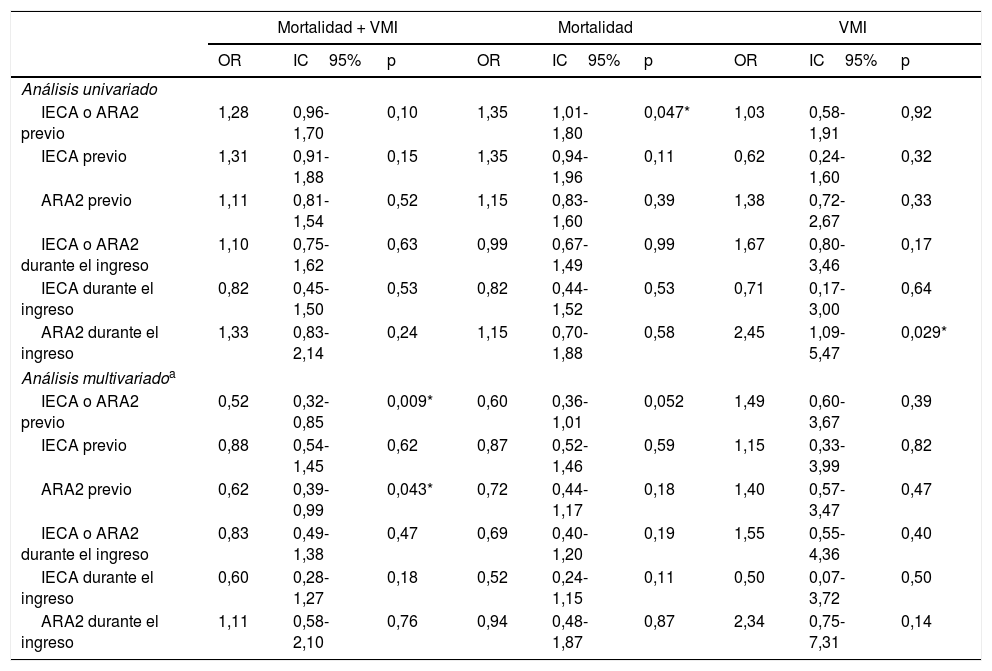
Inhibición del sistema renina-angiotensina y eventos en la evoluciónEl tratamiento previo con IECA o ARA2, en combinación o por separado, mostró un efecto neutro sobre la variable principal en el análisis univariado (tabla 4). Sin embargo, en el modelo de regresión logística ajustado a aquellas variables que se asociaron con el evento combinado (tabla A.4) el empleo previo de IECA o ARA2 se relacionó con un menor riesgo de desarrollo del mismo, al igual que ocurrió con la prescripción previa exclusiva de ARA2 (tabla 4).
Relación entre IECA/ARA2 y eventos intrahospitalarios
| Mortalidad + VMI | Mortalidad | VMI | |||||||
|---|---|---|---|---|---|---|---|---|---|
| OR | IC95% | p | OR | IC95% | p | OR | IC95% | p | |
| Análisis univariado | |||||||||
| IECA o ARA2 previo | 1,28 | 0,96-1,70 | 0,10 | 1,35 | 1,01-1,80 | 0,047* | 1,03 | 0,58-1,91 | 0,92 |
| IECA previo | 1,31 | 0,91-1,88 | 0,15 | 1,35 | 0,94-1,96 | 0,11 | 0,62 | 0,24-1,60 | 0,32 |
| ARA2 previo | 1,11 | 0,81-1,54 | 0,52 | 1,15 | 0,83-1,60 | 0,39 | 1,38 | 0,72-2,67 | 0,33 |
| IECA o ARA2 durante el ingreso | 1,10 | 0,75-1,62 | 0,63 | 0,99 | 0,67-1,49 | 0,99 | 1,67 | 0,80-3,46 | 0,17 |
| IECA durante el ingreso | 0,82 | 0,45-1,50 | 0,53 | 0,82 | 0,44-1,52 | 0,53 | 0,71 | 0,17-3,00 | 0,64 |
| ARA2 durante el ingreso | 1,33 | 0,83-2,14 | 0,24 | 1,15 | 0,70-1,88 | 0,58 | 2,45 | 1,09-5,47 | 0,029* |
| Análisis multivariadoa | |||||||||
| IECA o ARA2 previo | 0,52 | 0,32-0,85 | 0,009* | 0,60 | 0,36-1,01 | 0,052 | 1,49 | 0,60-3,67 | 0,39 |
| IECA previo | 0,88 | 0,54-1,45 | 0,62 | 0,87 | 0,52-1,46 | 0,59 | 1,15 | 0,33-3,99 | 0,82 |
| ARA2 previo | 0,62 | 0,39-0,99 | 0,043* | 0,72 | 0,44-1,17 | 0,18 | 1,40 | 0,57-3,47 | 0,47 |
| IECA o ARA2 durante el ingreso | 0,83 | 0,49-1,38 | 0,47 | 0,69 | 0,40-1,20 | 0,19 | 1,55 | 0,55-4,36 | 0,40 |
| IECA durante el ingreso | 0,60 | 0,28-1,27 | 0,18 | 0,52 | 0,24-1,15 | 0,11 | 0,50 | 0,07-3,72 | 0,50 |
| ARA2 durante el ingreso | 1,11 | 0,58-2,10 | 0,76 | 0,94 | 0,48-1,87 | 0,87 | 2,34 | 0,75-7,31 | 0,14 |
ARA2: antagonistas del receptor de angiotensina2; IC95%: intervalo de confianza al 95%; IECA: inhibidores de la enzima conversora de angiontensina; OR: odds ratio; VMI: ventilación mecánica invasiva.
Análisis ajustado a las variables con p<0,05 en el análisis univariado para cada evento (tabla A.4).
Respecto de la mortalidad intrahospitalaria, el análisis univariado evidenció un mayor riesgo de la misma asociado al uso previo de IECA o ARA2 (OR1,35; IC95%: 1,01-1,80; p=0,047), si bien esta relación desapareció tras el análisis ajustado (tabla 4).
El empleo de IECA o ARA2 durante la hospitalización no mostró impacto en el riesgo de desarrollar la variable principal ni de muerte por cualquier causa, ni en el análisis univariado ni tras realizar el ajuste por las variables predictoras de cada uno de los eventos. No obstante, la prescripción de fármacos ARA2 durante el ingreso se asoció a un mayor riesgo de necesidad de soporte ventilatorio invasivo (OR2,45; IC95%: 1,09-5,47; p=0,029), aunque, finalmente, en el modelo de regresión logística ajustado demostró efecto neutro sobre dicho evento (tabla 4).
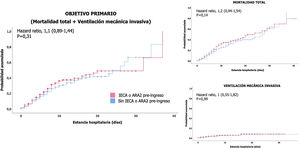
Análisis de supervivenciaEn el análisis de supervivencia, comparando los pacientes que estaban bajo tratamiento ambulatorio con IECA o ARA2 con los pacientes que no lo tenían prescrito, no se observó mayor riesgo de presentar más precozmente ni el evento primario combinado (fig. 2A), ni muerte por cualquier causa (fig. 2B), ni necesidad de ventilación mecánica invasiva (fig. 2C).
DiscusiónEn el presente estudio se ha evaluado la influencia de la prescripción previa al ingreso y durante el mismo de fármacos IECA o ARA2 en el pronóstico intrahospitalario de pacientes con infección respiratoria por SARS-CoV-2, habiéndose demostrado un efecto neutro en el riesgo de mortalidad por cualquier causa o de necesidad de ventilación mecánica invasiva. Asimismo, el empleo de estos fármacos antes del ingreso por infección respiratoria por SARS-CoV-2 se asoció a un menor riesgo de desarrollo del evento primario combinado en el análisis ajustado, resultado que apoyaría las recomendaciones realizadas por diferentes sociedades científicas de mantener el tratamiento con estos medicamentos21-22.
No se observaron diferencias en el análisis de supervivencia, si bien este resultado pudo verse influenciado por el corto periodo de seguimiento (solo el 38% presentaron estancia hospitalaria superior a 8días), pudiendo justificarse este hecho por altas hospitalarias precoces debido a la saturación del sistema sanitario.
Los resultados observados podrían explicarse a partir de las hipótesis fisiopatológicas sobre la infección por SARS-CoV-2. El mayor porcentaje de pacientes fallecidos en el grupo de prescripción previa de IECA o ARA2 concuerda con la hipótesis de que los IECA y ARA2 promueven la expresión de la ECA2 a nivel del epitelio respiratorio, pudiendo aumentar la susceptibilidad de infección entre los pacientes con uso de dichos medicamentos4-6,8-11. Asimismo, en el presente estudio se observó una mayor prevalencia de factores de riesgo cardiovascular y de enfermedad cardiovascular entre los pacientes que desarrollan el evento primario, al igual que estudios observacionales previos en los que una peor evolución de infección COVID-19 se asoció a estas condiciones, en las que los IECA y ARA2 son fármacos ampliamente utilizados2,12-14. Sin embargo, en nuestro estudio el empleo previo de IECA o ARA2 no mostró un impacto negativo en el riesgo de muerte por cualquier causa o de necesidad de ventilación mecánica invasiva, e incluso se asoció a un menor riesgo de desarrollo del evento combinado. Este hecho podría ser explicado por la idea cada vez más aceptada de la función dual que desempeña la ECA2 en la infección COVID-19: aunque su sobreexpresión podría incrementar el riesgo de infección, la reducción de la expresión de la ECA2 asociada al envejecimiento y a comorbilidades cardiovasculares, y potenciada con la infección por SARS-CoV-217,25, dejaría a la angiotensina2 sin oposición, ejerciendo efectos proinflamatorios en diversos tejidos. La enzima ECA2 actúa inhibiendo la angiotensina2 y aumentando la producción de angiotensina1-7, un péptido con efectos antiinflamatorios y vasodilatadores4,6, habiéndose demostrado en estudios previos que los pacientes que sobreviven a distrés respiratorio agudo presentan niveles superiores de dicho péptido en comparación con los fallecidos26. Esta hipótesis concuerda con los resultados del presente trabajo, pues no solo se evidenció un menor riesgo del evento primario combinado con el uso indistinto previo de IECA o ARA2, sino también entre los que solo tenían prescrito un fármaco ARA2.
El elevado interés en el efecto de la inhibición del eje renina-angiotensina en pacientes con infección COVID-19 ha promovido la publicación de diversos estudios observacionales, la mayoría evaluando el riesgo asociado al consumo de IECA o ARA2 de padecer infección COVID o ingresar por la misma. Dos de los trabajos más relevantes son los publicados recientemente por Abajo et al.27 y por Mancia et al.28. Ambos son estudios de casos y controles (realizados en una cohorte española e italiana, respectivamente) en los que el empleo de IECA o ARA2 previo al ingreso no supuso un incremento del riesgo de hospitalización por COVID-1927-28. Esto concuerda con los resultados obtenidos en el presente estudio. No obstante, en nuestro estudio destaca un mayor porcentaje de pacientes fallecidos entre los que tomaban previamente IECA o ARA2 en comparación con el resto, diferencias no objetivadas en los mencionados estudios de Abajo et al.27 y Mancia et al.28. En este sentido, cabe destacar que aproximadamente la mitad de los casos COVID-19 de la cohorte italiana considerados como «leves-moderados» (los que no requirieron ingreso en unidades de cuidados intensivos ni fallecieron) no requirieron ingreso hospitalario28, mientras que el presente estudio analiza el posible efecto de IECA o ARA2 en el pronóstico únicamente de los pacientes hospitalizados. Otra posible justificación es la diferencia entre las características de las cohortes de estudio. A pesar de la similitud entre las edades medias de las poblaciones a estudio, la edad media del grupo que fallece en nuestro trabajo es mayor que la de los pacientes con peor evolución de ambos estudios (78,7 [12,3] vs 75,3 [12,3] vs 75,0 [10,0] años). Por otro lado, la población del actual estudio con infección COVID presentaba una mayor prevalencia de diversos trastornos comórbidos, destacando las diferencias en tasas de enfermedad renal crónica (11,8% vs 7,8% vs 2,9%) y de insuficiencia cardíaca (8,2% vs 7% vs 5,1%). Asimismo, en comparación con el estudio de Mancia et al.28, la cohorte del presente trabajo presentó mayor frecuencia de enfermedad pulmonar obstructiva crónica (7,4% vs 3%) o asma (4,2% vs 0,3%)28.
Las publicaciones acerca del efecto de IECA o ARA2 en la evolución intrahospitalaria de los pacientes con infección COVID-19 son más escasas. En este sentido, uno de los trabajos más destacados es el de Gao et al.29, en el que el empleo durante la hospitalización de IECA o ARA2 en pacientes hipertensos se asoció con un menor riesgo de mortalidad global en comparación con los pacientes que no fueron tratados con estos inhibidores del eje renina-angiotensina. En nuestro estudio, el efecto de estos fármacos sobre la mortalidad total fue neutro. No obstante, destacan las diferencias en cuanto a cifras de fallecidos entre ambos estudios. Concretamente, la tasa de mortalidad en el grupo tratado con IECA o ARA2 de la cohorte china fue del 3,7%, dato que contrasta con la mortalidad del 26,9% observada en los pacientes de nuestro estudio que recibieron IECA o ARA2 durante la hospitalización. Estas diferencias pueden justificarse por varios motivos. En primer lugar, la diferencia en los tamaños muestrales de ambas cohortes: mientras que nuestro estudio incluye 400 pacientes con toma previa de IECA o ARA2, la cohorte del estudio de Gao et al.29 solo registró 188 pacientes con administración de estos fármacos. Además, esta disparidad en las cifras de mortalidad podría explicarse atendiendo a las diferencias en las características clínicas basales de ambas cohortes: mayor edad en nuestra cohorte de pacientes con toma de IECA o ARA2 (datos expresados en mediana y rango intercuartílico: 78 [68-85] vs 64 [55-68] años), mayor prevalencia de diabetes mellitus (31,5% vs 23,4%), enfermedad pulmonar obstructiva crónica (8% vs 0,5%) o enfermedad renal crónica (17% vs 3,7%).
En resumen, este trabajo constituye uno de los primeros estudios realizados en una cohorte española en el que se analiza el efecto del uso, tanto domiciliario como durante el ingreso, de IECA o ARA2 sobre la mortalidad hospitalaria y la necesidad de soporte ventilatorio invasivo en pacientes con COVID-19. Los resultados descritos complementan a los de otras publicaciones recientes y apoyan la recomendación de las diferentes sociedades internacionales de no suspender estos fármacos. No obstante, el carácter observacional de todos estos trabajos limita su interpretación, siendo preciso el desarrollo de ensayos clínicos aleatorizados que aporten evidencia al respecto.
LimitacionesEl presente trabajo muestra varias limitaciones. En primer lugar, se revisó la prescripción farmacológica del mes previo al ingreso de los pacientes incluidos, si bien no se pudo garantizar una adecuada adherencia terapéutica. Además, no se evaluaron los efectos según diferentes dosis de los fármacos. Otra limitación fue la no disponibilidad de un grupo control sin infección COVID-19 establecida que permitiese comparar los resultados de nuestra cohorte de casos. Asimismo, la saturación de las unidades de cuidados críticos pudo influir en la selección de pacientes candidatos a medidas de soporte ventilatorio invasivo y, por ende, en la incidencia de los eventos analizados. Por otra parte, el periodo de seguimiento de los pacientes se limitó a su estancia hospitalaria, siendo un intervalo corto de tiempo. Finalmente, por el carácter observacional y unicéntrico del presente estudio no se puede descartar el efecto residual de posibles factores de confusión no conocidos o no estudiados.
ConclusionesLos pacientes con infección respiratoria por SARS-CoV-2 que ingresaron en el HGUCR y con prescripción previa al mismo de IECA o ARA2 presentaron un menor riesgo de desarrollo del evento primario combinado. Asimismo, el empleo previo al ingreso o durante el mismo de estos fármacos mostró un efecto neutro sobre la mortalidad total y sobre la necesidad de ventilación mecánica invasiva.
FinanciaciónNo se ha percibido ningún tipo de financiación para la elaboración del presente trabajo.
Conflicto de interesesLos autores del presente documento declaran la ausencia de cualquier conflicto de interés relacionado con la publicación de este manuscrito.
Queremos dar las gracias a la Dra. Lourdes Porras Leal y al Dr. Francisco Javier González Gasca, responsables de la unidad de Enfermedades Infecciosas de nuestro centro. Además, queremos agradecer la gestión, el esfuerzo y el trabajo por parte de la Dirección Médica, de Enfermería y de la Dirección de la Gerencia de Atención Integral de Ciudad Real. Finalmente, damos las gracias a los compañeros de Medicina Interna, Medicina Intensiva y, en general, a todos los que participaron en la asistencia de pacientes con infección COVID-19.