El sistema renina-angiotensina-aldosterona (SRAA) es un regulador de las funciones cardiovascular y renal. No es de extrañar, por lo tanto, que las alteraciones de este sistema desempeñen un papel fundamental en la fisiopatología de varias enfermedades cardiovasculares y renales1-4. Una de las principales dianas no sólo en el tratamiento de la hipertensión arterial, sino también con la finalidad de retrasar la progresión de la insuficiencia renal, es el bloqueo de dicho sistema5. El SRAA es una cascada hormonal que se inicia a través de la síntesis de renina en el aparato yuxtaglomerular. Está presente en muchos órganos y tejidos6,7. La angiotensina I es un decapéptido inactivo al que la enzima conversiva de la angiotensina (ECA) convierte en angiotensina II, péptido biológicamente activo. La angiotensina II ejerce la mayoría de sus funciones, como la vasoconstricción y la reabsorción de sodio en el túbulo renal, a través del receptor de la angiotensina II tipo 18. En contraste, al receptor de la angiotensina II tipo 2 se le atribuyen los efectos opuestos, entre ellos, vasodilatadores y antiproliferativos8.
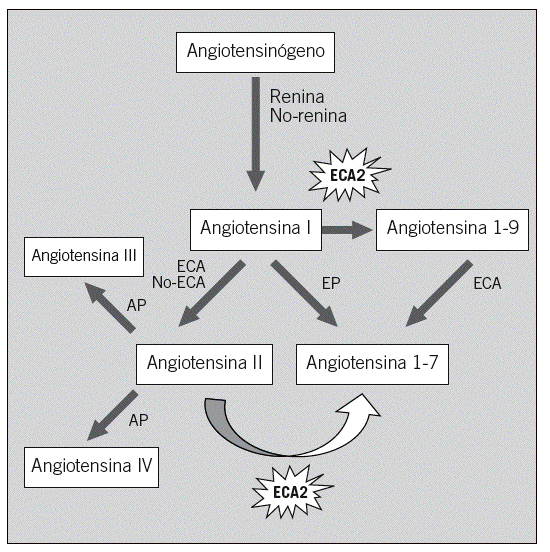
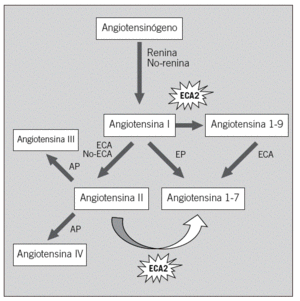
Hasta la fecha, la mayor parte de la investigación, tanto básica como clínica, se ha centrado en los mecanismos que controlan la formación de la angiotensina II9-12, es decir, los sustratos proximales, el angiotensinógeno, la ECA y otros mecanismos de formación independientes de la ECA. Recientemente, el descubrimiento de un mecanismo de degradación de la angiotensina II con una homóloga de la ECA, conocida como ECA2, ofrece la oportunidad de estudiar otro aspecto de la regulación del SRAA. La angiotensina II puede degradarse por lo menos en 3 metabolitos: a) desaspartil-angiotensina II (angiotensina III), con funciones similares a la angiotensina II pero menos eficaz por su acelerado metabolismo in vivo; b) angiotensina IV, que puede causar vasodilatación y natriuresis, y c) angiotensina 1-7, que puede formarse directamente desde la angiotensina II por la acción de la ECA2 (fig. 1). La angiotensina 1-7 tiene funciones opuestas a la angiotensina II, de tipo vasodilatador y antiproliferativo13,14. La ECA2 también degrada la angiotensina I a angiotensina 1-9, un péptido inactivo.
Fig. 1. Vías de formación de los péptidos biológicamente activos de la angiotensina II. Papel de la enzima conversiva de la angiotensina 2 (ECA2). AP: aminopeptidasa; EP: endopeptidasa.
En este artículo se revisan trabajos recientes que han permitido conocer la localización de la ECA2 en distintos órganos y se discute el posible papel que puede ejercer como mecanismo de protección renal, cardíaco y pulmonar.
La enzima conversiva de la angiotensina 2
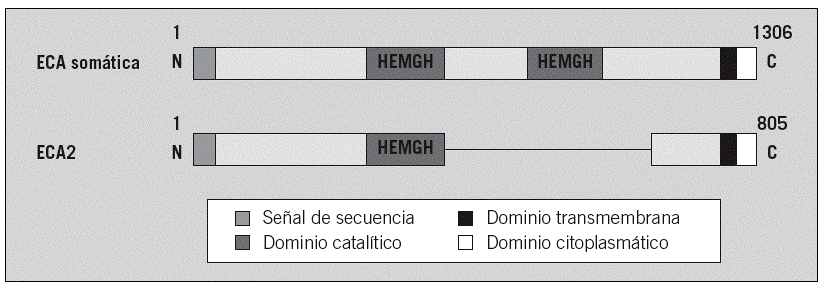
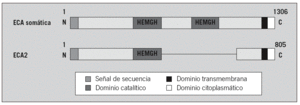
La ECA2 es una enzima homóloga de la ECA y la única con actividad enzimática que se conoce15,16. Está formada por 2 dominios: el catalítico aminoterminal y el carboxiterminal (fig. 2). Comparte un 42% de identidades con el dominio catalítico aminoterminal de la ECA15-17. El gen de la ECA2 se localiza en el cromosoma X (Xp22) y codifica 805 aminoácidos (fig. 2)18. Del mismo modo, el dominio carboxiterminal presenta un 48% de homología con la collectrin, una glucoproteína enzimáticamente inactiva que se presenta de forma exclusiva en el riñón y cuya función se desconoce18-20.
Fig. 2. Estructuras del dominio de la enzima conversiva de la angiotensina (ECA) somática y de la ECA2. Cada una de ellas es una proteína integral tipo 1 con un péptido de señal, representado en color blanco, y un dominio transmembranario, en color negro. La proteína de unión del cinc (HEMGH) se repite 2 veces en la ECA y sólo aparece una vez en la ECA2, y se localiza en la región homóloga indicada en color gris oscuro. Los números representan los aminoácidos de cada proteína. (Modificada de Oudit GY et al.69)
Mientras que la ECA cataliza la angiotensina I a angiotensina II, la ECA2 facilita la conversión de la angiotensina II en angiotensina 1-7 y de la angiotensina I en angiotensina 1-9, entre otros21,22. Inicialmente se describió la presencia de la ECA2 en el riñón, el corazón y los testículos15,16. También se encuentra en el hígado, el sistema nervioso central y la placenta, entre otros órganos21,23,24. Los valores altos de la ECA2 en el riñón y el corazón inducen a pensar que tiene un papel importante en la regulación cardiovascular y renal16,17,25,26.
La ECA2, una glucoproteína transmembranaria tipo I, es la primera carboxipeptidasa de mamífero identificada que contiene un cinc HEXXH (His-Glu-Xaa-Xaa-His) en el sitio de unión, y en términos estructurales pertenece a la familia de los péptidos, que incluye las metalocarboxipeptidasas27. Sin embargo, la secuencia primaria de la ECA2 guarda un mayor parecido con la de la ECA que con las metalocarboxipeptidasas (PfuCP). Investigaciones recientes indican que la ECA2 estructuralmente forma parte del mismo grupo que no sólo incluye su homologia, la ECA, sino también con la neurolisina y las PfuCP27.
La enzima conversiva de la angiotensina 2 en el corazón y la vasculatura
En un trabajo fundamental, Crackover et al15 describieron que en ratones de 6 meses de edad con deleción del gen de la ECA2 (ECA2-/y) hay una reducción de la contractibilidad cardíaca y de la presión tanto ventricular como aórtica. Es interesante remarcar que la deleción del gen de la ECA en el ratón mutante ECA2-/y eliminó completamente la disfunción cardíaca presente en el modelo con una única deleción en el gen de la ECA. En otro modelo de deleción del gen de la ECA2, los ratones presentaron morfología y función cardíacas normales28. Sin embargo, tras sobrecarga de presión mantenida mediante constricción aórtica transversa, los ratones desarrollaron hipertrofia y dilatación cardíacas, con disminución de la contractibilidad cardíaca, que se previno con la administración de antagonistas del receptor de la angiotensina II tipo 1 (ARA-II)28. A su vez, en los ratones ECA2-/y aumentó la incidencia de muerte súbita cardíaca en comparación con los ratones ECA2+/y. Hay que señalar que recientemente Gurley et al29 han observado que, en ratones con diferentes genotipos, la deleción del gen de la ECA2 no se acompaña de ninguna anormalidad cardíaca aparente.
En ratas Sprague-Dawley el infarto agudo de miocardio, inducido mediante ligadura de la arteria coronaria izquierda, aumenta la expresión génica cardíaca de la ECA y la ECA230. A su vez, en un estudio en humanos la actividad de la ECA2 estaba aumentada en los ventrículos de pacientes con insuficiencia cardíaca, tanto secundaria a miocardiopatía dilatada idiopática como a hipertensión pulmonar idiopática primaria, en comparación con controles sanos31. El tratamiento con ARA-II en el modelo murino de infarto agudo de miocardio inducido tras ligadura de la arteria coronaria aumentó 3 veces la expresión génica de la ECA2 en el miocardio viable, en comparación con el grupo con infarto agudo de miocardio tratado con vehículo32. En otro estudio, en un modelo experimental murino (ratas Lewis) el tratamiento con inhibidores de la ECA aumentó la expresión génica de la ECA2 en el corazón33. El tratamiento con los antagonistas del receptor de la aldosterona aumentó la actividad cardíaca de la ECA234. A su vez, los macrófagos procedentes del suero de los pacientes con insuficiencia cardíaca congestiva presentaron un aumento de la actividad de la ECA2 tras tratamiento con espironolactona34. Nuestro laboratorio encontró que la expresión de la ECA2 en la vasculatura renal aumenta después del tratamiento con un ARA-II tipo 1 (telmisartán)35.
Sorprendentemente, el primer modelo transgénico de la ECA2 descrito no ofreció ninguna evidencia beneficiosa en el corazón36. Al contrario de lo que se esperaba, el modelo murino con sobreexpresión de la ECA2 presentó una alta incidencia de muerte súbita, relacionada con la expresión del gen36. Los ratones transgénicos jóvenes del modelo de la ECA2 desarrollaron defectos importantes de la conducción y problemas del ritmo con bloqueo auriculoventricular completo36. Se atribuyeron dichos problemas al tipo de transgénico, ya que posteriormente, en un segundo modelo en que se usó un vector lentivírico con sobreexpresión del gen murino de la ECA2 en el corazón de las ratas Sprague-Dawley, se observó protección frente a la fibrosis y la hipertrofia secundaria a la infusión de angiotensina II37.
Enzima conversiva de la angiotensina 2 y presión arterial
En el riñón, un órgano fundamental en la regulación de la presión arterial38, Crackover et al15 estudiaron la expresión de los valores de la ECA2 en diferentes modelos murinos de hipertensión arterial. La expresión proteica y del ácido ribonucleico mensajero (ARNm) de la ECA2 en ratas SABRA sensibles a la sal e hipertensas (SBH/y) está disminuida en comparación con sus controles, ratas SABRA resistentes a la sal y normotensas (SBN/y)15. La disminución de la expresión de la ECA2 en las ratas SBH/y se observó tanto si se administraba una dieta normal como una dieta rica en sal15. Del mismo modo, en los modelos de rata espontáneamente hipertensa (SHR) y rata espontáneamente hipertensa con predisposición al accidente cerebrovascular (SHRSP), la expresión proteica y del ARNm de la ECA2 está disminuida en comparación con los respectivos controles, las ratas Wistar Kyoto15,39. Sin embargo, no se observó ninguna diferencia en la expresión tanto proteica como del ARNm en el modelo experimental murino de hipertensión secundaria al retraso intrauterino mediante la restricción de nutrientes durante la gestación (ratas FR30)40.
Se estudió la expresión de la ECA2 en el corazón de ratas transgénicas con el gen murino de la renina [mRen2]2741. Así, en las ratas [mRen2]27, un modelo que presenta una intensa hipertensión e hipertrofia cardíaca, la actividad enzimática y la expresión proteica de la ECA2 están aumentadas en comparación con las controles41. En contraste con dichos resultados, en el modelo SHR la expresión proteica y del ARNm de la ECA2 en el corazón está disminuida en comparación con los respectivos controles, las ratas Wistar Kyoto39.
La presión arterial sistólica en ratones deficientes en el gen de la ECA2 fue ligeramente mayor que en los controles en el genotipo C57BL/6, pero no en todos los genotipos estudiados29. La infusión de angiotensina II en ratones con deleción del gen de la ECA2 produjo un aumento de la presión arterial sistólica que fue 2 veces mayor al aumento que se observó en los controles29. La deleción del gen de la ECA2 potencia los efectos de la remodelación cardíaca de la angiotensina II15,28,29.
Wakahara et al42 han estudiado la expresión génica y los valores de ARNm de la ECA y la ECA2 en la corteza renal de pacientes hipertensos en comparación con controles sanos. El cociente ECA/ECA2 estaba aumentado en la corteza renal de pacientes hipertensos en comparación con los controles sanos no hipertensos42. En cambio, en los monocitos procedentes de pacientes prehipertensos la actividad enzimática de la ECA2 se encontró aumentada en comparación con los pacientes controles no hipertensos43. Sin embargo, no se observó ningún cambio en cuanto a la actividad enzimática de la ECA2 en los monocitos procedentes de pacientes hipertensos en comparación con los controles normotensos43. Esto podría hacer pensar en un papel protector de la ECA2 en los pacientes prehipertensos. Los datos en este campo son claramente escasos y la información disponible hasta ahora en humanos es insuficiente para llegar a ninguna conclusión. En estudios preliminares se ha visto que la administración de una forma recombinante de ECA2 humana es capaz de disminuir la presión arterial en ratones infundidos con angiotensina II. Ésta sería una prueba más concluyente del papel de esta enzima en la hipertensión arterial44.
La enzima conversiva de la angiotensina 2 en el pulmón
La importancia del SRAA en el pulmón se conoció tras la identificación de la ECA2 como receptor del Coronavirus en el síndrome respiratorio agudo grave45,46. La ECA2 se expresa tanto en pulmones sanos como en los patológicos47,48. En pulmones sanos, está presente en las células epiteliales alveolares (tipos 1 y 2) y en los capilares endoteliales47,48.
La ECA2 es capaz de proteger los pulmones murinos frente a una lesión aguda grave producida experimentalmente45,49. Este hallazgo, de gran potencial clínico, se realizó en el síndrome de distrés respiratorio secundario a broncoaspiración ácida, endotoxinas y sepsis peritoneal49. Usando estos modelos experimentales, los ratones ECA2-/y presentaron enfermedad grave en comparación con los ratones ECA2+/y. La pérdida de la expresión de la ECA2 en ratones mutantes llevó a un aumento de la permeabilidad vascular y del edema pulmonar, a la acumulación de neutrófilos y al empeoramiento de la función pulmonar. El tratamiento con la proteína recombinante de la ECA2 mejoró los síntomas de la lesión pulmonar aguda49 tanto en el ratón ECA2+/y como en el ECA2-/y. Sobre la base de estos estudios, parece que la ECA2 desempeña un papel protector en la lesión pulmonar aguda. El tratamiento con ARA-II o la deleción adicional en el gen de la ECA rescató el fenotipo pulmonar grave en la lesión pulmonar aguda49 en el ratón ECA2-/y.
Los ratones con deleción del gen de la ECA2 sometidos a sobrecarga de volumen mediante constricción aórtica transversal presentan congestión pulmonar y un aumento de la relación del peso pulmón/peso corporal (mg/g), en comparación con los ratones normales28. Dicho aumento es reversible con el tratamiento con ARA-II28.
En el modelo experimental en ratas Sprague Dawley, en ambos sexos, se demostró una disminución de la expresión de la ECA2 en el pulmón asociada con el envejecimiento48. Sin embargo, en dicho proceso de envejecimiento la disminución de la ECA2 fue mucho más espectacular en los machos que en las hembras. Del mismo modo, la expresión de la ECA2 en el pulmón a los 24 meses fue mayor en las ratas hembras que en los machos48.
La enzima conversiva de la angiotensina 2 en el riñón
En un principio se pensó que la ECA2 estaba restringida al riñón, el corazón y los testículos15,16. Luego se vio que su expresión es más generalizada23,40,45. Es interesante señalar que la actividad enzimática de la ECA2 es mucho mayor en el tejido procedente de la corteza renal que en el tejido cardíaco25. Dichos resultados apuntan a que la ECA2 es una enzima importante en el riñón debido a su abundante presencia en dicho órgano. A su vez, la ECA2 puede desempeñar un papel importante en las diferentes funciones que dependen del riñón, como la regulación de la presión arterial.
En 2004, nuestro laboratorio describió la expresión de la ECA2 en los túbulos renales corticales del modelo experimental murino de diabetes db/db y sus respectivos controles db/m26. La expresión proteica de la ECA2 en la corteza renal de los ratones diabéticos db/db, a las 8 semanas de edad, está aumentada en comparación con los ratones controles no diabéticos db/m26. Por el contrario, la expresión proteica de la ECA está muy disminuida en el túbulo proximal renal en comparación con controles no diabéticos25,26. En el mismo sentido, la expresión génica de la ECA en la corteza renal de los ratones diabéticos db/db está disminuida en comparación con los controles db/m26. Sin embargo, no se observaron diferencias significativas en cuanto a la expresión génica de la ECA2 en la corteza renal de los ratones diabéticos db/db en comparación con los controles26. El hallazgo de la disminución de la expresión de la ECA, junto con un aumento de la ECA2, nos hizo postular que esta combinación puede aportar un mecanismo renoprotector en fases precoces de la nefropatía diabética, limitando la acumulación renal de angiotensina II al favorecer la degradación de ésta26. Hay que tener en cuenta que la degradación de la angiotensina II por la ECA2 lleva a la formación de angiotensina 1-7, péptido activo que puede tener acciones favorables para el riñón13,50.
Nuestro laboratorio también describió la localización de ambas enzimas, ECA y ECA2, en el borde en cepillo del túbulo renal proximal51. En riñones procedentes de ratón, en el túbulo proximal tanto la tinción de la ECA2 como de la ECA se marcó en el borde en cepillo. La tinción para la ECA2 también se observó más débilmente en el citoplasma51. Las células epiteliales distales y del túbulo colector mostraron asimismo expresión de la ECA2.
La ECA y la ECA2, así pues, se localizan ambas en el túbulo renal proximal, pero en el glomérulo no tienen la misma localización51. Lo más destacado de estos hallazgos es que en el glomérulo la ECA2 se localizó de forma abundante en las células epiteliales del glomérulo, es decir, en el podocito, y en menor cantidad en las células mesangiales51. En las células endoteliales del glomérulo no se detectó la presencia de la ECA2. Sin embargo, se encontró abundante presencia de la ECA en las células endoteliales del glomérulo51. Así, mientras que la ECA2 es una enzima que en el glomérulo se encuentra localizada en el podocito y en las células mesangiales, la ECA se halla en las células endoteliales51.
Otros estudios han descrito la ubicación de la ECA2 en el riñón. En riñones humanos, la ECA2 se localizó en los túbulos proximal, distal y colector, el glomérulo y la vasculatura renal52. Lely et al52 describieron la localización de la ECA2 en las arterias interlobulares del endotelio y en las células de la musculatura lisa. Además, observaron la presencia de la ECA2 en el endotelio de arteriolas y pequeños vasos, pero no en los capilares peritubulares, en tejidos procedentes de humano52. A su vez, se observó la presencia de la ECA2 de forma lineal en el urotelio, la pelvis renal y los uréteres en tejido renal humano52.
Por lo que se refiere al estudio de la actividad enzimática de la ECA, hay varios ensayos bastante fiables basados en diferentes métodos: la espectrofotometría51, la fluorometría53, la cromatografía líquida de alta resolución54 y la radiometría55. Sin embargo, son menos los ensayos sobre la actividad enzimática de la ECA230,33,36,56, dado el reciente descubrimiento de dicha enzima. Wysocki et al25 han desarrollado un ensayo para medir la actividad de la ECA2 usando como sustrato el 7-Mca-YVADAPK(Dnp). La rotura de dicho sustrato tanto por la ECA como por la ECA2 permitió medir al mismo tiempo la actividad de dichas enzimas. La señal de fluorescencia fue parcialmente desactivada por inhibidores específicos de ambas enzimas (ECA y ECA2), pero no de otras metaloproteasas como la carboxipeptidasa A25.
En 2 modelos de nefropatía diabética experimental (ratón db/db y diabetes inducida mediante estreptozotocina), tanto la expresión proteica como la actividad enzimática de la ECA2 están aumentadas en la corteza renal, en comparación con los respectivos controles25. En cambio, en la corteza renal la expresión proteica, la actividad enzimática y la expresión génica de la ECA en ambos modelos están disminuidas en comparación con los respectivos controles25.
Estudios inmunohistoquímicos han demostrado la disminución de la expresión gomerular de la ECA2 en los ratones diabéticos db/db, en comparación con los controles no diabéticos (db/m)51. Por el contrario, la expresión de la ECA en el glomérulo de los ratones diabéticos db/db está aumentada en comparación con los respectivos controles no diabéticos db/m51. Estos resultados apuntan a que la expresión aumentada de la ECA en el glomérulo se relaciona con un aumento de la expresión de la ECA en las células endoteliales del glomérulo51. Con el mismo razonamiento, la disminución gomerular de la expresión proteica de la ECA2 refleja una disminución de la expresión de dicha enzima en los podocitos y posiblemente también en las células mesangiales. Esta distribución en sí misma indica que la ECA2 es una enzima que puede tener un papel crucial en la nefropatía diabética. En particular, la presencia de la ECA2 en los podocitos puede desempeñar un papel en la regulación del SRAA intraglomerular favoreciendo la degradación de angiotensina II localmente y evitando así la acumulación excesiva, con el consiguiente aumento de la permeabilidad glomerular. En este sentido, en la nefropatía diabética la disminución de la expresión de la ECA2 intraglomerular puede ser perjudicial, ya que puede llevar a la acumulación de angiotensina II.
En la nefropatía diabética se observa una dicotomía entre la expresión de la ECA/ECA2 en la corteza renal y en el glomérulo. Anderson et al57 ya describieron resultados en esta dirección por lo que se refiere a la expresión de la ECA en ratas con diabetes inducida mediante estreptozotocina. Estos autores encontraron una disminución de la actividad enzimática de la ECA en la corteza renal, lo que coincide con nuestros estudios en ratones diabéticos57.
Estudios de inhibición de la enzima conversiva de la angiotensina 2 e implicaciones en la nefropatía diabética
Se han descrito diversos inhibidores de la ECA2. Entre los inhibidores selectivos de primera clase figura una serie de componentes no peptídicos cuya concepción se basó en la especificidad del sustrato de la ECA2 y en la necesidad de un carboxilato localizado centralmente para coordinar el inhibidor, como en el caso del MLN-476058. Usando otra estrategia, mediante el cribado de diferentes peptidotecas restringidas, se ha identificado otro tipo de inhibidores peptídicos estables como el DX60059.
En 2 modelos experimentales de nefropatía diabética, el ratón db/db y la nefropatía diabética tras tratamiento con estreptozotocina, nuestro laboratorio utilizó el inhibidor de la ECA2, MLN-4760, para estudiar el efecto de la inhibición de dicha enzima en la función renal. La administración del inhibidor de la ECA2 durante semanas produjo un incremento significativo de la expresión urinaria de albúmina51,60. Además, dicho aumento estuvo directamente relacionado con el receptor de la angiotensina II tipo 1, ya que el bloqueo de éste con el telmisartán previno el aumento de la excreción urinaria de albúmina en comparación con el grupo diabético (db/db) en el que tan sólo se administró el inhibidor de la ECA251. A su vez, en el glomérulo la inhibición de la ECA2 se acompaña de un aumento de las lesiones histológicas que se observan normalmente en la nefropatía diabética60. En el modelo de diabetes db/db, tras la inhibición de la ECA2 se observó un aumento de la expresión de la fibronectina glomerular, reflejo de un aumento de la acumulación de dicha proteína en el mesangio51. Este efecto podría estar mediado por el aumento de los valores de angiotensina II intraglomerular, ya que se sabe que la angiotensina II produce un incremento de la expresión de fibronectina en las células mesangiales del glomérulo61.
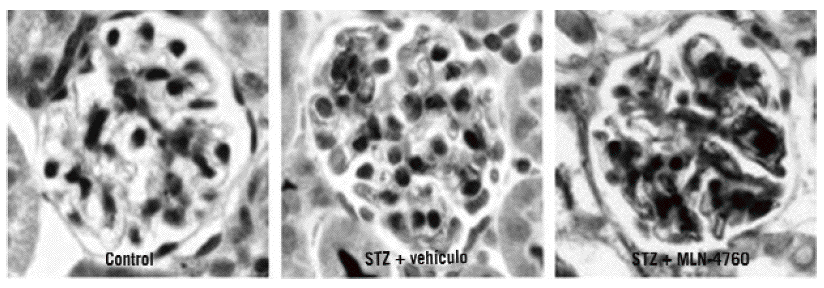
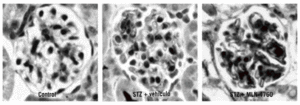
En el modelo experimental de nefropatía diabética inducida mediante estreptozotocina, la inhibición crónica de la ECA2 con un inhibidor específico, el MLN-4760, empeoró las lesiones renales de dicha enfermedad60. Es interesante comentar que, a su vez, la administración de MLN-4760 se asocia a un aumento de la expresión glomerular de la ECA (fig. 3). Así, con la inhibición crónica de la ECA2 se produce una doble activación del SRAA: la disminución de la degradación de la angiotensina II, con el consiguiente aumento de los valores de angiotensina II intraglomerular, y el incremento de la expresión de la ECA, que conduce a un aumento de la formación de angiotensina II a partir de la angiotensina I. Además, la disminución de la degradación de angiotensina II llevará a una disminución de la formación de an giotensina 1-7, un péptido que tiene un efecto antiproliferativo13,14,62.
Fig. 3. Tinción inmunohistoquímica para la enzima conversiva de la angiotensina en el glomérulo, en ratón control (izqda.), en ratón con diabetes inducida por estreptozotocina (STZ) al que administramos vehículo (centro) y en ratón con diabetes inducida por STZ al que se administró MLN-4760 (dcha.) en el glomérulo.
Wong et al63 describieron que, en ratones diabéticos heterocigotos Akita (Ins2WT/C96Y) de 3 meses de edad, la deleción del gen de la ECA2 (ECA2-/y) se acompaña del aumento de la excreción urinaria de albúmina y de la hipertrofia glomerulae;n de fibronectina y actina alfa de músculo liso, y del aumento del grosor de la membrana basal glomerular, en comparación con los ratones diabéticos ACE2+4y Ins2WT/C96Y. El tratamiento con ARA-II produce una disminución de la excreción urinaria de albúmina en los ratones ACE2+4Ins2WT/C96Y, lo que indicaría que la angiotensina II es el péptido responsable del empeoramiento de las lesiones de la nefropatía diabética en dicho modelo experimental63.
En la nefropatía diabética, se cree que tras la inhibición de la ECA2 habrá un incremento de la acumulación de angiotensina II, y se supone que la angiotensina 1-7 debería de estar disminuida. Hay estudios que indican que la angiotensina 1-7, péptido activo, puede atenuar la hipertrofia secundaria a acumulación de angiotensina II64,65. En contraste con dichos resultados, tras la administración del inhibidor de la ECA2 a ratones con diabetes inducida por estreptozotocina se observó atrofia de la médula y la papila renales. Hay que señalar que dichas lesiones habían sido descritas con anterioridad por Esther et al66 en ratones con deleción en el gen de la ECA.
Paralelamente, tras la inhibición de la ECA2 en la nefropatía diabética experimental hemos observado un aumento de la expresión gomerular de la ECA60. Esto indica que una parte de los efectos debidos a la inhibición de la ECA2 pueden estar relacionados con el aumento de la ECA60. En este sentido hay que tener en cuenta que un discreto aumento de la expresión génica de la ECA en ratones con diabetes inducida por estreptozotocina, con 3 copias para el gen de la ECA, produce una elevación de la albuminuria, probablemente secundaria a la hiperactividad del SRAA67. Esto invita a pensar que en la nefropatía diabética los valores elevados de la ECA contribuyen de forma importante al daño glomerular. En resumen, la combinación de valores elevados de la ECA con valores disminuidos de la ECA2, es decir, el aumento del cociente ECA/ECA2, sólo puede conducir a un incremento de la formación de angiotensina II, con una disminución de la degradación de ésta26. Del mismo modo, la disminución de la ECA2 conducirá a una disminución de la formación de angiotensina 1-7, péptido con acciones vasodilatadoras y antiproliferativas13,14. La importancia relativa de cada uno de estos péptidos ha de investigarse con el uso de bloqueadores y agonistas específicos, así como con modelos de ablación genética. En el riñón y en el pulmón creemos que los datos hasta ahora publicados indican que los efectos beneficiosos de la ECA2 deberían ser en gran parte el resultado de una disminución de los valores locales de angiotensina II. Es posible, sin embargo, que en el corazón la ECA2 ejerza efectos beneficiosos debido a un aumento de los valores de angiotensina 1-7, un péptido que posee efectos antifibróticos en este órgano62,65. En cualquier caso, es muy posible que la ECA2 pueda ser una diana terapéutica para las enfermedades pulmonares, renales y cardiovasculares51,68.
Conclusiones
La expresión de la ECA2 en el organismo mamífero es generalizada. En el riñón, se localiza principalmente en el túbulo renal proximal, en el glomérulo y en las arteriolas renales. En el túbulo renal proximal, la ECA y la ECA2 se localizan ambas en el borde en cepillo. Sin embargo, en el glomérulo la ECA y la ECA2 no tienen la misma localización: mientras que la ECA se encuentra en las células endoteliales, la ECA2 se localiza principalmente en las células epiteliales y, en menor cuantía, en las células mesangiales.
Para el estudio de la actividad enzimática de la ECA y la ECA2 se ha desarrollado un ensayo fluorométrico que permite medir al mismo tiempo la actividad de ambas. La actividad enzimática de la ECA2 en el tejido procedente de la corteza renal es mucho mayor que en el tejido cardíaco.
En la nefropatía diabética experimental, se observa que la ECA se sobreexpresa en el glomérulo, mientras que la expresión de la ECA2 está disminuida. En cambio, en la corteza renal existe un aumento de la expresión de la ECA2, con una disminución en la expresión de la ECA.
Tanto la inhibición como la deleción del gen de la ECA2 se han asociado a un efecto perjudicial en el riñón, con aumento de la albuminuria y empeoramiento de las lesiones histológicas renales. A su vez, la inhibición de la ECA2 se acompaña de la sobreexpresión glomerular de la ECA. En el riñón, la combinación de elevadas concentraciones glomerulares de la ECA con valores disminuidos de la ECA2 conducirá a un aumento de la formación de angiotensina II intraglomerular, con una disminución de la degradación de ésta, y a la aparición de sus consiguientes efectos nocivos.