Los informes de datos acumulados de antibiograma son útiles para la selección del tratamiento empírico, como herramienta educativa en los programas de utilización de antimicrobianos y para la definición de puntos de corte de categorías clínicas. Estos informes deben basarse en los datos, verificados por el microbiólogo clínico, de aislamientos obtenidos de muestras diagnósticas (y no las de programas de vigilancia). Para intentar evitar los sesgos derivados de incluir varios aislamientos del mismo paciente, se aconseja considerar, para un marco temporal definido, solamente el primero de ellos. El informe debe incluir un número mínimo de aislados por especie, aceptándose estadísticamente adecuada una cifra≥30. El informe suele presentarse en forma de tablas, en las que en cada celda se presenta la información de microorganismos-antimicrobianos de relevancia clínica. Dependiendo de las necesidades se prepararán múltiples tablas que consideren tipos de pacientes, muestras, servicios o patógenos especiales.
Cumulative reports on antimicrobial susceptibility tests data are important for selecting empirical treatments, as an educational tool in programs on antimicrobial use, and for establishing breakpoints defining clinical categories. These reports should be based on data validated by clinical microbiologists using diagnostic samples (not surveillance samples). In order to avoid a bias derived from including several isolates obtained from the same patient, it is recommended that, for a defined period, only the first isolate is counted. A minimal number of isolates per species should be presented: a figure of >=30 isolates is statistically acceptable. The report is usually presented in a table format where, for each cell, information on clinically relevant microorganisms-antimicrobial agents is presented. Depending on particular needs, multiple tables showing data related to patients, samples, services or special pathogens can be prepared.
Una de las actividades fundamentales en los servicios y unidades de microbiología clínica es la realización de estudios de sensibilidad (antibiograma), encaminados, en primer lugar, a guiar las opciones terapéuticas en los pacientes infectados1,2. Además, el análisis conjunto de los datos procedentes de múltiples microorganismos (y pacientes) durante un determinado periodo es de gran valor epidemiológico y clínico, pues permite conocer variaciones en las tendencias de sensibilidad a los antimicrobianos, y resulta de gran ayuda en la selección de los tratamientos empíricos2,3. Por estas razones, la preparación de informes acumulados de sensibilidad a los antimicrobianos también debe ser una actividad que debe realizar el microbiólogo clínico.
En España, y en muchos otros países de nuestro entorno geográfico y científico, la determinación de la sensibilidad a los antimicrobianos se suele llevar a cabo empleando sistemas automáticos, que incorporan programas informáticos capaces de planificar la preparación de informes acumulados de sensibilidad. Estos sistemas prácticamente siempre necesitan complementarse con otras técnicas, como la difusión con disco, la difusión en gradiente y más raramente métodos de referencia de dilución en caldo o en agar (que también se usan de forma primaria en algunos centros), cuyos resultados pueden evaluarse con el apoyo del sistema de información del laboratorio empleado en cada centro, al que también se pueden volcar los datos obtenidos en los sistemas automáticos.
Se dispone, igualmente, de diferentes programas de libre acceso, como el de WHONET (http://www.who.int/drugresistance/whonetsoftware/en), que permiten interaccionar con sistemas automáticos empleando vínculos de enlace externos (backlink). SaTScan (http://www.satscan.org) es otro programa de libre acceso gracias al cual se pueden analizar estadísticamente datos espaciales y temporales con los que definir grupos de microorganismos que pueden estar implicados en una epidemia.
Los informes acumulados de sensibilidad pueden cubrir datos obtenidos a nivel local4,5, pero dado el interés creciente de las autoridades y responsables de salud pública por obtener información sobre resistencia a los antimicrobianos, existen diversas experiencias de integración de la información procedente de múltiples servicios/unidades en una base de datos común que permite la explotación de esos datos a nivel regional, nacional o supranacional6–8.
En España la experiencia regional más avanzada es la de la Red de Vigilancia Microbiológica de la Comunidad Valenciana9, con cuya información se han elaborado diferentes publicaciones, entre otras, la que recoge datos relacionados con la sensibilidad de Escherichia coli analizados en función de diversos parámetros (género, edad, tipo de muestra clínica, etc.)10.
Por otra parte, diversas sociedades científicas y grupos de investigación (incluyendo la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica —www.seimc.org— y sus grupos de estudio, así como la Red Española de Investigación en Patología Infecciosa —www.reipi.org—) también están promoviendo el desarrollo de estudios multicéntricos nacionales sobre tendencias de sensibilidad y análisis de mecanismos de resistencia (en ocasiones con detallados análisis moleculares de los mismos). Es posible que a corto plazo, y como parte de un plan estratégico nacional para el control de la resistencia a los antimicrobianos, pueda desarrollarse un programa estatal de vigilancia de la resistencia.
Varios países en Europa han desarrollado con financiación pública programas para la vigilancia de la resistencia a los antimicrobianos (y en ocasiones también de consumo de estos agentes). Tal es el caso de Dinamarca (DANMAP, www.danmap.org), Países Bajos (NETHMAP, www.swab.nl), Finlandia (FiRe) o Suecia (SWEDRES). Iniciativas similares (pero con una cobertura que no siempre abarca una parte significativa del país o referida solo a uno o unos pocos microorganismos concretos) se han desarrollado también en otros países europeos, así como en EE. UU., Canadá, China, Corea, Tailandia, Singapur y Australia, entre otros.
En el ámbito supranacional también existen iniciativas para la vigilancia de la resistencia subvencionadas con fondos públicos que se apoyan en el análisis de los datos proporcionados por múltiples centros. La organización de estas bases de datos internacionales es muy compleja y sufre diversos problemas, en especial los relacionados con la estandarización de los métodos de antibiograma, los puntos de corte utilizados para la interpretación de los resultados obtenidos como categorías clínicas (sensible, intermedio o resistente) y la variable representación de cada país en el conjunto de la base datos, como consecuencia del número de centros que voluntariamente participan.
La red europea de vigilancia de resistencia a los antimicrobianos (European Antimicrobial Resistance Surveillance Network; EARS-Net, http://ecdc.europa.eu/en/activities/surveillance/EARSNet/database/Pages/database.aspx) es probablemente la base de datos supranacional más importante en este ámbito. En la misma se recoge información de unos 1.400 hospitales (que atiende en torno a los 100 millones de habitantes) procedente de múltiples redes nacionales que envían su información al European Centre for Disease Prevention and Control (http://www.ecdc.europa.eu/en/Pages/home.aspx). La base de datos abarca 8 microorganismos (Streptococcus pneumoniae, Staphylococcus aureus, Enteococcus faecalis, Enterococcus faecium, Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa y más recientemente Acinetobacter baumannii) causantes de infecciones invasivas, para los que se dispone de información comparativa de más de 400.000 aislados obtenidos desde 1999. Un consorcio de la Organización Mundial de la Salud (www.who.int/es), la European Society of Clinical Microbiology and Infectious Diseases (https://www.escmid.org) y el Dutch National Institute for Public Health and the Environment (www.rivm.nl) están promoviendo el programa Central Asian and Eastern European Surveillance on Antimicrobial Resistance (CAESAR) para obtener información de países de Asia Central y Europa Oriental empleando la misma metodología que en EARS-Net. Otras redes similares, con diferente grado de desarrollo incluyen Red Latinoamericana de Vigilancia de la Resistencia a los Antimicrobianos y Community-Acquired Respiratory Tract Infection Pathogen Surveillance, en países de Asia. Finalmente, varias compañías farmacéuticas de ámbito internacional también han subvencionado estudios supranacionales para disponer de información actualizada sobre resistencia a los antimicrobianos a nivel mundial. Con frecuencia estos programas de financiación privada se han centrado en analizar la resistencia a ciertos compuestos, o en determinados grupos de microorganismos y tipos de infección. Ejemplos de estos programas son los estudios (algunos ya extintos) Alexander project, SENTRY, TSN, TEST, SMART, MYSTIC, ZAAPS, entre otros.
Por último, los datos agregados de sensibilidad son también relevantes para los comités que participan en la definición de los puntos de corte (Clinical and Laboratory Standards Institute [CLSI] en EE. UU. —http://clsi.org—, el European Comitee of Antimicrobial Susceptibility testing, en Europa —http://www.eucast.org— y su homónimo en España, el Comité Español del Antibiograma —http://coesant-seimc.org—), ya que pueden utilizarse para reconocer las poblaciones que carecen de mecanismos de resistencia (wild type population) y definir los denominados puntos de corte epidemiológicos o epidemiological cutoff values11, o los más recientemente definidos puntos de corte poblacionales de resistencia (resistant population cut-off)12. Los datos agregados también pueden usarse en la adecuación de los tratamientos antimicrobianos mediante modelizaciones famacocinéticas y farmacodinámicas13.
Aspectos generales para la preparación del informe acumulado de antibiogramaEl CLSI ha aprobado el documento Analysis and Presentation of Cummulative Antimicrobial Susceptibility Test Data (M39-A4), en el que se presentan directrices generales sobre datos acumulados de antibiograma14,15.
De acuerdo con este documento los informes de datos de sensibilidad acumulados deben considerar múltiples aspectos.
Los datos presentados deben incluir al menos 30microorganismos de la especie o del grupo considerado. Eventualmente, pueden incluirse datos de más de un año para alcanzar este valor de referencia (o, dependiendo de las circunstancias, datos de más de una institución de la misma zona geográfica), o pueden agruparse varias especies de un mismo género (por ejemplo, en el caso de Shigella spp.); en este caso el informe dejará constancia de esta situación. Alternativamente, puede añadirse una nota en el informe indicando la menor validez estadística de los resultados.
Si un mismo laboratorio (por ejemplo, un centro de referencia o un centro que coordine este tipo de estudios) proporciona datos para más de un centro el informe de datos acumulados debe prepararse para cada centro (siempre que se alcance el valor antes indicado de al menos 30 aislamientos por especie/grupo).
El informe debe tener una periodicidad (al menos) anual. Si se estudian un número de aislamientos lo suficientemente grande, puede considerarse preparar informes con mayor frecuencia.
Se debe incluir la información relativa a los microorganismos que se hayan aislado en muestras clínicas para el diagnóstico, excluyendo aquellas referidas a estudios de vigilancia, de muestras ambientales o, si es el caso, de muestras no humanas. Los datos de estas muestras podrían eventualmente utilizarse de forma separada y con un objeto de comparación con los procedentes de muestras clínicas. En todo caso, se debe dejar clara constancia de su procedencia.
El informe debe estar basado en los datos finales verificados por el microbiólogo clínico, no en la información cruda que pueda obtenerse del antibiograma (con frecuencia, en nuestro entorno, de sistemas automáticos).
Si en la interpretación final de los datos que se hace llegar al clínico se aplican reglas expertas16 o lectura interpretada17, el informe debe tener en cuenta este aspecto. Debe prestarse especial atención a la confirmación de fenotipos raros o improbables.
Existen diversas publicaciones en las que se puede consultar información más detallada y concreta sobre estos aspectos.
Cuando se consideran todos los microorganismos obtenidos de muestras diagnósticas de un mismo centro se produce en muchos casos una sobrevaloración de las tasas de resistencia, porque suelen hacerse más estudios microbiológicos en pacientes con una mala respuesta terapéutica (la cual puede ser consecuencia, precisamente, de la resistencia del agente etiológico a los antimicrobianos). Se han publicado múltiples estudios en los que se ha valorado el impacto de los aislamientos duplicados en los resultados finales del informe acumulado de antibiograma18–24.
En realidad no existe un criterio único que, de forma absoluta, pueda considerarse perfecto para resolver esta cuestión, pues cada criterio que se tenga en cuenta proporcionará un tipo de información distinta, y su importancia deberá valorarse en función de la aplicación que se vaya a hacer de la misma. En general, para evitar este tipo de sesgo se recomienda considerar solo el primer aislado24 de cada paciente obtenido durante el periodo considerado, sin tener en cuenta que puedan obtenerse posteriormente nuevos aislamientos de la misma especie con igual sensibilidad, o incluso más resistentes, en muestras de igual o diferente tipo. Este es el criterio de referencia que considera el CLSI en su documento M39-A4.
También se ha valorado la preparación del informe en función de:
- •
Primer aislamiento por episodio (definiendo este último en un espacio temporal de, por ejemplo, 7, 15, 21, 30… días)24.
- •
Aislamiento más resistente (de entre todos los aislados en un mismo paciente durante el periodo considerado). Este tipo de aplicación puede ser útil para reconocer fenotipos de especial importancia clínica o epidemiológica.
- •
Valor medio de la sensibilidad: se calcula el porcentaje proporcional de sensibilidad de cada combinación microorganismo-antimicrobiano para el total de los aislamientos de un paciente.
- •
Primer aislamiento considerando diferencias en el perfil de sensibilidad. Este criterio ha sido propuesto en un documento de consenso redactado por el Study Group for Antimicrobial Resistance Surveillance (ESGARS) de la European Society for Clinical Microbiology and Infectious Diseases (ESCMID)7. Se recomienda incluir todos los primeros aislamientos representantes de los distintos fenotipos observados, considerando fenotipos distintos aquellos en los que existe un cambio «mayor» (sensible versus resistente) en las categorías clínicas de uno o más (a definir) agentes antimicrobianos. En este caso conviene previamente asegurar que las diferencias de categoría son tales y no representan problemas metodológicos al realizar el antibiograma.
Con el criterio de incluir solo el primer aislamiento, es posible que no se estén considerando cepas diferentes o cepas que hayan adquirido resistencia durante el tratamiento25–28. Estos aislamientos sí deben quedar registrados en la base de datos global, aunque no se incluirán para la preparación del informe acumulado. El reconocimiento de aparición de resistencia durante el tratamiento o de la emergencia de nuevos mecanismos de resistencia debe formar parte de la tarea diaria en el análisis de los datos de antibiograma. En los casos en que se considere clínicamente relevante puede hacerse un análisis independiente considerando estas circunstancias. Por otra parte, si en algún caso se detectara un aislamiento con un mecanismo de resistencia de especial importancia (por ejemplo, resistencia a glucopéptidos en S. aureus, resistencia a carbapenémicos probada o posible por producción de carbapenemasas, etc.) puede optarse por reseñar un porcentaje de sensibilidad de solamente el 99% y añadir un comentario sobre el fenotipo/mecanismo en cuestión.
Se deben presentar los antimicrobianos que se incluyen en los informes clínicos de los pacientes, y si alguno de dichos antimicrobianos solo se informa en determinados casos (por ejemplo, únicamente para cepas resistentes a otros antimicrobianos), debe quedar constancia de ello para evitar sesgos de interpretación. Si se estudian antimicrobianos que son marcadores de los resultados correspondientes a otros agentes (por ejemplo, cefoxitina u oxacilina para betalactámicos en Staphylococcus), la base de datos original debe incluir el resultado del antimicrobiano marcador, pero el informe debe incluir el/los antimicrobianos realmente informados al clínico.
Cuando en los informes clínicos del antibiograma de cada microorganismo se incluyen antimicrobianos que solamente se estudian si el correspondiente agente etiológico es resistente a algunos otros de primera línea, los informes acumulados referidos a agentes estudiados selectivamente tienden a presentar tasas de resistencia más altas que si estos se hubieran evaluado para todos los microorganismos, por lo que puede considerarse no incluir estos agentes selectivos o, si se incluyen, esa circunstancia debe quedar claramente recogida en el informe acumulado.
Los informes acumulados de sensibilidad a los antimicrobianos habitualmente se preparan indicando los porcentajes de cepas sensibles (la principal razón para ello radica en que no es frecuente tratar infecciones causadas por microorganismos con la categoría clínica de intermedio). La definición de la categoría clínica de «sensible» estará basada en los criterios de referencia que emplee el servicio de Microbiología (habitualmente European Comitee of Antimicrobial Susceptibility testing o CLSI). Con independencia de ello, en algunos casos (por ejemplo, Streptococcus pneumoniae y Streptococcus del grupo viridans y penicilina) se aconseja incluir separadamente los porcentajes de cepas sensibles y de cepas intermedias.
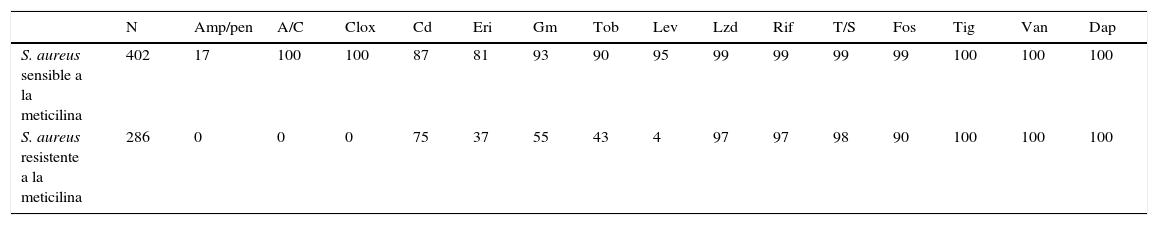
Además, muchos laboratorios preparan también informes en los que se incluyen microorganismos con fenotipos de resistencia de especial relevancia clínica, como S. aureus resistente a la meticilina o enterobacterias productoras de beta-lactamasas de espectro extendido. En las tablas 1 y 2 se presentan sendos ejemplos.
Sensibilidad (%) comparada a los antimicrobianos de aislamientos de S. aureus sensible y resistente a meticilina en pacientes ingresados en un centro hospitalario (según criterios EUCAST)
| N | Amp/pen | A/C | Clox | Cd | Eri | Gm | Tob | Lev | Lzd | Rif | T/S | Fos | Tig | Van | Dap | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| S. aureus sensible a la meticilina | 402 | 17 | 100 | 100 | 87 | 81 | 93 | 90 | 95 | 99 | 99 | 99 | 99 | 100 | 100 | 100 |
| S. aureus resistente a la meticilina | 286 | 0 | 0 | 0 | 75 | 37 | 55 | 43 | 4 | 97 | 97 | 98 | 90 | 100 | 100 | 100 |
A/C: amoxicilina-ácido clavulánico; Amp/pen: ampicilina, penicilina G; Cd: clindamicina; Clox: cloxacilina; Dap: daptomicina; Eri: eritromicina; Fos: fosfomicina; Gm: gentamicina; Lev: levofloxacino; Lzd: linezolid; Mup: mupirocina; n: número de aislamientos; Rif: rifampicina; Tig: tigeciclina; Tob: tobramicina; T/S: cotrimoxazol; Van: vancomicina.
Teniendo en cuenta que los puntos de corte de categorización clínica pueden variar a lo largo del tiempo, es recomendable que la base de datos original contenga los valores reales de CMI o de diámetros de halos, para poder hacer reinterpretación de los resultados cuando se analizan series temporales de datos acumulados de antibiograma. A la hora de almacenar datos concretos de CMI, el documento M39-A4 (que toma como referencia los puntos de corte del propio CLSI) recomienda que para valores inferiores a 1mg/l solo se consideren 2 decimales (por ejemplo, 0,125mg/l se almacenarán como 0,12mg/l).
Una vez que se ha elaborado una primera versión del informe de datos acumulados es conveniente que se haga un análisis detallado del mismo y que los correspondientes resultados se validen, preferiblemente haciendo una comparación con los porcentajes de sensibilidad calculados manualmente para una especie o unas pocas especies de microorganismos en un breve período de tiempo, tomando como referencia un archivo en el que se listen los valores de sensibilidad para el o los agentes y el tiempo evaluados. Si se observara alguna discrepancia relevante sería necesario aclararla antes de emitir el informe acumulado definitivo.
Exportación de datos de antibiogramaCada centro debe decidir el modelo de envío de los datos de antibiograma a la base de datos definitiva con la que se elaborará el informe acumulado de datos de antibiograma, teniendo en cuenta la necesidad de que en dicha base queden recogidos los datos finales verificados.
Con frecuencia la base de datos se organiza por el propio sistema de gestión de laboratorio; cuando ello no es posible y se deban emplear los recursos de que disponga un sistema automático de antibiograma, habrá una clara limitación de la información, pues habitualmente los antibiogramas que no se hayan procesado en dicho sistema solo podrían analizarse de forma independiente.
En función de los datos pormenorizados que se incluyan en el informe, la base de datos debiera incluir información demográfica (identificador único de paciente, edad, sexo, unidad-servicio donde se atiende al paciente, fecha de admisión), relativos a la muestra (número, tipo, fecha de recogida), al microorganismo (identificación, preferiblemente a nivel de especie, número de aislamiento si hubiera más de uno) y a los antimicrobianos (datos finales verificados de CMI o de diámetro de halo, categoría clínica para cada agente).
Preparación del informe de datos acumulados de antibiogramaUna forma conveniente y sencilla de preparar un informe de datos acumulados de antibiograma es emplear el formato de tabla(s), en la(s) que se incluyan, respectivamente, microorganismos y agentes antimicrobianos, indicando en las casillas de la misma el número de microorganismos incluidos y los correspondientes porcentajes de sensibilidad. Para los casos en los que se sabe que una especie es intrínsecamente resistente a un antimicrobiano puede emplearse la abreviatura «R» (resistente) y si el agente en cuestión no se ha evaluado para un microorganismo, la celdilla se puede rellenar con un guión o dejarla vacía. Para la preparación de informes sobre tendencias temporales de sensibilidad suele resultar más útil la presentación de los datos en forma de figura que en forma de tabla.
El informe debe incluir las fechas a las que se refiere el mismo, la(s) persona(s) responsables de su elaboración (preferiblemente aportando datos de contacto) y la metodología empleada para la elaboración de antibiogramas en el servicio de microbiología clínica.
Es aconsejable preparar tablas diferentes para bacterias grampositivas y bacterias gramnegativas (para estas últimas puede diferenciarse entre fermentadores y no fermentadores de la glucosa). Si se dispone de información específica para microorganismos anaerobios o para levaduras, esta debiera presentarse también de forma individualizada.
Pueden emplearse diversos criterios para listar los microorganismos del informe: alfabéticamente, por grupo taxonómico o por prevalencia. Cada servicio debe definir qué microorganismos se incluirán en su informe. En el documento M39-A4, se aconsejan los siguientes agentes:
- •
Bacterias gramnegativas: Acinetobacter baumannii, Citrobacter freundii, Enterobacter aerogenes, Enterobacter cloacae, Escherichia coli, Haemophilus influenzae, Klebsiella oxytoca, Klebsiella pneumoniae, Morganella morganii, Proteus mirabilis, Providencia spp., Pseudomonas aeruginosa, Salmonella spp., Serratia marcescens, Shigella spp., Stenotrophomonas maltophilia.
- •
Bacterias grampositivas: Enterococcus spp. (preferiblemente diferenciando E. faecalis y E. faecium), Staphylococus aureus, Staphylococcus coagulasa-negativa (pueden listarse de forma separada S. lugdunensis y S. saprophyticus), Streptococcus pneumoniae, Streptococcus grupo viridans.
- •
Bacterias anaerobias: Bacteroides fragilis, Bacteroides grupo fragilis (diferentes a B. fragilis propiamente dicho), Clostridium perfringens.
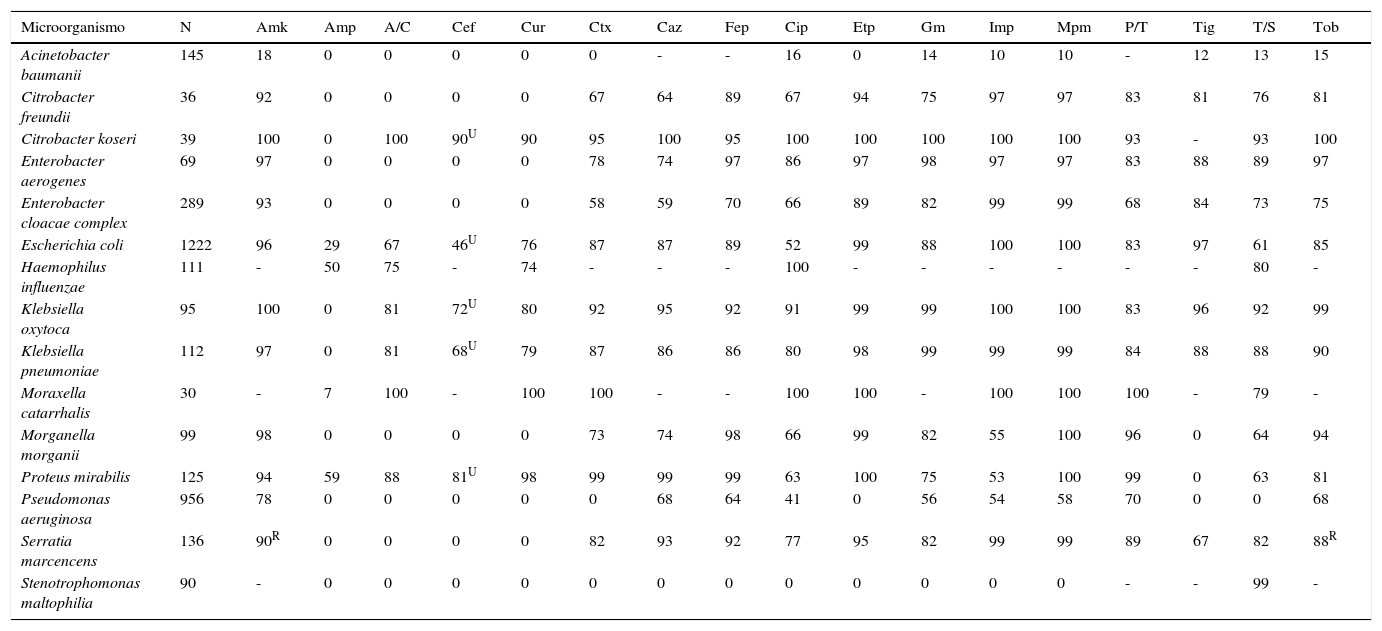
Cada centro puede definir la idoneidad de estas recomendaciones, e incluir (o suprimir en su caso) otros microorganismos, para los que se alcance el valor de referencia de al menos 30 aislamientos. En la tabla 3 se recoge un ejemplo concreto de parte del informe de un servicio de microbiología clínica.
Informe anual de sensibilidad acumulada de bacterias gramnegativas aisladas en pacientes ingresados en un centro hospitalario
| Microorganismo | N | Amk | Amp | A/C | Cef | Cur | Ctx | Caz | Fep | Cip | Etp | Gm | Imp | Mpm | P/T | Tig | T/S | Tob |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Acinetobacter baumanii | 145 | 18 | 0 | 0 | 0 | 0 | 0 | - | - | 16 | 0 | 14 | 10 | 10 | - | 12 | 13 | 15 |
| Citrobacter freundii | 36 | 92 | 0 | 0 | 0 | 0 | 67 | 64 | 89 | 67 | 94 | 75 | 97 | 97 | 83 | 81 | 76 | 81 |
| Citrobacter koseri | 39 | 100 | 0 | 100 | 90U | 90 | 95 | 100 | 95 | 100 | 100 | 100 | 100 | 100 | 93 | - | 93 | 100 |
| Enterobacter aerogenes | 69 | 97 | 0 | 0 | 0 | 0 | 78 | 74 | 97 | 86 | 97 | 98 | 97 | 97 | 83 | 88 | 89 | 97 |
| Enterobacter cloacae complex | 289 | 93 | 0 | 0 | 0 | 0 | 58 | 59 | 70 | 66 | 89 | 82 | 99 | 99 | 68 | 84 | 73 | 75 |
| Escherichia coli | 1222 | 96 | 29 | 67 | 46U | 76 | 87 | 87 | 89 | 52 | 99 | 88 | 100 | 100 | 83 | 97 | 61 | 85 |
| Haemophilus influenzae | 111 | - | 50 | 75 | - | 74 | - | - | - | 100 | - | - | - | - | - | - | 80 | - |
| Klebsiella oxytoca | 95 | 100 | 0 | 81 | 72U | 80 | 92 | 95 | 92 | 91 | 99 | 99 | 100 | 100 | 83 | 96 | 92 | 99 |
| Klebsiella pneumoniae | 112 | 97 | 0 | 81 | 68U | 79 | 87 | 86 | 86 | 80 | 98 | 99 | 99 | 99 | 84 | 88 | 88 | 90 |
| Moraxella catarrhalis | 30 | - | 7 | 100 | - | 100 | 100 | - | - | 100 | 100 | - | 100 | 100 | 100 | - | 79 | - |
| Morganella morganii | 99 | 98 | 0 | 0 | 0 | 0 | 73 | 74 | 98 | 66 | 99 | 82 | 55 | 100 | 96 | 0 | 64 | 94 |
| Proteus mirabilis | 125 | 94 | 59 | 88 | 81U | 98 | 99 | 99 | 99 | 63 | 100 | 75 | 53 | 100 | 99 | 0 | 63 | 81 |
| Pseudomonas aeruginosa | 956 | 78 | 0 | 0 | 0 | 0 | 0 | 68 | 64 | 41 | 0 | 56 | 54 | 58 | 70 | 0 | 0 | 68 |
| Serratia marcencens | 136 | 90R | 0 | 0 | 0 | 0 | 82 | 93 | 92 | 77 | 95 | 82 | 99 | 99 | 89 | 67 | 82 | 88R |
| Stenotrophomonas maltophilia | 90 | - | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | - | - | 99 | - |
N: número de aislamientos
-: antibiótico no analizado para el correspondiente microorganismo o analizado en escasos aislamientos; A/C: amoxicilina+ácido clavulánico; Amk: amikacina; Amp: ampicilina; Cef: cefalotina; Cip: ciprofloxacino; Ctaz: ceftazidima; Ctx: cefotaxima; Cur: cefuroxima; Etp: ertapenem; Fep: cefepima; Gm: gentamicina; Imp: imipenem; Mpm: meropenem; P/T: piperacilina+tazobactam; Tig: tigeciclina; Tob: tobramicina; T/S: trimetoprim+sulfametoxazol o cotrimoxazol.
UInterpretación de sensibilidad válida solo para infecciones urinarias no complicadas.
RSe considera que Serratia marcescens tiene resistencia intrínseca de bajo nivel a tobramicina y amikacina.
Para la denominación de los antimicrobianos pueden emplearse abreviaturas cuyo significado se recoja a pie de tabla. En su caso, estas abreviaturas deben ser las mismas que consten en el informe clínico habitual. Pueden seguirse varios criterios para preparar informes detallados de datos acumulados de antibiograma:
- •
Por unidades/servicios/localización del paciente28,29: los informes se pueden referir a unidades de cuidados intensivos, pacientes ingresados o comunitarios.
En ocasiones pueden presentarse dificultades para asignar los resultados a un epígrafe concreto por limitaciones en la información disponible en el servicio de microbiología (por ejemplo, consultas externas hospitalarias y su consideración como pacientes ingresados o no). Las decisiones tomadas al respecto para la preparación del informe deben reseñarse en el propio informe.
- •
Atendiendo al fenotipo de resistencia de algunos microorganismos (ver previamente).
- •
En función del tipo de muestra: es interesante considerar los resultados específicos de muestras de orina o de hemocultivos, en el primer caso por el sesgo que pueden producir los datos de patógenos urinarios en el total de datos analizados, y en el segundo caso por la importancia para orientar el tratamiento empírico de una situación de especial importancia clínica.
En ocasiones puede ser de interés que el informe acumulado de antibiograma incluya datos sobre sensibilidad que ayuden a planificar el uso de combinaciones de antimicrobianos30. De esta forma puede presentarse información sobre el porcentaje adicional de sensibilidad que se obtendría si se considera un segundo antimicrobiano (con respecto al porcentaje de un primer agente aislado). Este tipo de información puede ser de relevancia para patógenos en los que se dispone de pocas alternativas terapéuticas (como en el caso de muchas bacterias gramnegativas no fermentadoras). En cualquier caso, debe tenerse en cuenta que dicha información no supone, necesariamente, que el uso combinado de 2 antimicrobianos sea mejor que el uso de uno solo31, y desde luego no considera el posible antagonismo entre 2 compuestos.
Es muy poco habitual que se disponga de información concreta sobre los resultados del estudio in vitro de combinaciones de antimicrobianos. En caso de recogerse esta información debe indicarse qué tipo de técnica se ha empleado para definir la sensibilidad de los antimicrobianos en combinación.
Aspectos estadísticos del informe acumulado de antibiogramaLa extrapolación de los resultados del informe como representantes de la situación real en los agentes etiológicos concretos que producen enfermedad en el entorno correspondiente se beneficia de la aplicación de métodos estadísticos, en particular la definición de intervalos de confianza para establecer la precisión de los porcentaje de sensibilidad y la evaluación de la significación estadística de las diferencias que se observen entre 2 valores de sensibilidad.
Los porcentajes de sensibilidad que se recogen en cada combinación microorganismo-antimicrobiano suponen una estimación de la verdadera proporción de cepas que conforman la población total, real, del agente considerado. Se pueden definir de forma estadística los intervalos de confianza que señalen la precisión del valor absoluto del porcentaje presentado en el informe. Los aspectos concretos se pueden consultar en el documento M39-A414. Para facilitar los cálculos de los porcentajes de sensibilidad, intervalos de confianza de los porcentajes y análisis temporales de tendencias de sensibilidad se ha desarrollado una herramienta estadística en Excel, que se facilita en el documento PNT-IASA-2 del procedimiento de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica Métodos estadísticos aplicados en el informe de sensibilidad acumulada a los antimicrobianos, disponible en: http://www.seimc.org/contenidos/documentoscientificos/procedimientosmicrobiologia/seimc-procedimientomicrobiologia51.pdf.
Es interesante comparar los resultados de informes correspondientes a diferentes periodos (años, habitualmente), servicios, instituciones, etc. Esta comparación se puede llevar a cabo empleando métodos estadísticos sencillos (fundamentalmente la prueba Chi-cuadrado). Ahora bien, debe distinguirse entre significación estadística (la ofrecida por el método antes reseñado) y la significación clínica o epidemiológica. Obviamente, cuando se comparan números absolutos muy grandes de aislamientos, pequeñas variaciones en los porcentajes de sensibilidad pueden suponer diferencias estadísticamente significativas, pero estas pueden no suponer un impacto en las decisiones terapéuticas o no abarcar tendencias que clínicamente puedan tener una gran repercusión (tal como la aparición de unas pocas cepas de K. pneumoniae resistentes a carbapenémicos), lo que convendrá analizar oportunamente.
Utilización del informe acumulado de antibiogramaQuizá la aplicación más relevante de este tipo de informes es servir como elemento de referencia para la planificación del tratamiento empírico1,2 y también con fines de educación en los programas de mejora de utilización de antimicrobianos (programas PROA).
Debe evaluarse la forma de hacer más fácilmente accesible el informe a los clínicos responsables de los pacientes. Se han empleado para ello distintas soluciones (que pueden ser complementarias). La inclusión de un formato electrónico en la página Web de la institución es muy recomendable, pero debe hacerse la oportuna publicidad de la misma para asegurar que los posibles usuarios conozcan esta opción; también se puede preparar un folleto impreso que pueda llevarse con comodidad en la bata del clínico, o se puede incluir una copia resumida del informe en la propia historia clínica del paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.