La diabetes mellitus tipo 2 (DM2) es la forma más frecuente de diabetes. Representa el 90-95% de los casos. Su prevalencia es más alta en los países occidentales, aumenta con la edad y en los individuos obesos o que tienen un estilo de vida sedentario1-3.
En España, la prevalencia de DM2 y su elevada morbimortalidad asociada la convierten en un importante problema de salud pública4. En particular, la prevalencia de la diabetes en adultos de mediana edad oscila entre el 7 y el 16% en función del área geográfica y de los criterios diagnósticos utilizados5-8.
La DM es una de las principales causas de muerte en la mayoría de los países desarrollados. En España, supone la tercera causa de muerte entre las mujeres y la séptima entre los varones9. Los pacientes diabéticos presentan 2 a 4 veces mayor riesgo que la población general de desarrollar enfermedad cardiovascular, así como mayor riesgo de presentar una enfermedad microvascular específica: retinopatía diabética que puede provocar ceguera (riesgo 20 veces superior), neuropatía (riesgo 7 veces mayor) e insuficiencia renal (riesgo 25 veces superior)10.
El UK Prospective Diabetes Study (UKPDS)11 ha demostrado que el estricto control glucémico se asocia con la disminución de las complicaciones micro y macrovasculares. Este estudio ha mostrado que no hay un límite para la asociación entre riesgo y control, y que los objetivos deben establecerse lo más cercano posible a los valores de glucemia y hemoglobina glucosilada de los individuos sin diabetes.
La DM origina elevados costes, tanto para los individuos que la presentan como para el sistema sanitario. En España, el coste directo de DM fue, en 1994, de unos 544,8 millones de euros en una población de 1.430.000 diabéticos conocidos, lo que significó un coste medio anual por paciente de 380,97 euros12. Los costes de hospitalización representaron el coste económico más importante y correspondieron al 35% del coste total de la diabetes en 1994. El 5% de los ingresos hospitalarios son de pacientes diabéticos, causan el 6% de las hospitalizaciones y representan el 8% del gasto total de hospitalización13.
Datos más recientes obtenidos a partir de un estudio de 1.004 pacientes que concurrían a 299 centros sanitarios en España revelan que el coste anual en salud por paciente con DM2 de una media de 10 años de evolución de su enfermedad fue de 1.305,15 euros. De este coste, el 28,6% (373,27 euros) se relacionó directamente con el control diabético, el 30,51% (398,20 euros) se atribuyó a las complicaciones de la enfermedad, mientras que el 40,9% no se relacionó directamente con la enfermedad. El coste medio de los pacientes sin complicaciones fue de 883 euros, mientras que el de los pacientes con complicaciones microvasculares fue de 1.403 euros y el de los pacientes con complicaciones macrovasculares, 2.022 euros. Los pacientes con complicaciones micro y macrovasculares presentaron un coste anual de 2.133 euros14.
La calidad de vida relacionada con la salud (CVRS) es un término genérico que incluye múltiples componentes del funcionamiento físico, mental y social. Una CVRS deficiente y un estado psicosocial problemático pueden afectar al control metabólico de la enfermedad interfiriendo en el cumplimiento del tratamiento. Los protocolos de tratamiento que incluyan estrategias para mejorar la CVRS pueden conseguir aumentar el cumplimiento y así optimizar el estado metabólico. La mejoría del bienestar psicológico es un objetivo importante en el tratamiento de la diabetes15. En consecuencia, es esencial considerar la CVRS de los pacientes diabéticos para establecer un determinado régimen terapéutico16,17. Sin embargo, en España no hay estudios que valoren el impacto de la diabetes y su tratamiento en la CVRS.
El objetivo del presente trabajo ha sido valorar el grado de control metabólico, la presencia de complicaciones, la CVRS y el uso de recursos sanitarios en la población diabética española asistida en centros de atención primaria.
Pacientes y método
Se trata de un estudio observacional, prospectivo y multicéntrico. Entre octubre de 2000 y junio de 2001, en 48 centros de atención primaria de España, se evaluó a un total de 628 pacientes divididos en 4 cohortes: 1. Pacientes con DM2 que iniciaban tratamiento farmacológico diagnosticados de novo o tras fracaso a las medidas dietéticas (n = 102). 2. Pacientes con DM2 que recibían tratamiento farmacológico desde hacía menos de un año, cohorte (n = 159). 3. Pacientes con DM2 tratados farmacológicamente por más de un año (n = 275). 4. Pacientes con glucemia basal alterada (glucemia en ayunas: 110 a 125,9 mg/dl) (cohorte control) (n = 92). La selección de los investigadores participantes (48 médicos de atención primaria) se realizó mediante muestreo estratificado por localización geográfica, medio (urbano, semiurbano y rural), edad y sexo, cuidando la representatividad de la población diabética atendida en atención primaria en España. Se excluyó a los pacientes con diabetes tipo 1, mujeres embarazadas, diabetes gestacional, diabetes resultante de síndromes genéticos específicos, pacientes sometidos recientemente a cirugía, en tratamiento con fármacos que puedan interferir con el metabolismo hidrocarbonado, malnutrición evidente e infecciones agudas.
Las entrevistas se realizaron a 0, 3 y 6 meses. Se recogió la siguiente información: hábitos y estilo de vida (tabaco, actividad física), datos antropométricos (peso, talla e índice de masa corporal [IMC]), control glucémico (glucemia y hemoglobina glucosilada [HbA1C) y control lipídico (triglicéridos plasmáticos y colesterol total y subfracciones: colesterol unido a lipoproteínas de alta densidad [cHDL] y baja densidad [cLDL]). El grado de sobrepeso se clasificó en: normopeso (IMC < 25 kg/m2), sobrepeso (IMC = 25-29,9 kg/m2), obesidad grado I (IMC = 30-34,9 kg/m2), obesidad grado II (IMC = 35-40 kg/m2) y obesidad grado III (IMC > 40 kg/m2). El control de la presión arterial (PA) se clasificó como sin HTA, HTA leve, moderada y grave (tabla 1). Por último, el grado de control glucémico y lipídico se clasificó en bueno, aceptable y deficiente (tabla 2). Se registró la presencia de complicaciones microvasculares (nefropatía, retinopatía y neuropatía diabética sintomática) y macrovasculares (cardiopatía isquémica, amputación de extremidades inferiores, vasculopatía periférica, úlceras vasculares por pie diabético, vasculopatía cerebral y claudicación intermitente), así como las hipoglucemias totales y graves.
Respecto al uso de recursos sanitarios, se investigó sobre la ayuda de terceras personas no sanitarias, visita al médico de atención primaria (AP), a enfermería, urgencias al médico de AP o del hospital, visita al médico especialista, ingreso hospitalario (planta, UVI o UCI), necesidad de transporte sanitario, limitación de la actividad principal, necesidad de tratamiento específico, analíticas (bioquímica simple, hemoglobina glucosilada, lipidograma, microalbuminuria), fondo de ojo, electrocardiograma (ECG) y otras exploraciones.
Para la valoración de la CVRS se utilizaron los cuestionarios ADDQoL y el EQ-5D18-19 en su versión en castellano. El ADDQoL permite la identificación de las dimensiones de la vida que son más importantes para el paciente y que se ven a su vez afectadas negativamente por la diabetes. Consta de 18 ítems que valoran 18 dimensiones específicas. Se evalúa el impacto de la DM2 en cada dimensión, así como la importancia de la dimensión por el paciente. Los ítems de impacto se evalúan mediante respuestas que oscilan entre 3 y 3 puntos. El EQ-5D consta de 5 preguntas que evalúan 5 dimensiones de la calidad de vida (sistema descriptivo) y de una escala visual analógica (EVA) para la autoevaluación del estado de salud. Las 5 dimensiones estudiadas son: movilidad, cuidado personal, actividades cotidianas, dolor o malestar y ansiedad o depresión. La EVA simula un termómetro con mínimo «0» y máximo «100», donde «0» representa el peor estado de salud imaginable y «100», el mejor. El paciente debe marcar el punto de la escala que cree que se aplica mejor a su estado de salud.
Análisis estadístico
Las variables continuas se informan como media (desviación estándar [DE]) y las discretas con el número y porcentaje de pacientes por categoría de respuesta. Las características de los pacientes, el tratamiento de la DM2, el uso de recursos, la calidad de vida, la satisfacción y el cumplimiento terapéutico entre cohortes se compararon mediante la prueba de la *2, y mediante el análisis de la varianza o su equivalente no paramétrico, la prueba de Kruskal-Wallis en el caso de variables continuas, dependiendo de si cumplían los criterios de aplicabilidad exigidos. Se han utilizado las pruebas de MacNemar (variables categóricas) o de los intervalos con signo de Wilcoxon para datos pareados al realizar algunas comparaciones longitudinales entre visitas de estudio. Para evaluar posibles diferencias entre cohortes de estudio, respecto a la presencia de hipoglucemias en cada una de las visitas se utilizó el estadístico de la *2 de asociación lineal. Para analizar la evolución del porcentaje de pacientes que experimentaron alguna hipoglucemia durante el desarrollo del estudio para cada cohorte se utilizó la prueba no paramétrica Q de Cochran.
Para evaluar los cambios producidos principalmente en calidad de vida y satisfacción con el tratamiento entre visitas de seguimiento, se utilizaron las tasas de crecimiento (TC), calculadas de la siguiente forma:
TC = puntuación final puntuación inicial * 100/ puntuación inicial
El uso de recursos realizados entre las visitas inicial y final se ha computado como la suma de uso de recursos de las 24 semanas transcurridas entre la visitas inicial y final, exigiendo como mínimo que 1 de los 2 diarios (3 o 6 meses) estuviera cumplimentado.
El análisis de los datos se realizó en SPSS® 10.0 para Windows.
Para el cálculo del tamaño muestral, dado que no se disponía de estimación previa de las diferencias entre las principales variables de estudio, se determinó la diferencia a detectar según criterio estadístico, esperando diferencias entre proporciones iguales o superiores al 15% (diferencias entre pequeñas y moderadas). Para un grado de significación de a = 0,01 y un poder estadístico de 0,8, se indicó la necesidad de incluir a un total de 258 pacientes en cada cohorte de estudio.
Resultados
Datos sociodemográficos, hábitos y estilo de vida
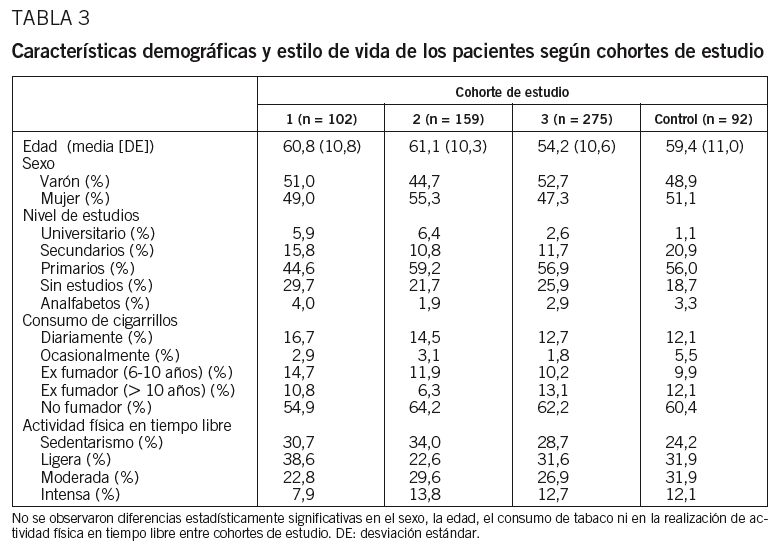
Se evaluó a un total de 628 pacientes, con una edad media (DE) de 62,2 (10,3) años. Las características demográficas (edad, sexo y nivel de estudios) y de estilo de vida (consumo de tabaco y grado de actividad), según cohorte se muestran en la tabla 3. La distribución fue homogénea entre varones y mujeres. El 82,7% de los pacientes presentó un nivel de estudios primarios o inferior. El 61,2% declaró que no fumaban ni habían fumado nunca y el 60,2% que realizaban actividad física ligera o nula. El número de fumadores entre los pacientes diabéticos fue semejante al número de fumadores entre los del grupo control. No se observaron modificaciones en el número de fumadores ni en el porcentaje de pacientes sedentarios en los 6 meses de seguimiento.
Control metabólico
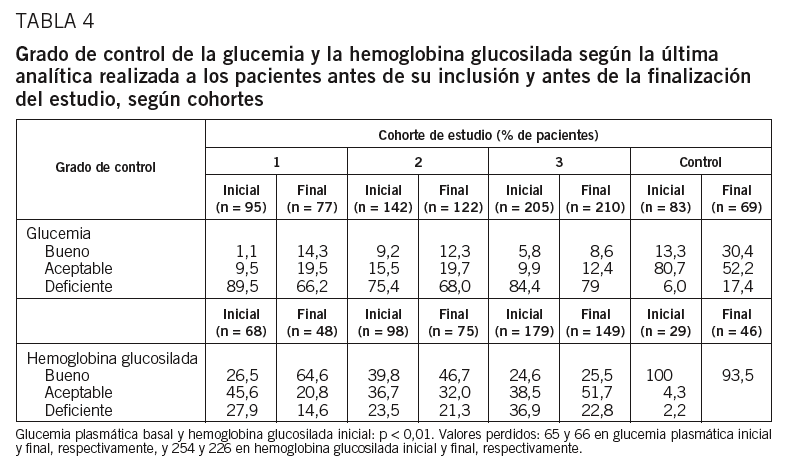
El grado de control glucémico mostró diferencias estadísticamente significativas por grupos de estudio al inicio del trabajo (p < 0,01). El porcentaje de «pacientes controlados» (definidos como control bueno y aceptable: valores de glucemia plasmática en ayunas inferiores a 126 mg/dl) fue del 86,9% en los pacientes de la cohorte control y del 10, el 40 y el 28,2% en las cohortes 1, 2 y 3, respectivamente. Los pacientes de la cohorte 2 presentaron inicialmente mejor control que los pacientes de las cohortes 1 y 3 (tabla 4). Tras 6 meses de seguimiento, los pacientes de la cohorte 1 fueron los mejor «controlados», seguidos de las cohortes 2 y 3 (tabla 4). También el control valorado por las concentraciones de HbA1C presentó diferencias significativas entre los grupos al inicio del estudio (tabla 4), y los pacientes de la cohorte 2 fueron los que presentaron el mayor porcentaje de pacientes controlados (el 39,8 en la cohorte 2 frente al 26,5 y el 24,6% de las cohortes 1 y 3, respectivamente). Se observaron cambios estadísticamente significativos tras los 6 meses de seguimiento, con una mejoría global en aproximadamente el 32,6% de los pacientes, el 52,2% se mantuvo igual y cerca del 15% empeoró el control (p < 0,05). Tras 6 meses de seguimiento, los pacientes de las cohortes 2 y 3 presentaron peor control, según el valor de la hemoglobina glucosilada, que los de la cohorte 1 (p < 0,05).
Los valores medios de la glucemia basal plasmática y hemoglobina glucosilada mostraron en general, para todos los participantes, un descenso estadísticamente significativo al cabo de los 6 meses de estudio (p < 0,05). Sin embargo, los pacientes de la cohorte 1 mostraron reducciones significativamente superiores que el resto de cohortes (p < 0,05), con un descenso medio de un 14,5% (21,8%) en la glucemia plasmática y de un 8,5% (16,4%) en los valores de hemoglobina glucosilada.
Un 38,8% de los pacientes presentaban sobrepeso (IMC = 25-29,9 kg/m2) en el momento de la inclusión en el estudio y un 44,8%, obesidad (IMC > 30 kg/m2). No se hallaron variaciones significativas en el porcentaje de pacientes con sobrepeso y obesidad a los 6 meses de seguimiento, ni en su conjunto ni por grupo de cohorte, grado de control metabólico ni tipo de tratamiento.
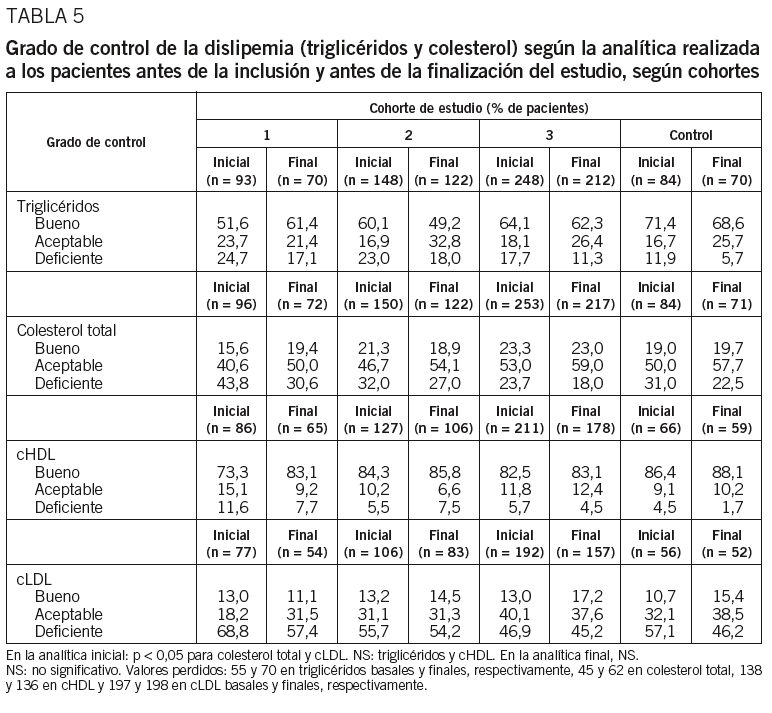
Al inicio, la cohorte 1 presentaba una proporción significativamente superior de pacientes con un control deficiente del colesterol total y del cLDL (p < 0,05) comparado con las restantes cohortes (tabla 5). Tras 6 meses de seguimiento, se observó un descenso generalizado de los valores de triglicéridos, colesterol total, cHDL y cLDL, pero estas diferencias resultaron estadísticamente significativas únicamente en el colesterol total (p < 0,05) y cLDL (p < 0,05). Se observó una tendencia a un mejor control de los valores de triglicéridos en la cohorte control en la analítica final (p = 0,054) (tabla 5). La media de los valores de cLDL inicial entre los pacientes diabéticos fue de 136,4 (3,1) mg/dl y tras 6 meses de seguimiento de 129,9 (30,3) mg/dl.
Complicaciones agudas y crónicas
Cincuenta y seis pacientes (9,2%) presentaron como mínimo una hipoglucemia durante el mes previo a la inclusión, contabilizando un total de 101 hipoglucemias entre todos los pacientes del estudio. De ellas, sólo 33 (58,9%) se confirmaron analíticamente. A los 3 meses de seguimiento se había producido un total de 106 casos de hipoglucemia, con valores de glucemia media de 58,4 (11,0) mg/dl valoradas en 51 (49,2%) pacientes. En los 3 meses finales se registraron 83 casos de hipoglucemia. Se hallaron diferencias estadísticamente significativas en el porcentaje de pacientes que presentaron hipoglucemia entre cohortes en el mes previo a la inclusión (p < 0,01) y durante los primeros 3 meses de seguimiento (p < 0,01), y se observó una tendencia a que hubieran más casos de hipoglucemia entre los pacientes de la cohorte 3 (el 14,5% en el mes previo a la inclusión, el 15,5% entre las visitas inicial e intermedia y el 11,6% entre las visitas intermedia y final), seguidos de la cohorte 2 (el 10,4, el 6. y el 7,6%, respectivamente) y la 1 (el 1,0, el 5,4 y el 8,6%, respectivamente).
El 12,6% de los pacientes de la cohorte 3, y el 1,0 y el 8,4% de las cohortes 1 y 2 presentaban, como mínimo, un factor favorecedor de hipoglucemia (p < 0,01). Los factores favorecedores más frecuentes de hipoglucemia son el error dietético y el ejercicio intenso.
No se halló asociación entre número de casos de hipoglucemia y grado de control metabólico. La presencia de hipoglucemia fue significativamente más frecuente entre los pacientes que recibían insulina, seguido de los pacientes que recibían antidiabéticos orales + insulina.
Un 18,8% de los participantes en el estudio había presentado alguna complicación microvascular en el momento de iniciarse el estudio; los pacientes de la cohorte 3 fueron los más afectados (29,8%), y los controles, los menos afectados (2,2%). En el 27,6% de los pacientes de la cohorte 1, el 14,8% de la cohorte 2, el 13,9% de la cohorte 3 y el 34,1% de la cohorte control no se exploró la presencia de nefropatía durante el año previo a la inclusión en el estudio. En el caso de la retinopatía diabética y de la neuropatía periférica sintomática, el porcentaje de pacientes no explorados fue del 39,2 y el 19,4%, respectivamente, en la cohorte 1; del 24,5 y el 14,8% en la cohorte 2; del 13,6 y el 10,2% en la cohorte 3 y del 45,9 y el 30,6% en la cohorte control. Refirió algún tipo de complicación macrovascular el 22,3% de los pacientes, y, de nuevo, los pacientes de la cohorte 3 fueron los más afectados (26,2%), frente a un 12,0, un 12,7 y un 18,2% de las cohortes control, 1 y 2, respectivamente. Entre los pacientes en los que se evaluó la presencia de cada una de las complicaciones microvasculares en el momento de la inclusión, el 12,9% presentaba nefropatía; el 10,7%, retinopatía diabética, y el 7,1%, neuropatía periférica sintomática.
En cuanto a las complicaciones macrovasculares, no se observaron diferencias estadísticamente significativas entre cohortes. El 10,5% de los pacientes presentaba cardiopatía isquémica; el 0,6%, amputación de extremidades inferiores; el 0,5%, vasculopatía periférica (con cirugía bypass); el 1,4%, úlceras vasculares por pie diabético; el 3,3%, vasculopatía cerebral; el 4,5%, claudicación intermitente de extremidades inferiores; el 1,6%, ceguera diabética; el 14,8%, catarata, y el 6,9%, glaucoma. La frecuencia de catarata fue superior entre los pacientes de la cohorte 3.
Uso de recursos sanitarios
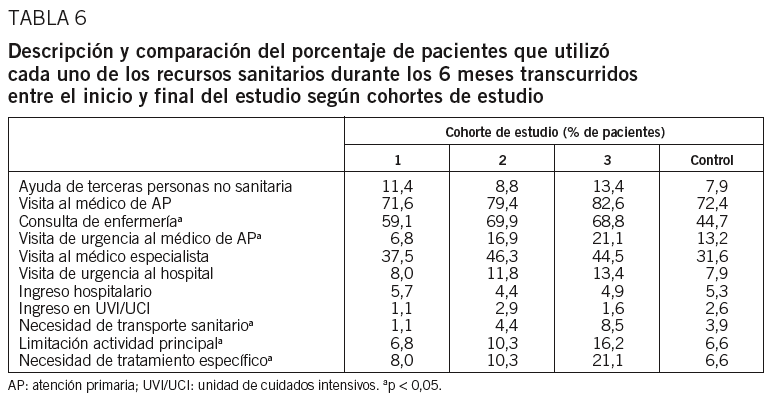
Durante el mes previo al inicio del estudio, los pacientes de la cohorte 1 realizaron más pruebas analíticas (HbA1C, perfil lipídico, microalbuminuria) y fondos de ojo que el resto de las cohortes. No se observaron diferencias estadísticamente significativas entre cohortes de estudio respecto a la utilización de otros recursos (ayuda de terceras personas, visita al médico de AP, visita a la consulta de enfermería, visita de urgencia al médico de AP y visita al médico especialista, entre otros). En su conjunto, el recurso más utilizado fue la visita al médico de AP (49,7%), seguida de la visita a la consulta de enfermería (37,5%) y de la visita al médico especialista (12,2%). Entre la visita inicial e intermedia (3 meses) y entre ésta y la final (6 meses), de nuevo los recursos mayormente requeridos fueron la visita al médico de AP (el 49,7 y el 78,6%, respectivamente), la visita a la enfermería (el 37,5 y el 64,2%, respectivamente) y la visita al especialista (el 12,2 y el 42,0%, respectivamente). En general, durante los 6 meses, las cohortes de pacientes con diabetes realizaron más pruebas analíticas y fondos de ojo que la cohorte control. Los pacientes de la cohorte 1 fueron los que menos acudieron de urgencia a visitar al médico de AP. Los pacientes de la cohorte 3 fueron los que más necesitaron transporte sanitario (p < 0,05), más limitaron su actividad principal (p < 0,05), y en mayor proporción necesitaron tratamiento específico (p < 0,05) (tabla 6). La angiofluoresceína y el Doppler fueron pruebas que se realizaron exclusivamente en pacientes de la cohorte 3. Con respecto a las pruebas analíticas, durante los 6 meses de seguimiento los pacientes de las cohortes 2 y 3 realizaron más análisis de glucosa en sangre, de HbA1C y perfil lipídico que las cohortes 1 y control, y los sujetos de la cohorte control fueron los que menos uso realizaron de pruebas como el fondo de ojo y el electrocardiograma, sin diferencias entre las cohortes de pacientes diabéticos.
Por otro lado, los pacientes con un control deficiente de la hemoglobina glucosilada durante el mes previo al inicio del estudio concurrieron más al médico de AP de urgencia (el 10,2 y el 2,6%, control deficiente frente a bueno, respectivamente). Durante los meses de seguimiento, los pacientes con un control deficiente de la glucemia visitaron más la consulta de enfermería y los pacientes con «buen control» necesitaron transporte sanitario en una proporción significativamente inferior (p < 0,05).
Calidad de vida relacionada con la salud
Al inicio del estudio, el 31,6% de los pacientes declaró tener problemas de movilidad; el 7,9%, de cuidado personal; el 21%, en la realización de las actividades cotidianas; el 47,4%, en dolor o malestar, y el 37,8%, en ansiedad o depresión. No se observaron, al inicio, diferencias significativas en el estado de salud valorado por la escala visual analógica (EVA) del EQ-5D ni en la tarifa obtenida del sistema descriptivo. Sin embargo, al concluir el estudio, se observaron diferencias significativas entre cohortes en el estado de salud valorado mediante la EVA del EQ-5D. Los pacientes de la cohorte 1 presentaron mejor estado de salud percibido que el resto de cohortes, con una media de 74,9 (13,2) respecto a las cohortes 2, 3 y control: 68,3 (17,1), 66,8 (17,9) y 67,9 (18,3), respectivamente. Los pacientes de la cohorte 1 presentaron un aumento relativo medio de 20,8% (79,6%) de las puntuaciones de EVA del EQ-5D entre las visitas inicial y final, incremento significativamente superior (p < 0,05) al resto de cohortes de estudio que presentaron porcentajes de cambio del 3,7% (1,9%), el 3,3% (35,1%) y el 5,3% (24,9%) en los pacientes de las cohortes 2, 3 y control, respectivamente.
Al iniciarse el estudio no se observaron diferencias estadísticamente significativas en la descripción de la calidad de vida en general (ADDQoL) entre las 4 cohortes de estudio, pero sí en la calidad de vida esperada sin diabetes (p < 0,01), y se observó que había más pacientes con diabetes (cohortes 1, 2 y 3) que consideraban que su calidad de vida sería mejor sin diabetes que los del grupo control. Asimismo, un número significativamente superior de pacientes de la cohorte 3 consideraban que su calidad de vida sería mejor sin diabetes con respecto a los pacientes de las cohortes 1 y 2. Al inicio del estudio, el 83,4% de los pacientes de la cohorte 3 declaró que tendría una mejor calidad de vida sin DM2. Los resultados fueron semejantes tras 3 y 6 meses de seguimiento.
En las visitas inicial e intermedia, los pacientes de la cohorte control presentaron una puntuación superior (< 0,01) en el ADDQoL que las cohortes de pacientes diabéticos; sin embargo, al concluir el estudio todas las cohortes presentaron puntuaciones semejantes.
No se observaron diferencias estadísticamente significativas entre los pacientes con control bueno, aceptable o deficiente de sus valores de hemoglobina glucosilada en ninguna de las áreas de salud valoradas por los pacientes al inicio del estudio. Sin embargo, las puntuaciones de la EVA resultaron significativamente diferentes según el control glucémico, y los pacientes con un control deficiente de la glucemia capilar en la visita inicial percibieron un peor estado de salud.
Un mayor porcentaje de pacientes con un control metabólico deficiente, comparados con los pacientes con control bueno o aceptable, según criterio médico (p = 0,06), valores de glucemia plasmática (p < 0,05) y hemoglobina glucosilada (p < 0,05), consideró que su calidad de vida sería mejor sin diabetes al iniciar el estudio. Asimismo, un 16,3% de los pacientes con control deficiente de los valores de hemoglobina glucosilada declaró, al concluir el estudio, que su calidad de vida actual era mala, y valoró su calidad de vida de forma significativamente peor que los pacientes con control bueno o aceptable. Por lo que respecta a la puntuación global obtenida del cuestionario ADDQoL, se observó que los pacientes con control deficiente de la glucemia refirieron, de forma estadísticamente significativa, una mayor afectación de la calidad de vida a causa de la diabetes (p < 0,05) en la visita inicial, aunque no se observaron diferencias al final del estudio.
Discusión
La DM2 es una enfermedad crónica que afecta a la salud de los españoles y el sistema sanitario en muchos aspectos. En este estudio se evaluó prospectivamente a 3 cohortes de pacientes diabéticos y un grupo control de pacientes con glucemia basal alterada.
El 13,7% de los pacientes declaró que fumaban a diario, sin que se observaran cambios tras los 6 meses de seguimiento. Esta prevalencia es semejante o muy poco más baja que la informada en población general española de igual edad20. El tabaco presenta una asociación dosis-respuesta con mortalidad general, tanto en varones como en mujeres con DM221, predice la progresión de la nefropatía diabética22 y aumenta per se la adhesión de moléculas solubles de adhesión vascular, agravando la macroangiopatía y el pie diabético23. Dado el riesgo adicional que representa el tabaquismo en la morbimortalidad de los pacientes diabéticos, podría resultar útil un programa de concienciación de la importancia de la cesación del tabaquismo entre los pacientes diabéticos.
Existen evidencias de la importancia de la actividad física para la mejoría del control glucémico y la disminución de otros factores de riesgo asociados a la diabetes24. El 60% de los pacientes estudiados realizaba actividad física ligera o nula, y no se observaron modificaciones en el porcentaje de pacientes sedentarios tras los 6 meses de seguimiento. Estudios previos muestran que el estímulo de la motivación y las técnicas cognitivas pueden ayudar a incrementar la actividad física en los pacientes con DM2, y que se asocian asimismo con mejorías significativas de la HbA1C, la presión arterial diastólica y los valores de fibrinógeno25.
Más de un 80% de los pacientes presentó un IMC mayor o igual de 25 kg/m2 y casi un 45%, obesidad. Estos datos concuerdan con otros estudios, que muestran hasta un 90% de sobrepeso en la población con DM226. Hay evidencias de que la obesidad presenta un factor de riesgo independiente de diabetes27 y que la disminución de peso se asocia con mejoría clínica y metabólica. Esto se debe a que la pérdida de grasa corporal se asocia con una disminución de la resistencia a la insulina que origina reducción de los valores de glucemia, trigliceridemia y HbA1C27. Sin embargo, el descenso de peso es más difícil entre los pacientes diabéticos28. Más aún, el tratamiento antidiabético se asocia en general con ganancia de peso. El UKPDS ha informado un aumento de peso de 5-10 kg asociado con la toma de glibenclamida11. No obstante, no todos los antidiabéticos orales originan incremento de peso; la metformina se asoció con disminución del peso corporal29. Asimismo, la combinación de nateglinida con metformina mejoró los valores de hemoglobina glucosilada y la glucemia posprandial con leve disminución del peso corporal en 11.476 pacientes con DM230. Por otro lado, algunos estudios publicados recientemente informaron una leve péntes con sobrepeso no varió en los 6 meses de seguimiento, ni en su conjunto, ni por grupo de cohorte ni por tipo de tratamiento (insulina sola o combinada o antidiabéticos orales). Sin embargo, una de las limitaciones del presente trabajo fue la ausencia de discriminación por tipo de antidiabéticos orales. Sería conveniente realizar estudios prospectivos que evaluaran los posibles efectos sobre el peso y grasa corporal de los distintos tipos de antidiabéticos orales.
Existe evidencia de la importancia del control metabólico en la prevención de la enfermedad micro y macrovascular11. El UKPDS ha mostrado que, potencialmente, por cada 1% de reducción en los valores de HbA1C, se redujo un 21% cualquier complicación asociada a la diabetes, un 21% de la mortalidad por diabetes, un 14% de infarto de miocardio y un 37% de complicaciones microvasculares, con el menor riesgo con valores de HbA1C dentro del intervalo de normalidad (< 6%)32. En nuestro estudio, sólo el 25% de los pacientes diabéticos de las cohortes 1 y 3 presentaron valores de HbA1C inferiores al 7%, proporción inferior a la observada entre los pacientes de la cohorte 2 (casi el 40%). Asimismo, presentaban control «deficiente» el 28, el 23,5 y el 37% de los pacientes de las cohortes 1, 2 y 3, respectivamente. Tras 6 meses de seguimiento, continuaban con HbA1C mayor del 8%, el 14,6, el 21,3 y el 23% de los pacientes de las cohortes 1, 2 y 3, respectivamente. Estos datos sugieren que la dosis y/o número de fármacos antidiabéticos indicados a este grupo de pacientes no ha sido suficiente para alcanzar el control metabólico.
Con respecto al metabolismo lipídico, presentaron control deficiente del cLDL un 68,8, un 55,7 y un 46,9%, de los pacientes de las cohortes 1, 2 y 3, respectivamente. Estos datos coinciden con un trabajo reciente en población diabética española que ha informado un 63% de pacientes con un control deficiente de sus lípidos plasmáticos33. La proporción de pacientes con control deficiente de los lípidos fue siempre superior en la cohorte 1 que en las cohortes 2 y 3. Esta diferencia podría explicarse por la mayor proporción de pacientes de reciente diagnóstico, sin previa indicación de dieta y/o tratamiento hipolipemiante en este grupo. Otra posible explicación podría basarse en que el peor control glucémico en los pacientes de la cohorte 1 se asoció con una mayor alteración del metabolismo lipoproteico. La media de la concentración de cLDL se redujo de 136,4 (34,1) mg/dl, al inicio, a 129,9 (30,3) mg/dl. A pesar del descenso significativo en los valores de cLDL, la media no alcanzó los objetivos propuestos por la Guías (ATP III) para pacientes diabéticos34.
Los casos de hipoglucemia fueron más frecuentes entre los pacientes de la cohorte 3, seguidos de la cohorte 2, y el error dietético y el ejercicio intenso fueron los factores favorecedores más frecuentes. Por otro lado, coincidiendo con publicaciones previas35, hubo más casos de hipoglucemia entre los pacientes que recibían insulina, seguido de los pacientes que recibían antidiabéticos orales más insulina.
Un 20% de estos pacientes presentaba alguna complicación microvascular en el momento de iniciarse el estudio. Este porcentaje fue mayor en los pacientes con más tiempo de tratamiento farmacológico (29,8%). Esto se explica probablemente por el mayor tiempo de evolución de la diabetes de estos pacientes, lo cual coincide con datos previos que indican una asociación de la microangiopatía en pacientes diabéticos con la edad de los pacientes y la duración de la diabetes36.
Nuestro estudio evidencia, además, que en una proporción importante de los pacientes con DM2, incluso en aquellos con más tiempo de evolución de la diabetes, no se explora la presencia de neuropatía (el 27,6% de los pacientes de la cohorte 1, el 14,8% de la cohorte 2 y el 13,9% de la cohorte 3), de retinopatía diabética (el 39,2, el 24,5 y el 13,6%, en las cohortes 1, 2 y 3, respectivamente) ni de neuropatía periférica (el 19,4, el 14,8 y el 10,2%, en las cohortes 1, 2 y 3 respectivamente). Los resultados del estudio UKPDS37 han demostrado claramente que la primera barrera de defensa contra las complicaciones microvasculares es el estricto control glucémico. Si esta barrera es superada, el diagnóstico precoz de las alteraciones es un paso de primordial importancia para evitar las complicaciones más tardías que conducirán a la ceguera y a la insuficiencia renal. La neuropatía constituye también un problema mayor: un 60-70% de las personas con diabetes la presentan y más de la mitad de las amputaciones de las piernas ocurren en personas diabéticas38. El alto porcentaje de pacientes no explorados alerta sobre la necesidad de concienciar en la prevención de las complicaciones crónicas.
Entre los pacientes en los que se evaluó la presencia de cada una de las complicaciones microvasculares en el momento de la inclusión, el 13% presentaba nefropatía; el 10,7%, retinopatía diabética, y el 7,1%, neuropatía periférica sintomática; el 10,5% de los pacientes presentaba cardiopatía isquémica; el 2,5%, alguna manifestación de pie diabético; el 3,3%, vasculopatía cerebral, y el 4,5%, claudicación intermitente de extremidades inferiores. Excepto para la nefropatía, la mayoría de las complicaciones vasculares mostraron menor prevalencia que en otros estudios. Morgan et al36 informaron, en una muestra de 10.709 pacientes del Reino Unido, la siguiente prevalencia de complicaciones micro y macrovasculares: 25,2% de enfermedad coronaria, 9,6% de enfermedad cerebrovascular, 18,1% de pie diabético, 16,5% de retinopatía y 2% de nefropatía. Una posible explicación a estas diferencias es la alta proporción de pacientes de reciente diagnóstico en nuestro estudio.
El conocimiento de los costes asociados a la diabetes se ha incrementado significativamente en los últimos años. Datos recientes han evidenciado que los gastos en salud son 5 veces superiores entre los pacientes diabéticos. El estudio CODE 2 en Europa mostró que el coste principal está asociado a la hospitalización, lo que representa alrededor del 55% del total, la medicación (insulina y antidiabéticos orales) representan sólo el 7% del total39. En el presente estudio, los recursos más utilizados fueron, al inicio y durante los 6 meses de seguimiento, la visita al médico de AP, seguida de la visita a la enfermería y al médico especialista.
Cuatro trabajos han estudiado los costes relacionados con la diabetes39: el DCCT (Estudio del control y complicaciones de la diabetes), el estudio de Estocolmo, el UKPDS y el estudio Kummamoto. Los 4 han investigado los efectos del menor control de la glucemia sobre las complicaciones crónicas. El UKPDS, en pacientes con DM2, mostró que resulta coste-efectivo invertir más recursos en el tratamiento temprano de la diabetes y que es conveniente el tratamiento intensivo de la diabetes, aun a mayor coste inicial. En el presente estudio, los pacientes recién diagnosticados (cohorte 1) fueron a quienes se practicó más bioquímicas simples, análisis de HbA1C, lipidogramas, microalbuminurias y fondos de ojo durante el mes previo a la inclusión en el estudio. Estos datos coinciden con los de Brown et al40, que señalan que los incrementos en los costes en salud en los pacientes con DM2 son evidentes tras el diagnóstico, y ya en el primer año son 2,1 veces superiores que los costes en salud de los pacientes sin diabetes.
Los pacientes con un control deficiente de la glucemia percibieron un peor estado de salud, mediante las puntuaciones de la escala visual analógica (EVA) del sistema descriptivo EQ5. Por otro lado, los pacientes de la cohorte 1 presentaron mayor aumento de las puntuaciones de la EVA entre las visitas inicial y final que las restantes cohortes. Esto coincide con una mejoría significativa en el control metabólico en esta cohorte, lo que no se observó en las demás cohortes de estudio. Con respecto a la calidad de vida valorada por el ADDQoL, más pacientes diabéticos que controles consideraron que su calidad de vida sería mejor sin diabetes y, de igual modo, más pacientes de la cohorte 3 que todos los otros grupos de pacientes con DM2. El 83,4% de los pacientes de la cohorte 3 declaró que tendría una mejor calidad de vida sin DM2. En las puntuaciones del ADDQoL se observó una puntuación significativamente superior en la cohorte control que en las cohortes de pacientes, lo que indica un menor grado de afectación de la diabetes. Además, un mayor número de pacientes con un control metabólico deficiente consideró que su calidad de vida sería mejor sin diabetes al inicio del estudio, y valoró su calidad de vida de forma significativamente peor que los pacientes con control bueno o aceptable. Todos estos datos coinciden con trabajos previos, que describen peor calidad de vida asociada a descontrol metabólico en pacientes con DM241 y con lo informado por Rubin et al42, quienes revisaron recientemente los trabajos publicados referentes a calidad de vida en pacientes diabéticos con las siguientes conclusiones: a) la calidad de vida fue peor entre los individuos diabéticos que en pacientes con otras enfermedades crónicas; b) el tratamiento intensivo no empeoró la calidad de vida y un mejor control glucémico se asoció a mejor calidad de vida, y c) las complicaciones de la diabetes fueron la causa más determinante de la calidad de vida.
La DM2 es un problema sanitario tanto a nivel individual como para la salud pública en España, dado que incrementa los costes y afecta a la calidad de vida de los pacientes. Los pacientes de reciente diagnóstico mejoran significativamente su control metabólico (glucémico y lipídico) así como la CVRS. Sin embargo, un número importante de pacientes (de todos los grupos, aunque más marcado en los de más larga evolución) no alcanzan los objetivos de control glucémico y lipídico que se asocian con menor riesgo de complicaciones micro y macrovasculares. Los pacientes de más larga evolución de su diabetes son los que presentan mayor número de complicaciones y quienes hacen más uso de los recursos sanitarios. Para reducir los costes asociados a las complicaciones será necesario trabajar en el reconocimiento de los grupos más vulnerables y el diagnóstico temprano así como en el tratamiento intensificado inicial. Ello conducirá a obtener un mejor estado de salud y calidad de vida de la población diabética, lo que finalmente favorecerá el mejor uso de los recursos para los presupuestos nacionales de salud.