La osteoporosis (OP) es un trastorno del esqueleto que afecta a la resistencia del hueso y predispone a la fractura1. Las fracturas osteoporóticas representan un importante problema de salud por su morbimortalidad y coste económico y social. La densidad mineral ósea (DMO) es el parámetro establecido para diagnosticar la OP2 y su disminución es el mejor predictor del riesgo de fractura en la mujer posmenopáusica3. Sin embargo, su sensibilidad es pequeña y se requiere un intervalo prolongado (1-2 años) entre medidas sucesivas para valorar la pérdida ósea4. Además, se ha puesto de manifiesto la importancia de otros factores de riesgo de fractura independientes de la DMO, como la edad, la historia personal o familiar de fractura, la velocidad de pérdida ósea y turnover o recambio óseo alto5.
Algunos productos generados durante la formación y la resorción óseas se conocen como marcadores bioquímicos del recambio o remodelado óseo (MRO). En la menopausia, hay un aumento del recambio óseo y, por tanto, de los valores de los MRO, del orden del 35-50% en los marcadores de formación y de un 80-100% en los de resorción, dependiendo del marcador estudiado6.
Aunque la aplicación actual más extendida de los MRO es en el seguimiento de la respuesta terapéutica de la OP, también se ha estudiado su utilidad para la predicción de la pérdida ósea y predicción del riesgo de fractura, así como la correlación de los MRO con la DMO. Los resultados han sido dispares, en función del tipo de estudio (longitudinal o transversal), la población (mujeres en la posmenopausia reciente o tardía, edad senil, con o sin tratamiento), el marcador utilizado, y el área esquelética analizada (antebrazo, fémur, columna lumbar). Respecto a la pérdida ósea, la elevación de los MRO tiene un valor predictivo positivo, aunque bajo7-11.
Resulta de gran interés la relación entre recambio óseo y pérdida ósea, si consideramos que la disponibilidad de densitómetros es aún escasa en numerosos lugares, mientras que los MRO están cada vez más al alcance del clínico. La comprobación de que pueden ser un subrogado de la pérdida ósea permitiría identificar con más facilidad a las mujeres perdedoras rápidas de masa ósea. No hemos encontrado referencia a estudios longitudinales sobre MRO y pérdida ósea realizados en España. Los resultados observados en otras zonas geográficas no deben extrapolarse a la población española, ya que hay diferencias regionales de prevalencia de OP y fracturas12.
Dada la relación inversa entre MRO y DMO, hay trabajos que han estudiado la utilidad de los marcadores en la identificación de mujeres con OP, con resultados dispares. Mientras que algunos estudios muestran valores de MRO superiores en las mujeres con OP frente a los controles, otros encuentran un solapamiento entre ambos grupos13,14.
Considerando estos datos, hemos diseñado el presente estudio con el objetivo principal de evaluar la utilidad de los MRO para predecir la pérdida de masa ósea en las mujeres posmenopáusicas recientes y, por tanto, para la identificación de mujeres perdedoras rápidas de hueso. Otros objetivos han sido estudiar la correlación entre los MRO y la DMO, así como su capacidad para diferenciar entre mujeres con OP, osteopenia (Op) y DMO normal (N), en los primeros años tras la menopausia. Para realizarlo, se seleccionó una cohorte de mujeres de Albacete (España).
Sujetos y método
Se trata de un estudio longitudinal, aleatorizado y observacional, realizado en el área sanitaria de Albacete. Los individuos de estudio han sido mujeres de 50-55 años, con menopausia natural de 6-36 meses de evolución. Se excluyó a aquellas con tratamiento hormonal sustitutivo u otra medicación con efecto en el metabolismo óseo. Se excluyó también a las mujeres con alguna enfermedad metabólica ósea diferente de la OP, diabetes mellitus u otra enfermedad crónica (insuficiencia renal crónica, enfermedades reumatológicas, digestivas, hepatopatías, neoplasias, cardiopatías, neumopatías, etc.). El comité ético de investigación del Complejo Hospitalario Universitario de Albacete aprobó el protocolo.
Selección de la muestra
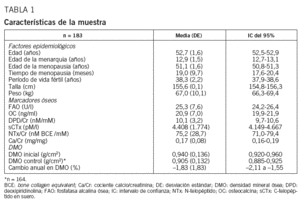
Seleccionamos al azar a 1.941 mujeres entre 50 y 55 años mediante la tarjeta sanitaria, de la que dispone prácticamente el 100% de la población del área. Se les envió una encuesta, a la cual respondieron 1.478 (76%, intervalo de confianza [IC] del 95%, 74-78%). Tras aplicar los criterios de inclusión y exclusión, obtuvimos una muestra final de 183 mujeres con una media (desviación estándar [DE]) de edad de 52,7 (1,6) años (IC del 95%, 52,4-52,9 años). En todas se recogió el consentimiento informado, se realizó una encuesta alimentaria, una entrevista clínica con recogida de antecedentes que incluía fracturas traumáticas y por fragilidad, medición de peso y talla, y se obtuvo una muestra de sangre y orina.
Determinación de MRO
Hemos determinado fosfatasa alcalina ósea (FAO) y osteocalcina intacta (OC) como marcadores de formación, y calcio/creatinina (Ca/Cr), deoxipiridinolina (DPD), telopéptido carboxiterminal de la cadena alfa 1 del colágeno tipo I o b-Crosslaps (sCTx), y telopéptidos aminoterminales del colágeno tipo I unidos por puentes de piridinolina (NTx) como marcadores de resorción. Realizamos análisis en suero y en la segunda orina de la mañana. Las muestras se obtuvieron entre las 8.00 y las 10.00, tras ayuno de 12 h. A continuación, describimos la metodología y los coeficientes de variación (CV) de cada prueba. En suero hemos analizado FAO (Alkphase-B, Metra; CV intraanálisis: 3,9-5,8%; CV interanálisis: 5-7,6%); OC (Human Osteocalcin-Easia; CV intraanálisis: 1,9-2,5%; CV interanálisis: 6-9,2%), y sCTx (SerumCrossLaps, Osteometer; CV intraanálisis: 4,9-5,3%; CV interanálisis: 5,4-8,1%). En la segunda orina de la mañana, determinamos Ca/Cr (O-cresoftaleina-complexona), DPD (ACS180, sistema automatizado de quimioluminiscencia; CV intraanálisis: 4,0-10,0%; CV interanálisis: 1,1-3,7%), y NTx (Osteomark, Johnson & Johnson; CV intraanálisis: 3-5%; CV interanálisis: 5-8%). Tanto los estándares como las muestras se analizaron por duplicado.
Densitometría ósea
Se realizó una densitometría ósea (absorciometría de rayos X de doble energía [DXA]) anteroposterior en L2-L4 (inicial) y se repitió a los 2 años (control), en un equipo Norland XR 26 Mark. El CV evaluado mediante la medición diaria del fantoma antropométrico de columna lumbar ha sido del 0,64% para la DXA inicial y del 0,83% para la DXA de control. Hemos calculado la densidad mineral volumétrica (DMV) o DMO aparente (DMOA) a partir de la fórmula: DMOA = DMO / _____AOV (donde AOV corresponde al área ósea vertebral)15.
De acuerdo a la medición inicial, se agrupó a las mujeres en osteoporóticas (OP), osteopénicas (Op) o con DMO normal (N) según los criterios densitométricos de la OMS (OP cuando la DMO expresada en T-score era < 2,5; Op cuando el T-score estaba entre < 1 y $ 2,5 y N cuando T-score $ 1)2. Se definió como mujer perdedora rápida aquella con una pérdida ósea anual en la densitometría $ 3%7. Se definió como recambio óseo alto el correspondiente a las mujeres con valores de marcadores dentro del cuartil superior6.
Análisis estadístico
Las variables cuantitativas se describen por la media (M), DE e IC del 95%. Las asociaciones entre variables se ha estudiado mediante el coeficiente correlación de Pearson (r), ajustado para la superficie corporal. Hemos calculado la superficie corporal mediante la fórmula: superficie corporal (m2) = _____Talla (cm) 3 peso / 60. La comparación entre grupos se ha hecho mediante la t de Student y el análisis de la variancia (ANOVA). Los cálculos de sensibilidad (Se), especificidad (Sp), valor predictivo positivo (VPP) y valor predictivo negativo (VPN) se han efectuado mediante la prueba de la x2 y mediante curvas ROC (Receiver Operating Characteristic).
Resultados
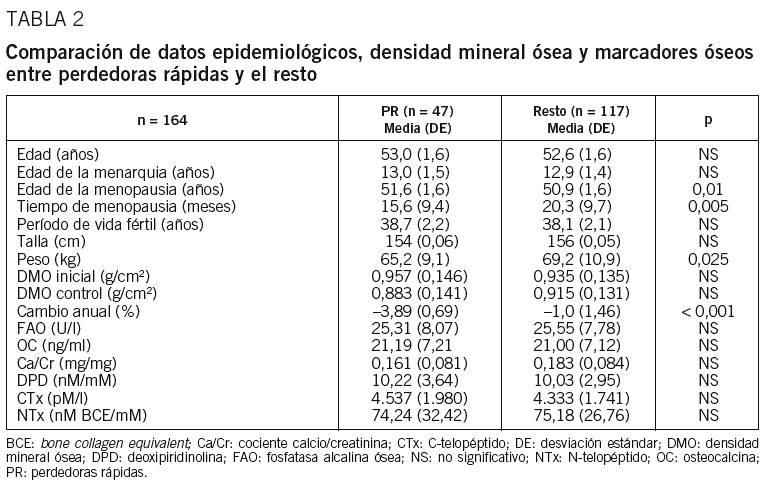
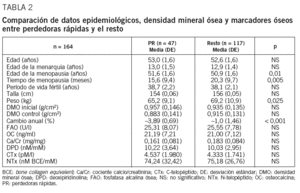
De las 183 mujeres que se incluyó en el estudio, 164 (90%) completaron todo el protocolo. En la tabla 1 se describen los datos epidemiológicos, valores de DMO, pérdida ósea y MRO de la cohorte de mujeres de Albacete. Cuarenta y siete mujeres (28,7%; IC del 95%, 22,0-36,3%) tuvieron una pérdida ósea media $ 3% y, por tanto, se consideraron perdedoras rápidas. Al comparar el conjunto de las perdedoras rápidas con el resto, se observa diferencia en el peso, la edad de la menopausia y el tiempo de menopausia (tabla 2).
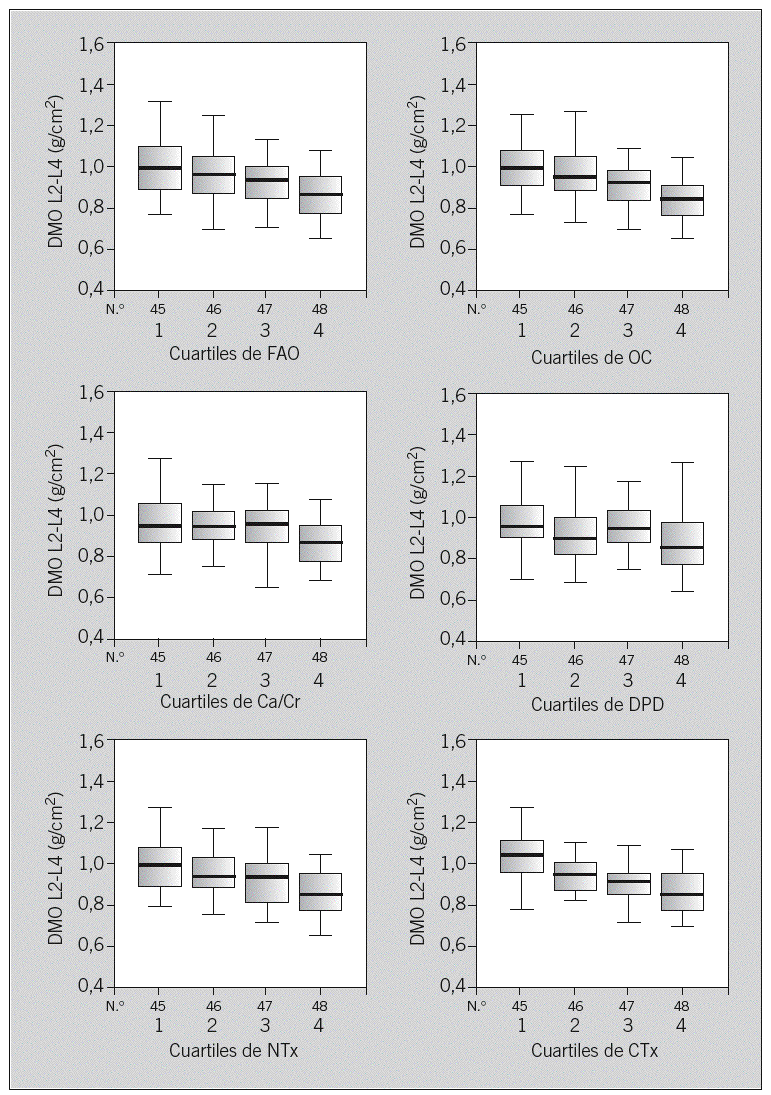
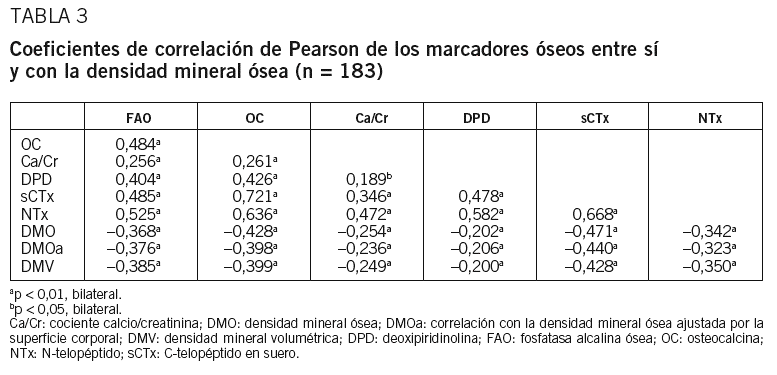
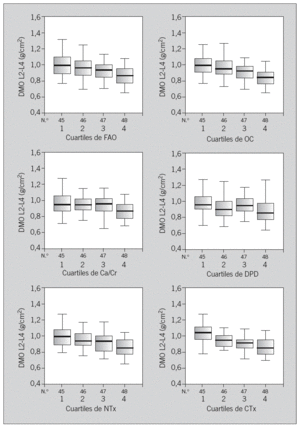
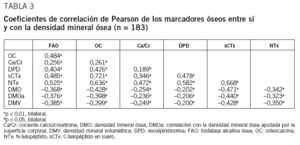
Encontramos correlación de todos los MRO entre sí, así como entre éstos y la DMO, principalmente con OC y sCTx (tabla 3). Esta asociación se mantiene tras ajustar por superficie corporal, y también hay correlación entre MRO y DMV. Los coeficientes de correlación para sCTx y OC son ligeramente más bajos que en el análisis de los datos brutos de MRO y DMO, pero son similares para el resto de los MRO (tabla 3). Agrupamos a las mujeres de nuestra muestra en cuartiles, según los valores de cada MRO, y se apreciaron diferencias en su DMO (p < 0,05). Las diferencias entre los cuartiles superior e inferior oscilan entre un 8,04% para Ca/Cr y un 16,3% para sCTX. Además, observamos diferencias significativas entre los cuartiles intermedios de OC y sCTx (fig. 1).
Fig.1. Diagramas de cajas: comparacion de la densidad ósea (DMO) entre los cuartiles de marcadores. Diferencia entre los distintos cuartiles (Q) y grado de significación (ap < 0,05. bp < 0,01. cp < 0,01):
Ca/Cr (CaU): Q1-Q4a; CTx (C-telopéptido): Q1-Q2b, Q1-Q3c, Q1-Q4c, Q2-Q4a; DPD (deoxipiridinolina): Q1-Q4b, Q3-Q4a; FAO (Fosfatasa alcalina ósea): Q1-Q3a, Q1-Q4c, Q2-Q4a; NTx (N-telopéptido): Q1-Q4c, Q2-Q4b; OC (osteocalcina): Q1-Q3a, Q1-Q4c, Q2-Q4c, Q3-Q4a.
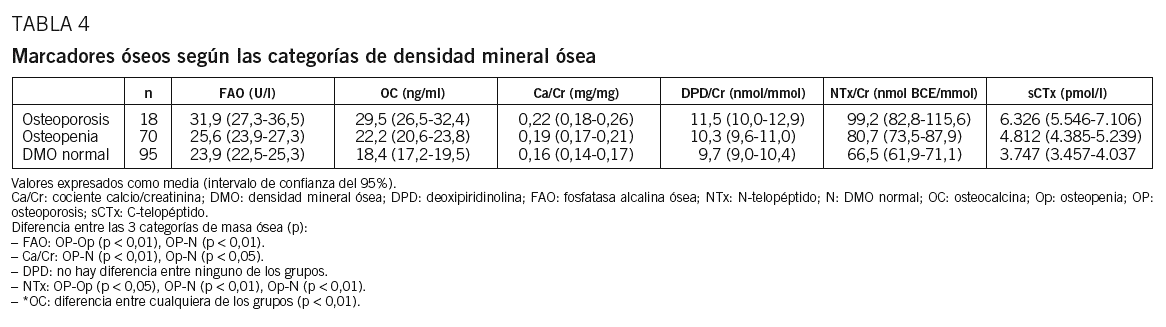
Analizamos la capacidad de los MRO para diferenciar entre OP, Op y N. Hay diferencias significativas (ANOVA, p < 0,05) en todos los marcadores, excepto en DPD, entre el grupo de mujeres con OP y el grupo N. También son significativas las diferencias entre las mujeres de los grupos Op y N para todos los MRO, excepto FAO y DPD. Por tanto, los MRO diferencian entre mujeres con OP, Op y DMO normal, con las excepciones señaladas (tabla 4).
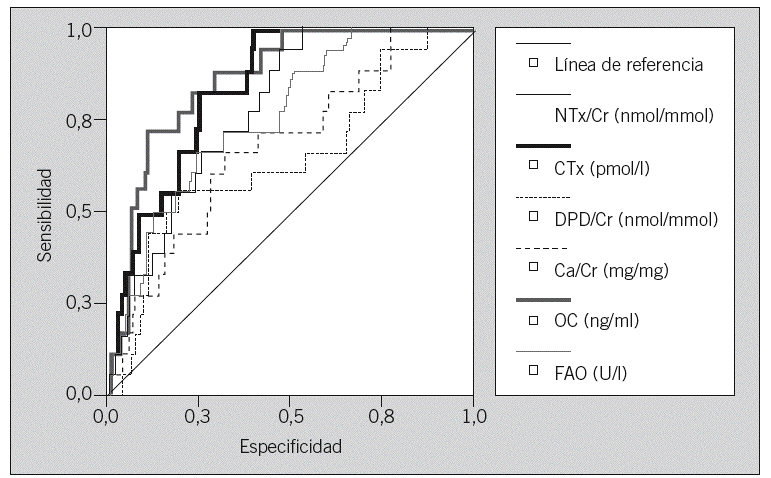
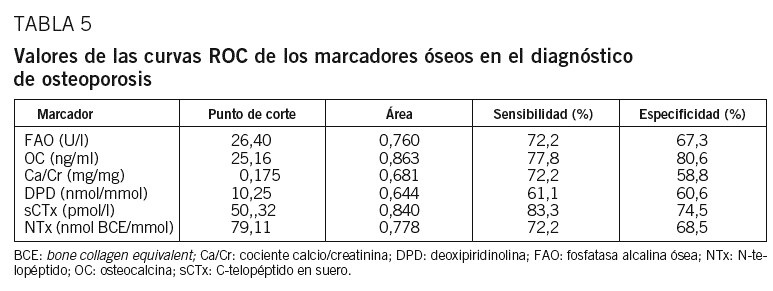
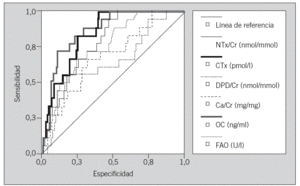
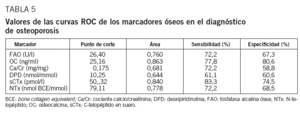
Las curvas ROC muestran las proporciones de verdaderos positivos (sensibilidad) y de falsos positivos (1-especificidad) de los marcadores en el diagnóstico de OP. Los marcadores con mayor área bajo la curva son OC (Se = 77,8%, Sp = 80,6%) y sCTx (Se = 83,3%, Sp = 74,5%) (tabla 5 y fig. 2).
Fig. 2. Curvas ROC que muestran las proporciones de verdaderos positivos (sensibilidad) y de falsos positivos (1-especificidad) de los marcadores en el diagnóstico de osteoporosis. En trazo grueso figuran las curvas de OC (osteocalcina) y CTx (C-telopéptido). En trazo fino están representadas las curvas de los restantes marcadores.
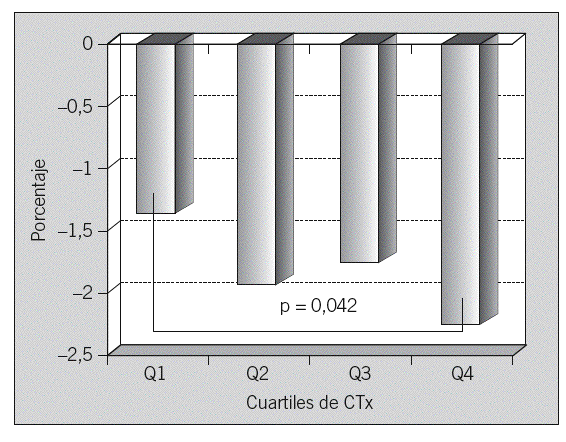
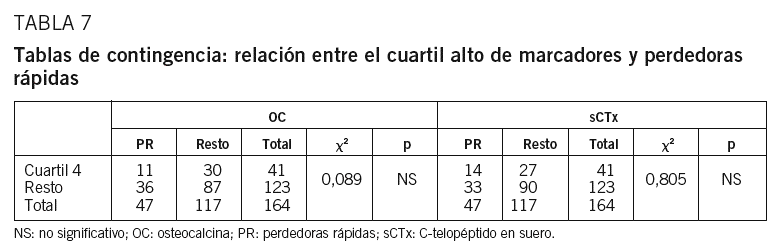
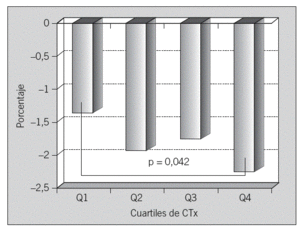
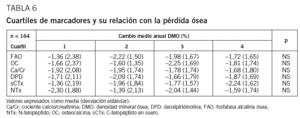
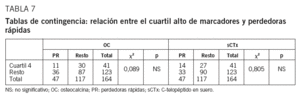
No se observa correlación entre los valores de MRO y la pérdida ósea a 2 años. Tampoco encontramos diferencia en la pérdida ósea entre cuartiles de MRO en el test de comparaciones múltiples (t de Student) (tabla 6). En la comparación directa del cambio medio anual en la DMO entre los cuartiles 1 y 4 de cada marcador sí hay diferencia significativa para sCTx (p = 0,042) (fig. 3). No encontramos asociación entre recambio óseo alto, expresado como el cuartil más alto de OC y sCTx, y las perdedoras rápidas; no hay diferencia significativa en la distribución de grupos en el test de la x2 (tabla 7). Los datos sobre sensibilidad y especificidad se describen a continuación. OC: Se = 23,4%; Sp = 74,4%; VPP = 26,86%; VPN = 70,7%. SCTx: Se = 29,8%; Sp = 76,9%; VPP = 34,1%; VPN = 73,2%.
Fig. 3. Diferencia en el cambio medio anual en la DMO entre los cuartiles (Q) 1y 4 de CTx (C-telopéptido).
Discusión
Hemos valorado la relación entre los MRO y la DMO en los primeros años de menopausia y su capacidad para identificar a las mujeres perdedoras rápidas de hueso a los 2 años de seguimiento. Hemos realizado un estudio prospectivo y aleatorizado en una cohorte de 183 mujeres de Albacete (España), con un período de posmenopausia inferior a 3 años. La persistencia fue elevada (tasa de abandonos, 10%).
Todos los MRO valorados se correlacionan de forma inversa con la DMO en columna lumbar. Para evitar el posible efecto del tamaño esquelético y corporal, hemos ajustado los valores de MRO urinarios por la superficie corporal16. Igualmente, hemos calculado la DMV para eludir los mismos efectos en la DMO15. Se mantiene la asociación entre MRO y DMO tras ajustar por superficie corporal y también entre MRO y densidad volumétrica calculada.
Aunque el NTx es el MRO más estudiado, los resultados de su relación con la DMO son variables11,17-22. De los MRO utilizados en nuestro estudio, OC y sCTx son los que muestran un grado mayor de asociación con la DMO, resultado similar al observado en un estudio con mujeres posmenopáusicas danesas, donde se encontró relación no sólo con la DMO, sino también con las fracturas vertebrales23. En mujeres con un período de posmenopausia superior a 20 años, se mantiene esta asociación, aunque más débil6,17. En mujeres con edades superiores, la correlación entre la DMO de columna disminuye y se conserva la de antebrazo y cadera. Estas diferencias probablemente se deben a un patrón de pérdida ósea variable durante la posmenopausia, con pérdida más acusada en la columna lumbar, donde predomina el hueso trabecular, en las etapas iniciales18.
Con la excepción de DPD, los MRO estudiados permiten diferenciar entre los grupos OP, Op y N. El mayor valor predictivo se alcanza con OC y sCTx. Otros autores también han encontrado diferencias entre mujeres con masa ósea baja y normal en MRO, como FAO, OC, propéptido aminoterminal del procolágeno de tipo I (PINP), piridinolina, DPD, CTx y NTx24-27. A pesar de ello, no se consideran útiles para el diagnóstico, debido al solapamiento de sus valores entre mujeres con y sin OP en numerosos estudios que, por otra parte, son heterogéneos en su diseño y realizados en poblaciones con grandes diferencias etarias28. No obstante, pueden contribuir con éxito a la selección de mujeres con masa ósea baja, en las que sería rentable la práctica de una densitometría y utilizar la información de ambas exploraciones para la determinación del riesgo de fractura individual. Así se contribuiría a la estrategia de búsqueda de casos recomendada por las agencias y guías de práctica clínica29,30.
La utilidad para identificar a las mujeres con OP se ha calculado mediante curvas ROC. Los marcadores OC y sCTx muestran el valor predictivo mayor para el diagnóstico de OP, con una sensibilidad del 78 y el 83%, y una especificidad del 81 y el 75%, respectivamente. Estamos de acuerdo con otros autores en considerar OC y sCTx como 2 de los mejores MRO en la evaluación de la OP posmenopáusica31; también otros MRO no incluidos en nuestro estudio han mostrado buenos resultados, como PINP y fosfatasa ácida resistente al tartrato. Nuestros resultados no coinciden con los de otros estudios que encuentran sensibilidad y especificidad elevadas para los restantes MRO, diferencias que pueden atribuirse a la distinta técnica empleada13,20.
Especial mención merecen los resultados obtenidos con el índice Ca/Cr, un MRO considerado poco específico. Este índice permite identificar a las mujeres con masa ósea baja, aunque con sensibilidad y especificidad débiles. Ya era conocida la elevación de la calciuria en mujeres con OP13,32, aunque es un parámetro influido por la dieta, especialmente cuando es pobre en calcio33.
El objetivo principal de nuestro trabajo era evaluar la capacidad de los MRO para predecir la pérdida ósea en columna lumbar y, por tanto, para identificar a las mujeres perdedoras rápidas, es decir, aquellas con una pérdida ósea igual o superior al 3% anual. Solamente sCTx ha mostrado valor predictivo para la pérdida ósea, con diferencia estadísticamente significativa entre los cuartiles superior e inferior del marcador. Su sensibilidad es pequeña (30%), si bien su especificidad es más elevada (65-75%). Otros resultados conocidos han sido muy variables, ya que muestran una buena correlación entre elevación de MRO y pérdida ósea en antebrazo34, aunque no son tan consistentes cuando se mide la pérdida ósea en otros lugares. En la columna lumbar la mejor asociación aparece entre los 5 y 10 años tras la menopausia35,36. En un reciente estudio prospectivo realizado con la cohorte JPOS (Japanese Population-based Osteoporosis) se encuentra asociación entre los marcadores y la pérdida ósea en columna lumbar en las mujeres perimenopáusicas, pero no en las posmenopáusicas, tras un período de seguimiento de 6 años37. Estas diferencias probablemente se deban a que en la mujer perimenopáusica y en los primeros años de menopausia la pérdida ósea es superior a la que ocurre con posterioridad38. Los cambios degenerativos en la columna lumbar, frecuentes en mujeres de más edad, son fuente de un grado mayor de error de exactitud y de precisión de la DMO.
Nuestro estudio tiene algunas limitaciones. Una de ellas es el tamaño de la muestra, ya que en un grupo más numeroso podría mejorarse el resultado del poder predictivo. Sin embargo, la muestra ha sido cuidadosamente seleccionada y es muy homogénea, lo que permite extraer conclusiones para las mujeres mayores de 48 años con menopausia natural en los primeros 3 años.
Otra debilidad es el seguimiento limitado a 2 años. Un período más largo y con un número mayor de mediciones de la DMO seguramente hubiera proporcionado información más precisa sobre la pérdida ósea posmenopáusica. Pero, teniendo en cuenta que esta pérdida está cercana al 2% anual en la población estudiada, y que el coeficiente de variación de la DXA en columna lumbar es del 1-2%, 2 años es un intervalo suficiente para considerar válido el cambio en la DMO. En ese sentido, hemos utilizado el período recomendado por numerosas guías de práctica clínica para el seguimiento de las mujeres. Por último, hay que señalar que el riesgo de fractura en esta población es muy pequeño, por lo que el análisis de la prevalencia de fracturas y su relación con los MRO no han sido un objetivo de este estudio.
En resumen, la medición de los MRO en la mujer sana en los primeros 3 años de la menopausia puede ser útil para detectar situaciones de masa ósea baja (OP y Op). Además, algunos MRO de resorción, como sCTx, son el reflejo de una elevación del recambio óseo asociado a la pérdida acelerada de hueso que acompaña a la menopausia. Aunque es preciso seguir buscando nuevos MRO que midan mejor el recambio óseo, algunos de los actuales, especialmente OC y sCTx, pueden ayudar a seleccionar a mujeres con masa ósea baja y en el caso de sCTx pérdida ósea acelerada. Ello permitiría incrementar el rendimiento de la densitometría ósea, a partir de la información conjunta de ambas exploraciones en el estudio de la OP en la mujer posmenopáusica reciente y aplicar intervenciones preventivas.
Agradecimientos
Los autores desean expresar su agradecimiento a la Clínica de Diagnóstico por Imagen Mansilla (Albacete) por el apoyo al estudio y las facilidades para la realización de las densitometrías.