El desarrollo de los nuevos agentes para el tratamiento del cáncer renal metastásico en la última década ha mejorado la calidad de vida y supervivencia de estos pacientes. Las nuevas terapias dianas (TKI), los inhibidores de los puntos de control inmunológicos (ICI) y las nuevas combinaciones de dichas moléculas, sumando sinergias, han cambiado las posibilidades de los tratamientos de primera línea. La mejor comprensión de la biología de cada tumor y su microambiente nos permitirán seleccionar a los pacientes que se beneficien de los distintos tratamientos. Los avances en la genética y la caracterización molecular han aportado un valor pronóstico importante, pero necesitamos biomarcadores que nos permitan individualizar los tratamientos y desarrollar nuevas vías terapéuticas.
The development in the last decade of new agents for the treatment of Metastatic Kidney Cancer has improved the quality of life and the survival of these patients. New target therapies (TKI), Immune-Checkpoint Inhibitors (ICI) and new combinations of these molecules, in addition to synergies, have changed the possibilities of first-line treatments. A better understanding of the biology of each tumor and its microenvironment, will allow us to select patients who benefit from different treatments. Genetic advances and molecular characterization have provided an important prognostic value; nonetheless, we need biomarkers which enable us to individualize treatments and develop new therapeutic lines.
El cáncer de células renales (CCR) es el tercer cáncer genitourinario más frecuente, encontrando más de 403.000 nuevos casos diagnosticados cada año (2,2% de todos los tumores), más de 175.000 muertes anuales (1,8% de la mortalidad por cáncer), con un incremento de la incidencia1,2 siendo más frecuente en los hombres (3:1). En España, en 2015, se estimó una incidencia de 3.720 casos, el décimo tumor sólido más frecuente2. El cáncer renal es una entidad muy heterogénea, con distintas clasificaciones según las características histológicas, moleculares, genómicas y sindrómicas. El más frecuente es el cáncer de células claras renales (aproximadamente el 80%).
Actualmente se diagnostican más casos y en estadios más tempranos por el aumento de las pruebas de imagen (sobre todo la ecografía), en muchas ocasiones como hallazgo casual. Pueden predisponer las enfermedades renales crónicas, la hipertensión mal controlada, el tabaco, y la obesidad. Aunque esta última Índice Masa Corporal (IMC) se asocia con el aumento de la supervivencia en los pacientes metastásicos, por influencia en las rutas metabólicas y los microambientes tumorales, en las que interactúan las nuevas terapias3,4.
Hasta una cuarta parte de los pacientes con cáncer renal localizado presentarán recidiva tras el tratamiento quirúrgico. Un tercio de los pacientes presentan metástasis en el momento del diagnóstico.
El desarrollo de nuevos fármacos, antiangiogénicos, dirigidos a la ruta del factor de crecimiento del endotelio vascular (VEFG), inhibidores de la tirosincinasa (TKI), inhibidores de la ruta de la diana de la rapamicina en las células de mamífero (m-TOR), y los inhibidores de los puntos de control inmunológicos (Immune-Checkpoint Inhibitors, ICI), junto al esfuerzo por comprender las diferencias biológicas entre cada subtipo de enfermedad, buscando biomarcadores moleculares y genéticos involucrados en la progresión de la enfermedad, nos permitirán seleccionar tratamientos adecuados para cada paciente.
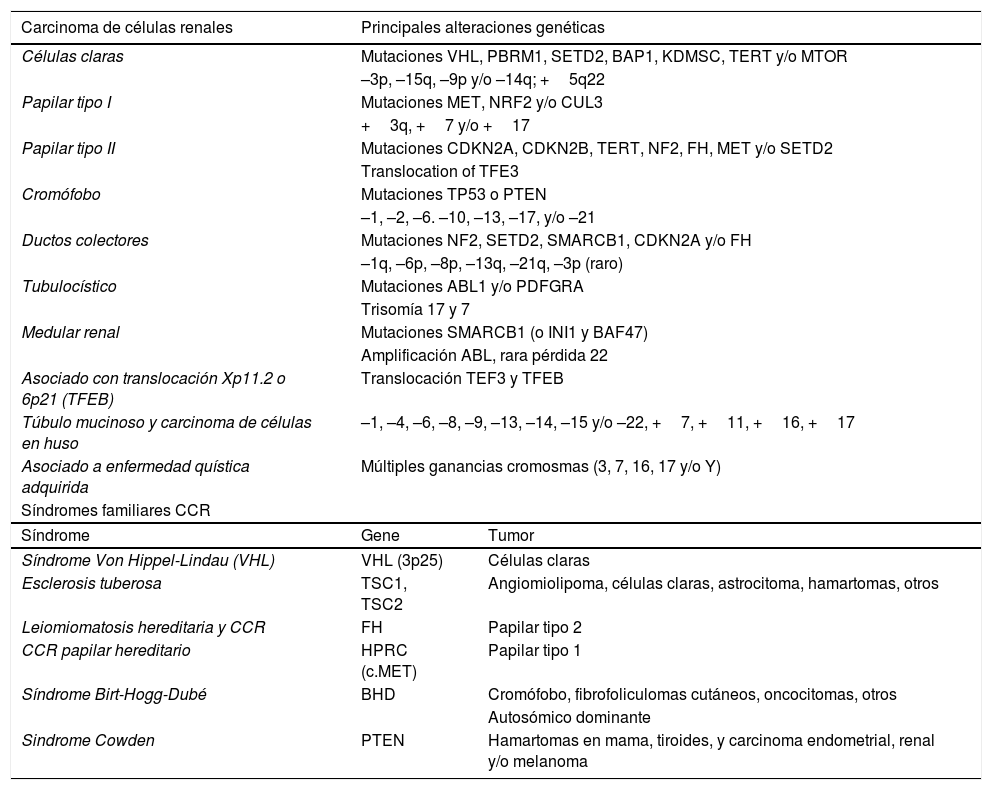
PatogénesisEl CCR comprende un grupo heterogéneo de tumores que pueden aparecer de forma esporádica o dentro de síndromes, y que presentan una serie de características genómicas, histológicas y clínicas particulares (tabla 1).
Principales alteraciones genéticas en los tumores renales.
| Carcinoma de células renales | Principales alteraciones genéticas | |
|---|---|---|
| Células claras | Mutaciones VHL, PBRM1, SETD2, BAP1, KDMSC, TERT y/o MTOR | |
| –3p, –15q, –9p y/o –14q; +5q22 | ||
| Papilar tipo I | Mutaciones MET, NRF2 y/o CUL3 | |
| +3q, +7 y/o +17 | ||
| Papilar tipo II | Mutaciones CDKN2A, CDKN2B, TERT, NF2, FH, MET y/o SETD2 | |
| Translocation of TFE3 | ||
| Cromófobo | Mutaciones TP53 o PTEN | |
| –1, –2, –6. –10, –13, –17, y/o –21 | ||
| Ductos colectores | Mutaciones NF2, SETD2, SMARCB1, CDKN2A y/o FH | |
| –1q, –6p, –8p, –13q, –21q, –3p (raro) | ||
| Tubulocístico | Mutaciones ABL1 y/o PDFGRA | |
| Trisomía 17 y 7 | ||
| Medular renal | Mutaciones SMARCB1 (o INI1 y BAF47) | |
| Amplificación ABL, rara pérdida 22 | ||
| Asociado con translocación Xp11.2 o 6p21 (TFEB) | Translocación TEF3 y TFEB | |
| Túbulo mucinoso y carcinoma de células en huso | –1, –4, –6, –8, –9, –13, –14, –15 y/o –22, +7, +11, +16, +17 | |
| Asociado a enfermedad quística adquirida | Múltiples ganancias cromosmas (3, 7, 16, 17 y/o Y) | |
| Síndromes familiares CCR | ||
| Síndrome | Gene | Tumor |
| Síndrome Von Hippel-Lindau (VHL) | VHL (3p25) | Células claras |
| Esclerosis tuberosa | TSC1, TSC2 | Angiomiolipoma, células claras, astrocitoma, hamartomas, otros |
| Leiomiomatosis hereditaria y CCR | FH | Papilar tipo 2 |
| CCR papilar hereditario | HPRC (c.MET) | Papilar tipo 1 |
| Síndrome Birt-Hogg-Dubé | BHD | Cromófobo, fibrofoliculomas cutáneos, oncocitomas, otros |
| Autosómico dominante | ||
| Sindrome Cowden | PTEN | Hamartomas en mama, tiroides, y carcinoma endometrial, renal y/o melanoma |
El conocimiento de la genética tan heterogénea del CCR, con muchas posibles mutaciones, ha permitido caracterizar algunos de estos subtipos de tumores. Así, en más del 90% de los CCR de células claras esporádicos presentan pérdida del cromosoma 3p, típicamente con ganancia del 5q (> 67%) y pérdida de 15q (45%). El 54% presenta la mutación del gen Von Hippel-Lindau (VHL)5. El CCR papilar tipo I presenta mutaciones MET, y el CCR cromófobo mutaciones en PTEN y p53.
La proteína VHL produce la degradación proteolítica del factor inductor de hipoxia 1α (HIF1α) y HIF2α, que son factores de transcripción que modulan las rutas involucradas en la angiogénesis, la progresión del ciclo celular y el metabolismo3. En el estudio TRACERx renal, de rastreo de la evolución del crecimiento del tumor primario y las rutas hacia la metástasis, refieren que los tumores con alta inestabilidad genética y mucha heterogeneidad intratumoral, con mutaciones PBRM1, son frecuentemente seguidos de la activación clonal de las mutaciones secundarias PI3KCA y SETD2, de forma secuencial. La pérdida de los cromosomas 9p y 14q ocurre en estadios tardíos, y conduce al desarrollo de la metástasis, siendo un marcador de peor supervivencia global. En los tumores con menos heterogeneidad intratumoral pero de alta inestabilidad genómica, las mutaciones SETD2 y BAP1 son sucesos tempranos asociados con tumores muy agresivos y metastásicos en el momento del diagnóstico3,6,7. Así, el diagnóstico molecular y genético puede aportar datos de la enfermedad que permitan comprender la evolución de cada tumor. La clasificación evolutiva del potencial metastásico podría servir como biomarcador importante para la estratificación de los pacientes con una enfermedad metastásica para cirugía (p. e., nefrectomía citorreductora o metastasectomía), para el manejo de los pacientes tras una cirugía con intención curativa, incluyendo decisiones sobre el seguimiento como la vigilancia o la terapia adyuvante, incluso en el contexto de la vigilancia activa de pequeñas masas renales6,7.
Clasificación en grupos de riesgo y biomarcadoresExisten varias clasificaciones de los pacientes con CCR metastásico según su pronóstico. Las más conocidas son las desarrolladas por el Memorial Sloan Kettering Cancer Center (MSKCC)8–10 y por el International Metastatic Renal Cell Carcinoma Database Consortium (IMDC), con parámetros clínicos y de laboratorio. El normograma de MSKCC fue desarrollado en la era de los tratamientos con citoquinas y ha sido actualizado para la era actual de los tratamientos con terapias dirigidas e inmunoterapia. La clasificación IMDC incluye además como criterios la trombocitosis y neutrofilia, mientras elimina el lactato deshidrogenasa (LDH)11,12. Esta clasificación IMDC permite valorar la eficacia de nuevas asociaciones de ICI (nivolumab más ipilimumab) en función del número de factores de riesgo IMDC13.
Otros marcadores clínicos y de laboratorio podrían valorar el pronóstico y la decisión terapéutica, pero precisan de más estudios. Por ejemplo, la localización de la metástasis (hepáticas, óseas) se ha asociado con un peor pronóstico14; la sarcopenia también se ha asociado a una pobre supervivencia global15. La disminución de la tasa neutrófilos/linfocitos y plaquetas/linfocitos durante el tratamiento con TKI o ICI puede ser un biomarcador de respuesta (disminuciones del 25% o más pueden asociarse a una supervivencia libre de progresión y supervivencia global mayor)16–18. La eosinofilia está asociada a menos riesgo de progresión19. La trombocitosis también se ha demostrado como un factor con más peso dentro del grupo de riesgo intermedio de la clasificación IMDC, definiendo un subgrupo, por su asociación a peor supervivencia de forma más marcada que otros factores3.
La PCR basal normal puede ser predictiva de buena respuesta a sunitinib18. También los niveles plasmáticos normales de interleukina 6 (IL6), incluso su expresión en células tumorales se asocia a una mejor respuesta al sunitinib, y el aumento del IL6 puede tener relación con los mecanismos de resistencia a dicho tratamiento; así, el grupo de Pilskog sugiere que podría representar un biomarcador para decidir distintos tratamientos20,21.
Kroeger encuentra que los pacientes fumadores activos tratados con terapias dirigidas presentan menor supervivencia global que aquellos que no lo son; además, si dejan de fumar, su respuesta se iguala a aquellos que no fumaban22.
En cuanto al tipo histológico, en los CCRm no de células claras, menos frecuentes, y en concreto al tipo células papilares, hay un reciente trabajo que encuentra resultados alentadores con el tratamiento en primera línea con axitinib, y plantea la posibilidad de ensayos en asociaciones con inmunoterapia (anti-PD1 y anti-PDL1)23.
Marcadores genéticosVoss et al. analizaron 6 mutaciones genómicas, encontrando que 3 de ellas se asocian a la respuesta al tratamiento y a la evolución. Así, proponen un modelo de riesgo que incluye el estado mutacional de estos 3 genes (PBRM1, BAP1 y TP539), con que mejoran el modelo de riesgo MSKCC en el 39% de los casos, correlacionándose con la supervivencia global y la supervivencia libre de progresión en los pacientes con CCR metastásicos o avanzados tratados con TKI24. De Velasco, aplica plataformas genómicas (como en el cáncer de mama) y encuentra en una de ellas, ClearCode34, que mide niveles de alteraciones de 34 genes en el tejido tumoral clasificando el tumor en 2 subtipos, con valor pronóstico, que puede complementar la clasificación de los modelos de riesgo clínicos, aunque precisa validación. La integración de los factores clínicos y datos moleculares podrá redefinir la clasificación del CCRm, mejorando la compresión de la biología y aportando predictores de respuesta a distintos tratamientos25.
PBRM1 es la segunda alteración genética más frecuente en los pacientes con CCR de células claras (30-40% de los tumores), y está asociada con una evolución clínica más desfavorable. Sin embargo, en los casos metastásicos le confiere una mejoría en la supervivencia global y libre de progresión. Este efecto pudiera estar relacionado con el efecto pro-angiogénico de la pérdida de PBRM1, que resulta en una sobrerregulación de las terapias dirigidas VEGF26.
Las mutaciones de BAP1 ocurren en el 10% de los pacientes con CCR de células claras y se asocian a una evolución peor, tanto en los tumores localizados como en los metastásicos. Los tumores que presentan esta mutación se asocian con mayor repuesta inflamatoria en el microambiente tumoral, asociándose a un aumento de la glucólisis aeróbica3,26.
La inactivación del gen supresor VHL provoca acumulación del factor de inducción de la hipoxia (HIF1α y HIF2α) que ocurre en la mayoría de los CCR. El desarrollo de los tratamientos dirigidos al HIF (X4P-001 y PT2385) están en investigación con resultados favorables27.
Se discute en varios estudios que las mutaciones en TSC1, TSC2 y MTOR, se asocien a un posible beneficio de los pacientes tratados con everolimus, que sí se asoció a la pérdida de PTEN28,29.
Alteraciones genéticas en CCR no células clarasLos CCR papilares tipo 1 y tipo 2 muestran diferencias clínicas y biológicas. Así las alteraciones en la vía MET están asociadas al tipo 1, y la activación de la vía NRF2-ARE (elementos de respuesta antioxidante) al tipo 2; la pérdida CDKN2 y CIMP, con mutaciones en el gen fumarato hidratasa (FH), en el tipo 2 conlleva a un pobre pronóstico. Dentro del tipo 2 encontraríamos varios subtipos según sus alteraciones moleculares y evolución clínica30.
Los tumores cromófobos presentan mutaciones en TP53 (58%), PTEN (24%) y duplicaciones cromosómicas (duplicación de ≥ 3 cromosomas, 25%) cuando son metastásicos, representando factores de riesgo de peor evolución31.
La identificación de mutaciones en síndromes hereditarios en CCR (5% de ellos) en la línea germinal ha aportado mucho en el conocimiento de la patogenia, la evolución de tratamientos y la valoración del riesgo de nuevos tumores. En los pacientes jóvenes con tumores bilaterales o multifocales se indica consejo genético. Pero en CCR avanzados y metastásicos, no seleccionados, encontramos mutaciones en la línea germinal en un 16,1%. En particular, en CCR no claras aparecen estas mutaciones en más del 20% de los pacientes, y algunos de estos podrían beneficiarse de seleccionar terapias dirigidas32.
Biomarcadores de tejidoExpresión de PD-L1La expresión del ligando de muerte celular programada 1 (PD-L1) por inmunohistoquímica puede variar en los ensayos por muchos diferentes factores como: diferentes anticuerpos, distintos límites de positividad, poblaciones celulares diferentes (tejido tumoral primario, heterogéneo en muchos casos, o tejido tumoral metastásico) o exposición a tratamientos previos33, también puede variar su interpretación; en cualquier caso, los niveles elevados de expresión de PD-L1 es un factor pronóstico de agresividad en CCR, que se asocia con otros factores de mal pronóstico (grado nuclear, estadios avanzados) y con una mala respuesta a las terapias diana (TKI)33.
En el estudio fase III que compara nivolumab con everolimus en los pacientes previamente tratados con CCR metastásico, la mediana de supervivencia global fue 21,8 meses en los tumores PD-L1+ comparado con 27,4 meses en los tumores PD-L134. En el estudio fase III comparando la combinación de ipilimumab y nivolumab con sunitinib, tiene un beneficio significativo en los pacientes con expresión de PD-L1+ ≥ 1% en células tumorales: supervivencia libre de progresión de 22,8 meses frente a 5,9 meses (frente a los PD-L1–), y tasa de respuestas objetivas del 58% frente al 37%, respectivamente. Sin embargo, una tasa de respuestas objetivas de 37% en los PD-L1 resalta que existen respuestas independientemente de la expresión de PD-L135.
En el estudio fase III IMmotion151 que compara la combinación de atezolizumab y bevacizumab con sunitinib en primera línea de CCR metastásico, también encuentra correlación entre los PD-L1+ y la respuesta a la enfermedad; esto sugiere que los pacientes con tumores PD-L1+ tienen una respuesta peor a la monoterapia con sunitinib36. En el estudio fase III que compara la combinación de axitinib y avelumab frente a sunitinib, encuentra una tasa de respuesta y una supervivencia libre de progresión significativamente superior en los pacientes con tumores PD-L1+36. En otro estudio similar, comparando la combinación de pembrolizumab más axitinib con sunitinib la supervivencia global y libre de progresión fue significativamente superior en el grupo de la combinación, y este beneficio se observa en todos los grupos de riesgo (IMCD) e independientemente de la expresión PD-L138.
La utilización solo de la expresión PD-L1 es insuficiente en la práctica clínica para seleccionar un tratamiento; solo el 20-30% de los CCR expresan PD-L1 y las respuestas pueden ser vistas en los pacientes con tumores PD-L133,39. El futuro de los biomarcadores predictivos pasará por una combinación de muchas variables biológicas, tales como la carga mutacional del tumor (posible predictor de respuesta a tratamientos ICI), perfiles de linfocitos infiltrantes tumorales, subtipos moleculares y PD-L233.
Microambiente tumoralEl análisis del microambiente tumoral (TME) en CCR nos aporta información importante. La infiltración inmune en el TME, con abundancia de células T y macrófagos asociados al tumor, se asocia con una peor evolución. De hecho, esta infiltración puede cambiar de forma dinámica con las terapias diana (TKI) y con las dirigidas a puntos de control inmunológico, ICI40. Los tumores con alta expresión de genes angiogénicos están asociados con la evolución favorable y con mejor respuesta a TKI36,41. Los tumores con mutaciones VHL tienen mayor carga angiogénica. La mutación PBRM1 tiende a aumentar la angiogénesis tumoral, mientras los tumores con mutaciones BAP1 presentan menos carga angiogénica41. Poco después del inicio del tratamiento con ICI (nivolumab) se producen cambios en el TME, en las células inmunes y expresión de las mutaciones del tejido tumoral. La investigación de este TME aportará información pronóstica y permitirá la selección y el desarrollo de los tratamientos combinados40.
Marcadores tumorales circulantesEl DNA tumoral circulante (ctDNA) y las células tumorales circulantes es material tumoral detectable periféricamente que aporta información de forma no invasiva. En el ctDNA se pueden encontrar múltiples alteraciones genéticas como VHL (23%), TP53 (35%), EGFR (17%), NF1 (16%) y ARID1A (12%) en el CCR metastásico. La mayoría de estas alteraciones aumentan tras el tratamiento de primera línea con TKI, y pueden estar en relación con los mecanismos de resistencia a dichos tratamientos42.
Tratamiento quirúrgicoEl estudio CARMENA cuestiona la utilidad de la nefrectomía citorreductora, estándar previo, más sunitinib frente al tratamiento con sunitinib solo en CCR metastásico, encontrando una supervivencia global no inferior en el grupo tratado con sunitinib solo, en los grupos de peor pronóstico43. Aunque este estudio tenga sus limitaciones, remarca la necesidad de clasificar a los pacientes de acuerdo con el riesgo cuando se considere el tratamiento quirúrgico. Otro estudio retrospectivo encuentra que los pacientes con al menos 4 factores pronósticos IMDC no tendrían beneficio clínico con la nefrectomía citorreductora, incluso pueden presentar una peor evolución44.
Tratamiento médicoTumores de riesgo favorableLa vigilancia activa en los pacientes seleccionados, sin ningún o con un solo factor de riesgo IMDC y menos de 2 lesiones metastásicas podría retrasar el inicio de tratamiento sistémico, en ocasiones durante largos periodos45.
Hasta hace poco, el tratamiento estándar en primera línea en los pacientes de riesgo favorable, han sido las terapias diana: TKI. El perfil de los efectos secundarios asociados a cada tratamiento puede inclinar la decisión individual3; los más comúnmente utilizados han sido sunitinib y pazopanib. Este último se asocia a una mejor tolerancia y menos toxicidad41. La administración de sunitinib en esquema de ciclos 2:1 (2 semanas si, 1 semana descanso), frente al habitual 4:2, se ha asociado con menor tasa de abandonos de la medicación, con menor toxicidad, manteniendo la calidad de vida y óptima eficacia46. Estos pacientes con enfermedad de riesgo favorable tienden a presentar tumores altamente angiogénicos, y siguen beneficiándose con TKI cuando se le compara con la combinación de ipilimumab más nivolumab35. En el estudio que compara la combinación axitinib más pembrolizumab versus sunitinib, sí encuentran beneficio sobre sunitinib en los 3 grupos de riesgo. Ya hay publicaciones recientes de consenso y guías que recomiendan esta combinación en primera línea en grupos de riesgo favorable38,39.
Tumores de riesgo intermedio y riesgo pobreVarios tratamientos de primera línea son posibles, siendo el más extendido la combinación de ipilimumab más nivolumab, por ser significativamente superior a sunitinib en supervivencia global y tasa de respuesta, con una tasa de respuestas completas del 9%35.
En los pacientes con enfermedades autoinmunes o con tratamientos de corticoides (prednisona > 10mg/día), debe considerarse la utilización de TKI, dada la mayor toxicidad mediada inmunológicamente y menor tasa de respuesta con ICI. En estos casos, se recomiendan sunitinib, pazopanib, y cabozantinib. El cabozantinib presenta mejor tasa de respuesta (46 vs. 18%) y mejor supervivencia libre de progresión comparado con sunitinib. Además, el cabozantinib puede ser preferido en los pacientes con metástasis óseas por tener efectos diana específicos en el hueso47,48.
Temsirolimus es recomendado previamente en los pacientes de riesgo pobre en primera línea y actualmente se reserva solo para los pacientes que no toleren medicación oral y con contraindicaciones para los ICI3.
Abordaje de nuevas dianas y combinacionesLa llegada de las nuevas combinaciones de ICI e ICI + TKI, plantea nuevos tratamientos, tanto en primera línea como en la secuenciación de los nuevos agentes disponibles. La compresión de los cambios en el TME, en el contexto de resistencia primaria y adquirida, será la clave. Las nuevas combinaciones ICI dependerán de los efectos adversos y toxicidades que tienen que prevenirse3,39,49.
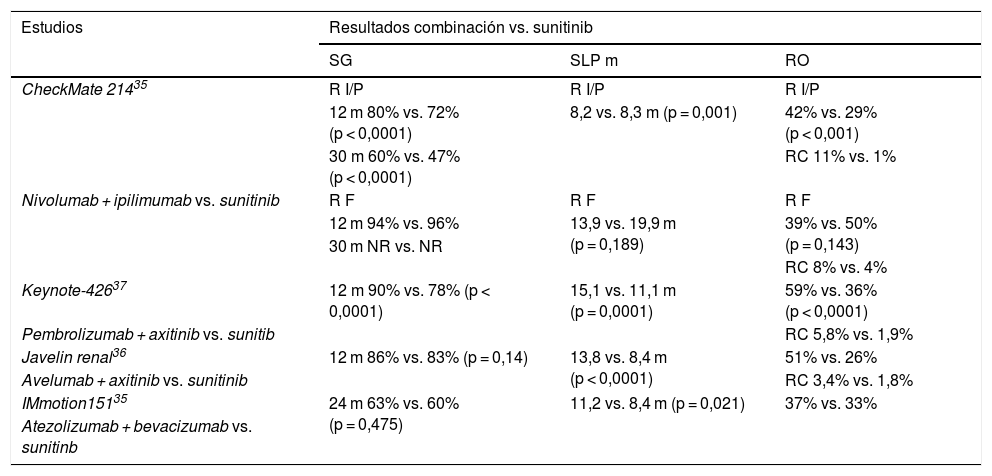
En la tabla 2 se resumen los ensayos fase III con los tratamientos de primera línea de nuevas combinaciones de ICI y terapias diana (TKI). El bloqueo dirigido a VEGF promueve la reclutamiento de poblaciones de células inmunes supresoras (células T), apoyando las estrategias de combinación y sinergia de los tratamientos. Las combinaciones de pembrolizumab más axitinib (KEYNOTE-426) y axitinib más avelumab (JAVELIN Renal-101), aparecen como opciones de tratamiento de primera línea. La combinación de pembrolizumab más axitinib ha demostrado aumento en la supervivencia global en comparación con sunitinib, independientemente de la expresión de PD-L1 y de la estratificación por factores de riesgo (IMDC)37,38. La nueva combinación de nivolumab más cabozantinib en comparación con sunitinib en primera línea ha sido recientemente comunicada con ventajas en todos los campos y grupos51. La incorporación de estas combinaciones a la práctica clínica probablemente va a ser mayor que la combinación de ipilimumab y nivolumab, además incluyen ventajas en los pacientes con riesgo favorable. Hay estudios que incorporan distintas combinaciones o incluso vigilancia activa, de forma individualizada, con base en la respuesta a un tratamiento inicial con monoterapia con nivolumab. Es necesario descubrir los biomarcadores capaces de identificar los pacientes que precisan los tratamientos combinados y los que no, evitando efectos secundarios innecesarios3,37,38.
Estudios fase 3 con combinaciones de ICI y TKI en el CCR metástasico.
| Estudios | Resultados combinación vs. sunitinib | ||
|---|---|---|---|
| SG | SLP m | RO | |
| CheckMate 21435 | R I/P | R I/P | R I/P |
| 12 m 80% vs. 72% (p < 0,0001) | 8,2 vs. 8,3 m (p = 0,001) | 42% vs. 29% (p < 0,001) | |
| 30 m 60% vs. 47% (p < 0,0001) | RC 11% vs. 1% | ||
| Nivolumab + ipilimumab vs. sunitinib | R F | R F | R F |
| 12 m 94% vs. 96% | 13,9 vs. 19,9 m (p = 0,189) | 39% vs. 50% (p = 0,143) | |
| 30 m NR vs. NR | |||
| RC 8% vs. 4% | |||
| Keynote-42637 | 12 m 90% vs. 78% (p < 0,0001) | 15,1 vs. 11,1 m (p = 0,0001) | 59% vs. 36% (p < 0,0001) |
| RC 5,8% vs. 1,9% | |||
| Pembrolizumab + axitinib vs. sunitib | |||
| Javelin renal36 | 12 m 86% vs. 83% (p = 0,14) | 13,8 vs. 8,4 m (p < 0,0001) | 51% vs. 26% |
| RC 3,4% vs. 1,8% | |||
| Avelumab + axitinib vs. sunitinib | |||
| IMmotion15135 | 24 m 63% vs. 60% (p = 0,475) | 11,2 vs. 8,4 m (p = 0,021) | 37% vs. 33% |
| Atezolizumab + bevacizumab vs. sunitinb | |||
RC: respuesta completa; RF: riesgo favorable; R I/P: riesgo intermedio y pobre; RO: respuesta objetiva; SG: supervivencia global; SLPm: supervivencia libre progresión en meses.
Es interesante conocer las resistencias adquiridas a los tratamientos. Los agentes que antagonizan la vía de la adenosina se proponen como potenciadores de los ICI, en particular en la resistencia adquirida a los inhibidores PD-1. La adenosina y ATP están normalmente presentes en el microambiente tumoral a bajas concentraciones, y aumentan en respuesta a la inflamación o a la hipoxia tumoral. El ATP es desfosforilado por ectonucleotidasas CD39 y CD73, con aumento de los niveles de adenosina. Este aumento parece ser una importante vía de escape al tratamiento con ICI. El incremento de CD73 se asocia a una supervivencia global pobre y al fallo del tratamiento con inmunoterapia50.
ConclusionesLos nuevos agentes VEGFR TKI y los ICI han mejorado de forma importante la supervivencia global en el cáncer renal metastásico. Además, con la reciente introducción de las nuevas combinaciones, que suman sinergias de esas 2 vías terapéuticas, han aumentado las posibilidades de tratamientos en primera línea. Los avances en la genética y la caracterización molecular aportan un valor pronóstico importante, pero se necesitan biomarcadores que permitan tomar decisiones en la práctica clínica e individualizar los tratamientos en distintas etapas de la enfermedad, a la vez que desarrollar nuevas vías terapéuticas. El futuro de los biomarcadores predictivos pasará por una combinación de muchas variables biológicas, tales como la carga mutacional del tumor, perfiles de linfocitos que infiltran el tumor, subtipos moleculares, PD-L1 y PD-L2.
Conflicto de interesesLos autores decaran no tener ningún conflicto de intereses.