Conferencias clínico-patológicas: la importancia del diagnóstico multidisciplinar
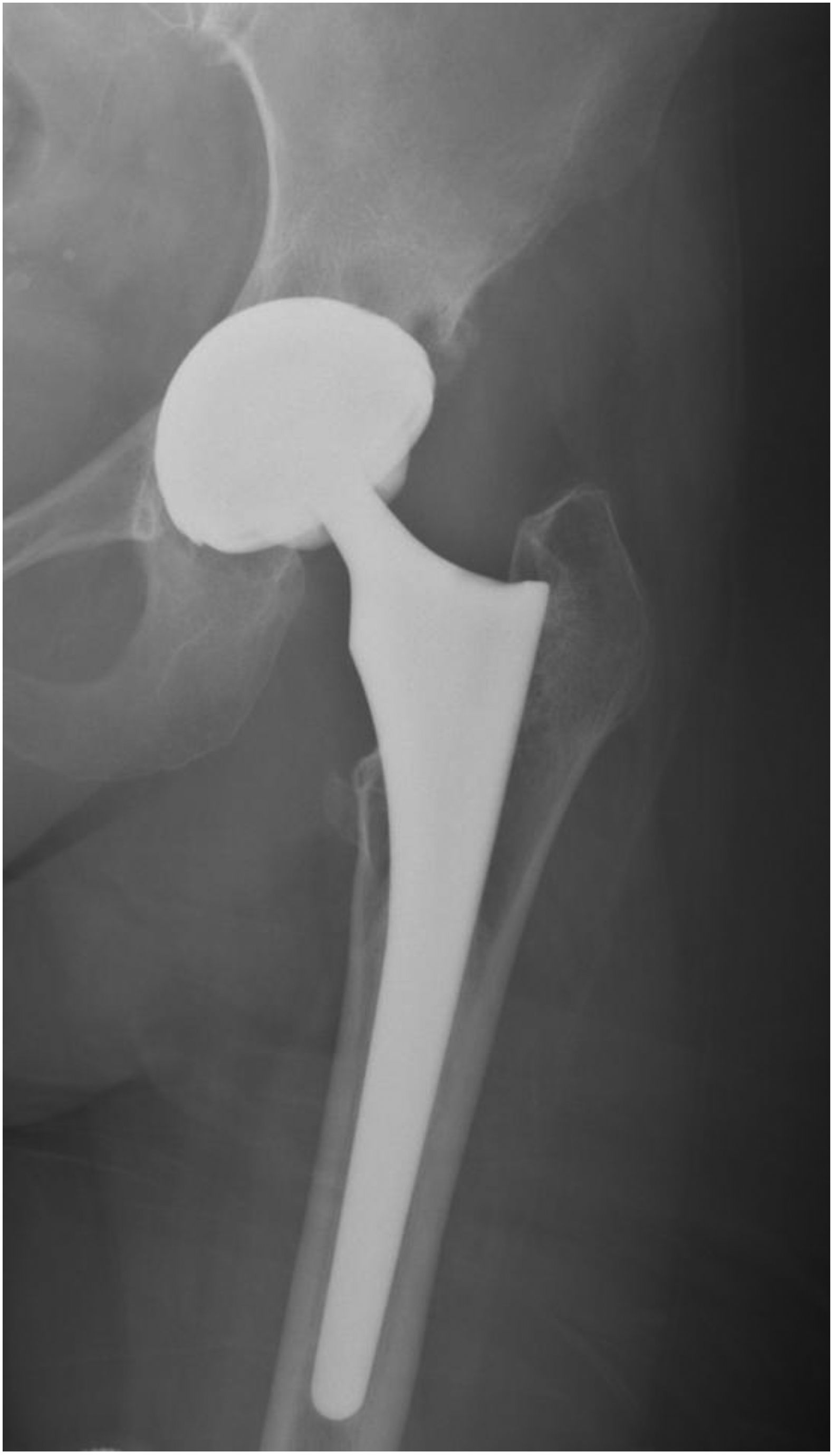
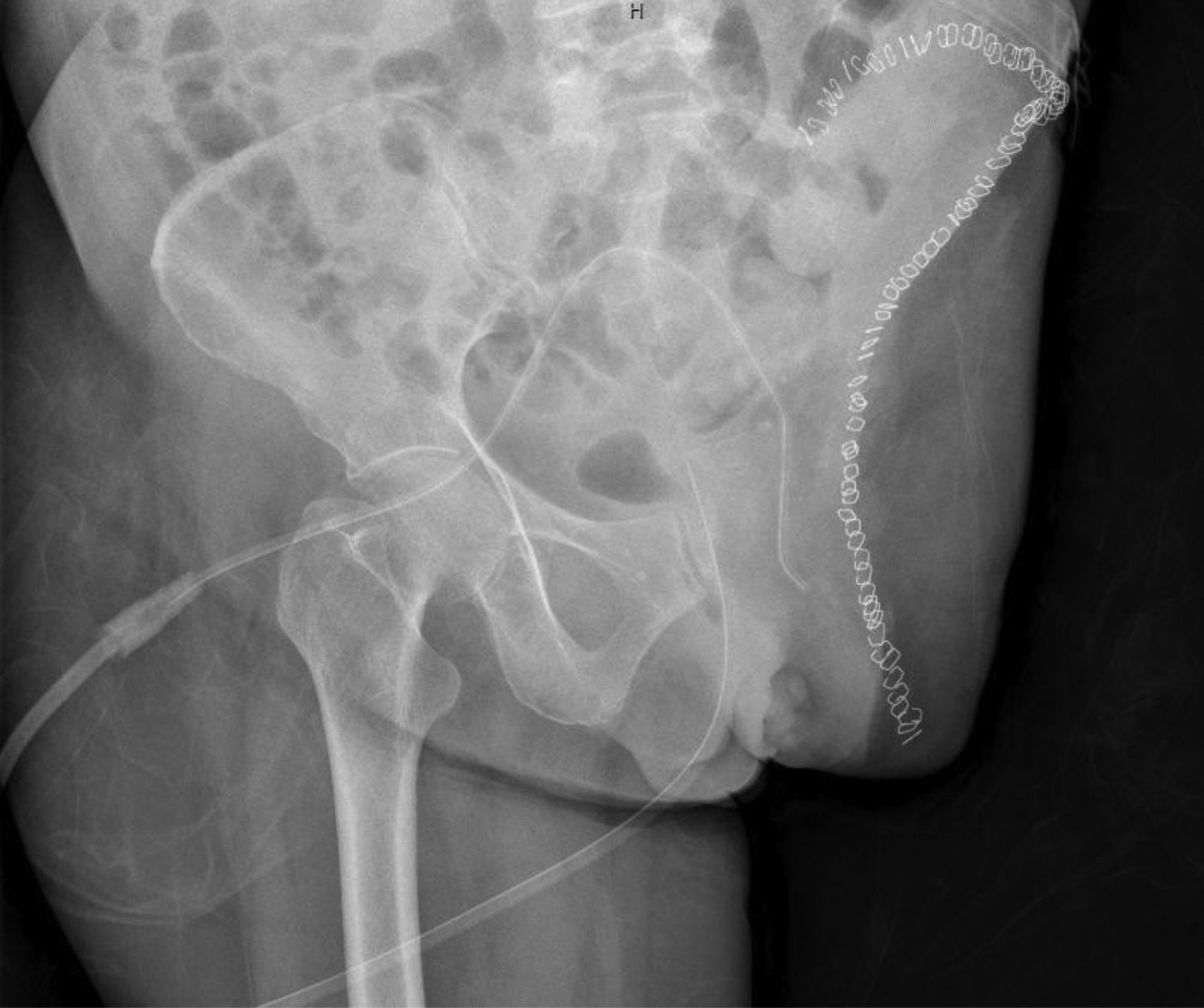
Más datosLa paciente de 58 años, natural de España, no tenía alergias medicamentosas conocidas ni presentaba hábitos tóxicos. Como antecedentes, refería hipertensión arterial y enfermedad de Perthes en la cadera izquierda desde la infancia (necrosis transitoria idiopática de la epífisis de cabeza de fémur). Por las secuelas degenerativas de esta lesión, precisó una prótesis total de cadera a la edad de 41 años (año 2004). Los componentes de la prótesis fueron no cementados en el fémur y en el acetábulo, y el par de fricción fue de cerámica-cerámica. La intervención quirúrgica mejoró notablemente la clínica dolorosa, la función y la calidad de vida de la paciente. Tras 14 años, comenzó a presentar dolor continuo, progresivo y limitante en la cadera izquierda por el que acudió al Servicio de Urgencias de varios centros de salud. Radiológicamente no se evidenció alteración alguna (fig. 1). Únicamente, se pautaron analgésicos. Posteriormente, presentó una tumoración de crecimiento lento en la región inguinal izquierda.
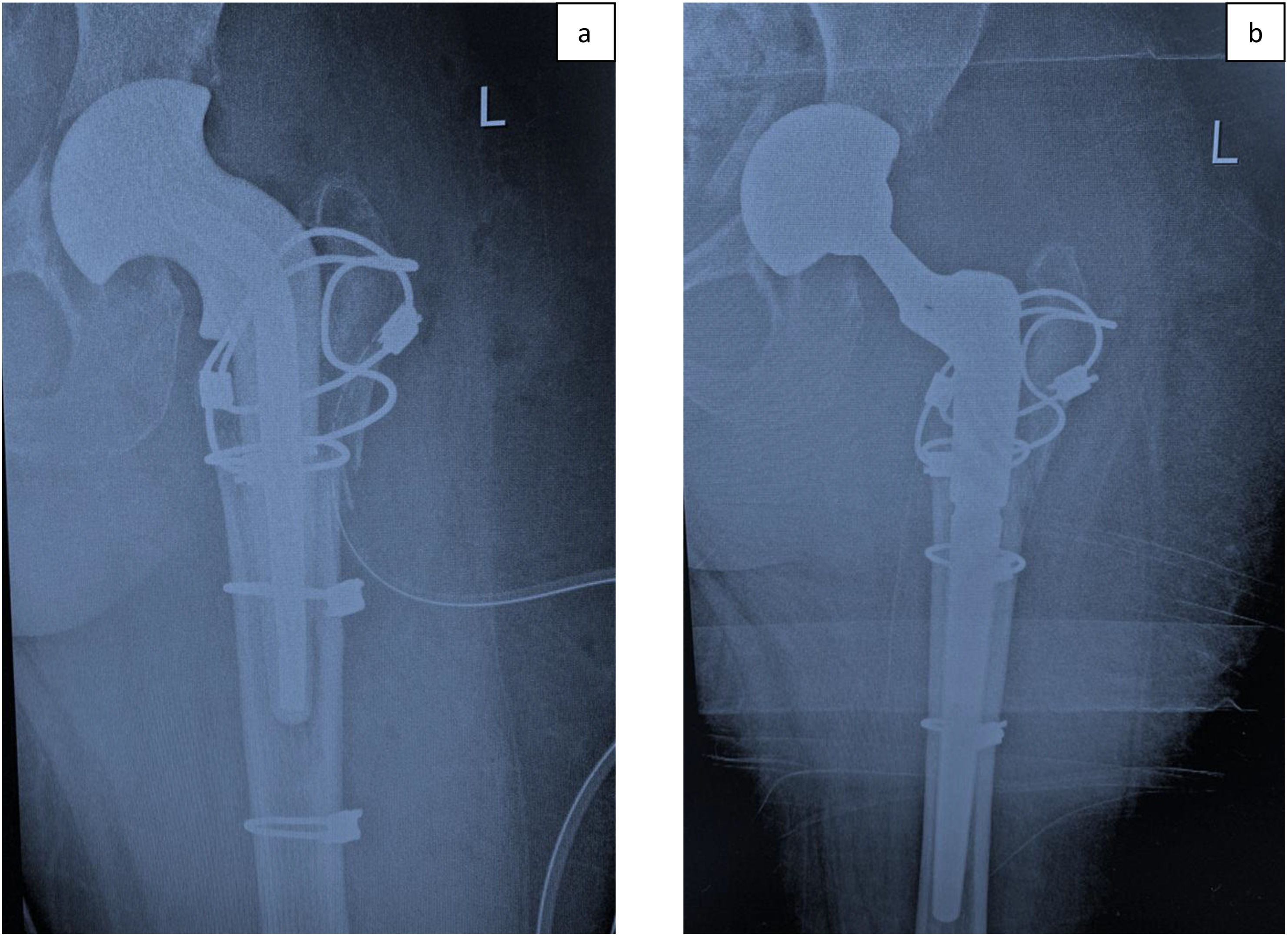
En el año 2019, la paciente fue ingresada en otro hospital por presentar anemia aguda, pérdida de peso progresiva y dolor en la cadera izquierda. Precisó transfusión de sangre y fue derivada al Servicio de Ortopedia. Se orientó como una infección periprotésica de cadera, por lo que se realizó el tratamiento estándar para esta complicación: recambio en 2 tiempos de la prótesis de cadera. El 26 de septiembre de 2019, se realizó la extracción de la prótesis y se colocó un espaciador articulado prefabricado de cadera cargado con antibióticos (vancomicina y gentamicina), cuyos objetivos son curar la infección, evitar mayor defecto óseo en casos sépticos y ofrecer estabilidad de la cadera hasta la implantación de una prótesis definitiva (fig. 2A). Como complicación inmediata de la cirugía, la paciente presentó una hemorragia masiva de la herida, que no requirió reintervención. Los cultivos intraoperatorios revelaron la presencia de Cutibacterium Acnes en una de las 5 muestras obtenidas. El 24 de octubre de 2019, se realizó el segundo tiempo de recambio de cadera implantándose una prótesis de revisión con un vástago modular no cementado y cerclajes para fijar los fragmentos de osteotomía, más un cótilo no cementado (Fig. 2B). Como complicación en el postoperatorio inmediato, la paciente presentó nuevamente una hemorragia masiva detectada por angiografía por tomografía computarizada (TC) que precisó de una embolización de ramas de circunfleja femoral lateral, rama púbica de la arteria epigástrica inferior y rama de la arteria glútea inferior.
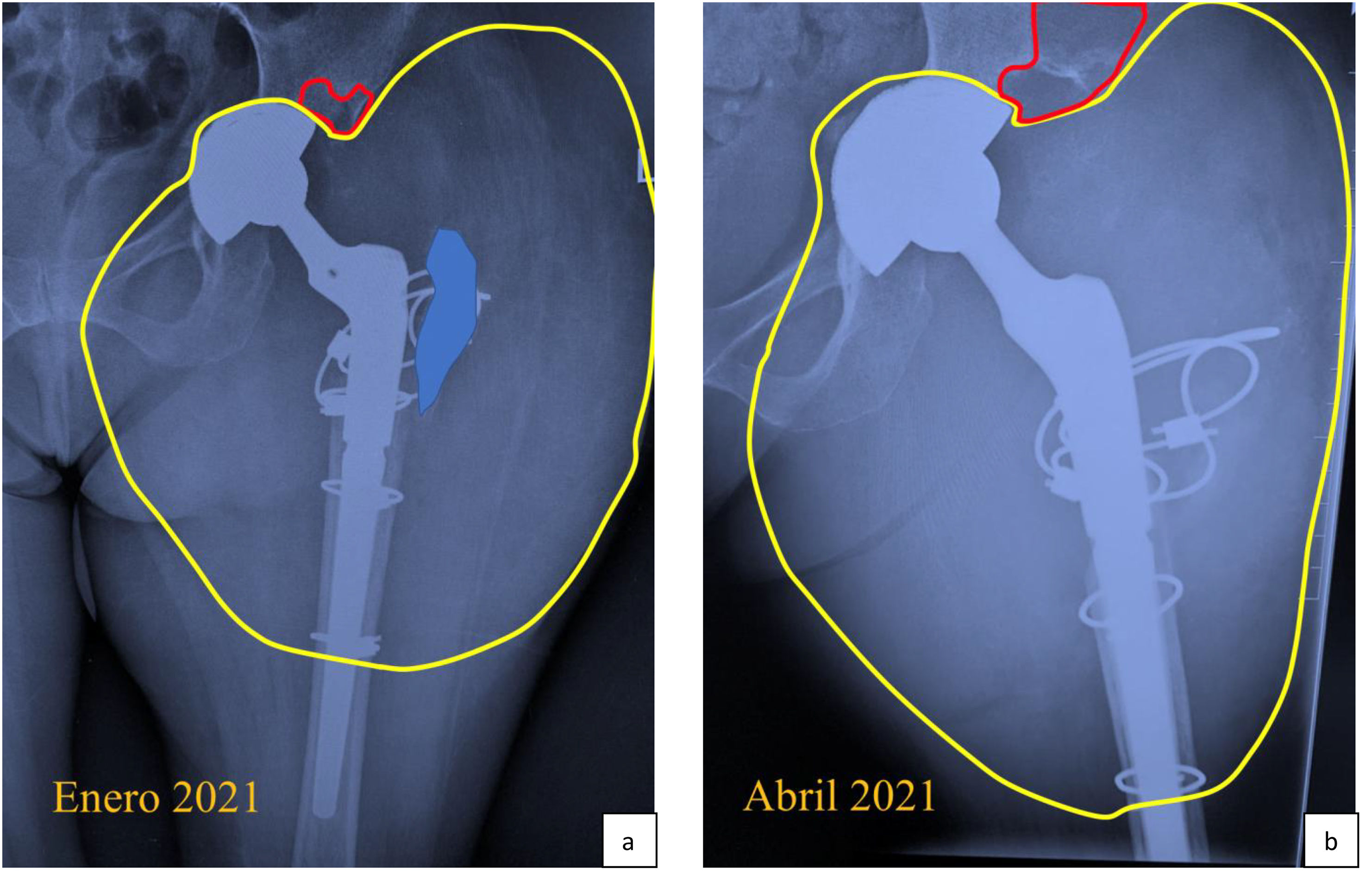
Cinco meses después, ante la persistencia de dolor limitante y un aumento del volumen del tercio proximal del muslo, se realizaron 2 biopsias de la lesión lítica tumoral alrededor de la prótesis de la cadera izquierda. La primera una punción aspirativa con aguja fina (PAAF) guiada por ecografía, la cual no pudo descartar un proceso neoplásico. Por lo que, en mayo de 2020, la paciente fue derivada a otro hospital para la segunda biopsia, en este caso guiada por TC, y la cual confirmó la ausencia de malignidad. Los controles radiológicos progresivos revelaron un aumento progresivo de las zonas de osteólisis en el acetábulo y en el tercio proximal del fémur (fig. 3A y B).
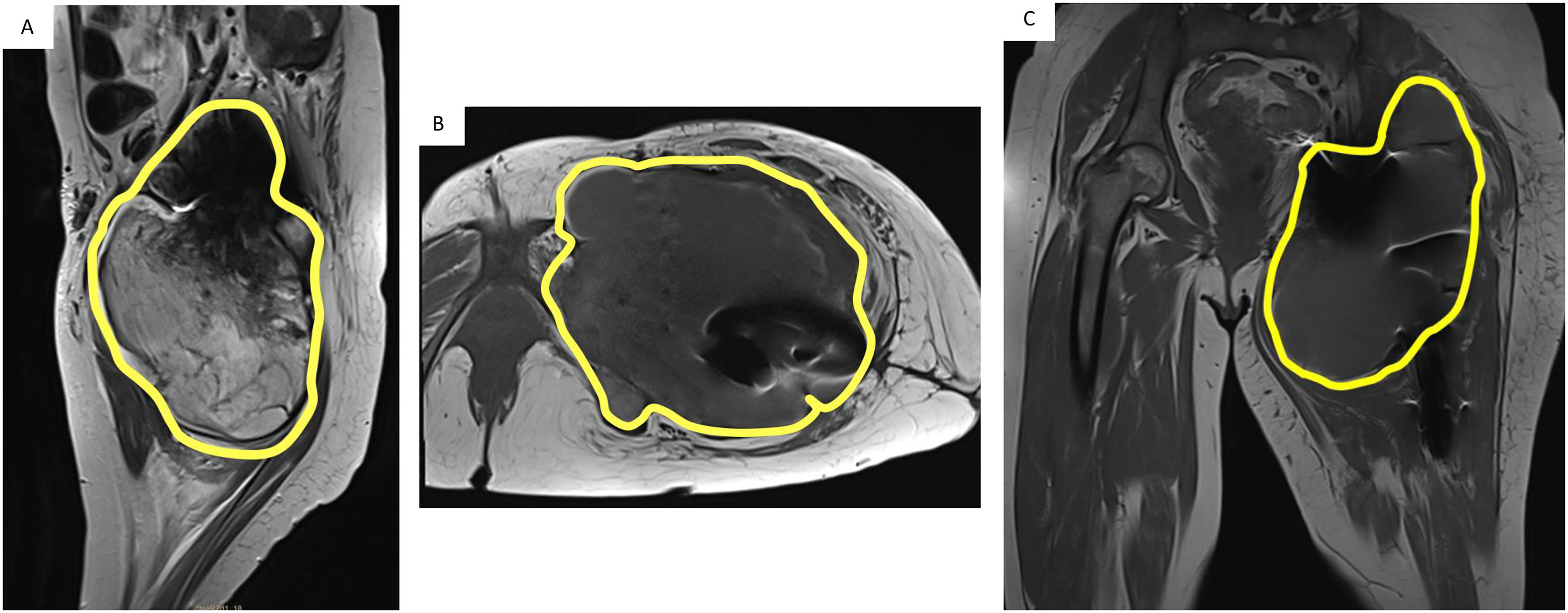
La línea roja muestra la osteolísis del acetábulo; la línea amarilla identifica la lesión tumoral de partes blandas periprotésica; y el área azul señala el trocánter mayor del fémur. A). Mayor aumento de la masa tumoral, lesión osteolítica del acetábulo y aún persistencia del trocánter mayor. B). Transcurridos 2 meses, se observa lisis completa del trocánter mayor (ausencia de área azul), aumento del tumor de partes blandas y mayor lisis del fémur proximal.
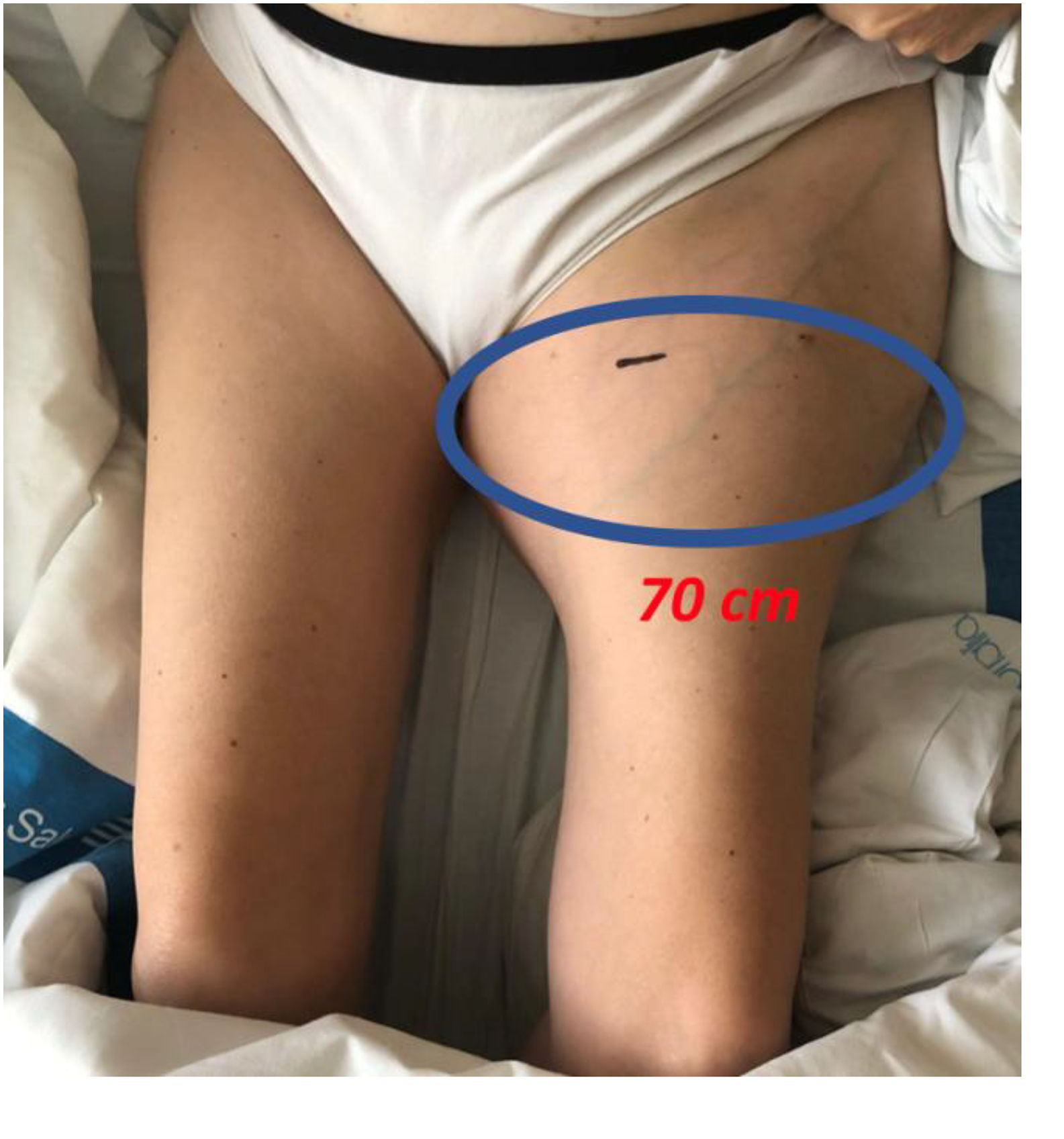
En junio de 2020, la paciente se derivó a nuestro centro objetivándose un deterioro clínico importante, anemia importante, y una masa tumoral dolorosa en el tercio proximal del muslo izquierdo de 70 cm de diámetro (fig. 4). En los análisis de sangre destacaba: hemoglobina 8,3 g/dL, hematocrito 27,9%, leucocitos 18,05 × 109/L, fibrinógeno 7,92 g/L, ferritina 3,307 ng/mL; transferrina 115 mg/dL, hierro 18 μg/dL, velocidad de sedimentación globular 120 mm/h, proteína C reactiva 30,05 mg/dL y creatinina 0,43 mg/dL. Las radiografías de cadera izquierda mostraban osteólisis importante del fémur proximal alrededor del vástago y osteólisis acetabular alrededor del cótilo. La resonancia magnética (RN) reveló una gran colección hemorrágica de 20 × 15 × 16 cm en el compartimento medial de los músculos aductores, rodeando la prótesis de cadera, con una cápsula engrosada y áreas de fina calcificación (fig. 5). Se realizó una TC toraco-abdomino-pélvica y una tomografía por emisión de positrones-TC (PET/TC), que revelaron múltiples imágenes nodulares y seudonodulares con leve hipermetabolismo en el pulmón derecho. La PET/TC mostró una gran colección periprotésica coxofemoral izquierda, con centro ametabólico y periferia heterogéneamente hipermetabólica, que se acompañaba de lisis ósea en el techo acetabular/hueso ilíaco, y protusión endopélvica. Posteriormente, se realizó una biopsia con aguja gruesa (BAG) guiada por ecografía.
En resumen, se trata de una mujer de 58 años que fue derivada a nuestro centro con un deterioro clínico acusado, anemia intensa, y una masa tumoral dolorosa en el tercio proximal del muslo izquierdo. Se consideraron como posibilidades diagnósticas las siguientes opciones.
La masa tumoral dolorosa que presentaba la paciente en el tercio proximal del muslo encaminó inicialmente el diagnóstico hacia un seudotumor protésico por partículas de desgaste. Las masas alrededor de las artroplastias totales de cadera fallidas o estables, han sido bien documentadas y descritas más comúnmente como seudotumores de una reacción granulomatosa a las partículas generadas por el desgaste normal del polietileno o de las partículas de metal. Estos seudotumores también pueden ser producto de un desgaste o aflojamiento precoz de los componentes de la prótesis de cadera1. Los seudotumores también se han descrito en asociación con la osteólisis femoral y acetabular periprotésica2. El estudio histológico de un seudotumor protésico por partículas de desgaste presenta típicamente una infiltración histiocítica, haciendo probable el diagnóstico de reacción a cuerpo extraño. La evolución agresiva y rápidamente progresiva de la osteólisis del fémur, y el aumento de la masa tumoral del tercio proximal de muslo izquierdo hacen poco probable este diagnóstico.
La infección articular periprotésica (IAP) es la complicación más devastadora de la cirugía ortopédica. Actualmente, el diagnóstico de la IAP de la cadera y de la rodilla todavía sigue siendo un gran reto, ya que no existe una prueba que permita un diagnóstico preciso. El diagnóstico de la IAP se basa pues en una combinación de los hallazgos clínicos, los resultados de laboratorio de la sangre periférica y el líquido sinovial, los cultivos microbiológicos, la evaluación histológica del tejido periprotésico y los hallazgos intraoperatorios3. Nueve meses antes, esta paciente ya había sido sometida a un recambio de prótesis de cadera en 2 tiempos más tratamiento antibiótico prolongado como tratamiento de la infección articular periprotésica que se consideró en otro hospital. Por este motivo, así como por la evolución clínica de la tumoración del fémur proximal y el deterioro clínico que presentaba la paciente, se descartó de nuevo el diagnóstico de IAP.
El crecimiento lento y persistente durante más de un mes después del evento inicial de la masa del tercio proximal del muslo podía indicar un hematoma crónico expansivo, tal y como describieron Reid et al.4, a partir de 6 casos en 1980. Éstas son entidades raras, y en la bibliografía médica únicamente se recogen 2 casos en el contexto de la artroplastia total de cadera. Se han descrito unos 40 casos de hematomas crónicos expansivos, la mayoría de los cuales se localizan en el tórax o el pecho, y ninguno estaba asociado a una artroplastia total de cadera. Se trata de una entidad clínica tan poco frecuente en una artroplastia de cadera, que se desestimó este diagnóstico y únicamente se barajó como una posibilidad diagnóstica alternativa en última instancia.
Otro dato que merecía especial atención en esta paciente, era el aumento progresivo de la osteólisis en el acetábulo y en el tercio proximal del fémur. La enfermedad de Gorham-Stout (EGS) es una rara condición mono o poliostótica caracterizada por una proliferación intraósea idiopática de estructuras angiomatosas que dan lugar a una destrucción y reabsorción del hueso. Poco se conoce sobre el curso de la enfermedad. Gorham y Stout5 describieron esta entidad concluyendo que «la osteólisis progresiva está siempre asociada a una angiomatosis de vasos sanguíneos y a veces de vasos linfáticos, que aparentemente son responsables de la misma». En la actualidad, se han descrito alrededor de 300 casos de EGS. No obstante, el diagnóstico puede ser difícil y los resultados del laboratorio suelen ser normales. Las radiografías locales pueden mostrar inicialmente radiolucencias inespecíficas en forma de parches, mientras que la osteólisis ósea progresiva puede observarse posteriormente. El diagnóstico final se basa en el examen histopatológico de una muestra de biopsia de los huesos afectados6. Dada la excepcionalidad de la EGS, que nunca previamente ha sido descrita alrededor de una prótesis, y el resultado de la biopsia en esta paciente, se descartó esta posibilidad diagnóstica.
En cuanto a la anemia grave que padecía la paciente, alcanzando valores de hemoglobina de hasta 6,8 g/dL, cabe destacar que el sangrado incontrolable es el aspecto más característico del angiosarcoma. En la mayoría de los casos publicados de tumores malignos alrededor de la prótesis, las BAG iniciales son negativas, por lo que el diagnóstico suele ser tardío. Con frecuencia, la BAG es negativa porque la reacción a cuerpo extraño podría haber cubierto la condición más relevante del angiosarcoma epitelioide7–10. Esta situación sugiere que en aquellos casos con osteólisis intensa y progresiva asociada a grandes masas alrededor de la prótesis, sea aconsejable una biopsia incisional. El angiosarcoma periprotésico debe considerarse realmente como un diagnóstico en un paciente que presenta hemorragia incontrolable, pérdida de peso y osteólisis masiva.
Diagnóstico clínico del Dr. Ernesto GuerraTumor maligno periprotésico, tipo fibrohistiocitoma maligno u osteosarcoma.
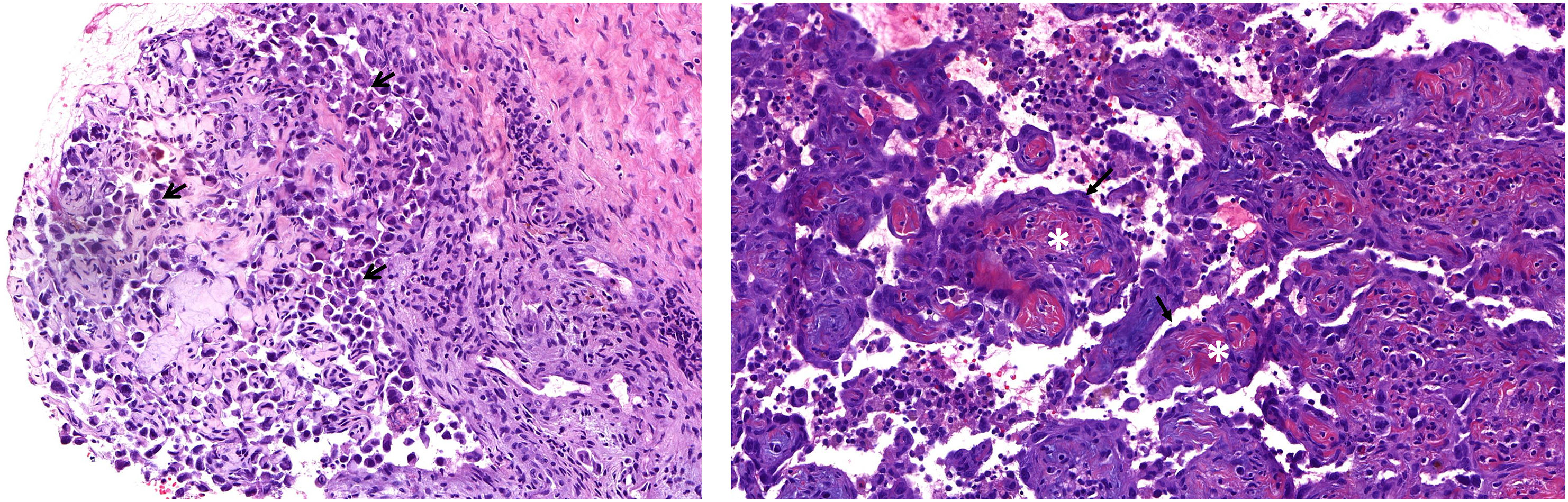
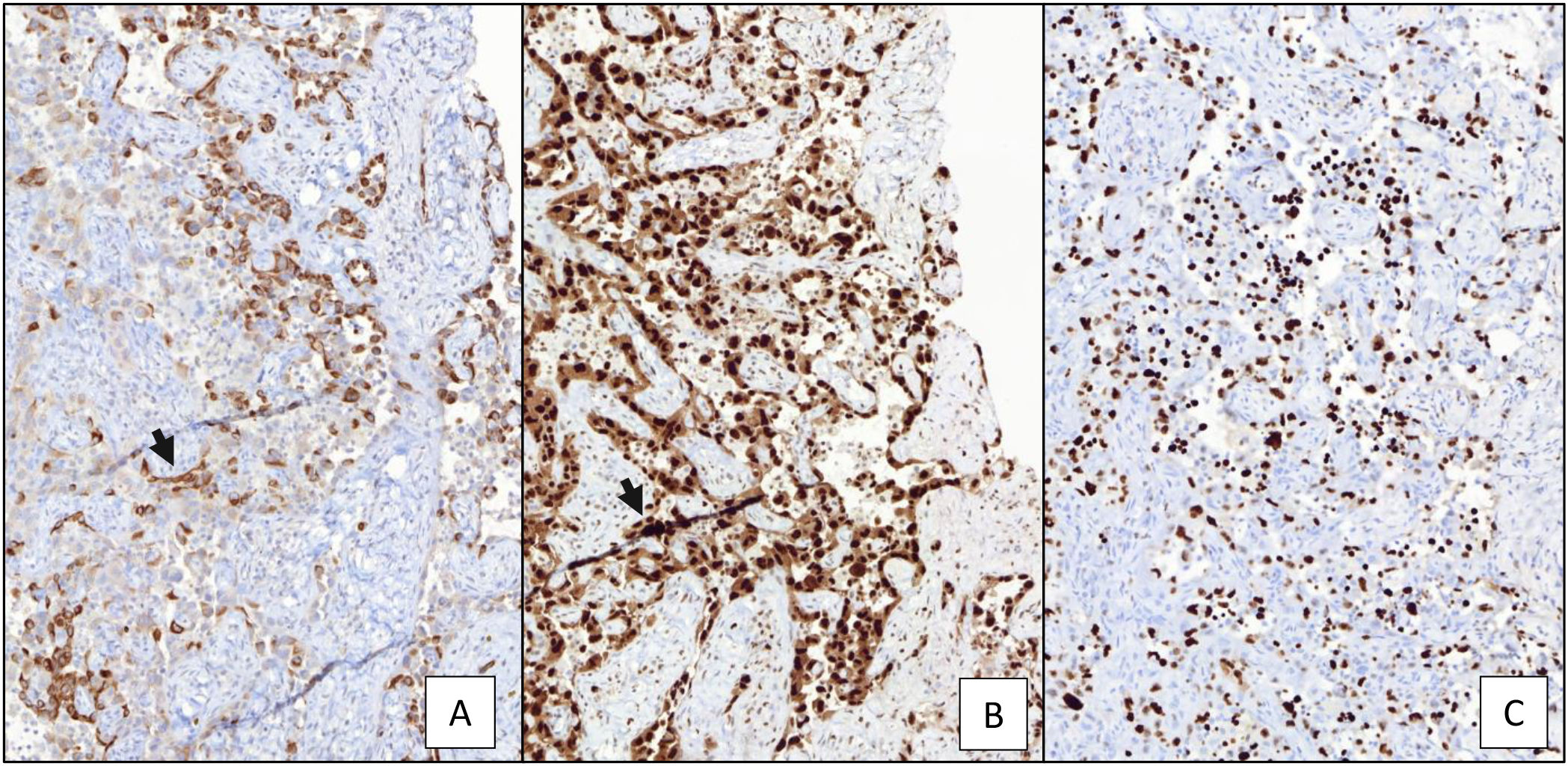
Discusión anatomopatológicaEl procedimiento diagnóstico consistió en una biopsia incisional de la lesión. En la muestra remitida, se observó una proliferación densamente celular de patrón papilar y reticular con múltiples hendiduras. La celularidad presentaba un núcleo aumentado de tamaño, con marcada atipia, frecuentes nucléolos y figuras de mitosis. El citoplasma era escaso, eosinófilo y bien delimitado. Esta celularidad atípica se extendía por el espesor de las papilas, así como por áreas de tejido colagenizado adyacentes (fig. 6A y B). En la muestra remitida se incluían otros fragmentos de tejido fibroso, así como material fibrinohemático. En el estudio inmunohistoquímico, se observó una expresión intensa y difusa en las células tumorales de citoqueratinas AE1/AE3, CD31, ERG y moderada para CD34. El índice de proliferación celular (ki67) superaba el 40% en las áreas de mayor actividad (fig. 7). Con estos hallazgos morfológicos y el perfil inmunohistoquímico, se estableció el diagnóstico de pseudoangiosarcoma Masson.
Según la última clasificación de tumores de partes blandas de la Organización Mundial de la Salud 2020 (tabla 1)11, el angiosarcoma es una neoplasia vascular maligna que comparte características morfológicas e inmunohistoquímicas con las células endoteliales. Representa el 2% de todos los sarcomas y puede desarrollarse en cualquier tejido de las partes blandas11–14. Suele presentarse de manera espontánea, pero se han descrito pocos casos desarrollados sobre lesiones prexistentes como hemangioma arterio-venoso y hemangioma capilar intramuscular13. Desde el punto de vista epidemiológico parece ser más frecuente en la séptima década de vida11–13.
Tumores vasculares de partes blandas
| 1. Hemangiomas |
| 2. Hemangioma sinovial |
| 3. Angioma intramuscular |
| 4. Malformación arteriovenosa/hemangioma |
| 5. Hemangioma venoso |
| 6. Hemangioma anastomosante |
| 7. Hemangioma epitelioide |
| 8. Linfangioma y linfangiomatosis |
| 9. Angioma en penacho y hemangioendotelioma kaposiforme |
| 10. Hemangioendotelioma retiforme |
| 11. Angioendotelioma papilar intralinfático |
| 12. Hemangioendotelioma compuesto |
| 13. Sarcoma de Kaposi |
| 14. Hemangioendotelioma seudomiogénico |
| 15. Hemangioendotelioma epitelioide |
| 16. Angiosarcoma |
Fuente: WHO11.
En el presente caso, la tumoración mostró un patrón arquitectural papilar que se asemeja a las lesiones vasculares tipo Masson, que son lesiones intravasculares benignas caracterizadas por una proliferación papilar endotelial. No obstante, la marcada atipia citológica, la presencia de mitosis y un foco de necrosis, así como el carácter infiltrativo de las células, sugieren un diagnóstico de malignidad. No se puede descartar que el angiosarcoma descrito pueda haber asentado sobre una lesión preexistente vascular. Como se mencionó anteriormente, existen escasos casos descritos sobre lesiones vasculares benignas. Rossi et al., describieron 4 de estos casos, todos ellos con un componente mixto benigno y maligno en la pieza, y uno de ellos con un foco de arquitectura papilar que sugería un remanente de un probable tumor de Masson13.
En cuanto a la etiopatogenia, se han descrito como factores de riesgo el antecedente de radiación, el linfedema crónico y ciertos síndromes familiares11–13. La relación de este tumor con la presencia de material extraño se ha reseñado en aislados casos, en particular con injerto vascular Dacron o prótesis articular ortopédica15. Se ha descrito además un alto riesgo de desarrollar sarcoma de partes blandas en los pacientes con reemplazo de cadera metal/metal16–17.
DiagnósticoPseudoangiosarcoma Masson de partes blandas.
EvoluciónLa paciente inició tratamiento de quimioterapia con paclitaxel semanal más radioterapia antiálgica con intención paliativa. Tras 8 meses de tratamiento, debido al buen control de la enfermedad a nivel sistémico, y dada la progresión de la zona de tumor en la pelvis (pseudoangiosarcoma Masson), finalmente se consideró realizar una cirugía radical con hemipelvectomía externa. Esta intervención quirúrgica (fig. 8) se llevó a cabo en agosto de 2021, y de la cual se encuentra en fase de recuperación en el momento de la presentación de este caso clínico.
ConclusionesLos pacientes con artroplastia total de cadera metal-metal, no solo están expuestos a un solo metal, sino a un «cóctel» de iones metálicos que incluyen cromo, cobalto, titanio, níquel y molibdeno, de los cuales al menos 2 son potencialmente cancerígenos (cromo y níquel), y uno es posiblemente cancerígeno (cobalto).
La Agencia Internacional para la Investigación del Cáncer (IARC) ha clasificado al cromo y níquel en el grupo 1, «cancerígeno para los seres humanos». El cromo (VI) en particular es cancerígeno a través del daño directo del ADN.
Los estudios con un seguimiento de más de 10 años sugieren un mayor riesgo de mortalidad en la artroplastia total de cadera metal/metal en comparación con la artroplastia total de cadera sin fricción metal/metal17.
Responsabilidades éticasSe han seguido las recomendaciones del Centro para la publicación de datos de pacientes.
FinanciaciónNinguna.
Conflicto de interesesNinguno.