el objetivo del estudio fue describir el perfil epidemiológico, clínico y calidad de vida de los pacientes con enfermedad pulmonar obstructiva crónica, estables, en tratamiento de mantenimiento con un agonista β2 adrenérgico de acción prolongada y un corticoide inhalado (LABA/ICS) en un mismo dispositivo presurizado (pMDI).
Materiales y métodosestudio observacional, multicéntrico, transversal en práctica clínica habitual, realizado en 50 centros en España. Se evaluaron 390 pacientes ≥ 40 años, en tratamiento con LABA/ICS en un pMDI durante al menos los 3 meses anteriores a la inclusión. Datos demográficos y clínicos recogidos de la historia clínica y la respuesta al cuestionario COPD Assessment Test.
Resultadoslos pacientes analizados en el estudio fueron mayoritariamente varones (71,3%); un 73,4% de los pacientes distribuidos en una puntuación de ausencia de comorbilidad o comorbilidad baja; un 84,9% en grupos GOLD 2-3; 32,6 y 38,2% de los participantes con un grado de disnea 1 y 2 según la escala modificada Medical Research Council, respectivamente. La puntuación media en el cuestionario COPD Assessment Test fue de 16,3 (8,4).
Conclusionesel perfil de los pacientes en tratamiento de mantenimiento con LABA/ICS en un pMDI es mayoritariamente varones, con ausencia o bajo nivel de comorbilidades, gravedad funcional moderada-grave y disnea leve-moderada. Los pacientes informaron un impacto medio de su calidad de vida.
The study aimed to describe the profile of patients with stable chronic obstructive pulmonary disease (COPD) and maintenance treatment with a long-acting beta2-adrenergic agonist and an inhaled corticosteroid (LABA/ICS) in a pressurised device (pMDI), and to assess the quality of life (HRQoL).
Materials and methodsObservational, multicentre, cross-sectional study in routine clinical practice, conducted in 50 sites in Spain. 390 patients aged ≥ 40 years, treated with LABA/ICS in a pMDI device for at least the previous 3 months before the inclusion, were assessed. Demographic and clinical data were collected from medical records and patient-reported COPD Assessment Test (CAT).
ResultsThe patients analysed in the study were mostly male (71.3%); 84.9% in GOLD 2-3 groups; and 32.6% and 38.2% of participants with dyspnoea grade 1 and 2 according to the modified Medical Research Council (mMRC) scale, respectively. The mean CAT questionnaire score (standard deviation [SD]) was 16.3 (8.4).
ConclusionsThe profile of the patients treated with LABA/ICS in a pMDI device is mainly male, with no or low comorbidities, moderate-severe functional severity, and mild-moderate dyspnoea. Patients reported a medium impact on their quality of life.
La enfermedad pulmonar obstructiva crónica (EPOC) se caracteriza por síntomas respiratorios persistentes y limitación del flujo aéreo1. Las guías clínicas GOLD y GesEPOC recomiendan un manejo óptimo de la EPOC mediante intervenciones no farmacológicas (cese del hábito tabáquico, ejercicio físico y rehabilitación pulmonar), vacunación para la gripe y neumococo y el manejo de las comorbilidades1,2. Asimismo, el tratamiento farmacológico controla los síntomas, reduce las exacerbaciones y mejora la calidad de vida relacionada con la salud (CVRS) del paciente, según la sintomatología, el fenotipo clínico y la progresión de la enfermedad1,2.
El tratamiento recomendado por las guías y aceptado en la práctica clínica habitual está basado en broncodilatadores de acción prolongada (agonistas β2 adrenérgicos -LABA- y antagonistas muscarínicos -LAMA-) en combinación o no con corticoides inhalados (ICS)1,2. Concretamente la combinación LABA/ICS está indicada actualmente en el perfil clínico asma-EPOC y en agudizadores frecuentes2.
La elección del dispositivo inhalador adecuado para cada perfil de los pacientes también influye en el éxito del tratamiento3,4. La EPOC conlleva un deterioro progresivo de la función pulmonar, con lo que ciertos pacientes pueden no ser capaces de generar el flujo inspiratorio requerido para un inhalador de polvo seco. Los pacientes con una buena coordinación pulsación-inhalación y flujo inspiratorio < 30 L/min tienen recomendado el uso de inhaladores presurizados de dosis medida (pMDI)5,6. Actualmente se estima que el 30% de los pacientes con EPOC en España utilizan el tratamiento de mantenimiento con LABA/ICS en un dispositivo pMDI, aunque se desconoce su perfil y los patrones de utilización de este7.
El objetivo principal del estudio ARIES fue describir el perfil de los pacientes diagnosticados de EPOC que reciben tratamiento de mantenimiento con LABA/ICS en un dispositivo pMDI e identificar sus características clínicas, epidemiológicas, funcionales y su CVRS.
MétodosEl estudio ARIES fue un estudio observacional, multicéntrico, transversal realizado en 50 centros en España (49 de Neumología, Medicina Interna y Geriatría, y uno de Atención Primaria). Las fuentes de datos fueron las historias clínicas de los pacientes y los cuestionarios de evaluación que cumplimentaron en la consulta, como parte de la práctica clínica habitual. Todos los participantes firmaron el consentimiento informado (CI). El estudio fue aprobado por el comité ético del Hospital Universitari Clínic de Barcelona (Código AEMPS: AST-LAB-2017-01) en cumplimiento con las guías de regulación local.
Población de estudioEntre febrero y julio de 2019 se incluyeron de forma consecutiva pacientes ≥ 40 años con EPOC estable (sin exacerbaciones en las 6 semanas anteriores a la firma del CI) y con tratamiento de control sintomático durante al menos 12 meses antes y con la combinación LABA/ICS en al menos los 3 meses anteriores. Se excluyeron los pacientes con otra enfermedad respiratoria crónica diferente de la EPOC (fibrosis quística, bronquiectasias graves, cáncer de pulmón activo, enfermedad pulmonar restrictiva), que estuvieran participando en otros ensayos clínicos o que no firmaron el CI.
ObjetivosEl objetivo principal del estudio ARIES fue describir el perfil de los pacientes con EPOC estable y tratamiento de mantenimiento con LABA/ICS en un pMDI. Además, se analizó el grado de conformidad de los investigadores participantes con el fenotipo GesEPOC y la gravedad funcional GOLD 2017 recogidos en la historia clínica, y la adecuación del manejo de según estas guías clínicas; se determinó la afectación de la calidad de vida relacionada con la EPOC; finalmente, se evaluó la experiencia previa de los pacientes con otros dispositivos inhaladores.
VariablesRecogidas de la historia clínica: perfil socio-demográfico y epidemiológico y última analítica antes de la visita; la información sobre comorbilidades e índice de comorbilidad de Charlson8,9; fenotipo según GesEPOC 20172, clasificación de la gravedad funcional de la EPOC y la clasificación del grupo de riesgo según GOLD 2017 (vigentes en el momento del análisis)10, grado de disnea según la escala modificada de valoración de la disnea del Medical Research Council11 y pruebas de función y capacidad pulmonar. Se recogió el grado de acuerdo del investigador con el fenotipo establecido disponible en la historia clínica, y se reevaluó con la información disponible en el momento de la visita. Además, se recogió la información disponible en la historia clínica sobre los dispositivos inhaladores para la EPOC previos y el tratamiento actual. La CVRS se evaluó utilizando el COPD Assessment Test (CAT)12.
Metodología estadísticaSe analizaron 390 pacientes, permitiendo la caracterización del perfil de los pacientes diagnosticados con EPOC que reciben tratamiento de mantenimiento con LABA/ICS en un dispositivo pMDI (objetivo principal del estudio). Con un nivel de confianza del 95%, el valor real estaría dentro de un intervalo de confianza de ± 5% del valor estimado.
Se realizó una descriptiva general de las variables incluidas en el estudio. Se presentaron las distribuciones de frecuencias absolutas y relativas de las variables cualitativas, así como las medidas de tendencia central y dispersión (media, desviación típica [DT]) de las variables cuantitativas. No se imputaron los datos ausentes.
El análisis estadístico se realizó mediante IBM SPSS Statistics software, Version 22.0 (IBM Corp. Armonk, NY). Los test de hipótesis que se realizaron fueron bilaterales y con un nivel de significación nominal de 0,05.
Esquema del estudioEstudio transversal, observacional en pacientes ≥ 40 años con EPOC estable y tratamiento de mantenimiento con LABA/ICS en un pMDI.
ResultadosCaracterísticas del paciente con Enfermedad pulmonar obstructiva crónica tratados con ICS/LABA en un mismo inhalador pMDICaracterísticas epidemiológicasSe incluyeron en el estudio 410 pacientes, de los cuales 20 fueron no evaluables por no cumplir algún criterio de inclusión, por lo que finalmente se analizaron 390. La mayoría (93,6%) habían sido tratados en la consulta de Neumología, el 4,6% en Medicina Interna, el 1% en Atención Primaria y un 0,8% en Geriatría. Se trató mayoritariamente de varones (71,3%) con una media (DT) de edad de 69,8 (10,2) años; exfumador (68,7%) con una historia media de tabaquismo (DT) de 41,5 (13,1) años, fumando una media (DT) de 23,7 (11,1) cigarrillos por día (tabla 1). La mayoría (63,6%) presentaban comorbilidades, siendo las más frecuentes diabetes (24,1%), insuficiencia cardiaca (15,9%) y enfermedad arterial periférica (12,1%). La media (DT) del índice de comorbilidad de Charlson fue de 2,1 (1,5), con un 73,4% de los pacientes con una puntuación de comorbilidad baja o ausente.
Características epidemiológicas de los pacientes participantes en el estudio
| Parámetro | n=390 |
|---|---|
| Edad (años), media (DT) | 69,8 (10,2) |
| Género, hombre, n (%) | 278 (71,3) |
| IMC (kg/m2), media (DT) | 28,2 (5,4) |
| Nivel educativo, n (%) | |
| Sin estudios | 38 (9,7) |
| Primaria | 178 (45,6) |
| Secundaria | 104 (26,7) |
| Universitario | 65 (16,7) |
| Posgrado | 5 (1,3) |
| Tabaquismo, n (%) | |
| No fumador | 5 (1,3) |
| Exfumador | 268 (68,7) |
| Exfumador (hace menos de un año) | 41 (10,5) |
| Fumador activo | 76 (19,5) |
| Número de años fumando, media (DT) | 41,5 (13,1) |
| ≤35 años, n (%) | 21 (28,8) |
| >35 y ≥ 40, n (%) | 24 (32,9) |
| >40 y ≤ 50, n (%) | 13 (17,8) |
| >50 años, n (%) | 15 (20,5) |
| Número de cigarrillos al día, media (DT) | 23,7 (11,1) |
| ≤20 cigarrillos/día, n (%) | 49 (65,3) |
| >20 cigarrillos/día, n (%) | 26 (34,7) |
| Pacientes con comorbilidades, n (%) | 248 (63,6) |
| Comorbilidades más frecuentes, n (%) | |
| Diabetes | 94 (24,1) |
| Insuficiencia cardiaca | 62 (15,9) |
| Enfermedad arterial periférica | 47 (12,1) |
| Infarto de miocardio | 34 (8,7) |
| Insuficiencia renal moderada o severa | 32 (8,2) |
| Enfermedad cerebrovascular | 28 (7,2) |
| Enfermedad respiratoria crónica | 27 (6,9) |
| Úlcera gastroduodenal | 26 (6,7) |
| Tumor o neoplasia sólida | 22 (5,6) |
| Enfermedad del tejido conectivo | 17 (4,4) |
| Hepatopatía crónica | 16 (4,1) |
| Índice de comorbilidad de Charlson, media (DT) | 2,1 (1,5) |
| Categorías índice de comorbilidad de Charlson, media (DT) | |
| 0-1 (ausencia de comorbilidad) | 115 (46,4) |
| 2 (comorbilidad baja) | 67 (27) |
| ≥3 (comorbilidad alta) | 66 (26,6) |
DT: desviación típica; IMC: índice de masa corporal.
La mayoría de los pacientes (84,9%) presentaban gravedad funcional moderada-grave, según GOLD 2017 (tabla 2). De acuerdo con GesEPOC, un total de 85 pacientes (26,8%) presentaban fenotipo no agudizador y 80 pacientes (25,2%) fenotipo mixto, mientras que 71 pacientes (22,4%) y 69 pacientes (21,8%) presentaban fenotipo agudizador con enfisema o con bronquitis crónica, respectivamente. Su grado de disnea según la escala Medical Research Council era mayoritariamente grado 1 y 2 (32,6 y 38,2%, respectivamente). Además del tratamiento con LABA/ICS, un 88,1% de los pacientes tenían un tratamiento LAMA. Un 36,5% estaban siendo tratados con un SABA (probablemente a demanda), un 21,1% habían recibido la vacuna antigripal; un 14,2% recibían oxigenoterapia domiciliaria continua y un 13,8% estaban en tratamiento con un SAMA.
Características funcionales y clínicas relacionadas con la EPOC de los pacientes participantes en el estudio
| Parámetros | n=390 |
|---|---|
| Función pulmonar, media (DT) | |
| FEV1 (ml) | 1.256,8 (495,9) |
| FCV (ml) | 2.413,8 (755,8) |
| FEV1/FCV (%) | 52,2 (11,9) |
| CI (L)a | 2,3 (0,9) |
| PEF (L/min) | 211,4 (562,6) |
| Insuficiencia respiratoria crónica, n (%) | 94 (24,1) |
| PaO2 (mmHg) | 57,3 (10,4) |
| PaCO2 (mmHg) | 45,1 (6,3) |
| pH | 7,41 (0,03) |
| Recuento eosinófilos en sangre (109células/L), media (DT)b | 2,4 (31,4) |
| Recuento neutrófilos en sangre (células/μL), media (DT)c | 5.150 (7.220) |
| Gravedad funcional EPOC (GOLD 2017), n (%)d | |
| GOLD 1 (leve) | 18 (4,6) |
| GOLD 2 (moderada) | 173 (44,4) |
| GOLD 3 (grave) | 158 (40,5) |
| GOLD 4 (muy grave) | 41 (10,5) |
| Fenotipo GesEPOC, n (%)e | |
| No agudizador | 85 (26,8) |
| Mixto (EPOC-asma) | 80 (25,2) |
| Agudizador con enfisema | 71 (22,4) |
| Agudizador con bronquitis crónica | 69 (21,8) |
| No claro / no definido | 12 (3,8) |
| Grado de disnea (escala de disnea mMRC), n (%) | |
| 0 | 8 (2,1) |
| 1 | 127 (32,6) |
| 2 | 149 (38,2) |
| 3 | 83 (21,3) |
| 4 | 23 (5,9) |
| Tratamientos actuales para EPOC, n (%) | |
| LABA / ICS | 390 (100) |
| LAMA | 280 (88,1) |
| SABA | 116 (36,5) |
| Vacuna antigripal | 67 (21,1) |
| Oxigenoterapia domiciliaria continua | 45 (14,2) |
| SAMA | 44 (13,8) |
| Metilxantinas | 25 (7,9) |
| Mucolíticos | 23 (7,2) |
| Macrólidos | 13 (4,1) |
| IPDE-4 | 10 (3,1) |
| ARLT | 8 (2,5) |
| CS | 2 (0,6) |
| Opciones LABA / ICS en pMDI, n (%) | |
| Budesonida/Formoterol | 182 (46,7) |
| Beclometasona/Formoterol | 208 (53,3) |
ARLT: antagonistas del receptor de los leucotrienos; CI: capacidad inspiratoria; CS: corticoides sistémicos; DT: desviación típica; EPOC: enfermedad pulmonar obstructiva crónica; FEV1: volumen espiratorio forzado en el primer segundo; FCV: capacidad vital forzada; GesEPOC: guía española de la EPOC; GOLD: global initiative for chronic obstructive lung disease; ICS: corticoides inhalados; IPDE-4: inhibidor de la fosfodiesterasa 4; LABA: agonistas β2 de acción prolongada; LAMA: anticolinérgicos de acción prolongada; μL:microlitro; mmHg: milímetros de mercurio; mMRC: escala de disnea Medical Research Council modificada; PaCO2: presión parcial del dióxido de carbono; PaO2: presión arterial de oxígeno; PEF: flujo espiratorio máximo; pMDI: inhalador presurizado de dosis medida; SABA: agonistas β2 de acción corta; SAMA: anticolinérgicos de acción corta.
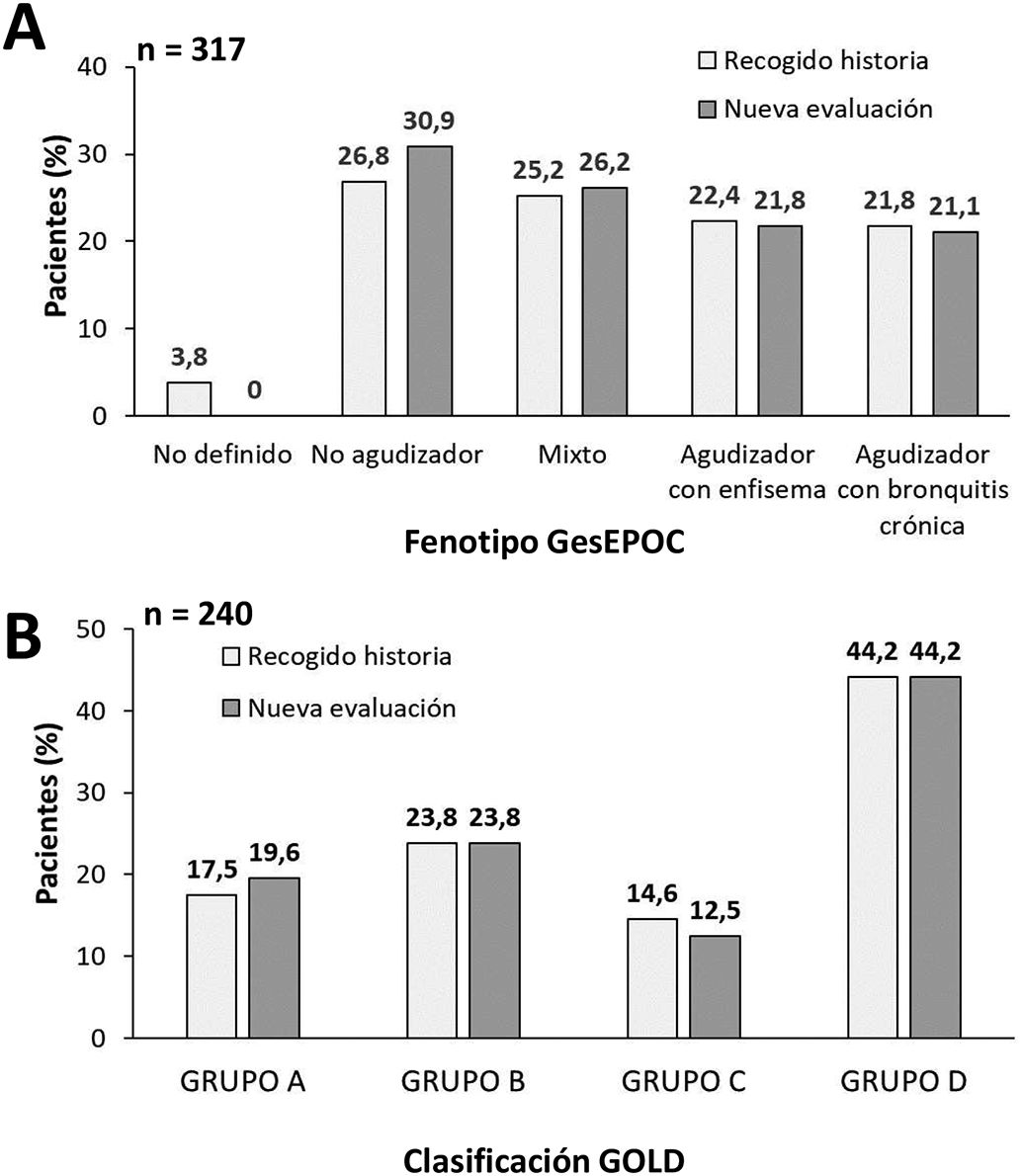
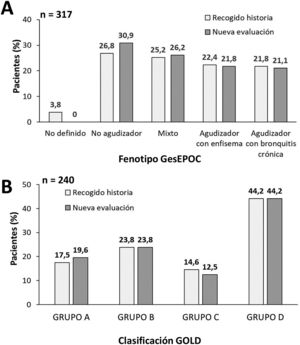
Un 81,3 y un 61,5% de los participantes, respectivamente, tenían recogidos en la historia clínica el fenotipo GesEPOC y la clasificación según los criterios GOLD. En el momento de la recogida de datos, el 11,7% de los investigadores no estaba de acuerdo con el fenotipo establecido y un 2,1% con la clasificación GOLD recogida en la historia. La figura 1 recoge la variación entre la historia y la posterior evaluación en los pacientes cuyos datos previos y revisados estaban disponibles. En un 14,8 y un 5% de los participantes hubo un cambio en el fenotipo y en la clasificación, respectivamente, tras la nueva evaluación.
A) Variación en el porcentaje de pacientes según el fenotipo GesEPOC, B) clasificación GOLD 2017, de acuerdo con la evaluación recogida en la historia clínica (gris claro) o la nueva evaluación realizada por los investigadores en el momento de la visita del estudio (gris oscuro). Abreviaturas: GesEPOC = Guía Española de la enfermedad pulmonar obstructiva crónica; GOLD = Global Initiative for Chronic Obstructive Lung Disease.
Un 62,8% de los pacientes se habían realizado una tomografía computarizada de tórax y un 44,6% al test de difusión de monóxido de carbono (tabla 3). Otros procedimientos registrados fueron la cuantificación de alfa1-antitripsina (α1-AT) (30,5%), índice BODEx (30%), test de la marcha de 6 minutos (26,7%), y determinación de la inmunoglobulina E (IgE) total (24,1%). Los pacientes habían presentado una media (DT) de 1,8 (2,2) exacerbaciones graves en el último año, en su mayoría atendidas en el servicio de urgencias de su centro de salud, y ninguna había requerido el ingreso en la UCI.
Uso de recursos sanitarios
| Parámetros | |
|---|---|
| Procedimientos realizados desde diagnóstico EPOC, n (%) | |
| TAC de tórax (n=377) | 245 (62,8) |
| Test de difusión de CO (n=351) | 174 (44,6) |
| Cuantificación de α1-AT (n=333) | 119 (30,5) |
| Índice BODEx (n=318) | 117 (30) |
| Test de marcha 6 minutos (n=360) | 104 (26,7) |
| IgE total (n=340) | 94 (24,1) |
| Índice BODE (n=305) | 70 (17,9) |
| Programa rehabilitación pulmonar (n=372) | 55 (14,1) |
| Estudio neumo-alergológico (n=338) | 52 (13,3) |
| Exacerbaciones graves en el último año, media (DT) (n=390) | 1,8 (2,2) |
| Uso de recursos sanitarios por exacerbaciones en el último año, media (DT) (n=390) | |
| Asistencia a urgencias en un centro de salud | 0,9 (1,4) |
| Asistencia a urgencias en un hospital | 0,4 (0,7) |
| Ingreso hospitalario | 0,5 (1) |
| Ingreso en UCI | 0 (0,2) |
α1-AT: alfa1-antitripsina; BODE: índice BODE; BODEx: índice BODEx (exacerbaciones graves); CO: monóxido de carbono; DT: desviación típica; IgE: inmunoglobulina E; TAC: tomografía computarizada; UCI: unidad de cuidados intensivos.
La puntuación media (DT) en el cuestionario CAT fue de 16,3 (8,4) (fig. 1A suplementaria). La media (DT) fue mayor para los pacientes en los grupos de mayor gravedad funcional GOLD, mostrando una media (DT) de 20 (9,1) para el grupo GOLD 4 frente a 15,8 (7) para el grupo GOLD 1 (p = 0,007) (fig. 1B suplementaria).
Experiencia con los dispositivos de inhalaciónExperiencia previaMás de la mitad de los pacientes (59,7%) habían tenido experiencia previa con 1 o 2 inhaladores durante el tratamiento de al menos un año para el control de la EPOC (tabla 4), siendo mayoritariamente inhaladores de polvo seco (80,9%) y, en menor medida, inhaladores de tipo presurizado (11,7%).
Dispositivos de inhalación previos
| Parámetros | |
|---|---|
| Número de dispositivos previos diferentes, n (%) | n = 390 |
| Media (DT) | 1,6 (1,4) |
| 0 | 73 (18,7) |
| 1 | 160 (41) |
| 2 | 72 (18,5) |
| ≥3 | 85 (21,8) |
| Tipo de dispositivos previos, n (%) | n=614 |
| Inhalador polvo seco | 497 (80,9) |
| Turbuhaler | 124 (24,9) |
| Accuhaler | 90 (18,1) |
| Nexthaler | 39 (7,8) |
| Ellipta | 27 (5,4) |
| Otro (más frecuentes): | 217 (43,7) |
| Handihaler Spiriva | 88 (40,6) |
| Breezhaler | 55 (25,3) |
| Genuair | 52 (24) |
| Spiromax | 6 (2,8) |
| Aerolizer | 4 (1,8) |
| Zonda | 4 (1,8) |
| Presurizado (más frecuentes): | 72 (11,7) |
| Respimat | 21 (29,2) |
| MDI | 15 (20,8) |
| PMDI | 9 (12,5) |
| Salbutamol | 6 (8,3) |
| Atrovent | 5 (6,9) |
| Presurizado | 5 (6,9) |
| Seretide | 3 (4,2) |
| Otros (más frecuentes): | 45 (7,3) |
| Respimat | 33 (73,3) |
| Handihaler | 4 (8,9) |
| SDI | 4 (8,9) |
DT: desviación típica; MDI: inhalador de dosis medida; pMDI: inhalador presurizado de dosis medida; SDI: inhalador de niebla fina.
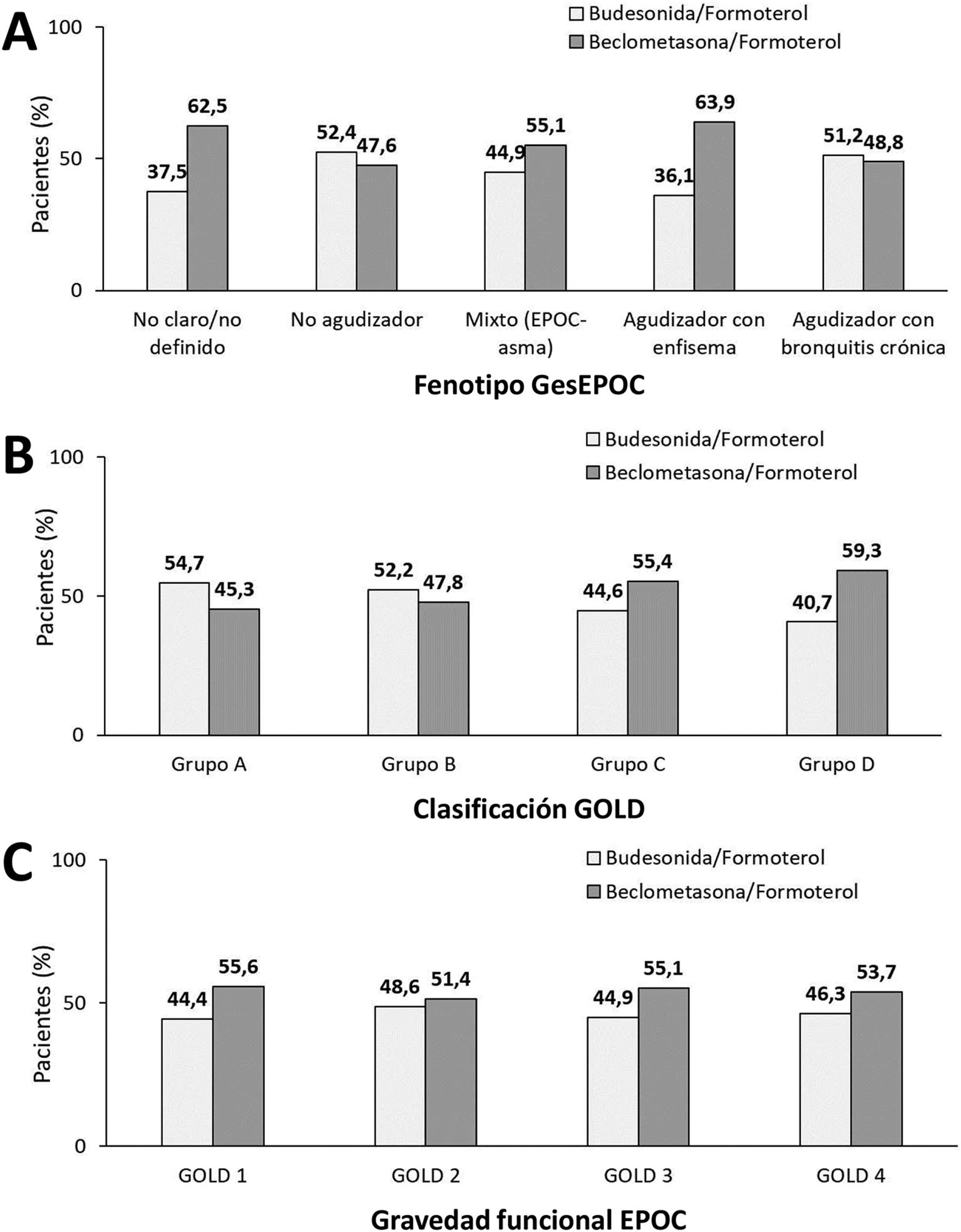
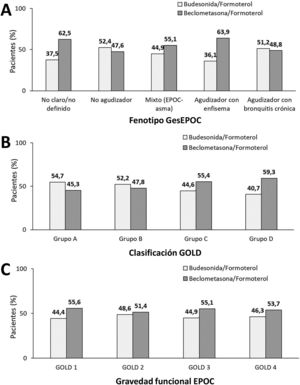
El inhalador pMDI con la combinación budesonida/formoterol se registró en un 46,7% de los casos, y con beclometasona/formoterol en el 53,3% (tabla 1). El tratamiento con beclometasona/formoterol predominaba en los fenotipos no claro/no definido (62,5%), mixto (EPOC-asma; 55,1%) y agudizador con enfisema (63,9%), mientras que en los fenotipos no agudizador (52,4%) y agudizador con bronquitis crónica (51,2%) predominó ligeramente el tratamiento con budesonida/formoterol (fig. 2A). Según la clasificación por grupos GOLD, el tratamiento con budesonida/formoterol predominaba en los grupos A (bajo riesgo y poco sintomáticos) y en el grupo B (bajo riesgo y sintomático) con un porcentaje de pacientes de 54,7 y 52,2% respectivamente, mientras que en los grupos C (alto riesgo y poco sintomático) y en el grupo D (riesgo alto y muy sintomático) predominaba la combinación beclometasona/formoterol (55,4 y 59,3% respectivamente) (fig. 2B). El tratamiento con beclometasona/formoterol predominaba en todos los grupos GOLD; GOLD 1-leve, GOLD 2-moderado, GOLD 3-grave y GOLD 4-muy grave (fig. 2C).
A) Tipo de tratamiento según la composición LABA/ICS en función del fenotipo GesEPOC, B) clasificación GOLD y C) grupo de gravedad funcional GOLD.
Abreviaturas: GesEPOC: Guía española de la enfermedad pulmonar obstructiva crónica; GOLD: Global Initiative for Chronic Obstructive Lung Disease.
El estudio ARIES describe el perfil de los pacientes con EPOC estable en tratamiento con LABA/ICS en un dispositivo pMDI. Mayoritariamente, es un paciente varón, con pocas comorbilidades, gravedad funcional con obstrucción moderada al flujo aéreo, fenotipo GesEPOC no agudizador o mixto, y grado de disnea leve-moderada. En el estudio EPOCONSUL, de práctica clínica habitual, el uso de LABA/ICS fue también más frecuente en los pacientes con bajo riesgo (10%) respecto a los de alto riesgo (7%)13. El uso de la combinación LABA/ICS en un único dispositivo, se ha analizado en vida real desde diferentes perspectivas y en la práctica clínica, la combinación de budesónida/formoterol o fluticasona/salmeterol fueron efectivas reduciendo la incidencia de exacerbaciones moderadas-graves14.
Un 88,3 y un 97,9% de los investigadores, respectivamente, se mostraron conformes con lo registrado en la historia clínica a la hora de describir el fenotipo y la clasificación de los pacientes según la gravedad. El mayor grado de desacuerdo entre la valoración recogida en la historia y la nueva evaluación fue una ligera infraestimación de los fenotipos no agudizador, del mixto y del grupo GOLD 1 en el diagnóstico, y una ligera sobreestimación en los fenotipos agudizadores y en el grupo GOLD 3. La determinación correcta del fenotipo clínico en EPOC estable es relevante ya que puede tener implicaciones en cuanto a los resultados informados por los pacientes y en el uso de recursos sanitarios15. La definición del fenotipo del paciente es especialmente importante a la hora de establecer el riesgo de presentar exacerbaciones graves y para indicar el tratamiento sintomático y de mantenimiento más adecuado, de acuerdo con las guías clínicas1,2. Estudios recientes han mostrado la necesidad de no utilizar únicamente la estrategia basada en fenotipos clínicos, ya que podría haber solapamiento en algunos casos y pacientes sin fenotipos claramente establecidos16. En el presente estudio es llamativa la ausencia de fenotipo clínico en un porcentaje importante de los sujetos incluidos. Sin embargo, en un estudio reciente se observó un 9,2% de pacientes con EPOC que no cumplían los criterios diagnósticos de ningún fenotipo GesEPOC y en un 19,1% había solapamiento16. Aunque el grado de discordancia es discreto, la EPOC es una enfermedad con matices que puede ser heterogénea y tener rasgos comunes que hagan difícil establecer clasificaciones exactas e inmutables.
Los pacientes analizados en el estudio ARIES informaron tener un impacto medio en su CVRS debido a la EPOC, con una tendencia significativamente creciente a mayor gravedad. Las guías actuales recomiendan el manejo de la EPOC basado en los síntomas y los parámetros de función pulmonar, pero también en el estado de la CVRS1,2. De hecho, revisiones sistemáticas y metaanálisis han sugerido que factores como la depresión, la ansiedad y la tolerancia al ejercicio físico tienen una mejor correlación con el estado de salud de los pacientes con EPOC que los valores de función pulmonar habitualmente manejados17. Además, los síntomas y comorbilidades «extrapulmonares», al margen de la disnea y la tos, suelen tener una gran importancia en los pacientes con EPOC leve-moderada, pero con gran afectación de su CVRS18. La incorporación de cuestionarios de CVRS relacionados con EPOC podrían ser de interés en la práctica clínica habitual.
La mayoría de los pacientes participantes en el presente estudio presentaba alguna comorbilidad (en el 63,6% de los casos), sin embargo, el índice de comorbilidad de Charlson definió a los pacientes como con ausencia de comorbilidad o comorbilidad baja en el 73,4% de los participantes, sin diferencias en función del perfil de gravedad de la EPOC establecido por GOLD 2017. Esta información concuerda con el estudio EPISCAN II, que reportaba una media (DE) del índice de Charlson de 0,68 (1,16) en pacientes con EPOC, aunque en el análisis no se describe el grado de comorbilidades según el tipo de tratamiento inhalado19. Sin embargo, nuestros datos referentes a enfermedades concomitantes contrastan con una descriptiva reciente en vida real realizada en la población alemana con diagnóstico reciente de EPOC y con cualquier tratamiento disponible (no únicamente LABA/ICS) en la que el índice de Charlson fue de 5,320. Un paciente con un gran número de comorbilidades puede necesitar manejar una gran cantidad de medicación, lo cual dificultaría su grado de cumplimiento o el entendimiento de las pautas y del correcto uso de un dispositivo inhalador21,22. Por otro lado, los pacientes con varias comorbilidades normalmente tienen un mayor seguimiento y, dependiendo del tipo de comorbilidad, mayor concienciación en cuanto al correcto seguimiento de las pautas de tratamiento23.
El estudio tiene algunas limitaciones. Se trata de un estudio en la práctica clínica habitual, en el que la principal fuente de datos son las historias clínicas, con lo que la obtención de la información para el análisis depende de que esta se encuentre convenientemente recogida en las mismas. Además, la naturaleza de diseño transversal, sin seguimiento en el tiempo o comparación con grupo control, no permite establecer un análisis de secuencia de acontecimientos o relación causal. Asimismo, el grado de impacto de las comorbilidades se recoge en función del índice Charlson, con mayor aplicación en el ámbito hospitalario frente a la atención primaria9. El uso de este índice puede infraestimar el número e impacto de las comorbilidades de los participantes analizados, debido a que no toma en cuenta comorbilidades como anemia, arritmias, hipertensión o depresión, con influencia en la CVRS relacionada con la EPOC y en el cumplimiento terapéutico24–26.
Sin embargo, la naturaleza descriptiva del estudio y la participación de 50 centros distribuidos por toda España, incluyendo mayoritariamente especialistas en Neumología, Medicina Interna y Geriatría, permite inferir los resultados obtenidos en este análisis a los pacientes con este perfil atendidos de forma habitual en las consultas especializadas. De hecho, la descripción de los pacientes y las pruebas diagnósticas observadas son muy similares a las recogidas en estudios previos en España27. Además, al ser el estudio ARIES un análisis del manejo de los pacientes con EPOC estable en la práctica clínica habitual, presentaron características más heterogéneas que en los estudios clínicos controlados y, por tanto, es un análisis en vida real.
ConclusionesEl perfil de los pacientes en tratamiento de mantenimiento con LABA/ICS en un pMDI es el de mayoritariamente varones, con ausencia o bajo nivel de comorbilidades, gravedad funcional moderada-grave y disnea leve-moderada. Así pues, este análisis en vida real sugiere la existencia de un subgrupo de pacientes con EPOC en tratamiento con LABA/ICS a pesar de no padecer de exacerbaciones. Sin embargo, al ser un estudio transversal descriptivo sin intervención no podemos concluir si este tratamiento determina dicha clasificación.
Los pacientes informaron un impacto medio de su calidad de vida. Esto refuerza el mensaje de las guías actuales de manejo de la enfermedad, que recomiendan no solamente valorar los síntomas o los parámetros funcionales, sino también evaluar el estado de calidad de vida. Así pues, sería recomendable incorporar cuestionarios de CVRS relacionados con EPOC en las evaluaciones en la práctica clínica real.
FinanciaciónEste trabajo ha contado con financiación de Astra Zeneca España.
AgradecimientosLos autores quieren agradecer a Alicia Subtil-Rodríguez de Evidenze Clinical Research (una compañía del grupo Evidenze Health España S.L.), por el apoyo editorial en la preparación del manuscrito.
Los autores quieren agradecer la participación de todos los investigadores del estudio ARIES.
Conflicto de interesesJorge Arencibia-Borrego, Javier Sanchez Lora, Joan Serra-Batlles, Juan A. Riesco Miranda, Juan Enrique Cimas y Rosa Malo de Molina declaran no tener conflictos de intereses. Lucía Regadera y Javier Nuevo forman parte de Astra Zeneca España.
Investigadores estudio ARIES: José Daniel Alcázar Ramírez (Hospital Quirón, Málaga); África Alcorta-Mesas (Hospital Infanta Leonor, Madrid); Jorge Arencibia (Hospital Doctor Negrín); Joan Bauza (Hospital Son Llatzer, Palma de Mallorca); José Calvo Bonachera (Hospital Torrecárdenas, Almería); Luis Carazo (Hospital de León); José Enrique Cimas (Centro de Salud Contrueces-Vega, Gijón); Leopoldo Damián Domínguez (Hospital General de Ceuta); José Ramón Donado-Uña (Hospital de Fuenlabrada, Madrid); Juan Fernández-Lahera (Hospital La Paz, Madrid); Javier Gallego (Hospital Nuestra Señora de Valme, Sevilla); José Manuel García-Pazos (Complejo Hospitalario Universitario de Santiago de Compostela -CHUS-); Ignacio García Talavera (Hospital Nuestra Señora de la Candelaria); Jordi Giner (Hospital Sant Pau, Barcelona); Elia Gómez (Hospital San Juan de Alicante); Cruz González (Hospital Clínico de Valencia); Armando González López (Complejo Hospitalario Universitario de Ourense -CHUO-); Ascensión Hernando Sanz (Hospital 12 de Octubre, Madrid); Alberto Herrejón (Hospital Doctor Peset, Valencia); Arturo Huerta (Hospital Clínic, Barcelona); Antonio Lalueza (Hospital 12 de Octubre, Madrid); Joan Antón Lloret (Hospital de Viladecans); Antonia Llunell (Hospital Consorci Terrasa); Encarnación López Gabaldón (Hospital Virgen de la Salud, Toledo); Rosa Malo (Hospital Puerta de Hierro); Alicia Marín (Hospital Germans Trias i Pujol, Girona); Eduardo Márquez (Hospital Virgen del Rocío, Sevilla); Sonia Martínez-Sáez (Hospital de la Vega Baja); Javier Mazo-Etxaniz (Hospital de Basurto, Vizcaya); José Manuel Melero-Brezo (HULA); Raquel Morillo-Guerrero (Hospital Ramón y Cajal, Madrid); Germán Peces-Barba (Fundación Jiménez Díaz, Madrid); Gerardo Pérez-Chica (Hospital de Jaén); Luis Puente-Maeztu (Hospital Universitario Gregorio Marañón, Madrid); Juan Antonio Riesco-Miranda (Hospital San Pedro de Alcántara, Cáceres); Sergio Salgado-Aranda (Hospital del Sudeste, Arganda del Rey, Madrid); Francisco Javier Sánchez (Hospital Universitario Virgen de la Victoria, FIMABIS, Málaga); Juan Miguel Sánchez-Nieto (Hospital Morales Messeguer, Murcia); Fernando Sánchez-Toril (Hospital Arnau de Vilanova); Gonzalo Segrelles (Hospital Rey Juan Carlos, Móstoles, Madrid); Joan Serra (Hospital Universitario de Vic); Agustín Valido (Hospital Virgen Macarena, Sevilla); Joaquín Vizcaíno (Hospital de Poniente, Almería).
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.mcpsp.2023.100367.
Figura suplementaria 1: A) Calidad de vida relacionada con la salud en cada uno de los ítems del cuestionario CAT, B) puntuación media (DT) del cuestionario CAT para cada uno de los grupos GOLD. La puntuación del cuestionario CAT oscila entre 0 (menor afectación, síntomas más leves) y 5 (afectación intensa, síntomas intensos), con una puntuación total máxima de 40 puntos. Abreviaturas: CAT = COPD Assessment Test; DT = Desviación típica; GOLD = Global Initiative for Chronic Obstructive Lung Disease. *Prueba de Kruskall Wallis.