Presentamos el caso de un varón de 85 años que presentaba un dolor lumbar de larga y tórpida evolución, que no mejoraba con los tratamientos convencionales. Aunque el paciente lo relacionaba de forma clara con un esfuerzo realizado, el resultado final fue que la fractura aplastamiento se originó por una tuberculosis vertebral o mal de Pott.
El objetivo de este trabajo es la revisión clínica y actualización de esta patología realmente poco frecuente.
We present the case on an 85-year old male who had a long and torpid clinical course of low back pain, which did not respond to conventional treatments. Although the patient clearly related it to an effort made, the end result was that the fracture was caused by a crushing spinal tuberculosis or Pott's disease. The aim of this paper is to review and update this really uncommon clinical pathology.
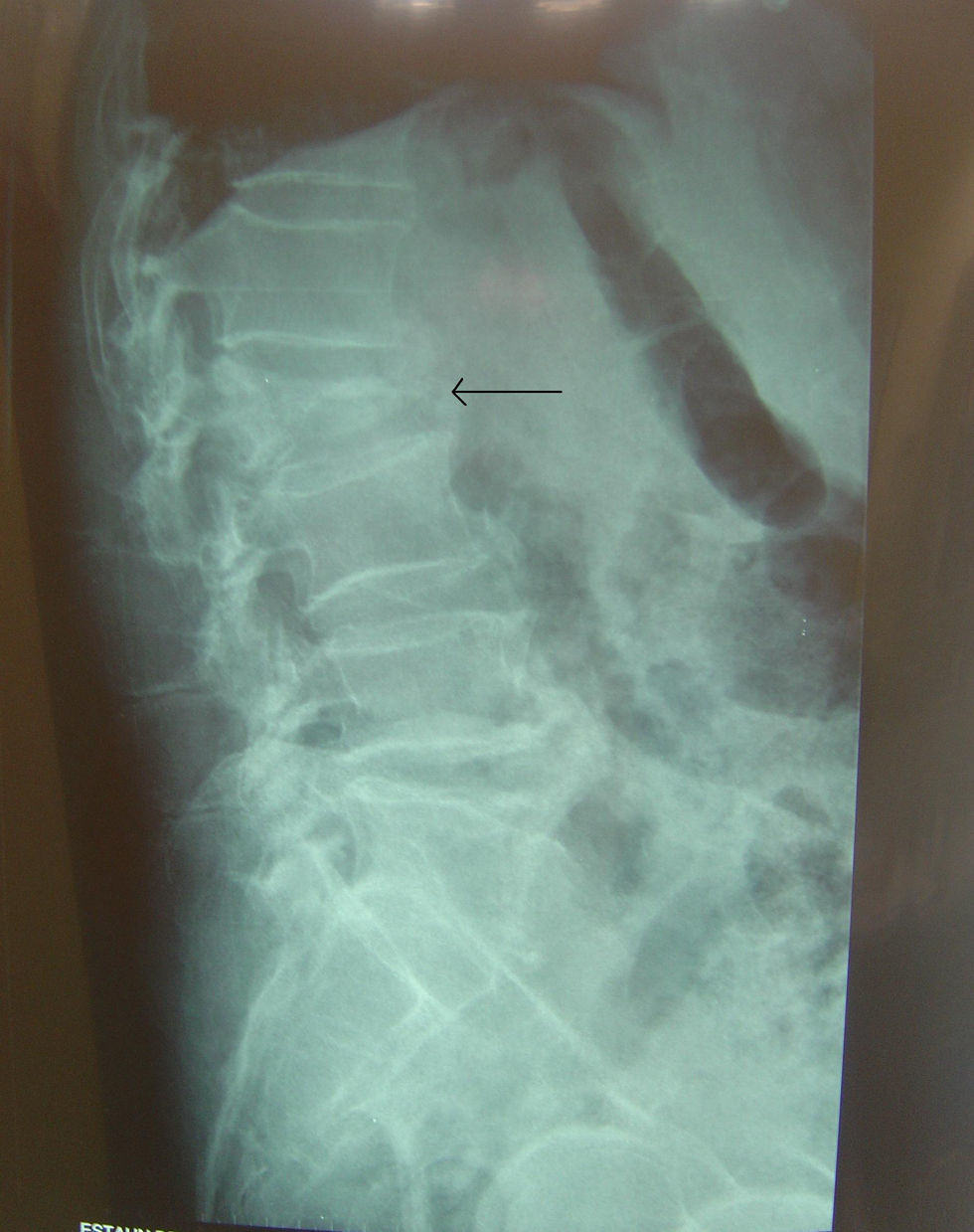
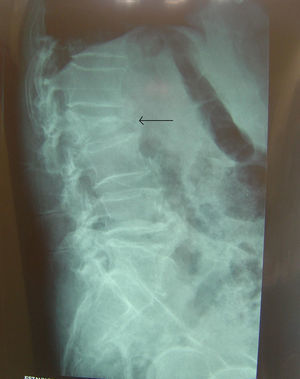
Paciente de 85 años que acude a la consulta por dolor lumbar bajo que irradia a zona posterior de piernas de 2 meses de evolución. Ha estado en tratamiento con AINE y relajantes musculares con nula respuesta. El dolor ha ido en aumento hasta el punto de impedirle la deambulación los últimos días. El paciente lo relaciona con un esfuerzo que realizó por esas fechas al intentar levantar a su esposa. Refiere, además, pérdida de 12kg de peso, pese a conservar el apetito y la ingesta. Últimamente ha presentado estreñimiento y algún episodio esporádico de incontinencia fecal, urgencia miccional y nicturia. Refiere clínica respiratoria de tos y expectoración de aspecto oscuro durante los últimos meses, sin saber precisar. Edemas en tobillo y en mano derecha. No presenta dolor torácico ni dolor abdominal ni náuseas ni vómitos, tampoco fiebre. Se le ha realizado una Rx lumbar que objetiva un aplastamiento de L2 (fig. 2). En el ámbito familiar, su esposa ha recibido tratamiento antibiótico durante 9 meses por tuberculosis (TBC) activa.
Antecedentes personalesNo se observan alergias medicamentosas conocidas. Presenta HTA en tratamiento con telmisartán 80.
Exploración físicaPresión arterial: 118/65mmHg. Pulso: 102 lpm. Temperatura: 37,4 °C.
Se observa un regular estado general y un regular estado de hidratación. Palidez de piel y mucosas.
Cuello: no hay adenopatías.
Tórax: no hay adenopatías suprainfraclaviculares.
Auscultación cardíaca: soplo sistólico, rítmico.
Auscultación pulmonar: hipoventilación generalizada, crepitantes bibasales.
Espalda: espinopercusión dolorosa desde L1 a sacro.
Extremidades: pulsos periféricos presentes, edemas maleolares, sin signos de trombosis venosa profunda.
Exploración neurológica: consciente y orientado temporoespacialmente. Lenguaje normal. No hay rigidez de nuca. Pupilas isocóricas y normorreactivas. Pares craneales normales. Tono normal. Cierta debilidad muscular para la flexión de ambos muslos.
ECG: ritmo sinusal, 100lpm, bloqueo incompleto de rama derecha del Haz de Hiss.
AnalíticaHematología: ligera leucocitosis (11.000/mm3), con neutrofilia (84%) y linfopenia (5%). Bioquímica: ALT: 48U/I, GGT: 407U/I, fosfatasa alcalina: 295U/I, LDH: 510U/I, VSG: 50mm/h, PCR: 10mg/dl.
El resto de la analítica fue anodina.
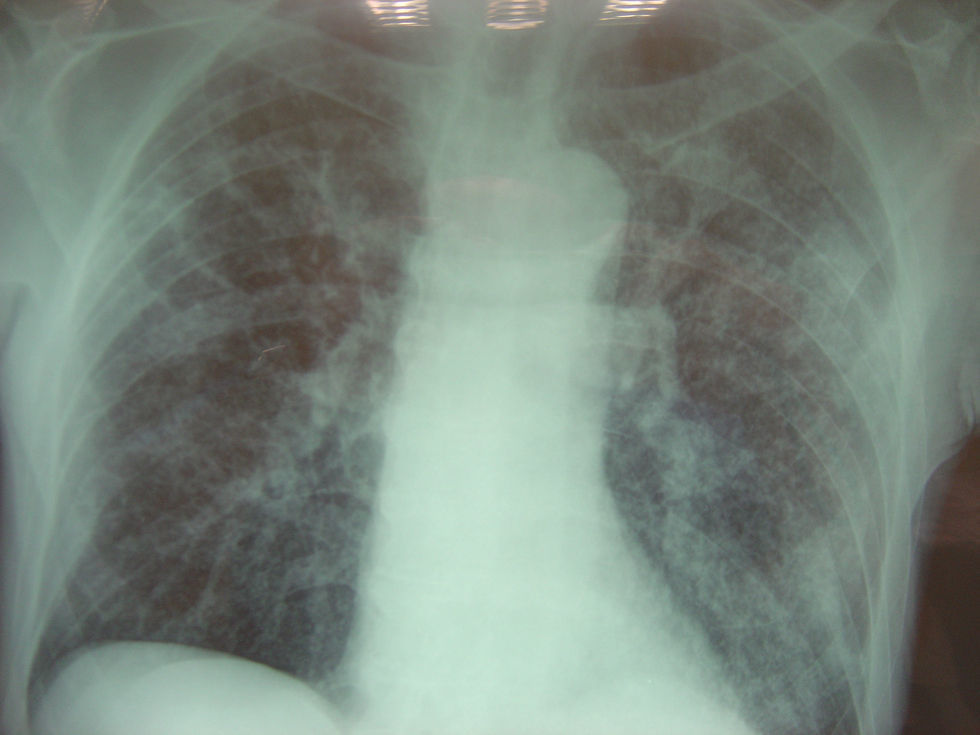
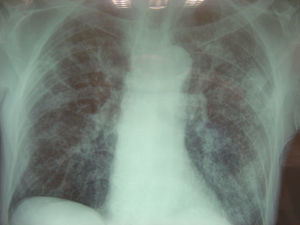
Radiografía de tórax: se informa como infiltrado intersticial bilateral micronodulillar, patrón miliar diseminado (fig. 1).
Prueba de tuberculina: 15mm.
Juicio clínicoAnte la sospecha (clínica y analítica) de tuberculosis miliar se deriva para ingreso y estudio a medicina interna.
Durante el ingreso en la planta de medicina interna, al paciente se le realizan TC de tórax, TC de columna lumbar, TC craneal, RM lumbar, PAAF y cultivo del material de punción en L2.
TC de tórax: múltiples nodulillos diseminados de forma difusa por ambos campos pulmonares, sin adenopatías mediastínicas ni hiliares; moderado derrame pleural.
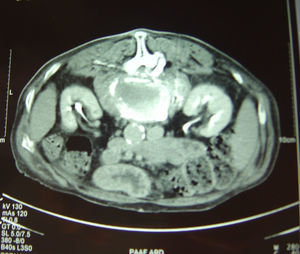
TC de columna dorsolumbar: fractura aplastamiento de L2, calcificación redondeada en psoas bilaterales compatible con zonas abscesificadas.
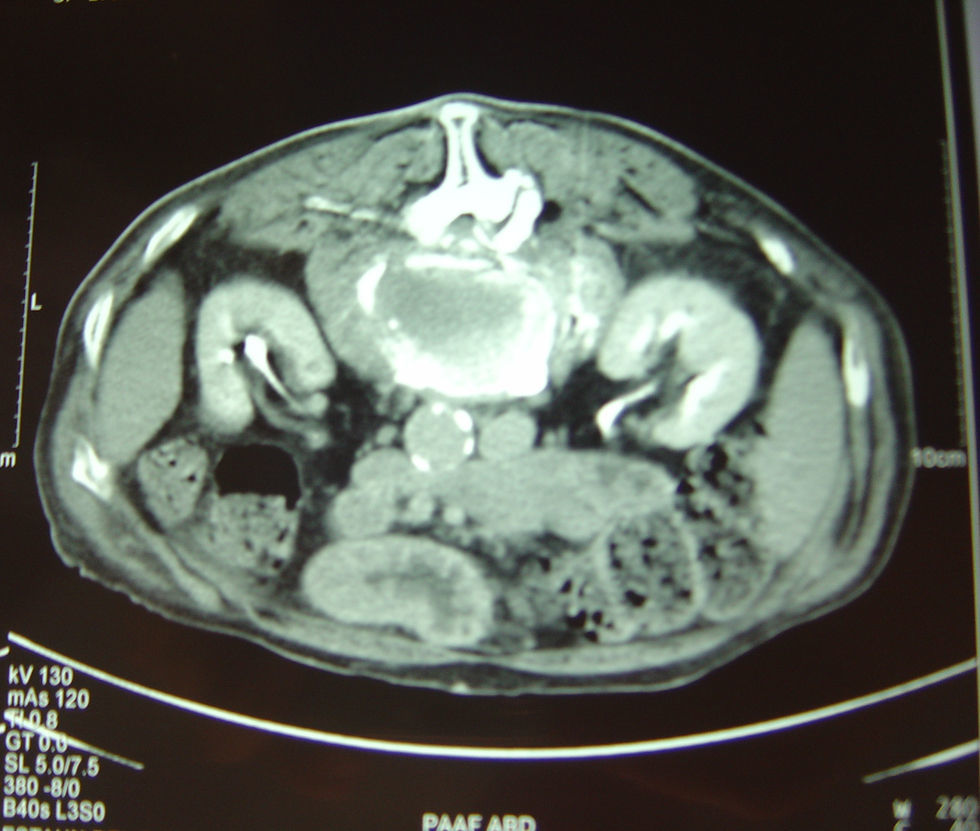
RM lumbar: fractura aplastamiento de L2, colecciones líquidas en psoas (fig. 3).
PAAF: punción en L2; el cultivo resultó positivo para Mycobacterium tuberculosis.
Microbiología: positividad de reacción en cadena de la polimerasa (PCR) en esputo para M. tuberculosis y baciloscopia de esputo.
Diagnóstico diferencial- 1.
TBC miliar: baciloscopia (–)
- ○
Cultivo Lowenstein: pendiente (positivo a las 4 semanas).
- ○
Cultivo Middlebroock: pendiente (positivo).
- ○
- 2.
Metástasis de carcinoma: principalmente tiroideo, que cuando se realiza la TC torácica no es determinante. Se solicitan hormonas tiroideas, siendo normales. Durante el estudio se han solicitado diversos marcadores tumorales siendo todos negativos (antígeno prostático específico [PSA], antígeno carcinoembrionario (CEA), alfafetoproteína, antígeno Ca-125 y 19.9, beta-2-microglobulinemia.
- 3.
Sarcoidosis: enzima conversiva de angiotensina (ECA) negativo.
- 4.
Granulomatosis de Wegener: anticuerpo anticitoplasma de neutrófilos (ANCA) y anticuerpos antinucleares (ANA) negativos.
- 5.
Artritis reumatoide: factor reumatoide (FR) negativo.
- 6.
Otros con los que realizar diagnóstico diferencial: histiocitosis X, fibrosis pulmonar, pulmón del granjero, silicosis, hemosiderosis, enfermedad de Niemann-Pick, Listeria, neumonía por varicela.
Juicio clínico definitivo: TBC miliar con afectación:
- 1.
Pulmonar.
- 2.
Ósea con espondilitis y aplastamiento de L2, invasión del canal medular y abscesos de psoas (mal de Pott).
- 3.
Hepática, con alteraciones analíticas típicas.
El paciente fue tratado con rifampicina, isoniacida, pirazinamida y myambutol, iniciando una mejoría clínica hacia las tres semanas y completando el tratamiento durante 9 meses. El paciente requirió tratamiento rehabilitador, con mejoría parcial dada su edad.
Comentario finalLa TBC miliar es la diseminación hematógena del M. tuberculosis; el término miliar se utiliza para todas las formas progresivas y diseminaciones hematógenas.
La clínica puede ser muy variable, durante la infección primaria el comienzo puede ser agudo y de rápida evolución, incluyendo fallo multiorgánico o shock séptico, o TBC miliar tardía con un curso subagudo o crónico (siendo estas formas más frecuentes). Muchos casos se pierden y se diagnostican post mórtem.
La participación pulmonar ocurre en el 50%, cursando con tos, expectoración, disnea, hipoxemia y derrame pleural (un 15% de los pacientes confirmados de TBC diseminada pueden tener Rx normales). La afectación del tracto gastrointestinal ocurre en el 33% de los casos, manifestándose como dolor abdominal difuso o localizado a nivel de hipocondrio derecho (HCD), acompañado de náuseas, vómitos, diarrea, hepatoesplenomegalia y alteraciones analíticas (aumento de fosfatasas alcalinas y transaminasas). La alteración del SNC ocurre en el 15–20% de los casos en forma de meningitis tuberculosa (post mórtem, más del 50% tenía daño meníngeo).
Otras formas de presentación más infrecuentes son la afectación ósea (como en nuestro caso) a nivel vertebral, la osteomielitis o artritis, la afectación cutánea en forma de máculas o pápulas generalizadas, rush o TBC liquenoide, la alteración cardiovascular (como pericarditis), la endocarditis, la afectación suprarrenal (aunque en necropsias se ve una afectación del 40%) y, por último, la TBC coroidea, que es específica de TBC miliar.
La afectación ósea y articular por TBC supone el 35% de todas las formas de TBC extrapulmonar y el 2% de todos los casos de TBC.
La mitad de los pacientes con afectación musculoesquelética tienen como localización preferente la columna vertebral; en segundo lugar se encuentra la artritis tuberculosa, seguida de la osteomielitis extraespinal.
La TBC vertebral, también denominada enfermedad de Pott o espondilitis tuberculosa, afecta principalmente a la columna lumbar y a la dorsal baja. Se puede asociar a un absceso paravertebral bilateral.
Conclusiones- •
La TBC extrapulmonar representa el 10–20% del total de TBC que padecen los enfermos inmunocompetentes. La gran mayoría de las TBC extrapulmonares tienen baciloscopia negativa.
- •
Su presencia se incrementa en las personas portadoras de algún grado de inmunodeficiencia.
- •
En un porcentaje elevado de casos existe un foco primitivo pulmonar. Salvo excepciones, el tratamiento de la TBC extrapulmonar es similar al indicado en la TBC pulmonar.