El cáncer de mama es una enfermedad prevalente con implicaciones en todas las esferas de la vida de las pacientes, por lo que el médico de familia debe conocer en profundidad esta dolencia, para optimizar la atención con los mejores recursos disponibles.
Los 5 artículos que se presentan ofrecen un resumen elaborado a partir de una revisión detallada de la literatura sobre el cáncer de mama publicada en los últimos 10 años. Este segundo artículo aborda el cribado poblacional y sus controversias, el cribado en las mujeres de mayor riesgo y las recomendaciones actuales.
Esta revisión pretende ofrecer una visión global, actualizada y práctica sobre esta enfermedad que permita resolver los interrogantes que se presentan en la consulta de Atención Primaria, facilitar respuestas a las mujeres que lo soliciten y, en definitiva, permanecer al lado de las pacientes a lo largo de su enfermedad con la tranquilidad del conocimiento.
Breast cancer is a prevalent disease affecting all areas of patients’ lives. Therefore, family doctors need to thoroughly understand this disease in order to optimize the health care services for these patients, making the best use of available resources.
A series of 5 articles on breast cancer is presented below. It is based on a review of the scientific literature over the last 10 years. The second one deals with population screening and its controversies, screening in high-risk women, and the current recommendations.
This summary report aims to provide a current and practical review about this problem, providing answers to family doctors, and helping them to be able to care for their patients for their benefit throughout their illness.
En el primer artículo de los 5 que componen esta actualización sobre el cáncer de mama para Atención Primaria se expusieron los motivos que han llevado a la realización de este trabajo, así como el objetivo final de ofrecer una visión global, actualizada y práctica sobre el cáncer de mama que permita resolver los interrogantes que se presentan en la consulta de Atención Primaria.
Este segundo artículo aborda el cribado poblacional del cáncer de mama, describe las técnicas utilizadas para el cribado, incluye las distintas controversias suscitadas hasta el momento y recoge las recomendaciones actuales de algunas de las principales agencias de salud. Su última parte está dedicada al cribado en mujeres en situaciones de riesgo aumentado y el consejo genético en estos tumores.
Para elaborar este artículo se ha revisado la literatura científica de los últimos 10 años, consultando bases de datos (PubMed, Cochrane, MEDES, IBECS), plataformas (BMJ, Science Direct, OVID), e información ofrecida por distintas sociedades científicas e institutos nacionales sobre cáncer, eligiendo fundamentalmente artículos de revisión y guías clínicas sobre cribado de cáncer de mama y cáncer de mama hereditario.
Diagnóstico precoz del cáncer de mamaPrevención secundaria del cáncer de mama. Programas de cribado. Técnicas de cribadoHasta el momento actual, la posibilidad de cambiar la historia natural del cáncer de mama se ha basado en la prevención secundaria, dado que los principales factores de riesgo conocidos (edad, sexo, antecedentes familiares y personales, menarquia precoz, menopausia tardía) no se pueden modificar.
El cáncer de mama constituye un importante problema de salud con altas tasas de morbimortalidad, que puede ser detectado en una fase preclínica mediante un test de cribado como es la mamografía (MX) (prueba sencilla, con adecuadas sensibilidad, especificidad y valor predictivo), y para el que existe un tratamiento que, aplicado precozmente, permite una actuación más conservadora en un alto porcentaje de los casos y proporciona tasas de supervivencia más elevadas. La decisión de realizar pruebas de detección precoz en una población o en determinados pacientes implica evaluar beneficios y costes.
Las medidas de prevención secundaria pretenden disminuir la mortalidad por esta causa, reducir las complicaciones debidas a la enfermedad y aumentar la calidad de vida de las personas afectadas.
Programas de cribado en EspañaLa Unión Europea, en el año 2003, estableció sus recomendaciones de cribado poblacional de cáncer, incluyendo entre ellas el cribado de cáncer de mama mediante MX cada 2 años en las mujeres de 50 a 69 años, de acuerdo con las directrices de la Guía Europea de Garantía de Calidad en cribado mamográfico. Esta guía recoge los estándares de calidad recomendados y constituye un documento de referencia en todos los aspectos del cribado (cuarta edición, año 2006)1.
En nuestro país, todas las comunidades autónomas (CCAA) y la Estrategia en Cáncer del Sistema Nacional de Salud del año 2009 apoyan la conveniencia de este cribado.
Actualmente, el cribado de cáncer de mama en España se ofrece al 100% de la población objetivo. La prueba de cribado es la MX (2 proyecciones, craneocaudal y oblicua mediolateral) por cada mama, con un intervalo bienal2.
Los Programas de Diagnóstico Precoz de Cáncer de Mama precisan de una participación multidisciplinar, con personal especialmente entrenado y cualificado, que colabore en la evaluación y el análisis de los resultados3.
En España, la implantación de los Programas de Diagnóstico Precoz de Cáncer de Mama ha sido progresiva a lo largo de los años y con protocolos organizativos distintos. Esto, unido a otros factores, hace que las diferencias en el funcionamiento de los distintos programas y la ausencia de uniformidad en el registro de los datos ocasione dificultades para el análisis de los resultados y su comparación entre las distintas CCAA4,5.
La edad de cribado abarca desde los 50 a los 64 años. En varias CCAA, siguiendo las recomendaciones del Consejo Europeo, han ampliado el límite superior hasta los 69 años y 6 de ellas incluyen, además, el grupo de 45 a 49 años2.
El número mínimo de lecturas/año no se exige por igual en las distintas CCAA. Siguiendo las directrices europeas, sería recomendable que cada radiólogo realizara un mínimo de 5.000 lecturas anuales1. El método de lectura más recomendable sería la doble lectura con arbitrio (2 radiólogos leen de forma independiente y, si no concuerdan, un tercer radiólogo haría prevalecer la conducta coincidente). La mayoría de los programas emplea la doble lectura independiente por 2 radiólogos con consenso (resultado definitivo consensuado entre ambos). Otras modalidades utilizadas son: lectura simple (un lector) y doble sin consenso (se acepta el resultado más desfavorable de las 2 valoraciones). Cada modelo presenta ventajas e inconvenientes; a mayor complejidad, mayor coste con mayor tasa de detección1,3,6.
El sistema de lectura y clasificación mamográfica es el sistema BI-RADS del Colegio Americano de Radiología. Este sistema ha permitido homogeneizar la terminología y clasificar las lesiones según el grado de sospecha, estableciendo la recomendación a tomar en cada caso.
Existe la Red de Programas de Cribado de Cáncer, que agrupa todos los programas nacionales, establece criterios y normas de actuación, elabora indicadores básicos basándose en las Guías Europeas de Garantía de Calidad en Cribado, y representa a España en la Red Europea de Cribado.
Técnicas de cribadoLa MX constituye el gold standard del cribado en cáncer de mama. La sensibilidad de la primera MX se mueve entre el 77-95%, con una especificidad en torno al 95%, aunque variable según los autores. Ambas disminuyen en mujeres jóvenes o en aquellas con mamas más densas.
Esta variabilidad depende en parte de la experiencia del radiólogo que evalúa la prueba. Su interpretación es una labor compleja, ya que la presentación radiológica del cáncer de mama es variable y algunas lesiones requieren un nivel alto de entrenamiento y especialización para poder ser detectadas.
En los últimos años, y de forma progresiva, la MX digital está reemplazando a la analógica. Ofrece algunas ventajas, como pueden ser disminución de la dosis de radiación, reducción de la tasa de repeticiones, mayor facilidad para comparar con estudios anteriores y existencia de herramientas que mejoran la detección (manipulación del contraste, zoom y sistemas de detección asistida por ordenador)6. Esta técnica permite también integrar la información en redes digitales. En una revisión de la evidencia comparando ambas técnicas (analógica y digital) no se hallaron diferencias significativas en su aplicación en la población de cribado, aunque sí se detectó que la MX digital presentaba beneficios potenciales, sobre todo en menores de 50 años, en mujeres con mamas densas o densidad heterogénea. En esta misma revisión se hace referencia a la necesidad de realizar más estudios comparativos que valoren el coste-efectividad y que incluyan seguimientos para valorar el efecto real sobre la disminución de la mortalidad7.
La ecografía (ECO) es un método de cribado complementario a la MX. Nunca sustituye a la MX en el cribado por sus limitaciones. Su realización por radiólogos expertos consigue valorar mejor determinados hallazgos mamográficos, otorgando un mejor grado de sospecha. También permite detectar lesiones adicionales (MX negativa y lesión palpable o mama densa)6,8.
La resonancia magnética (RM) es la técnica de imagen de elección para el diagnóstico precoz del cáncer de mama en aquellas mujeres con implantes de mama8,9, y es la técnica complementaria a la MX en el estudio de mujeres de alto riesgo9,10.
La tomosíntesis, aprobada por la FDA en febrero de 2011, ha conseguido mejorar la sensibilidad diagnóstica y reducir la tasa de segundas exploraciones en determinados tipos de mamas, como en las que son muy densas, donde la MX presenta limitaciones (sensibilidad próxima al 48% de MX en estos casos). Es capaz de detectar nódulos y distorsiones de la arquitectura que la superposición de imágenes en la MX convencional puede ocultar, o bien descartar alteraciones inicialmente sospechosas. Esta nueva tecnología consiste en la realización, con un mamógrafo digital especialmente adaptado para ello, de una serie de imágenes radiográficas de la mama (al menos 15), desde diferentes ángulos siguiendo un movimiento circular en arco, en aproximadamente 11s. Simultáneamente el equipo realiza una MX digital convencional, procesando en 3 o 4s toda la información y con reconstrucción en 3D de los cortes adquiridos. Las imágenes obtenidas en los múltiples cortes pueden ser visualizadas de manera individual o de forma secuencial en modo dinámico tipo «cine» en la estación de trabajo11.
La dosis de irradiación que recibe la paciente (proyección de 2D más las 15 de 3D) no supera las recomendaciones del Mammography Quality Standards Act y suma un total que oscila entre los 2,4 y los 2,7mGy (valores en línea con las recomendaciones del protocolo de control de calidad para MX digital).
La exploración física de la mama aporta poco a la MX como método de cribado. Se realiza en los casos en que la mujer refiera antecedentes familiares en primer grado, dolor, tumoración u otros signos, o a criterio del profesional, tras el examen del estudio radiológico.
Controversias sobre el cribado poblacionalEl cribado se dirige a una población «asintomática», por ello debe cumplir requisitos más estrictos que los exigibles a pruebas diagnósticas empleadas en pacientes sintomáticas.
El cribado de cáncer de mama es una de las actuaciones de salud pública más discutidas.
El concepto de balance riesgo-beneficio no se evalúa como tal en ningún estudio.
Respecto a este balance, persiste una importante controversia en el mundo científico que se deriva, por una parte, de las limitaciones de los estudios (son antiguos, o presentan carencias, errores en la publicación de los datos, sesgos de aleatorización, grupos de edad dispares, etc.), y por otra parte, de la subjetividad que afecta al análisis de los mismos.
Dudas sobre los beneficiosEl beneficio principal que se busca con el cribado es la disminución de la mortalidad por cáncer de mama. Las formas más habituales de evaluarlo son mediante la disminución relativa y la disminución absoluta de la mortalidad. Ambas se obtienen de comparar las muertes producidas en el grupo de mujeres invitadas al cribado frente a las producidas en el grupo control.
A pesar de los posibles sesgos (principalmente el de la causa de la muerte), la mejor información se obtiene de los ensayos clínicos aleatorizados (ECA). Estos intentan demostrar esta reducción de la mortalidad con un resultado variable dependiendo de factores como el rango de edad de las mujeres incluidas, el proceso de aleatorización, los años de seguimiento, etc.
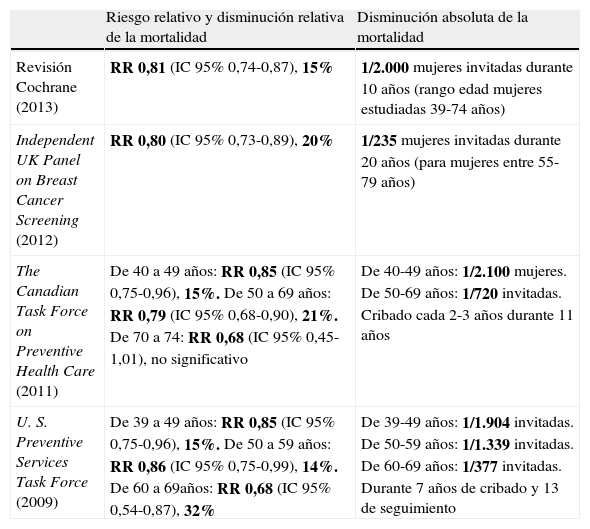
Al comparar los informes publicados por distintas agencias (tabla 1), se observan conclusiones dispares, a pesar de analizar los datos obtenidos de los mismos ensayos clínicos (11 ensayos, 3 de ellos desarrollados en 2 fases), y ello se debe a que su interpretación se basa en distintos aspectos y utilizan diferentes métodos de metaanálisis12.
Riesgo relativo y disminución de la mortalidad por cáncer de mama basados en ensayos clínicos aleatorizados según diferentes agencias
| Riesgo relativo y disminución relativa de la mortalidad | Disminución absoluta de la mortalidad | |
| Revisión Cochrane (2013) | RR 0,81 (IC 95% 0,74-0,87), 15% | 1/2.000 mujeres invitadas durante 10 años (rango edad mujeres estudiadas 39-74 años) |
| Independent UK Panel on Breast Cancer Screening (2012) | RR 0,80 (IC 95% 0,73-0,89), 20% | 1/235 mujeres invitadas durante 20 años (para mujeres entre 55-79 años) |
| The Canadian Task Force on Preventive Health Care (2011) | De 40 a 49 años: RR 0,85 (IC 95% 0,75-0,96), 15%. De 50 a 69 años: RR 0,79 (IC 95% 0,68-0,90), 21%. De 70 a 74: RR 0,68 (IC 95% 0,45-1,01), no significativo | De 40-49 años: 1/2.100 mujeres. De 50-69 años: 1/720 invitadas. Cribado cada 2-3 años durante 11 años |
| U. S. Preventive Services Task Force (2009) | De 39 a 49 años: RR 0,85 (IC 95% 0,75-0,96), 15%. De 50 a 59 años: RR 0,86 (IC 95% 0,75-0,99), 14%. De 60 a 69años: RR 0,68 (IC 95% 0,54-0,87), 32% | De 39-49 años: 1/1.904 invitadas. De 50-59 años: 1/1.339 invitadas. De 60-69 años: 1/377 invitadas. Durante 7 años de cribado y 13 de seguimiento |
La revisión de los ECA (excluyeron el estudio de Edimburgo) publicada en 2012 por un grupo de expertos independientes del Reino Unido (IBSR) presenta como conclusión un riesgo relativo del 0,80 (IC 95% 0,73-0,89) tras 13 años de seguimiento, y aunque detecta cierta heterogeneidad entre los estudios, no la considera relevante. Por tanto, la estimación de reducción de la mortalidad en las mujeres invitadas al cribado sería de en torno al 20%. También analizan distintos tipos de estudios observacionales, y aunque aportan una información más reciente que los ensayos clínicos que se realizaron hace más de 20-30 años, los consideran menos fiables, con más limitaciones y una sobrestimación del beneficio13.
Una revisión Cochrane (también elimina el estudio de Edimburgo) publicada en 2013, que incluye 600.000 mujeres entre 39-74 años, estima el riesgo relativo para el conjunto de los ensayos tras 13 años de seguimiento en un 0,81 (IC 95% 0,74-0,87), un 0,90 para los ensayos que considera adecuadamente aleatorizados y un 0,75 para los de aleatorización subóptima. Considera plausible que el cribado de cáncer de mama reduzca la mortalidad tras 13 años de seguimiento en un 15%, a costa de un sobrediagnóstico y sobretratamiento del 30%.
Finalmente añade que los resultados recientes de estudios observacionales sobre cribado muestran un mayor sobrediagnóstico que los ensayos clínicos, y escasa o nula reducción de la incidencia de cáncer avanzado14.
Ambas revisiones cuestionan si el resultado de estos estudios seguiría siendo relevante hoy en día debido a los cambios producidos en los últimos años en el conocimiento y tratamiento de la enfermedad.
Otros autores opinan que los ECA en los que se basan gran parte de las conclusiones podrían subestimar el beneficio del cribado porque muchas de las mujeres invitadas no acudieron, se realizaron MX en el grupo de control y las técnicas utilizadas no cumplían lo que hoy se considera estándar de calidad15.
Una revisión reciente de estudios observacionales europeos sobre el impacto de los programas de cribado en mujeres de 50 a 69 años (Euroscreen 2012) encuentra en los estudios metodológicamente más válidos una reducción de la mortalidad por cáncer de mama del 25-35% entre las mujeres invitadas (del 38-48% de las realmente exploradas). Por cada 1.000 mujeres entre 50-69 años cribadas, se evitarían entre 7-9 muertes (de las 30 esperadas), diagnosticándose un total de 71 cánceres (4 más que sin cribado)16.
Por otro lado, aunque las evidencias sobre los beneficios del cribado referentes a disminución de la mortalidad no parecen del todo concluyentes, son varios los autores que creen que habría que valorar otras consideraciones, como son el diagnosticar cánceres más pequeños, con menor afectación glanglionar o metástasis, o menos infiltrantes17.
Deberíamos tener en cuenta que no todas las mujeres se beneficiarán por igual del cribado poblacional, los hallazgos parecen más claros en mujeres mayores de 50 años y cuando la tasa de participación en el cribado es mayor del 70%1. Además, el cáncer de mama presenta una gran variabilidad en el tiempo de duplicación, oscilando entre pocos días (en el carcinoma inflamatorio) y alrededor de un año. El diagnóstico precoz es más eficaz para los tumores de crecimiento lento; los de crecimiento rápido tienen menor probabilidad de ser detectados.
La densidad mamográfica elevada es uno de los factores de riesgo de cáncer de mama, siendo en estas mamas la sensibilidad de la MX menor. El empleo de MX digital, ECO, RM y tomosíntesis puede aumentar la detección de cáncer en mamas densas, pero en el contexto del cribado es necesario valorar el coste en términos de rentabilidad6,7,10.
Existe una gran controversia en cuanto a las mujeres menores de 50 años. El debate se centra en la relación coste-riesgo-beneficio. A esta edad, la incidencia del cáncer es menor, los tumores son de crecimiento más rápido y la densidad mamaria es mayor. La falta de consenso en este grupo de edad ha generado mensajes contradictorios en la población.
El beneficio del cribado en mujeres con una expectativa de vida inferior a 5 años es dudoso. La detección temprana del cáncer y el tratamiento rápido seguramente no reducirán la morbimortalidad en los 5 años de supervivencia prevista, pero las consecuencias negativas se presentarán de inmediato (pruebas adicionales, aplicación de un tratamiento que podría empeorar su calidad de vida sin mejorar la supervivencia)18.
Aunque algunos ECA incluyeron mujeres de entre 70 y 74 años, el número de pacientes participantes de este grupo resulta insuficiente para realizar una valoración.
Parece que las mujeres mayores de 70 años aún podrían beneficiarse gracias a la elevada sensibilidad de la MX en estas edades, pero esto conlleva un mayor riesgo de sobrediagnóstico. Además, en mujeres mayores aumenta la proporción de tumores sensibles a estrógenos y, por tanto, más fáciles de tratar. Finalmente, a estas edades existe mayor riesgo de morir por otra causa. Se debería realizar una valoración individual teniendo en cuenta otras comorbilidades y el estado de salud de la mujer15,18,19.
Riesgos potenciales del cribado de cáncer de mamaMuchas de las controversias en el cribado de cáncer de mama giran alrededor de cómo equilibrar los riesgos con los beneficios potenciales.
Los riesgos identificados son reales, aunque la carga de estos se podría discutir (ansiedad ante los resultados, falsos negativos, falsos positivos, riesgos asociados a la realización de pruebas, sobretratamiento en las formas más leves de la enfermedad, etc.).
La MX realizada a las mujeres utiliza rayos X y, por lo tanto, las expone a dosis de radiación ionizante. El riesgo teórico de cáncer inducido por radiación se basaba en datos recogidos de mujeres con exposiciones a radiaciones mucho mayores (como mujeres radiadas por linfoma, supervivientes de bombas atómicas, etc.). La dosis promedio para una exploración estándar de 2 proyecciones con MX digital es de 3,7mGy frente a los 4,7mGy3 con MX analógica, y se considera insignificante para producir un cáncer radioinducido6. El riesgo de radiación está relacionado también con la edad a la exposición. La glándula mamaria de la mujer adolescente es indiferenciada y altamente susceptible a la radiación. El riesgo puede incrementarse con la acumulación de dosis de las MX realizadas a lo largo de la vida, especialmente cuando la mamografía periódica se inicia a edades jóvenes15.
La aparición de cáncer entre 2 exploraciones (llamado cáncer de intervalo [CI]) es un importante indicador de la calidad de un programa. Se estima que entre un 10-30% de los cánceres pueden no detectarse con la MX6; de ellos, un porcentaje se puede ver retrospectivamente (serían falsos negativos). No se puede evitar la aparición del CI, pero su proporción debe mantenerse lo más baja posible, sin exceder del 20%, porque si es mayor reduce la efectividad del programa3.
Otro aspecto de estos falsos negativos es la sensación de falsa seguridad en la mujer, que podría ocasionar un retraso en el diagnóstico de cáncer.
En relación con los falsos positivos, la recitación o rellamada para realizar estudios complementarios es uno de los principales inconvenientes del cribado. Un alto porcentaje incrementa los costes del programa y genera ansiedad en las mujeres. También disminuye la probabilidad de que la mujer vuelva a la siguiente convocatoria6. Por el contrario, tasas de recitación bajas disminuyen la detección y aumentan los CI.
Conseguir tasas de rellamada aceptables (inferiores al 7% en ronda inicial y al 5% en sucesivas, como recomienda la Guía Europea)1 supone conseguir un equilibrio entre diagnosticar el mayor número de tumores y minimizar los daños ocasionados por falsos positivos.
Los datos publicados sobre recitación (que incluyen otras proyecciones, ecografías e indicación de procedimientos invasivos, principalmente biopsias) son variables según la bibliografía consultada. Se considera que el riesgo de falsos positivos oscila entre el 1-6% tras un estudio mamográfico, pudiendo elevarse hasta al 50% tras 10 estudios. El riesgo de procedimiento invasivo varía entre el 1-30%.
También se ha visto que la aparición de falsos positivos es mayor cuanto más joven es la mujer (2-4% por estudio, si bien no parece que esto suponga un aumento de procedimientos invasivos)12.
Existe también la posibilidad del sobrediagnóstico y sobretratamiento en los cribados de cáncer debido a que algunos tumores detectados nunca hubieran dado síntomas y, por tanto, no se hubiesen diagnosticado (la mujer podría morir por otra causa), existiendo también la posibilidad teórica de tumores de crecimiento tan lento que nunca se hubieran manifestado, por quedar estáticos o, incluso, remitir12. Aunque esto último fuese cierto en algunos casos, actualmente no se puede conocer a priori cuáles son los tumores potencialmente poco agresivos que no precisarían ser tratados. Solo es posible estimar su número3.
Dimensionar esta estimación adecuadamente no parece fácil, teniendo en cuenta la variación de formas para calcularlo; de esto se derivan las diferencias mostradas en los estudios12–14,16,20,21. En la Revisión Cochrane de 2013 se estima un sobrediagnóstico del 30%; el grupo independiente del Reino Unido (IBSR) en 2012 cifró este valor en un 11-19%, y añade que por cada cáncer prevenido se estima que se produzcan 3 casos sobrediagnosticados y tratados; la U. S. Task Force en 2009 lo valoró entre el 1-10%, y el estudio Euroscreen de 2012 consideró una sobrestimación de alrededor del 6,5%.
Serían necesarios nuevos ECA para evaluar los beneficios y los efectos adversos del cribado, pero factores como el coste, el tiempo necesario para obtener resultados en morbimortalidad y cuestiones éticas, entre otros, hacen difícil la puesta en marcha de estos estudios.
Una alternativa a los ensayos poblacionales son los modelos matemáticos (analíticos o de simulación), que utilizan información procedente de metaanálisis, ECA, estudios observacionales y registros demográficos y sanitarios. Recogen datos de beneficios y costes, pero pocos son los que han incluido los efectos adversos. Constituyen una herramienta dinámica, pues permiten tener en cuenta la evolución de la población o de los programas, y podrían ser, en un futuro, la respuesta a dudas que se plantean sobre el impacto en la reducción de la mortalidad y el coste del cribado22.
Recomendaciones actuales de cribado poblacional20,21,23Recientemente, tanto la CTF como la USPSTF han reducido la fuerza de las recomendaciones para este cribado, y el PAPPS también ha adoptado recomendaciones más restrictivas. Todo ello se resume en la tabla 2.
Recomendaciones para el cribado de cáncer de mama en población general según diferentes agencias
| USPSTF (diciembre 2009) | Canadian Task Force (2011) | PAPPS (2012) |
| La decisión de iniciar un cribado regular cada 2 años antes de los 50 debe ser individualizada y tener en cuenta las características de los pacientes, incluyendo sus preferencias en cuanto a beneficios y riesgos (Recomendación Grado C) | Mujeres de 40-49 años recomiendan no hacer cribado de rutina con mamografía (recomendación débil, calidad de evidencia moderada) | La mamografía de cribado no debería recomendarse a las mujeres de 40 a 49 años (evidencia moderada, recomendación débil en contra) |
| Recomienda screning con mamografía bienal a mujeres de 50 a74 años (Recomendación Grado B) | Para las mujeres de 50-69 años recomienda cribado con mamografía cada 2 a 3 años (recomendación débil, calidad de evidencia moderada) | La mamografía de cribado debería recomendarse a las mujeres de 50 a 69 años cada 2 años (evidencia moderada, recomendación débil a favor) |
| La evidencia actual para evaluar los beneficios y riesgos de la mamografía en mujeres mayores de 75 años es insuficiente | Para las mujeres de 70-74 años recomienda cribado con mamografía cada 2 a 3 años (recomendación débil, calidad de evidencia baja)No hacen recomendaciones para las mujeres mayores de 75 años por falta de datos | La mamografía de cribado debería recomendarse a las mujeres de 70 a 74 años cada 2 años (evidencia baja, recomendación débil a favor) |
| Recomienda en contra de enseñar cómo se debe hacer la autoexploración mamaria (Recomendación Grado D) | Recomiendan no asesorar a las mujeres en autoexploración mamaria rutinaria (recomendación débil, calidad de evidencia moderada) | |
| La evidencia actual para evaluar los beneficios y riesgos adicionales del examen clínico de la mama (CBE) más allá del cribado con mamografía en mujeres mayores de 40 años es insuficiente | Recomiendan no realizar rutinariamente examen clínico de la mama sólo o combinado con mamografía (recomendación débil, calidad de evidencia baja) | |
| La evidencia actual para evaluar el beneficio o daño adicional de usar la mamografía digital o la resonancia magnética en lugar de la mamografía convencional como modalidad de cribado es insuficiente | No recomiendan realizar cribado habitual con resonancia magnética (recomendación débil, no hay evidencias) |
El enfoque de exponer a los pacientes los riesgos y beneficios y permitirles tomar sus propias decisiones conlleva también problemas, ya que para los médicos puede resultar difícil comunicar conceptos científicos, y para los pacientes, comprenderlos; el profesional puede carecer de tiempo para transmitir toda la información necesaria, y, por otro lado, existen pacientes que prefieren dejar las decisiones en manos de los médicos. Además, muchas mujeres sobrestiman la eficacia del cribado, desconocen que existen los falsos negativos, y piensan que hacerse una MX disminuye la posibilidad de padecer cáncer.
Finalmente, valorar estos posibles beneficios o riesgos puede ser irrelevante en la decisión final del paciente, influyendo más las costumbres sociales, los miedos e intuiciones o el consejo de familiares o amigos24.
Concepto de riesgo elevado e intermedio para cáncer de mama y recomendaciones de cribadoEl cáncer de mama constituye uno de los principales problemas de salud para la mujer, pero el riesgo de padecerlo no es el mismo para toda la población.
La probabilidad de desarrollar cáncer de mama depende del efecto combinado de varios factores: genéticos, hormonales o reproductivos, enfermedad mamaria benigna proliferativa, densidad mamaria, y otros como edad, raza y dieta, reseñados en el capítulo anterior.
Se entiende por riesgo poblacional el riesgo que tiene una mujer de padecer cáncer de mama dentro de una determinada población. Cuando la mujer presenta historia personal o familiar asociada a una mayor probabilidad de mutaciones de genes de alta penetrancia decimos que presenta «alto riesgo». En un grupo de «riesgo intermedio» quedarían aquellas mujeres cuyos antecedentes predisponen a un mayor riesgo de cáncer de mama, sin presencia o sospecha de estos genes de alta penetrancia.
Se han desarrollado diferentes modelos matemáticos que permiten calcular el riesgo individual de padecer cáncer de mama, pero su correlación no es muy elevada y el resultado varía según el modelo utilizado porque los factores de riesgo que recogen no coinciden en todos los casos. Además, ninguno valora la densidad mamaria ni la presencia de tumores mamarios en parientes de tercer grado como factores de riesgo. Entre ellos destacan el modelo de Gail (http://www.cancer.gov/bcrisktool) y el de Claus (http://www4.utsouthwestern.edu/breasthealth/cagene/default.asp)10.
Menos de un 5% de los cánceres de mama se consideran hereditarios. De los distintos genes que han sido identificados como asociados, las mutaciones en los genes BRCA1 y BRCA2 son las que ocasionan mayor predisposición al cáncer de mama y ovario (genes transmitidos mediante herencia autosómica dominante), pero ambos genes solo aparecen en alrededor de un 15% de estas familias de riesgo25.
La penetrancia de las mutaciones BRCA sigue siendo tema de investigación (definida como probabilidad de que una enfermedad ocurra ante la presencia de una mutación). Causas no relacionadas con la genética, como pueden ser la toma de anticonceptivos orales, la ooforectomía, etc., pueden condicionarla.
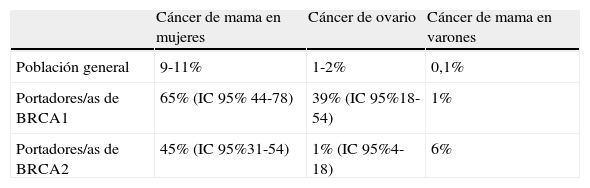
En la tabla 3 se resume el riesgo de padecer cáncer de mama u ovario en la población general y en portadores de las mutaciones BRCA1 y BRCA2, aunque la estimación del riesgo varía en los distintos estudios25,26.
Riesgo acumulado de cáncer de mama/ovario en población general y portadores/as de BRCA1/BRCA2
| Cáncer de mama en mujeres | Cáncer de ovario | Cáncer de mama en varones | |
| Población general | 9-11% | 1-2% | 0,1% |
| Portadores/as de BRCA1 | 65% (IC 95% 44-78) | 39% (IC 95%18-54) | 1% |
| Portadores/as de BRCA2 | 45% (IC 95%31-54) | 1% (IC 95%4-18) | 6% |
Entre los modelos que se han desarrollado para calcular la probabilidad de que un determinado miembro de la familia tenga una mutación de los genes BRCA1 y BRCA2 se encuentran el BRCAPRO o BRCA Program (http://www4.utsouthwestern.edu/breasthealth/cagene/default.asp) y el Breast and Ovarian Analysis of Disease Incidence and Carrier Estimation Algorithm28 (, http://www.srl.cam.ac.uk/genepi/boadicea/boadicea_intro.html). Este último puede utilizarse también para estimar el riesgo de desarrollar cáncer de mama u ovario a una edad determinada.
La utilización de estos modelos predictivos implica conocerlos en profundidad y estar familiarizado con sus limitaciones. Hay factores que pueden limitar la capacidad predictiva de estos modelos, como el tamaño pequeño de la familia, la escasez de mujeres, o la etnia, entre otros. A medida que se van realizando más pruebas genéticas, se van modificando los modelos predictivos, consiguiendo una mejor evaluación del riesgo.
Mujeres de alto riesgo de cáncer de mamaSe consideran mujeres con alto riesgo de padecer cáncer de mama las portadoras de mutaciones en genes BRCA1 o BRCA2, sus familiares de primer grado (con BRCA desconocido) y aquellas con antecedentes familiares importantes.
En la tabla 4 se detallan los antecedentes familiares que permiten incluir a una mujer en la categoría de «alto riesgo» para padecer cáncer de mama. Estos criterios difieren entre las distintas guías de las diferentes CCAA29–31.
Criterios familiares de alto riesgo de cáncer de mama
| Tres casos en la familia |
| Tres o más casos de cáncer de mama u ovario en familiares de primer grado |
| Dos casos en familiares de primer o segundo grado |
| Dos casos de cáncer mama (en menores de 50 años los 2) |
| Dos casos de cáncer de ovario |
| Un cáncer de mama (menor de 50 años) y un cáncer ovario en 2 personas diferentes |
| Un cáncer de mama en varón y un cáncer de mama u ovario en mujer |
| Un cáncer de mama bilateral y otro cáncer de mama (menor de 50 años) |
| Un caso en la familia |
| Cáncer de mama en menor de 30 años |
| Cáncer de mama bilateral antes de los 40 años (al menos uno de los tumores) |
| Cáncer de mama y cáncer de ovario en la misma mujer |
Grados de parentesco: familiares de primer grado (comparten 50% genes): padres, hijos y hermanos; familiares de segundo grado (comparten 25% genes): abuelos, tíos, nietos y sobrinos; familiares de tercer grado (comparten 12,5% genes): primos hermanos, sobrinos nietos.
Fuente: elaboración propia con datos de la OncoGuía del consejo y asesoramiento genéticos en el cáncer hereditario29, Guía de práctica clínica en cáncer hereditario30 y la Sociedad Española de Oncología Médica31.
En cuanto a las recomendaciones de cribado para mujeres de alto riesgo, la mayoría de las guías recomiendan comenzar las exploraciones entre los 25-30 años6,10,31.
La MX a estas edades presenta inconvenientes por tener menor sensibilidad, por la aparición de tasas elevadas de CI y la posibilidad de provocar cánceres radioinducidos. La RM en este grupo de mujeres detecta un mayor número de cánceres (sensibilidad 71-94%, 2 veces mayor que el 36-59% de la MX) y encuentra tumores más pequeños y con menor porcentaje de afectación ganglionar. Presenta como inconvenientes su elevado coste económico, el tiempo de exploración requerido, la intolerancia por parte de algunas pacientes por claustrofobia, su contraindicación en portadoras de implantes metálicos, y una especificidad baja y muy variable (mencionada en distintas series en un 35-90%). La ECO tiene una sensibilidad de entre el 33 y el 65%. Es una técnica económica y no utiliza radiación ionizante, pero es dependiente del operador y el número de falsos positivos es mayor que con la MX6,9,10.
Hay discrepancias entre algún grupo europeo (la Sociedad Europea de Especialistas de Cáncer de Mama) que recomienda evitar realizar MX antes de los 34 años (en estas mujeres aconsejan RM y ECO anual) y guías americanas (American College of Surgeons, American College of Rheumatology, Society of Breast Imaging, National Comprehensive Cancer Network) que sí recomiendan la MX antes de los 35 años, justificando que el beneficio supera la exposición a la radiación y que se necesitan más estudios para descartar la MX como técnica de cribado en estos casos10.
Dos estudios multicéntricos recientes, uno alemán (EVA trial)32 y otro italiano (HIBCRIT-1)33, comparaban las distintas técnicas y encontraron que la tasa de detección de cáncer con RM en este grupo de mujeres era superior a la de la MX, incluso a la de MX más ECO, y esa tasa no aumentaba significativamente al añadirle las otras pruebas.
Actualmente, tanto las sociedades americanas como las europeas recomiendan realizar una RM de la mama junto a la MX anual. No hay datos suficientes para afirmar qué opción es mejor, si alternar ambas pruebas cada 6 meses o realizar las 2 a la vez.
El consenso entre la Sociedad Española de Oncología Médica y las sociedades de Atención Primaria (SEMFYC, SEMERGEN, SEMG)34 establece como medida de detección y prevención precoz del síndrome de mama-ovario hereditario asociado a BRCA1/BRCA2:
- -
RM y MX anuales a partir de los 25-30 años.
- -
Ecografía transvaginal y marcador tumoral CA 125 cada 6-12 meses a partir de los 35 años y hasta decisión de salpingooforectomía bilateral profiláctica.
Las pacientes con riesgo intermedio de desarrollar cáncer de mama presentan una probabilidad superior a la poblacional e inferior al grupo de mujeres con riesgo elevado. En este grupo de pacientes se centran las mayores dudas, ya que la MX en ellas puede presentar menor sensibilidad. Sin embargo, no se aconsejaría el uso sistemático de RM por la menor prevalencia de enfermedad, el menor coste-efectividad y la mayor tasa de falsos positivos10. Las pacientes incluidas en este riesgo intermedio se resumen en la tabla 5.
Criterios de riesgo intermedio de cáncer de mama
| Criterios de riesgo intermedio por historia personal | Criterios de riesgo intermedio por historia familiar | |
| Cáncer de mama previo | Dos familiares de primer grado con diagnóstico de cáncer de mama entre los 51-60 años | Un familiar de primer grado con cáncer de mama entre los 31-50 años |
| Diagnóstico previo de carcinoma lobulillar in situ, hiperplasia lobulillar atípica o hiperplasia ductal atípica | Un familiar de primer grado con cáncer de mama bilateral en mayor de 40 años | |
| Mama densa en la mamografía | ||
Aunque en pacientes de riesgo intermedio también se aconseja adelantar el inicio del cribado a los 25-30 años, esto no está consensuado y varía según la sociedad consultada. Se realizaría mediante MX anual, junto a ECO si la mama es densa, sobre todo si existe otro factor de riesgo intermedio, no existiendo evidencia suficiente para recomendar el uso de RM sistemática10.
Consejo genético en cáncer de mamaCuando una mujer consulta sobre su riesgo de padecer cáncer de mama y las medidas a seguir al respecto, el médico de familia debería informar, en base a una anamnesis e historia clínica dirigidas, si la mujer en cuestión pertenece a la categoría de «riesgo general» y, por tanto, debe seguir las directrices de cribado poblacional, o bien su riesgo es mayor, en cuyo caso debería ser derivada a una unidad especializada.
En España, desde 1998 se vienen creando, principalmente en los servicios de Oncología Médica de los hospitales, unidades de Consejo Genético en cáncer hereditario, formadas por un equipo cualificado y dirigidas por facultativos (generalmente oncólogos), cuya finalidad es ofrecer consejo y asesoramiento a pacientes con cáncer y sus familiares. En este complejo proceso de asesoramiento, se analizan todos los factores de riesgo personales y familiares posibles (al menos 3 generaciones), se informa sobre la probabilidad de ser portador de mutación y de desarrollar cáncer, y se ofrecen las recomendaciones más adecuadas al riesgo detectado. Todo ello implica tener en cuenta diferentes aspectos médicos, psicológicos, éticos y legales, dando prioridad en todo momento al principio de autonomía del paciente y de no maleficencia34,35.
El único test genético recomendado en el cáncer de mama actualmente sigue siendo el de los genes BRCA1 y BRCA2, pero no se realiza el estudio genético en todos los casos. Una vez valorado el riesgo, la Unidad de Consejo Genético recomendará el estudio a las mujeres de alto riesgo y, fundamentalmente, cuando su resultado pudiera influir en el diagnóstico o tratamiento de la paciente o sus familiares.
Además, es necesario considerar el impacto emocional que puede ocasionar esta medida y asegurarse de que el paciente ha comprendido la información que se le da, especialmente lo referente a los beneficios y limitaciones de someterse a la prueba (precisa consentimiento informado).
No se recomendaría el estudio genético en niños ni adolescentes, ya que estos no van a obtener un beneficio inmediato.
Entre los posibles beneficios de la realización del estudio genético se encuentran la disminución de la incertidumbre, la posibilidad de actuaciones profilácticas y, en caso de detección del gen hereditario, la oferta a los familiares de consejo genético. Entre los efectos negativos potenciales podemos incluir los riesgos y costes de las pruebas o medidas profilácticas, el estrés psicológico, los sentimientos de culpa en caso de detección del gen y la posibilidad de discriminación social o laboral.
Según el reciente Consenso sobre Cáncer Hereditario, los criterios de derivación de individuos o familias con riesgo aumentado de cáncer de mama o de mama-ovario por parte de Atención Primaria a una Unidad de Consejo Genético son (solo uno es suficiente)34:
- -
Dos o más casos de cáncer de mama y/u ovario en la misma línea familiar.
- -
Cáncer de mama a una edad joven (antes de los 50 años).
- -
Cáncer de mama y ovario en la misma mujer.
- -
Cáncer de mama en varón.
- -
Cáncer de mama bilateral (uno de ellos diagnosticado antes de los 50 años).
Existe variabilidad de actuación en asistencia en cáncer hereditario dependiendo de cada comunidad autónoma. Mientras algunas autonomías disponen de leyes que regulan esta asistencia, protocolos y guías (Comunidad Valenciana o Cataluña), otras carecen de ellos o tienen todavía que clarificar los circuitos de derivación (este es el caso de Madrid)36.
En cuanto a la interpretación de los resultados genéticos, una prueba genética con resultado negativo en la paciente afectada de cáncer proporciona escasa información y debe ser interpretada con cuidado. No es concluyente. Puede ser que el cáncer esté asociado a una mutación no detectable por el método usado, deberse a una susceptibilidad genética diferente o ser causado por factores no hereditarios.
La familia debe saber que este resultado negativo no elimina la posible existencia de un factor hereditario.
Si ya existe una mutación identificada en la familia y el estudio de esta mutación en el sujeto da un resultado negativo, se considera no portador de dicha mutación.
Por el contrario, una prueba genética con resultado positivo en la paciente afectada de cáncer confirma el origen genético del cáncer, y en el familiar sin enfermedad indica que este presenta un riesgo aumentado para los cánceres asociados al BRCA1 o al BRCA2. En estos casos se recomendará un seguimiento más exhaustivo o cirugía profiláctica, según el caso.
Entre las opciones actuales para la prevención primaria del cáncer de mama en mujeres de alto riesgo se incluyen:
- 1.
Cirugía profiláctica: mastectomía total bilateral y salpingooforectomía bilateral.
El riesgo de cáncer contralateral en mujeres portadoras de mutación BRCA1 es de alrededor del 5% en 10 años y de un 40% de por vida, menor en caso de BRCA2. Cuanto más joven es la mujer al diagnóstico, más alto es este riesgo. También estas mujeres presentan un mayor riesgo de recidiva ipsilateral y de cáncer de ovario.
La mastectomía recomendada por la mayoría de los autores es la total con conservación de piel, pero hay que saber que aunque reduce el riesgo un 90%, no lo elimina completamente. La salpingooforectomía profiláctica se realiza una vez finalizado el deseo reproductivo de la mujer portadora, y si se efectúa antes de los 45 años se asocia con una reducción del riesgo de cáncer de mama del 50%26,35.
- 2.
Quimioterapia preventiva: diversos estudios han demostrado la eficacia de tamoxifeno y raloxifeno como tratamiento preventivo en mujeres de alto riesgo (algo menor para raloxifeno comparando ambos según el estudio STAR). Los 2 han sido aprobados por la FDA, aunque hasta ahora su utilización no ha sido ampliamente admitida por sus efectos secundarios (cáncer de endometrio con tamoxifeno y eventos tromboembólicos en ambos). En Europa, su aplicación hasta el momento se ha realizado en el contexto de ensayos clínicos29,37.
También los inhibidores de la aromatasa han demostrado ser efectivos en este campo, con una menor toxicidad que tamoxifeno en estudios como el IBIS II (anastrozol versus placebo, seguimiento de 7 años) y el MAP3 (exemestano versus exemestano más celecoxib versus placebo, seguimiento medio de 3años) en mujeres posmenopáusicas de alto riesgo38,39.
El médico de familia, que conoce la historia personal y familiar del paciente, es el profesional más adecuado para ofrecer información sobre cribado e identificar a las mujeres con riesgo aumentado de cáncer de mama.
Para poder ejercer adecuadamente esta labor es importante tener en cuenta una serie de aspectos:
- -
Es necesario conocer la situación actual del cáncer de mama y la evidencia de la recomendación del cribado, esto permitirá informar adecuadamente a las mujeres sobre los beneficios y daños potenciales, así como sobre las limitaciones de la prueba en función de la edad.
- -
El médico de Atención Primaria deberá disponer de conocimientos sobre cáncer hereditario, protocolos y guías actualizados sobre el tema y familiarizarse con ellos. Este aspecto es esencial, debiendo existir previamente una labor de divulgación de dichos protocolos entre los profesionales. Conocer cuáles son los criterios de derivación a las unidades de Consejo Genético facilitará la detección temprana de las mujeres que presentan mayor riesgo.
- -
Es necesario saber dónde y cómo derivar adecuadamente a las pacientes con sospecha de cáncer hereditario. Es labor de la autoridad sanitaria establecer un circuito asistencial claro que permita la comunicación adecuada entre los distintos niveles asistenciales.
- -
El médico de Atención Primaria debe realizar un seguimiento de las mujeres que tras ser valoradas por una unidad especializada en cáncer hereditario hayan sido consideradas de «bajo riesgo». El seguimiento de las mujeres de «riesgo intermedio o alto» tendrá lugar en atención especializada.
Las autoras declaran no tener ningún conflicto de intereses.
Este artículo está dedicado a todas las mujeres y sus familiares que luchan cada día contra el cáncer de mama, lo harán en un futuro o lo hicieron en el pasado. En especial a vosotras, Ana M. y Ana H. También a los profesionales y asociaciones que contribuyen con su trabajo y dedicación a la mejora de la salud y calidad de vida de estas pacientes.