Los tumores malignos óseos son poco frecuentes, ya que no superan el 0,2-0,5% de todos los cánceres. Su importancia radica en que afectan a pacientes jóvenes en la segunda década de la vida, implican mal pronóstico en su evolución natural y suelen requerir tratamientos radicales, muy agresivos y sofisticados. Sin embargo, en los últimos años se ha producido un enorme progreso en el conocimiento de su biología, historia natural y métodos diagnósticos que, junto con los tratamientos, están suponiendo mayores posibilidades de curación.
Con este trabajo pretendemos ampliar conocimientos sobre la historia natural y el desarrollo de la enfermedad, las técnicas diagnósticas, los diferentes tipos de tratamientos utilizados, con especial interés en la indicación según la localización y estadiaje y la evolución del osteosarcoma, relacionando los criterios pronósticos con el tratamiento aplicado.
Entendemos que desde la consulta de Atención Primaria se puede contribuir a un correcto manejo de estos pacientes.
Malignant bone tumors are rare, and do not exceed 0.2-0.5% of all cancers. Its importance lies in that they affect young patients in the second decade of life, have a poor prognosis in the natural course and often require very aggressive and sophisticated radical treatment. However, with the enormous progress in recent years in understanding their biology, natural history and diagnostic tests, along with treatments, there are greater chances of a cure.
In this article we intend to expand the knowledge on the natural history and development of the disease, diagnostic techniques, different types of treatments used, with special emphasis on associating the indication of the location, staging and progression of osteosarcoma, with prognostic criteria and the treatment applied. We believe that Primary Health Care can contribute to a correct management of these tumours.
El osteosarcoma o tumor osteogénico es un tumor de células en huso de origen mesenquimatoso que se caracteriza por su aspecto sarcomatoso y su capacidad para producir osteoide1. Se clasifica en el grupo 170, según la CIE 9 MC. Es el tumor óseo maligno más frecuente después del mieloma y constituye entre el 30-40% de los tumores óseos malignos, con un predominio del sexo masculino (1,5:1) y una incidencia máxima en la segunda década de la vida (70-75% de los casos) y un segundo pico en la sexta década de la vida, por lo que presenta una distribución por edades bimodal1. La incidencia es de 1 a 3 casos por millón de habitantes. Aunque la etiología de los osteosarcomas es desconocida, se han implicado factores genéticos; de hecho algunos casos se dan en familias y al menos un gen (LOH de gen Rb expresión de MDR) ha sido relacionado con el aumento del riesgo. Este gen también se asocia con el retinoblastoma hereditario, síndrome de Li-Fraumeni y síndrome de Rothmund-Thomson1,2. El osteosarcoma así mismo se asocia a la exposición a radioterapia (hasta un 3% de los casos se induce por radiación ionizante usada con fines terapéuticos); a algunos agentes alquilantes y a antraciclina. También se ha relacionado con la enfermedad de Paget, el condrosarcoma de bajo grado y la patología ósea benigna. Otra teoría es la etiología vírica del osteosarcoma, que se deriva de observaciones en animales3.
Según la OMS, los osteosarcomas se clasifican en dos grandes grupos2:
- •
Osteosarcomas centrales (medulares): son los más frecuentes. Incluyen el osteosarcoma clásico (90%), y sus variedades: osteoblástico (45% de los casos), condroblástico (27%), fibroblástico (9%), anaplásico (7%) y el osteosarcoma telangiectásico (2%). Otros osteosarcomas centrales son: el osteosarcoma intraóseo bien diferenciado (bajo grado) y el de células pequeñas.
- •
Osteosarcomas superficiales (periféricos): que son los yuxtacorticales o paraostales bien diferenciados (3-4%), los periostiales o periósticos y los superficiales de alto grado.
El subtipo patológico más común es el osteosarcoma central convencional, que se caracteriza por áreas de necrosis, mitosis atípicas y tejido osteoide o cartilaginoso maligno. Los otros subtipos son menos frecuentes y cada uno se presenta con una frecuencia de menos del 5%. El osteosarcoma telangiectásico se puede confundir en la radiografía con un quiste óseo aneurismático o un tumor de células gigantes. Esta variante debe enfocarse como un osteosarcoma convencional. Es importante identificar el osteosarcoma intraóseo bien diferenciado y el osteosarcoma paraostal porque ambos se relacionan con el pronóstico más favorable y pueden ser tratados con éxito solo con la escisión radical del tumor primario. El paraostal se localiza en la superficie del hueso y afecta en el 75% de los casos al fémur distal en su cara posterior. El osteosarcoma perióstico tiene un pronóstico generalmente bueno, se presenta como una lesión radiolúcida adherida a la cortical, sin invasión medular y el tratamiento viene condicionado por el grado histológico, pero generalmente tiene buen pronóstico2.
El osteosarcoma extraóseo es una neoplasia mesenquimal maligna sin vínculo directo con el sistema esquelético. El tratamiento para el osteosarcoma extraóseo ha seguido las mismas pautas que las usadas para el sarcoma de tejido blando, aunque un análisis retrospectivo del Estudio Cooperativo Alemán sobre el Osteosarcoma (COSS) identificó un resultado favorable para el osteosarcoma extraóseo tratado con cirugía y terapia convencional del osteosarcoma4. La desdiferenciación del osteosarcoma (incremento del potencial maligno) o la transformación maligna de una lesión benigna es un fenómeno muy raro.
ClínicaEl síntoma guía del osteosarcoma es el dolor local de esfuerzo de corta duración, que se hace constante y de predominio nocturno, a menudo acompañado de masa, con flogosis y pérdida de función de la articulación afecta. Casi nunca existen síntomas generales. En el momento de su presentación, el osteosarcoma suele estar confinado al sitio de origen en un 80-85% de los casos, pero sin tratamiento adyuvante la mayoría de los pacientes fallece por enfermedad metastásica. Aproximadamente la mitad de los tumores surgen en el fémur y, de estos, un 80% se presentan en el fémur distal. Otros lugares primarios importantes en orden de frecuencia descendente son la tibia proximal, el húmero proximal, la pelvis, la mandíbula, el peroné y las costillas. Cuando se compara con el osteosarcoma del esqueleto apendicular, el osteosarcoma de la cabeza y el cuello tiene más probabilidad de ser de grado bajo y de presentarse en pacientes de mayor edad5.
Los osteosarcomas son tumores muy agresivos localmente, con un patrón de diseminación predominantemente hemático. Las localizaciones metastásicas mas frecuentes son las pulmonares (90%) y las óseas, en el mismo hueso (skip lesions, en un 3% de los casos) o a distancia, siendo muy poco frecuentes las linfáticas. Las metástasis aparecen generalmente entre los 5 y 8 meses después del diagnóstico en el 10-20% de los pacientes. El síndrome de osteosarcoma multifocal es una presentación de múltiples tumores en múltiples huesos, con frecuente afectación metafisaria simétrica. El osteosarcoma multifocal tiene un pronóstico extremadamente grave5. Los pacientes con metástasis no continuas (≥2 lesiones no continuas en el mismo hueso) tienen un pronóstico peor. Sin embargo, la experiencia adquirida en los análisis realizados por el COSS6 indica que las lesiones no continuas en el mismo hueso no confieren un pronóstico peor si se incluyen en la resección quirúrgica.
Síntomas- •
Dolor óseo: es el primer síntoma, con o sin una masa que puede ser palpada. El área del dolor depende del área implicada con tumor. El osteosarcoma afecta con más frecuencia a los huesos largos (fémur o húmero) o a la pelvis. Los tumores pélvicos pueden no dar síntomas hasta que sean más grandes.
- •
Fractura ósea (puede suceder espontáneamente o después de un movimiento rutinario).
- •
Limitación de movimiento.
- •
Cojera (si el tumor afecta a la pierna).
- •
Dolor al subir o lanzar algo (si el tumor es en el brazo).
- •
Sensibilidad, hinchazón, abultamiento o enrojecimiento en el sitio del tumor.
Viene dado por:
- 1.
La existencia de sintomatología, siendo lo más frecuente la presencia de dolor, aumento de sensibilidad o inflamación en los huesos. Se realizará una historia clínica y examen físico completo.
- 2.
Pruebas complementarias
- •
Analítica con hemograma y perfil bioquímico, incluyendo calcio y fósforo.
- •
Pruebas de función hepática, fosfatasa alcalina (FA) y lactato deshidrogenasa (LDH).
- •
Estudios locales:
- -
Radiografía del área afectada: es el estudio inicial más útil para evaluar el tumor. Los patrones radiológicos sin valor pronóstico son: escleróticos (32%), osteolíticos (22%) y mixtos (46%).
- -
RMN o TAC. La RMN indica afectación y extensión a tejidos blandos adyacentes y junto con TAC aportan afectación vascular, nerviosa y del canal medular. Especialmente útiles si se considera la resección conservadora de la extremidad.
- -
Angiografía opcional: evalúa compromiso vascular y respuesta a quimioterapia (QT), especialmente la neoadyuvante.
- -
- •
- 3.
Diagnóstico de confirmación: biopsia, abierta (en el momento de la cirugía (QX) y/o cerrada (percutánea- PAFF), es crítica para determinar el tipo exacto de sarcoma.
- 4.
Estudio de extensión:
- •
Gammagrafía ósea con 99Tc: para ver si se ha diseminado a otros huesos.
- •
TAC toracoabdominal: para ver si se ha diseminado a los pulmones (es el lugar más común de metástasis).
- •
PET: para detectar cualquier metástasis del tumor.
- •
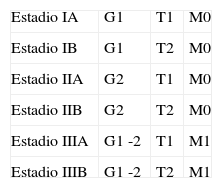
El estadiaje en este tipo de tumor es complejo dada la gran variedad de tipos y las diferentes localizaciones. Existe una clasificación TNM, pero los dos sistemas más utilizados son: la clasificación de Enneking (de 1980, que incorpora el tamaño, ausencia o presencia de metástasis y el grado histológico) y la clasificación AJCC/UICC. Esta fue desarrollada en 1992 por la Comisión Mixta Americana sobre el Cáncer (AJCC, por sus siglas en inglés) y la Unión Internacional Contra el Cáncer (UICC, por sus siglas en inglés), e incorpora también el tamaño y el grado histológico en la determinación del estadiaje1 (tablas 1 y 2).
Clasificación de Enneking.
| Estadio IA | G1 | T1 | M0 |
| Estadio IB | G1 | T2 | M0 |
| Estadio IIA | G2 | T1 | M0 |
| Estadio IIB | G2 | T2 | M0 |
| Estadio IIIA | G1 -2 | T1 | M1 |
| Estadio IIIB | G1 -2 | T2 | M1 |
Fuente: Elaboración propia.
Esta Clasificación determina el estadiaje de los tumores considerando 3 condiciones: grado de malignidad, localización del tumor y presencia o no de metástasis, clasificando a su vez a cada una de ellas en dos categorías: Grado 1: bajo grado de malignidad, Grado 2: alto grado de malignidad.
M0: ausencia de metástasis; M1: presencia de metástasis; T1: localización intracompartimental; T2: localización extracompartimental.
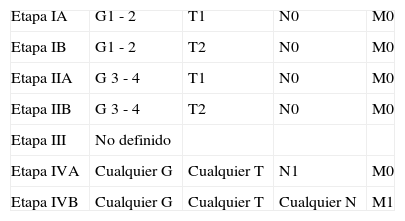
Clasificación AJCC/UICC para los sarcomas.
| Etapa IA | G1 - 2 | T1 | N0 | M0 |
| Etapa IB | G1 - 2 | T2 | N0 | M0 |
| Etapa IIA | G 3 - 4 | T1 | N0 | M0 |
| Etapa IIB | G 3 - 4 | T2 | N0 | M0 |
| Etapa III | No definido | |||
| Etapa IVA | Cualquier G | Cualquier T | N1 | M0 |
| Etapa IVB | Cualquier G | Cualquier T | Cualquier N | M1 |
Fuente: Elaboración propia.
La clasificación AJCC/UICC fue desarrollada en 1992 por la Comisión Mixta Americana sobre el Cáncer (AJCC, por sus siglas en inglés) y la Unión Internacional Contra el Cáncer (UICC, por sus siglas en inglés). Incorpora el tamaño y el grado histológico en la determinación del estadiaje:
Tx: tumor primario no valorable; T0: no evidencia tumoral; T1: tumor confinado dentro del córtex; T2: tumor que invade más allá del córtex.
Nx: no valoración adecuada; N0: no afectación linfática; N1: afectación linfática.
M0: ausencia de metástasis; M1: presencia de metástasis.
G1: bien diferenciado; G2: moderadamente diferenciado; G3: pobremente diferenciado; G4: indiferenciado.
El osteosarcoma hoy es el paradigma del tratamiento multimodal exitoso. En la actualidad, la QT neoadyuvante permite alcanzar una supervivencia a los 5 años del 60 al 70%, en contraste con los índices del 10 al 15% previos al uso de QT neoadyuvante. El tratamiento multimodal permite, bajo ciertas condiciones, resecar el tumor primario sin necesidad de amputación, lo que sin duda se traduce en una mejor calidad de vida3.
La QX es el método de elección. La QT debe utilizarse inicialmente, previa a la QX, excepto en los osteosarcomas intraóseos bien diferenciados de bajo grado y el paraostal bien dierenciado. La radioterapia (RT) tiene escasa eficacia y sus indicaciones son: tratamiento paliativo, recidivas locales y metástasis óseas. La mayoría de los pacientes recibe QT preoperatoria (neoadyuvante) seguida de QX de extirpación (amputación, preservación de la extremidad) y QT adyuvante postoperatoria7.
CirugíaEl tratamiento específico depende fundamentalmente del tamaño. Clásicamente la amputación era la única opción quirúrgica, pero en la actualidad es de elección la QX conservadora (limb sparing) con incisión intracompartimental amplia (área de dos centímetros del tejido fino normal alrededor del tumor) y siempre que exista evidencia de buena respuesta a la QT preoperatoria. El uso generalizado, con éxito, de la QX conservadora ha sido posible por los siguientes avances:
- •
Progreso significativo en el desarrollo de prótesis modernas, disponibles de inmediato tras la QX.
- •
Grandes avances en las técnicas quirúrgicas ortopédicas. Además, se ha observado que el tradicional temor a la aparición de “skip” metástasis (metástasis “saltarinas”, surgidas dentro del mismo hueso afectado) era excesivo; la incidencia de skip metástasis parece ser inferior al 10%.
- •
Uso de QT preoperatoria (neoadyuvante): puede producir una reducción del tumor que permita el uso de prótesis, a la vez que otorga tiempo para su fabricación; y proporciona un ensayo farmacológico in vivo para determinar la sensibilidad de un tumor individual a un determinado fármaco y para programar los regímenes quimioterápicos postoperatorios. En general, los pacientes que responden a la QT preoperatoria evolucionarán bien, y viceversa8.
El tipo de QX necesaria para realizar una ablación completa del tumor primario depende de varios factores, que deben evaluarse individualmente. Cuando se piensa realizar un procedimiento para preservar un miembro (limb sparing o extirpación del tumor maligno óseo sin amputación y reemplazo de huesos o articulaciones con aloinjertos o prótesis), la biopsia debe hacerla el mismo cirujano que vaya a realizar la operación definitiva, ya que es crucial el lugar de la incisión para la posterior reconstrucción de la extremidad.
Se han evaluado diferentes procedimientos quirúrgicos de preservación de un miembro, tanto por su resultado funcional como por su efecto en la supervivencia7, y sin embargo, no hay diferencia en la supervivencia general entre los pacientes tratados inicialmente con amputación y aquellos tratados con un procedimiento para preservar el miembro9. Los procedimientos para la preservación de un miembro sólo deben planificarse cuando la estadificación preoperatoria indica que es posible lograr márgenes quirúrgicos amplios. Una fractura patológica observada en el momento del diagnóstico o durante la QT preoperatoria no debe impedir la cirugía para preservar el miembro si se pueden obtener márgenes quirúrgicos amplios10.
Si el examen patológico de la exéresis quirúrgica muestra márgenes inadecuados, se debe considerar la amputación inmediata, especialmente si la necrosis histológica posterior a la QT preoperatoria fue deficiente9. En un estudio, los pacientes sometidos a un procedimiento para preservar un miembro que tuvieron una respuesta histológica deficiente y márgenes quirúrgicos próximos, presentaron una tasa (sobra “la”) de recidiva local alta, esto es, del 13,3% 11. Para los pacientes que reciben QT antes de la cirugía, el grado de necrosis tumoral observado después de la operación es un buen indicador de supervivencia sin enfermedad, recidiva local y supervivencia general12.
Las circunstancias que contraindican la QX conservadora y conllevan a la amputación son: 1) tumores de gran tamaño, 2) invasión neurovascular mayor, 3) fractura patológica a excepción de la fractura que consolida durante la QT o la que permite obtener márgenes quirúrgicos amplios, 4) contaminación de tejidos blandos secundaria a mala planificación de la biopsia, 5) sepsis activa en la región quirúrgica, 6) inmadurez esquelética en extremidad pélvica, 7) insuficiente músculo para reconstruir una extremidad funcional, y 8) lesiones de alto grado del pie y tibia distal.
Si la QX conservadora de la extremidad es posible, la técnica de reconstrucción depende de la localización del tumor y de las necesidades funcionales. Así, la reconstrucción de la rodilla incluye la instalación de prótesis no convencionales y artrodesis. Para pacientes muy jóvenes, se consideran las prótesis expansibles o la plastia de rotación. En la reconstrucción del hombro las opciones incluyen reemplazos protésicos de tipo modular, la artrodesis y el injerto de peroné microvascularizado. Para las lesiones de la pelvis, la hemipelvectomía es una opción. Para la resección periacetabular, la fusión o artrodesis es una alternativa, sobre todo en pacientes ancianos o con menos demandas funcionales; mientras que en los pacientes jóvenes se puede considerar la reconstrucción con autoinjertos óseos de la pelvis, combinada con reemplazos protésicos de cadera. Las complicaciones de estos procedimientos incluyen fractura del autoinjerto, rechazo, infección y pérdida protésica3. Por otra parte, tanto los pacientes reconstruidos como los no reconstruidos presentan similares resultados al aplicarles escalas funcionales como la Musculoskeletal Tumor Rating Scale o de Enneking (MSTS) y la Toronto Extremity Salvage Score (TESS) para pacientes sometidos a cirugía de preservación del miembro por tumores13.
La presencia de metástasis pulmonares no impide un tratamiento con objeto curativo. Se recomienda administrar el tratamiento sistémico, realizar QX para control local y luego resecar toda la enfermedad pulmonar residual. Con la extirpación de la metástasis, del 30 al 40% de los pacientes podría alcanzar supervivencias a largo plazo (5 años)3 Un dato importante del tratamiento quirúrgico de estas metástasis es que se obtienen mejores resultados que en la cirugía del cáncer de pulmón14,15, con supervivencias del 20 al 45% de los pacientes con resección completa del tumor pulmonar metastásico y QT a los 5 años.
QuimioterapiaLa variedad histológica se relaciona con la respuesta; igualmente los tumores voluminosos tienen una sensibilidad disminuida a la QT neoadyuvante. Se presume respuesta cuando el dolor disminuye, la fosfatasa alcalina se normaliza, la lesión neoplásica se calcifica en las placas radiográficas o los márgenes se tornan definidos y la vascularización disminuye en el estudio angiográfico. Una buena respuesta no solo tiene utilidad pronóstica sino también terapéutica, ya que permite cirugías mas conservadoras. Se recomienda el uso de soportes protectores para aquellos pacientes con tumores de los huesos que sostienen mucho peso, para prevenir fracturas patológicas que puedan impedir la QX preservadora de un miembro1,2.
En ensayos clínicos aleatorizados se ha establecido que tanto la QT adyuvante como la neoadyuvante son eficaces para prevenir las recaídas en pacientes con tumores clínicamente no metastásicos. Los pacientes con un 90% o más de necrosis en el tumor primario después de la QT de inducción o neoadyuvante tienen un mejor pronóstico que los que tienen menos necrosis. Con menos necrosis, la tasa de recidiva es más alta durante los primeros dos años (70 y 62% según las series) en comparación con los pacientes que tienen una cantidad de necrosis mayor o igual al 90% (30-20%)16,17.
Existen varias clasificaciones del grado de respuesta a la QT neoadyuvante, siendo la más conocida la del Memorial Sloan Kettering:
- •
Grado I: respuesta mínima o inapreciable (<50% necrosis).
- •
Grado II: áreas de tumor osteoide acelular, necrosis o fibrosis atribuible a la QT, con zonas de tumor viable (50-90% necrosis).
- •
Grado III: áreas de tumor osteoide acelular, necrosis o fibrosis atribuible a la QT, con focos aislados de tumor viable (>90% necrosis).
- •
Grado IV: no se identifica tejido tumoral (100% necrosis).
Por ello, de todos los factores pronósticos el grado de respuesta a la QT neoadyuvante es reconocido por todos los autores como el factor pronóstico mas importante. La QT sola como terapéutica paliativa se indica en casos de enfermedad irresecable.
Esquemas de quimioterapiaRadioterapiaEn el caso de las lesiones que no se pueden extirpar, algunos estudios retrospectivos no aleatorios indican que las dosis altas de RT pueden mejorar el control local, especialmente en aquellos casos donde solo hay enfermedad residual microscópica o mínima17,18. Actualmente se están llevando a cabo estudios clínicos que usan QT intensiva de combinación y radiación a altas dosis muy bien colimada y localizada2.
Seguimiento de la enfermedadEl seguimiento deberá incluir un examen físico, radiografía de tórax y de la localización primaria del tumor, cada 3 meses los 2 primeros años, cada 4 meses durante el tercer año, cada 6 meses el cuarto y quinto año, y por último anualmente. En caso de haber recibido RT, el periodo mínimo de vigilancia es de 10 años, puesto que existe riesgo de aparición de un nuevo sarcoma, inducido por la RT. Se indica TAC si se demuestra alguna anormalidad en la radiología simple y se realiza gammagrafía ósea cada 6 meses durante 5 años, ya que evidencia metástasis óseas o enfermedad poliostótica.
Osteosarcoma recidivanteAún con los mejores esquemas de QT, el 30-40% de los pacientes desarrolla enfermedad metastásica. La mayoría de las recidivas se presentan dentro de los 2 a 3 años de haber concluido el tratamiento. Las recidivas tardías son poco comunes: se presentan en el 0,6-3,7% de los pacientes18. El osteosarcoma recidiva con mayor frecuencia en el pulmón (70-80%). La capacidad de lograr una resección completa de la enfermedad recidivante es el factor pronóstico más importante en la primera recidiva, con una tasa de supervivencia a cinco años del 20 al 45% después de una resección completa de tumores pulmonares metastásicos, y tasa de supervivencia de un 20% después de una resección completa de metástasis en otros lugares19. La supervivencia para pacientes con enfermedad metastásica no resecable es inferior al 5%20. Los factores que indican mejor respuesta incluyen: menos ganglios pulmonares, metástasis pulmonares unilaterales o intervalos más largos entre la resección del tumor primario y las metástasis21.
Los pacientes con recaída ósea solitaria tardía tienen una tasa de supervivencia a los 5 años de aproximadamente el 30%. La respuesta al tratamiento de las recaídas de los pacientes que tienen recidiva local es peor que la de los pacientes que tienen recaída con metástasis única. La incidencia de la recidiva local es más alta en aquellos pacientes que presentan una respuesta precaria ante la QT enfocada al tumor primario y en pacientes con márgenes quirúrgicos inadecuados12,22–24.
En el osteosarcoma recidivante no está bien definida la función de la QT sistémica. Así, la ifosfamida con uroprotección de MESNA, sola o en combinación con etopóxido, ha mostrado actividad hasta en un tercio de los pacientes con osteosarcoma recidivante que no habían recibido este fármaco previamente. La ciclofosfamida y el etopóxido también han mostrado actividad en el osteosarcoma recidivante24. El trasplante de células madre de sangre periférica, que utiliza dosis altas de QT, no parece mejorar la respuesta. Las dosis altas de samario-153-EDTMP junto con el apoyo de células madre de sangre periférica pueden paliar significativamente el dolor de los pacientes con metástasis óseas25.
Complicaciones- •
Efectos de la QT.
- •
Amputación de la extremidad.
- •
Metástasis pulmonar.
- •
Metástasis en otras localizaciones.
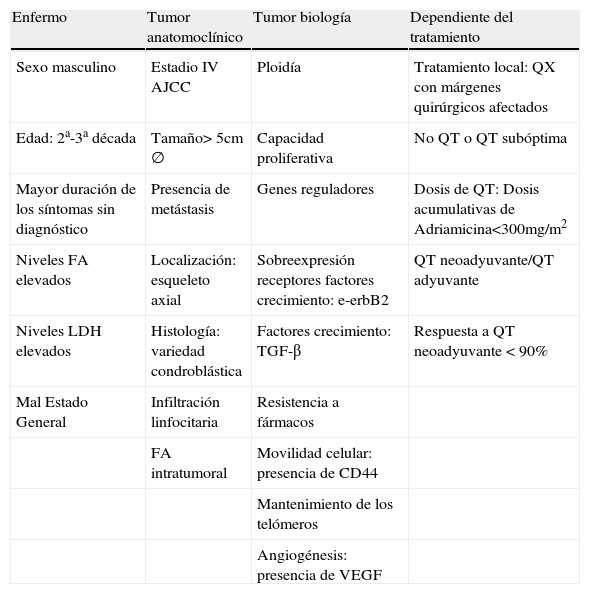
Los principales factores estudiados desde el punto de vista pronóstico son los recogidos en la tabla 326, si bien destacamos los siguientes por su mayor relevancia:
- •
Niveles de fosfatasa alcalina: la actividad osteoblástica de las células tumorales determina un incremento en los niveles plasmáticos de FA, que se comporta como un marcador tumoral26. (Sería importante determinar qué cifras de FA implican un mal pronóstico, sobre todo porque son tumores de pacientes jóvenes en crecimiento con FA elevadas por él mismo)
- •
Estadio: cada estadio es, por definición, un grupo pronóstico. Así, la supervivencia a los 5 años de los estadios IA y IB de Enneking se acerca al 100%, mientras que en los estadios IV casi ningún paciente sobrevive ese periodo de tiempo. Las curvas para los estadios IIA y IIB ocuparían una posición intermedia, entre el 40 y el 60%.
- •
Localización: menor supervivencia en los tumores del esqueleto axial (columna, pelvis, pared torácica, etc.) por menor accesibilidad al tratamiento local27. Una excepción son los osteosarcomas de la mandíbula, que, a pesar de su localización en el esqueleto proximal, tienen un escaso potencial metastático. En el caso de los huesos largos, cuanto más proximal o cercana al tronco sea la lesión peor es el pronóstico, sin que ello guarde relación con el mayor tamaño que suelen tener los tumores de esas localizaciones. Asimismo, se sabe que las lesiones tibiales evolucionan mejor que las femorales.
- •
Receptores para factores de crecimiento: existe mayor riesgo de metástasis en los pacientes que sobreexpresan c-erbB2.
- •
Angiogénesis: la presencia del factor de crecimiento del endotelio vascular (VEGF) se relaciona con la respuesta a la QT, pero supone una menor supervivencia global y libre de enfermedad.
- •
Respuesta a la QT preoperatoria: la utilización de QT neoadyuvante permite valorar la sensibilidad del tumor mediante el estudio anatomopatológico de la pieza quirúrgica. Está comprobado que la supervivencia está directamente relacionada con el grado de respuesta, sobre todo si se produce una necrosis superior al 90%. Una mala respuesta a la QT supone un mayor riesgo de metástasis a distancia e incluso un peor control local de la enfermedad. Actualmente se considera el factor pronóstico más importante.
Factores de mal pronóstico vital en el osteosarcoma.
| Enfermo | Tumor anatomoclínico | Tumor biología | Dependiente del tratamiento |
| Sexo masculino | Estadio IV AJCC | Ploidía | Tratamiento local: QX con márgenes quirúrgicos afectados |
| Edad: 2a-3a década | Tamaño> 5cm ∅ | Capacidad proliferativa | No QT o QT subóptima |
| Mayor duración de los síntomas sin diagnóstico | Presencia de metástasis | Genes reguladores | Dosis de QT: Dosis acumulativas de Adriamicina<300mg/m2 |
| Niveles FA elevados | Localización: esqueleto axial | Sobreexpresión receptores factores crecimiento: e-erbB2 | QT neoadyuvante/QT adyuvante |
| Niveles LDH elevados | Histología: variedad condroblástica | Factores crecimiento: TGF-β | Respuesta a QT neoadyuvante < 90% |
| Mal Estado General | Infiltración linfocitaria | Resistencia a fármacos | |
| FA intratumoral | Movilidad celular: presencia de CD44 | ||
| Mantenimiento de los telómeros | |||
| Angiogénesis: presencia de VEGF |
Fuente: Elaboración propia.
Esta tabla pretende recoger todos los factores que influyen en el pronóstico vital de los pacientes con osteosarcoma. Hemos clasificado los distintos factores en 4 grupos: aquellos que dependen de las características del propio paciente (sexo, edad, duración de los síntomas…), en aquellos que vienen dados de las propias características del tumor, ya sea desde el punto de vista anatomopatológico como desde su propio comportamiento biológico, y por último, aquellos factores que dependen del tratamiento.
CD44: glucoproteína transmembrana relacionada con la movilidad celular; e-erbB2: receptor para el factor de crecimiento epidérmico; FA: fosfatasa alcalina; LDH: lactato deshidrogenasa; TGF-β: factor de transformación beta; VEGF: factor de crecimiento del endotelio vasular.
La mayor parte de los fracasos terapéuticos que se producen en el osteosarcoma se deben a la aparición de metástasis pulmonares. Desde hace años se sabe que la resección quirúrgica completa de las mismas es el único tratamiento que permite una supervivencia a largo plazo. Los pacientes con enfermedad exclusivamente pulmonar tienen mayor supervivencia que aquéllos que presentan otras localizaciones metastásicas. El momento de aparición de las metástasis es importante. La mayoría de autores consultados coinciden en que los pacientes con intervalos libres de enfermedad prolongados (entre 1 y 2 años hasta que aparecen las metástasis) tienen mejor pronóstico. Es posible que el número de metástasis, lo mismo que su situación hiliar o la invasión de la pleura, sólo tenga influencia en la mayor dificultad técnica para conseguir la resección completa.
Conclusiones- •
EL osteosarcoma constituye el 30-40% de los tumores óseos malignos, con predominio del sexo masculino (1,5:1) e incidencia máxima en la segunda década de la vida (70-75% de los casos).
- •
El síntoma guía es el dolor local de esfuerzo de corta duración, que se hace constante y de predominio nocturno, a menudo acompañado de masa, flogosis y pérdida de función de la articulación afecta.
- •
Afecta con más frecuencia a los huesos largos (fémur o húmero) o a la pelvis.
- •
Para su diagnóstico se realizará una historia clínica y examen físico completo, que incluirá al menos la determinación de FA y LDH y radiografía del área afectada
- •
La mayoría de los pacientes recibe QT preoperatoria (neoadyuvante) seguida de QX de extirpación (amputación, preservación de la extremidad) y QT adyuvante postoperatoria.
- •
Deben cumplirse tres condiciones para que la QX conservadora se lleve a cabo con éxito: a) evidencia de buena respuesta a la QT preoperatoria; b) habilidad para obtener un margen quirúrgico; y c) experiencia para reconstruir la extremidad con razonable seguridad de función significativa.
- •
La QT neoadyuvante permite alcanzar una supervivencia a los 5 años del 60-70%, en contraste con los indices previos del 10 al 15%.
- •
El tratamiento multinodal permite, bajo ciertas condiciones resecar el tumor primario sin necesidad de amputación, lo que, sin duda, se traduce en una mejor calidad de vida.
- •
La respuesta a la QT preoperatoria actualmente se considera el factor pronóstico más importante.
Los autores declaran no tener ningún conflicto de intereses.
Los autores expresan su agradecimiento al Dr. Raul J. Regal Ramos por sus siempre oportunos comentarios y consejos.