Analizar la adherencia terapéutica a los fármacos biológicos modificadores de la enfermedad (FAME-b) y los posibles factores que afectan a la misma en pacientes con artritis reumatoide, artritis psoriásica y espondilitis anquilosante.
MétodoEstudio observacional, descriptivo, transversal, unicéntrico realizado en pacientes con artritis reumatoide, espondilitis anquilosante y artritis psoriásica en tratamiento con fármacos biológicos antirreumáticos subcutáneos modificadores de la enfermedad. Se midieron variables socieconómicas, patológicas, farmacológicas y clínicas. La adherencia se calculó mediante la razón de posesión de medicación, el cuestionario Compliance Questionnaire on Rheumatology y el cuestionario Morisky Medication Adherence Scale.
ResultadosSe evaluaron 112 pacientes y 6 FAME-b diferentes prescritos. La media de edad fue de 56,8±13,2 años y 52,7% de los pacientes fueron mujeres. El porcentaje de adherentes fue del 59,3% en artritis reumatoide, 62,5% en artritis psoriásica y 76,2% en espondilitis anquilosante. La administración del fármaco por parte de un familiar y/o cuidador se relacionó con una mayor falta de adherencia (odds ratio: 9,6; intervalo de confianza 95%: 1,5-61,8 [p<0,05]). No hubo diferencias en la adherencia en función del FAME-b utilizado.
ConclusionesSegún los datos obtenidos, no existen diferencias en cuanto a la adherencia en función del fármaco biológico utilizado ni de la patología reumática. Parece que la administración del fármaco por parte de un familiar y/o cuidador influye negativamente sobre la adherencia terapéutica.
To quantify adherence to biological disease-modifying anti-rheumatic drugs (DMARD) and to determine the factors that can predict adherence in patients with rheumatoid arthritis, psoriatic arthritis and ankylosing spondylitis in daily clinical practice.
MethodsAn observational, descriptive, cross-sectional and single-center study was carried out. Patients with rheumatoid arthritis, ankylosing spondylitis and psoriatic arthritis who were in treatment with subcutaneous biological DMARD were included. Variables related to socioeconomic status, disease, biological therapy and safety were recorded. Adherence was calculated by using medication possession ratio, Compliance Questionnaire on Rheumatology and Morisky Medication Adherence Scale Questionnaire.
ResultsOne hundred twelve patients and 6 different biological DMARDs were included. Mean age was 56.8±13.2 years and 52.7% were women. The percentage of adherent patients was 59.3% in rheumatoid arthritis, 62.5% in psoriatic arthritis and 76.2% in ankylosing spondylitis. Lesser adherence was associated with the administration of the drug by a family member and/or caregiver (odds ratio: 9.6; 95% confidence interval: 1.5-61.8 (p <.05)). There were no differences between adherent and non-adherent patients in terms of the biological DMARD used.
ConclusionsThere are no differences in adherence to biological therapies among patients with chronic inflammatory arthropathies. Adherence correlates negatively with administration of biological DMARD by a family member and / or caregiver.
En los últimos años, el arsenal terapéutico para las enfermedades inflamatorias crónicas como artritis reumatoide (AR), espondilitis anquilosante (EspA) y artropatía psoriásica (APs) se ha incrementado con la aparición de los fármacos biológicos modificadores de la enfermedad (FAME-b)1.
Estos fármacos han mejorado la progresión de estas enfermedades impactando positivamente en la satisfacción del paciente con los tratamientos y en su calidad de vida. A pesar de ello, el éxito terapéutico de los tratamientos se ve comprometido por la falta de adherencia. La falta de adherencia es un proceso complejo, multifactorial, influido por factores que dependerán de la situación clínica del paciente, el tratamiento, su entorno personal y el entorno sanitario2. Existen pocos datos acerca de los factores predictivos de falta de adherencia en pacientes con AR, EspA y Aps3–5.
La tasa de adherencia terapéutica a los FAME-b en pacientes con artropatías inflamatorias crónicas varía entre el 28,2 y el 92,5% en función del fármaco y el método de evaluación6–9. La falta de adherencia en pacientes con una enfermedad reumatológica propicia nuevos procesos diagnósticos, respuestas subóptimas, cambios de tratamiento, retraso en la recuperación, progreso de la enfermedad, incremento significativo del número de hospitalizaciones, mayor duración de la estancia hospitalaria y un aumento de los costes sanitarios1,10.
El médico de atención primaria tiene un papel clave en el seguimiento de estos pacientes. Pudiendo detectar de manera eficaz factores relacionados con falta de adherencia que permiten realizar un seguimiento individualizado del paciente, mejorando así la adherencia terapéutica.
A nivel de atención primaria, el conocimiento que el facultativo adquiere del paciente, integrando aspectos clínicos y socioculturales, en coordinación con los servicios de reumatología y farmacia es clave en la adherencia terapéutica del paciente. Por ello, el médico de familia debe adquirir y mantener actualizados los conocimientos relacionados con las terapias biológicas y realizar un seguimiento del grado de adherencia al tratamiento detectando posibles factores asociados. Todo ello redundará en una mayor eficacia y seguridad del tratamiento y en una mayor calidad asistencial11.
En este sentido, conocer el grado de adherencia de los pacientes en la práctica clínica real, así como, identificar los factores asociados a la falta de adherencia, posibilita desarrollar estrategias individualizadas a las necesidades de cada paciente. El objetivo de este estudio fue conocer la adherencia terapéutica a FAME-b en pacientes con AR, EspA y APs y evaluar los factores predictivos de falta de adherencia.
Material y métodosEstudio observacional descriptivo transversal unicéntrico desarrollado en un hospital de tercer nivel. Se analizaron todos los pacientes diagnosticados de AR, APs o EspA en seguimiento por el Servicio de Reumatología, que cumplían los criterios de clasificación de AR de la American Rheumatism Association 198712, los criterios CASPAR de clasificación de APs13 y los criterios de clasificación de EspA de Nueva York modificados14–15, que habían firmado el consentimiento informado y que estuvieran en tratamiento con un FAME-b subcutáneo con una duración mínima de 6 meses con dicho tratamiento entre el 14 de noviembre de 2018 y el 15 de noviembre de 2019. Los FAME-b se dispensan desde las consultas externas de farmacia hospitalaria. Mediante el registro de dispensaciones y la historia clínica electrónica se identificó a los pacientes que cumplían los criterios de inclusión.
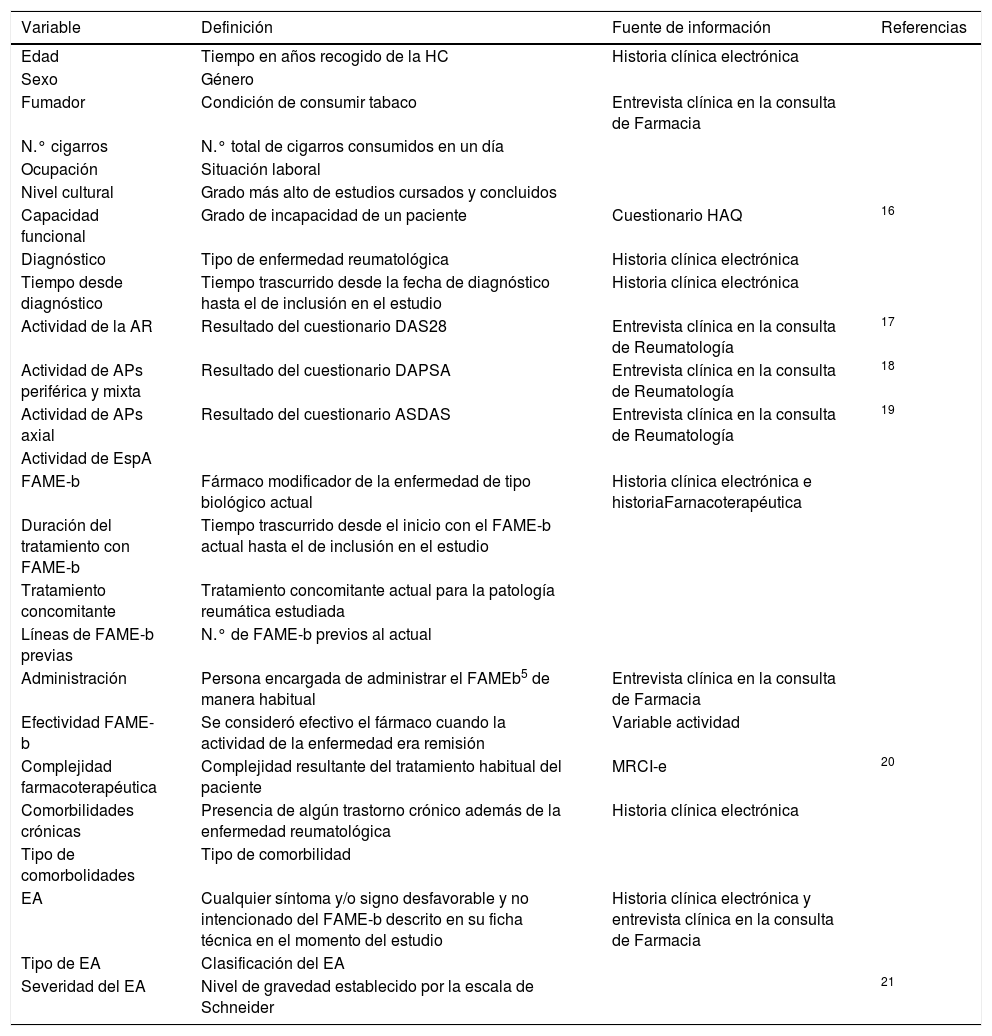
Las variables independientes estudiadas se muestran en la tabla 1. Las variables fueron recogidas mediante la realización de una entrevista clínica en la consulta de farmacia hospitalaria y otra en la consulta de Reumatología. Además, se revisaron las historias clínicas electrónicas del registro farmacoterapéutico de la farmacia.
Variables independientes y fuente de información
| Variable | Definición | Fuente de información | Referencias |
|---|---|---|---|
| Edad | Tiempo en años recogido de la HC | Historia clínica electrónica | |
| Sexo | Género | ||
| Fumador | Condición de consumir tabaco | Entrevista clínica en la consulta de Farmacia | |
| N.° cigarros | N.° total de cigarros consumidos en un día | ||
| Ocupación | Situación laboral | ||
| Nivel cultural | Grado más alto de estudios cursados y concluidos | ||
| Capacidad funcional | Grado de incapacidad de un paciente | Cuestionario HAQ | 16 |
| Diagnóstico | Tipo de enfermedad reumatológica | Historia clínica electrónica | |
| Tiempo desde diagnóstico | Tiempo trascurrido desde la fecha de diagnóstico hasta el de inclusión en el estudio | Historia clínica electrónica | |
| Actividad de la AR | Resultado del cuestionario DAS28 | Entrevista clínica en la consulta de Reumatología | 17 |
| Actividad de APs periférica y mixta | Resultado del cuestionario DAPSA | Entrevista clínica en la consulta de Reumatología | 18 |
| Actividad de APs axial | Resultado del cuestionario ASDAS | Entrevista clínica en la consulta de Reumatología | 19 |
| Actividad de EspA | |||
| FAME-b | Fármaco modificador de la enfermedad de tipo biológico actual | Historia clínica electrónica e historiaFarnacoterapéutica | |
| Duración del tratamiento con FAME-b | Tiempo trascurrido desde el inicio con el FAME-b actual hasta el de inclusión en el estudio | ||
| Tratamiento concomitante | Tratamiento concomitante actual para la patología reumática estudiada | ||
| Líneas de FAME-b previas | N.° de FAME-b previos al actual | ||
| Administración | Persona encargada de administrar el FAMEb5 de manera habitual | Entrevista clínica en la consulta de Farmacia | |
| Efectividad FAME-b | Se consideró efectivo el fármaco cuando la actividad de la enfermedad era remisión | Variable actividad | |
| Complejidad farmacoterapéutica | Complejidad resultante del tratamiento habitual del paciente | MRCI-e | 20 |
| Comorbilidades crónicas | Presencia de algún trastorno crónico además de la enfermedad reumatológica | Historia clínica electrónica | |
| Tipo de comorbolidades | Tipo de comorbilidad | ||
| EA | Cualquier síntoma y/o signo desfavorable y no intencionado del FAME-b descrito en su ficha técnica en el momento del estudio | Historia clínica electrónica y entrevista clínica en la consulta de Farmacia | |
| Tipo de EA | Clasificación del EA | ||
| Severidad del EA | Nivel de gravedad establecido por la escala de Schneider | 21 |
Para el cálculo de la adherencia se empleó la ratio media de posesión (MPR)22, definida como el porcentaje de días cubiertos con medicación dispensada respecto al total de días con medicación prescrita durante los 6 meses previos a la inclusión en el estudio, y dos cuestionarios de adherencia autorreferida por el paciente: el Compliance Questionnaire on Rheumatology (CQR-19)23 y el cuestionario Morisky Medication Adherence Scale (MMAS-8)24. El CQR-19 es un cuestionario de 19 ítems utilizado para medir la adherencia a un régimen terapéutico, identificando factores que contribuyen a la adherencia subóptima en pacientes con patologías reumáticas. La sensibilidad y especificidad es del 98%23. El MMAS-8 es el cuestionario de Morisky-Green modificado, presenta una sensibilidad del 93% y una especificidad del 53% e identifica comportamiento y barreras (olvidos, falta de cuidados, efectos adversos e ineficacia)24. Se consideraron «adherentes» los pacientes que cumplieron los tres criterios siguientes: MPR ≥ 80%, CQR ≥ 80% y MMAS-8 ≥ 8. En caso contrario se consideraron «no adherentes».
El análisis estadístico se llevó a cabo mediante el programa IBM-SPSS Stadistics® versión 25. En el análisis descriptivo, las variables cuantitativas se expresaron como media y desviación estándar en el caso de que siguieran una distribución normal, o como mediana y rango intercuartílico (RIQ) si no seguían distribución normal. Las variables categóricas se expresaron como valores absolutos y porcentajes. Para determinar los factores relacionados con la falta de adherencia se realizó un análisis bivariado. Para establecer la influencia de las variables cuantitativas se utilizó el test de la t de Student, si la variable seguía una distribución normal y el test de la U de Mann-Whitney, si la variable no seguía una distribución normal. Para establecer la influencia de las variables cualitativas se aplicó el test de la χ2 o el test de Fisher. Posteriormente, se realizó un análisis multivariado, de regresión logística mediante el método LR hacia atrás. El nivel de confianza se fijará en un 95%, aceptándose como significativas las diferencias encontradas en las que el valor p sea <0,05.
Se respetaron los principios éticos para la investigación médica en seres humanos promulgados en la Declaración de Helsinki25. De acuerdo con lo exigido por la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales. La base de datos se realizó garantizando la total confidencialidad de los pacientes, empleando exclusivamente dentro del ámbito profesional26. El estudio fue aprobado por el Comité Ético de Investigación del área sanitaria. Los autores de este estudio declaran no tener conflicto de intereses.
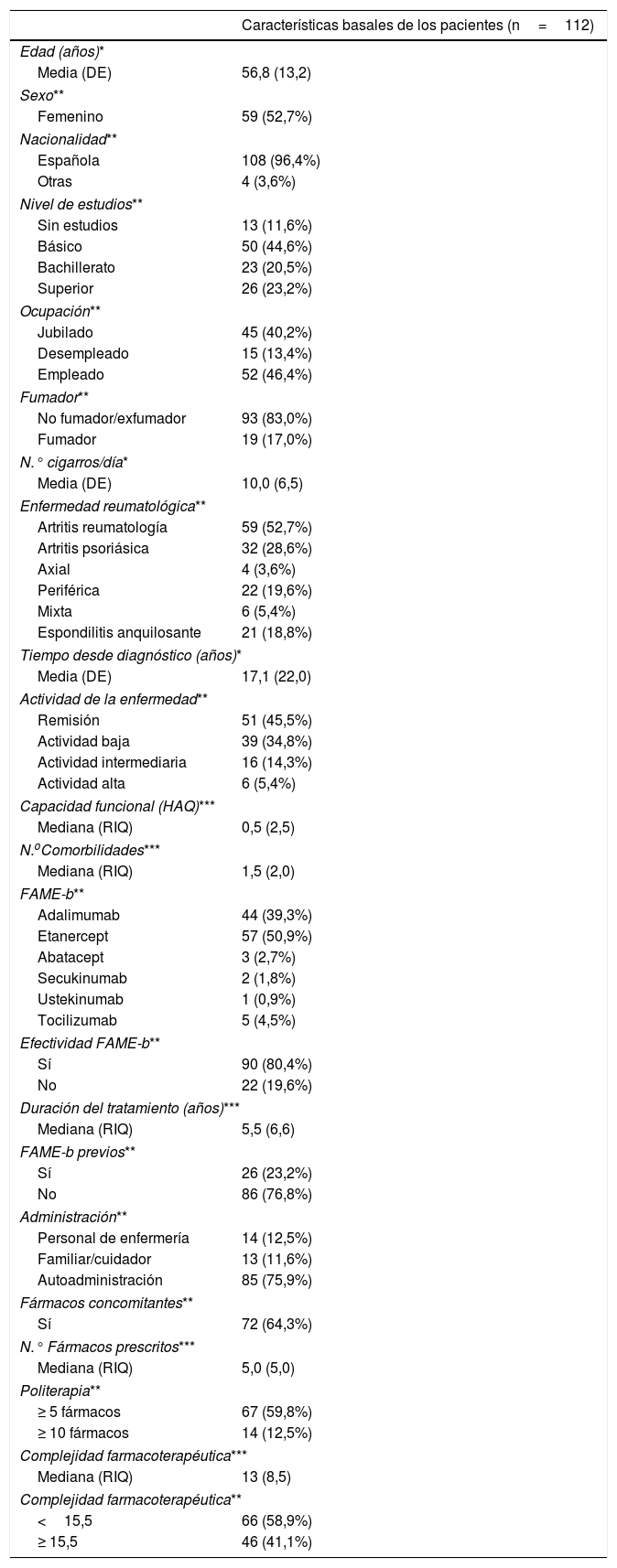
ResultadosSe analizaron 112 pacientes, un 52,7% (n=59) de los pacientes tenía artritis reumática, un 28,6% (n=32) artritis psoriásica y un 18,8% (n=21) espondilitis anquilosante. Los FAME-b prescritos fueron etanercept en el 50,9% (n=57) de los casos, adalimumab en el 39,3% (n=44), tocilizumab en el 4,5% (n=5), abatacept en el 2,7% (n=3), secukinumab en el 1,8% (n=2) y ustekinumab en el 0,9% (n=1).
La mediana de tiempo de duración del tratamiento con el FAME-b en el grupo adherente fue de 5,6 años (RIQ=6,5) y de 5,5 (RIQ=6,8) en el grupo de no adherentes. Las características clínicas, sociodemográficas y farmacoterapéuticas de los pacientes se muestran en la tabla 2.
Características basales de los pacientes
| Características basales de los pacientes (n=112) | |
|---|---|
| Edad (años)* | |
| Media (DE) | 56,8 (13,2) |
| Sexo** | |
| Femenino | 59 (52,7%) |
| Nacionalidad** | |
| Española | 108 (96,4%) |
| Otras | 4 (3,6%) |
| Nivel de estudios** | |
| Sin estudios | 13 (11,6%) |
| Básico | 50 (44,6%) |
| Bachillerato | 23 (20,5%) |
| Superior | 26 (23,2%) |
| Ocupación** | |
| Jubilado | 45 (40,2%) |
| Desempleado | 15 (13,4%) |
| Empleado | 52 (46,4%) |
| Fumador** | |
| No fumador/exfumador | 93 (83,0%) |
| Fumador | 19 (17,0%) |
| N.° cigarros/día* | |
| Media (DE) | 10,0 (6,5) |
| Enfermedad reumatológica** | |
| Artritis reumatología | 59 (52,7%) |
| Artritis psoriásica | 32 (28,6%) |
| Axial | 4 (3,6%) |
| Periférica | 22 (19,6%) |
| Mixta | 6 (5,4%) |
| Espondilitis anquilosante | 21 (18,8%) |
| Tiempo desde diagnóstico (años)* | |
| Media (DE) | 17,1 (22,0) |
| Actividad de la enfermedad** | |
| Remisión | 51 (45,5%) |
| Actividad baja | 39 (34,8%) |
| Actividad intermediaria | 16 (14,3%) |
| Actividad alta | 6 (5,4%) |
| Capacidad funcional (HAQ)*** | |
| Mediana (RIQ) | 0,5 (2,5) |
| N.oComorbilidades*** | |
| Mediana (RIQ) | 1,5 (2,0) |
| FAME-b** | |
| Adalimumab | 44 (39,3%) |
| Etanercept | 57 (50,9%) |
| Abatacept | 3 (2,7%) |
| Secukinumab | 2 (1,8%) |
| Ustekinumab | 1 (0,9%) |
| Tocilizumab | 5 (4,5%) |
| Efectividad FAME-b** | |
| Sí | 90 (80,4%) |
| No | 22 (19,6%) |
| Duración del tratamiento (años)*** | |
| Mediana (RIQ) | 5,5 (6,6) |
| FAME-b previos** | |
| Sí | 26 (23,2%) |
| No | 86 (76,8%) |
| Administración** | |
| Personal de enfermería | 14 (12,5%) |
| Familiar/cuidador | 13 (11,6%) |
| Autoadministración | 85 (75,9%) |
| Fármacos concomitantes** | |
| Sí | 72 (64,3%) |
| N.° Fármacos prescritos*** | |
| Mediana (RIQ) | 5,0 (5,0) |
| Politerapia** | |
| ≥ 5 fármacos | 67 (59,8%) |
| ≥ 10 fármacos | 14 (12,5%) |
| Complejidad farmacoterapéutica*** | |
| Mediana (RIQ) | 13 (8,5) |
| Complejidad farmacoterapéutica** | |
| <15,5 | 66 (58,9%) |
| ≥ 15,5 | 46 (41,1%) |
FAME-b: fármacos biológicos modificadores de la enfermedad; HAQ: Health Assessment Questionnaire.
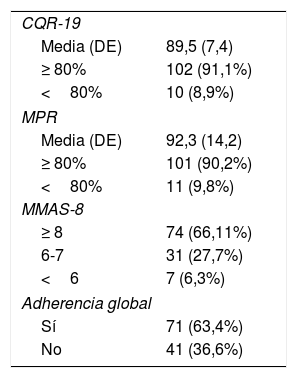
La adherencia media según la MPR fue de 92,3±14,2%. No se encontraron diferencias entre las diferentes patologías. La media en AR fue de 89,4±17,0%, en AP fue de 96,5±6,4% y en EspA fue de 93,7±12,4%. El porcentaje de pacientes con una MPR ≥ 80% fue similar entre las enfermedades, en EA 96,19% (n=31), en AR 84,7% (n=50) y en APs 95,2% (n=20) (p=0,123).
En cuanto a la seguridad de los FAME-b, un 32,1% (n=36) de los pacientes presentaron algún tipo de EA, en el 18,8% (n=21) de los casos fue de tipo infeccioso. La gravedad del EA fue el 28,6% (n=32) de las ocasiones de Grado 1 y solo un 16,1% (n=18) de los pacientes necesitó espaciar la dosis por EA.
La adherencia media según el CQR-19 fue de 89,5±7,4%. No se encontraron diferencias entre las diferentes patologías. La media en AR fue de 89,1±8,4%, en AP fue de 90,3±5,6% y en EspA fue de 89,2±7,1%. El porcentaje de pacientes con un CQR-19 ≥ 80% fue similar entre las enfermedades: en EA 96,19% (n=31), en AR 88,1% (n=52) y en APs 90,5% (n=19) (p=0,375). El 20,5% de los pacientes presentaban falta de confianza en sus fármacos.
Según el MMAS-8, 74 pacientes (66,1%) presentaban una adherencia alta. El porcentaje de pacientes con una MMAS-8 ≥ 8 fue similar entre las enfermedades: en AR (64,4%) (n=38), en EA 62,5% (n=20) y en APs 76,2% (n=16) (p=0,637).
Se dividió la muestra en dos grupos: pacientes adherentes (que cumplían los tres criterios: MPR ≥ 80%, CQR-19 ≥ 80% y MMAS-8 ≥ 8) y no adherentes (que no cumplían algunos de los criterios: MPR <80% o CQR-19 <80% o MMAS-8 <8). De esta manera fueron considerados adherentes el 63,4% (n=71) y no adherentes el 36,6% (n=41). En la tabla 3 se muestra la adherencia medida según CQR-19, MMAS-8 y la ratio media de posesión y la adherencia global. Según el MMAS-8, el 79,5% (n=89) de los pacientes nunca o casi nunca olvidaba administrarse la medicación, un 14,3% (n=16) de los pacientes rara vez olvidaba la administración, un 2,7% (n=3) se olvidaba habitualmente, un 2,7% (n=3) se olvidaba siempre de administrarse la medicación y un 0,9% (n=1) se olvidaba solo algunas veces.
Adherencia según CQR-19, MMAS-8, MPR y adherencia final
| CQR-19 | |
| Media (DE) | 89,5 (7,4) |
| ≥ 80% | 102 (91,1%) |
| <80% | 10 (8,9%) |
| MPR | |
| Media (DE) | 92,3 (14,2) |
| ≥ 80% | 101 (90,2%) |
| <80% | 11 (9,8%) |
| MMAS-8 | |
| ≥ 8 | 74 (66,11%) |
| 6-7 | 31 (27,7%) |
| <6 | 7 (6,3%) |
| Adherencia global | |
| Sí | 71 (63,4%) |
| No | 41 (36,6%) |
Las variables cualitativas se expresan como media y desviación estándar (DE) y las variables cualitativas se expresan como número absoluto y porcentaje.
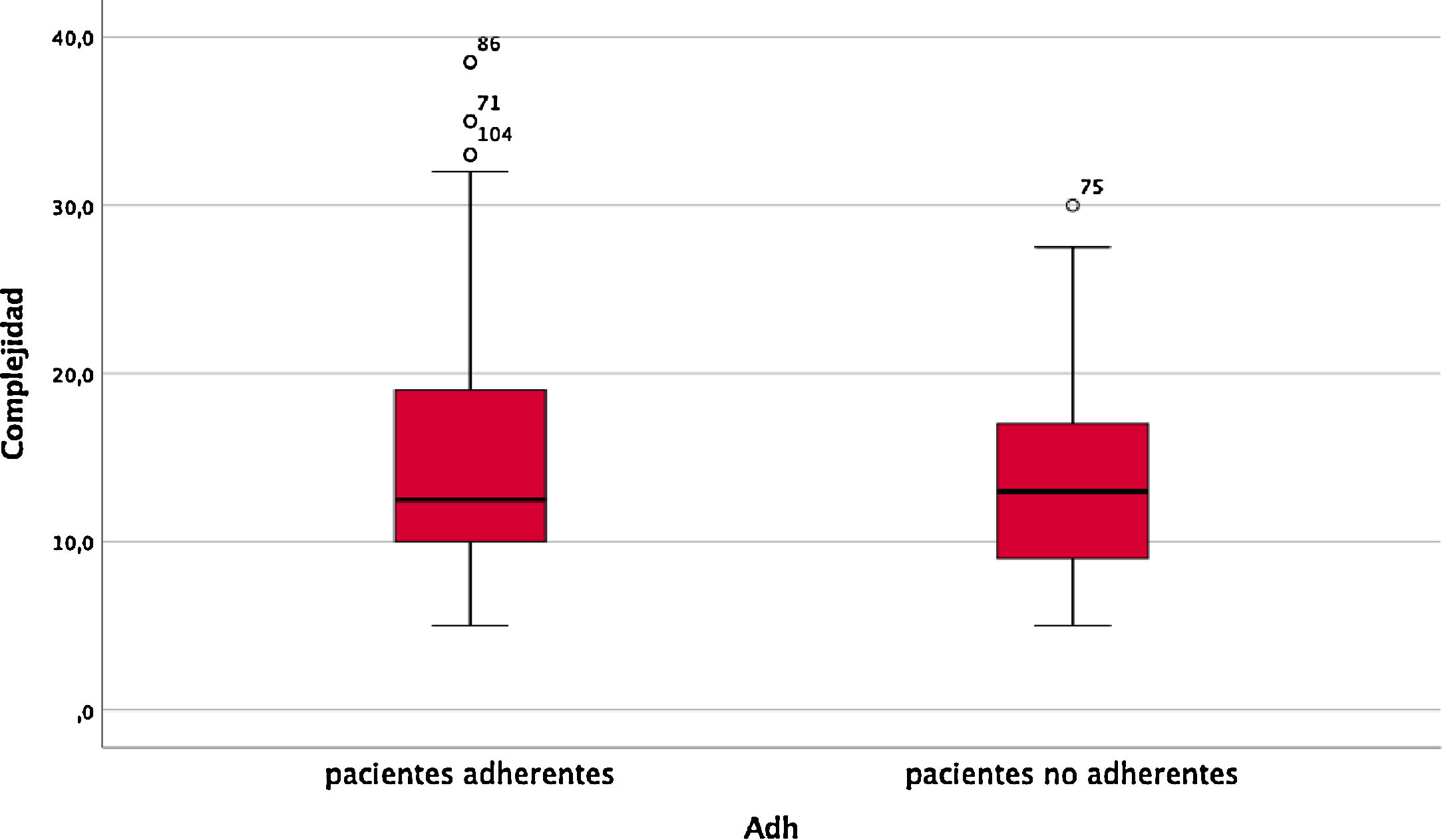
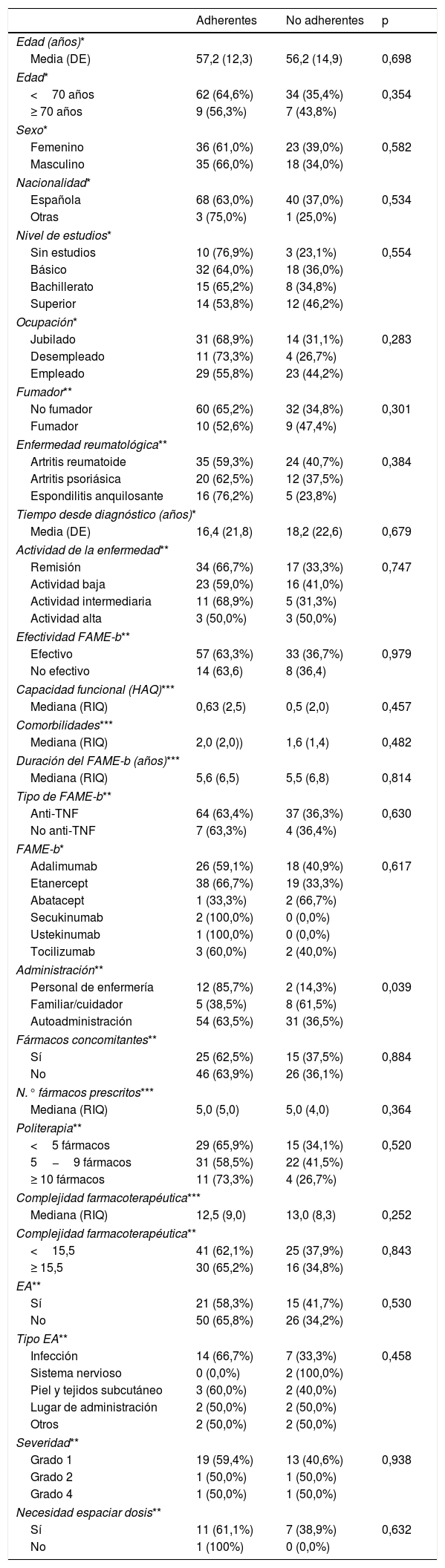
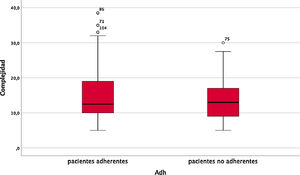
Se realizó un análisis univariante de los posibles factores de riesgo cuyos resultados se detallan en la tabla 4. La mediana de complejidad farmacoterapéutica fue de 13,0 (RIQ=8,5), no existiendo diferencias entre grupos (fig. 1). Solo se encontraron diferencias estadísticamente significativas en cuanto a la administración del FAME-b; de manera más llamativa, en la administración por parte del personal de enfermería, pues parece favorecer una mejor adherencia al tratamiento lográndose un 85,7% de adherencia en estos pacientes.
Análisis univariante de los posibles factores de riesgo relacionados con la adherencia
| Adherentes | No adherentes | p | |
|---|---|---|---|
| Edad (años)* | |||
| Media (DE) | 57,2 (12,3) | 56,2 (14,9) | 0,698 |
| Edad* | |||
| <70 años | 62 (64,6%) | 34 (35,4%) | 0,354 |
| ≥ 70 años | 9 (56,3%) | 7 (43,8%) | |
| Sexo* | |||
| Femenino | 36 (61,0%) | 23 (39,0%) | 0,582 |
| Masculino | 35 (66,0%) | 18 (34,0%) | |
| Nacionalidad* | |||
| Española | 68 (63,0%) | 40 (37,0%) | 0,534 |
| Otras | 3 (75,0%) | 1 (25,0%) | |
| Nivel de estudios* | |||
| Sin estudios | 10 (76,9%) | 3 (23,1%) | 0,554 |
| Básico | 32 (64,0%) | 18 (36,0%) | |
| Bachillerato | 15 (65,2%) | 8 (34,8%) | |
| Superior | 14 (53,8%) | 12 (46,2%) | |
| Ocupación* | |||
| Jubilado | 31 (68,9%) | 14 (31,1%) | 0,283 |
| Desempleado | 11 (73,3%) | 4 (26,7%) | |
| Empleado | 29 (55,8%) | 23 (44,2%) | |
| Fumador** | |||
| No fumador | 60 (65,2%) | 32 (34,8%) | 0,301 |
| Fumador | 10 (52,6%) | 9 (47,4%) | |
| Enfermedad reumatológica** | |||
| Artritis reumatoide | 35 (59,3%) | 24 (40,7%) | 0,384 |
| Artritis psoriásica | 20 (62,5%) | 12 (37,5%) | |
| Espondilitis anquilosante | 16 (76,2%) | 5 (23,8%) | |
| Tiempo desde diagnóstico (años)* | |||
| Media (DE) | 16,4 (21,8) | 18,2 (22,6) | 0,679 |
| Actividad de la enfermedad** | |||
| Remisión | 34 (66,7%) | 17 (33,3%) | 0,747 |
| Actividad baja | 23 (59,0%) | 16 (41,0%) | |
| Actividad intermediaria | 11 (68,9%) | 5 (31,3%) | |
| Actividad alta | 3 (50,0%) | 3 (50,0%) | |
| Efectividad FAME-b** | |||
| Efectivo | 57 (63,3%) | 33 (36,7%) | 0,979 |
| No efectivo | 14 (63,6) | 8 (36,4) | |
| Capacidad funcional (HAQ)*** | |||
| Mediana (RIQ) | 0,63 (2,5) | 0,5 (2,0) | 0,457 |
| Comorbilidades*** | |||
| Mediana (RIQ) | 2,0 (2,0)) | 1,6 (1,4) | 0,482 |
| Duración del FAME-b (años)*** | |||
| Mediana (RIQ) | 5,6 (6,5) | 5,5 (6,8) | 0,814 |
| Tipo de FAME-b** | |||
| Anti-TNF | 64 (63,4%) | 37 (36,3%) | 0,630 |
| No anti-TNF | 7 (63,3%) | 4 (36,4%) | |
| FAME-b* | |||
| Adalimumab | 26 (59,1%) | 18 (40,9%) | 0,617 |
| Etanercept | 38 (66,7%) | 19 (33,3%) | |
| Abatacept | 1 (33,3%) | 2 (66,7%) | |
| Secukinumab | 2 (100,0%) | 0 (0,0%) | |
| Ustekinumab | 1 (100,0%) | 0 (0,0%) | |
| Tocilizumab | 3 (60,0%) | 2 (40,0%) | |
| Administración** | |||
| Personal de enfermería | 12 (85,7%) | 2 (14,3%) | 0,039 |
| Familiar/cuidador | 5 (38,5%) | 8 (61,5%) | |
| Autoadministración | 54 (63,5%) | 31 (36,5%) | |
| Fármacos concomitantes** | |||
| Sí | 25 (62,5%) | 15 (37,5%) | 0,884 |
| No | 46 (63,9%) | 26 (36,1%) | |
| N.° fármacos prescritos*** | |||
| Mediana (RIQ) | 5,0 (5,0) | 5,0 (4,0) | 0,364 |
| Politerapia** | |||
| <5 fármacos | 29 (65,9%) | 15 (34,1%) | 0,520 |
| 5−9 fármacos | 31 (58,5%) | 22 (41,5%) | |
| ≥ 10 fármacos | 11 (73,3%) | 4 (26,7%) | |
| Complejidad farmacoterapéutica*** | |||
| Mediana (RIQ) | 12,5 (9,0) | 13,0 (8,3) | 0,252 |
| Complejidad farmacoterapéutica** | |||
| <15,5 | 41 (62,1%) | 25 (37,9%) | 0,843 |
| ≥ 15,5 | 30 (65,2%) | 16 (34,8%) | |
| EA** | |||
| Sí | 21 (58,3%) | 15 (41,7%) | 0,530 |
| No | 50 (65,8%) | 26 (34,2%) | |
| Tipo EA** | |||
| Infección | 14 (66,7%) | 7 (33,3%) | 0,458 |
| Sistema nervioso | 0 (0,0%) | 2 (100,0%) | |
| Piel y tejidos subcutáneo | 3 (60,0%) | 2 (40,0%) | |
| Lugar de administración | 2 (50,0%) | 2 (50,0%) | |
| Otros | 2 (50,0%) | 2 (50,0%) | |
| Severidad** | |||
| Grado 1 | 19 (59,4%) | 13 (40,6%) | 0,938 |
| Grado 2 | 1 (50,0%) | 1 (50,0%) | |
| Grado 4 | 1 (50,0%) | 1 (50,0%) | |
| Necesidad espaciar dosis** | |||
| Sí | 11 (61,1%) | 7 (38,9%) | 0,632 |
| No | 1 (100%) | 0 (0,0%) | |
EA: efecto adverso; FAME-b: fármacos biológicos modificadores de la enfermedad; HAQ: Health Assessment Questionnaire.
El análisis multivariante de los factores de riesgo, con el fin de valorar el impacto de los mismos sobre la falta de adherencia, mostró que la administración del FAME-b por parte de un familiar se asocia, de manera independiente y ajustado a los otros factores, con 9,6 veces más probabilidad de ser no adherente con respecto a la administración por parte de personal sanitario (OR=9,6; [IC] 95%: 1,5-61,8; p <0,05).
DiscusiónLa tasa de adherencia terapéutica a los FAME-b en este estudio fue similar a lo publicado en otros estudios variando entre 57,3–92,5%6–8 para AR, entre 57,7–89,0% para Aps7–8 y entre 28,2–89,0% para EspA7–9.
El cuestionario MMAS-8 parece detectar más pacientes no adherentes (34,0%) que el CQR-19 (8,9%) y el MPR (9,8%). Sin embargo, la utilización del cuestionario de Morisky Green en este tipo de pacientes no parece tener tanta utilidad como en otras patologías7,27.
Nuestro estudio presenta diferencias importantes entre el número de pacientes con adalimumab o etanercept respecto al resto de FAME-b, lo que dificulta la comparación de la adherencia entre los diferentes FAME-b. Cuando se agruparon los FAME-b según su mecanismo de acción (aquellas con mecanismo de acción antifactor de necrosis tumoral alfa frente a las de otro mecanismo de acción) no se encontraron diferencias entre ambos grupos, aunque en la publicación de Smolen et al. el uso de fármacos antifactor de necrosis tumoral alfa, sí fue un factor predictivo de adherencia pero no comparado frente a otros FAME-b, sino frente al uso de fármacos modificadores de la enfermedad sintéticos8.
El factor que mejor parece correlacionarse con falta de adherencia es la administración del medicamento. Existen estudios que describen una mayor falta de adherencia en relación con la vía de administración subcutánea6,28 o en aquellos pacientes que se autoadministran el FAME-b3–4. En nuestro estudio se objetiva una menor adherencia si el medicamento es administrado por un familiar/cuidador con respecto a la administración por el personal de enfermería. Calip et al. relacionaron la autoadministración con la falta de adherencia3, pero no hemos encontrado ningún estudio en pacientes con estas enfermedades que relacione el fallo de adherencia con la administración por un familiar/cuidador. Este hecho podría ser explicado por una incompatibilidad temporal del familiar/cuidador con la pauta posológica.
Estudios publicados relacionan como factores predictivos de no adherencia, características demográficas como la edad y el sexo3–4. Con relación a la edad parece existir una ligera mayor adherencia en pacientes menores de 70 años (p=0,096). Contrariamente, en el estudio de Calip et al. se vio una peor adherencia en adultos jóvenes comparativamente con las personas de mayor edad3. Turcu-Stiolica et al. encontraron diferencias significativas entre el sexo y la adherencia5. En nuestro estudio no se han encontrado diferencias estadísticamente significativas en relación con la adherencia en función del sexo, lo mismo que ocurre en diversos estudios publicados8,29.
El aumento de medicamentos en el plan farmacoterapéutico del paciente ha sido descrito por Salt et al. como un riesgo de no adherencia (OR 1,7; p<0,05) en AR, así como el aumento en la complejidad farmacoterapéutica entendida, no solo como el número de fármacos y dosis que toma el paciente, sino también las formas farmacéuticas presentes y las instrucciones especiales de administración4. Esto también se ha relacionado con una menor adherencia a los tratamientos en pacientes mayores de 65 años30–31. En nuestro estudio no hubo diferencias estadísticamente significativas en términos de complejidad, probablemente debido al bajo tamaño muestral.
Con respecto al nivel de educación y la situación laboral en este trabajo parece haber una relación favorable entre el desempleo y la adherencia, no obstante, en la literatura no encontramos ningún artículo a favor de esta relación29. Esto podría deberse a la mayor disponibilidad horaria en este tipo de pacientes. Turcu-Stiolica et al. concluyeron que la adherencia estaba relacionada con el nivel cultural, en nuestro estudio no se han encontrado diferencias estadísticamente significativas5.
En este estudio no se ha tenido en cuenta la variable frecuencia de dosificación de manera individualizada. En algunos estudios sobre AR se vio una menor adherencia en aquellos pacientes con administración semanal en comparación con la administración mensual27.
En relación con la seguridad de los FAME-b, no se encontraron diferencias estadísticamente significativas entre los EA y la adherencia. La presencia de EA afecta negativamente a la adherencia y es un factor mencionado a menudo por los pacientes para alterar la posología por su cuenta. Sin embargo, se constata que en la práctica esta razón no suele ser tan primordial como se aduce32.
Nuestro estudio tiene algunas limitaciones. En primer lugar, el tamaño muestral insuficiente y la baja potencia estadística. Se comprobó mediante un análisis univariante que la muestra seleccionada no presentaba diferencias estadísticamente significativas en cuanto a edad y sexo frente a la población. Probablemente podría existir un infrarregistro debido a que las historias clínicas electrónicas no están diseñadas para la explotación de datos. También puede existir un sesgo de memoria selectiva de los pacientes a la hora de realizar la entrevista clínica.
Según los datos obtenidos, la tasa de adherencia terapéutica a los FAME-b es similar a lo publicado en la literatura. No se han encontrado diferencias en cuanto a la adherencia en función del FAME-b utilizado ni de la patología. En cuanto a los posibles factores de riesgo, la administración del fármaco por parte de un familiar y/o cuidador se relacionó con una mayor falta de adherencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.