El cáncer de cuello uterino es el segundo tumor más frecuente a nivel mundial en mujeres, con una mortalidad anual en España de 3,6 por 100.000 mujeres. En Cantabria existe un protocolo oportunista de detección precoz. El objetivo de este trabajo es proponer un diseño de programa poblacional para Cantabria y evaluar su coste-beneficio.
Pacientes y métodosEl diseño del programa poblacional se ha realizado teniendo en cuenta las características de la historia natural de esta enfermedad, y su incidencia y mortalidad en Cantabria entre 2000-2009. Se plantean propuestas para aumentar la participación en el programa y evaluar su calidad. Se han estimado costes y beneficios (directos e indirectos) en diversos escenarios variando la periodicidad de las pruebas (3-5 años), la edad de acceso al programa (21, 25 o 30 años), la cobertura de este (60-80%), y tasas de descuento (0-3-6%).
ResultadosCon una cobertura del 80% realizar las pruebas cada 3 años genera unos costes anuales de 893.000€ (tasa de descuento del 3%) respecto al protocolo oportunista actual. Los escenarios de pruebas cada 5 años generan unos beneficios anuales superiores a 618.000€, dependiendo de la edad de entrada en el programa.
ConclusionesLos escenarios con cobertura menor del 60% o entrada al programa a partir de los 30 años de edad no son interesantes debido a los menores beneficios en salud, mientras que con similares resultados en salud, realizar las pruebas cada 5 años es más beneficioso económicamente que realizar las pruebas cada 3.
Cervical cancer is the second most common cancer worldwide in women, with an annual mortality of 3.6 per 100.000 women in Spain. An opportunistic screening protocol is currently being developed in Cantabria. The objective of the study is to propose a population-based screening program in Cantabria and assess its cost-benefits.
Patients and methodsThe population-based program design has been carried out according to the description of the natural course of cervical cancer and its incidence and mortality in Cantabria during 2000-2009. There have been some proposals to increase participation in the program and to evaluate its quality. Costs and benefits (direct and indirect) have been analyzed in several scenarios by modifying the frequency of tests (3-5 years), the age at which the program can be accessed (21, 25 or 30 years), the coverage of the program (60-80%), and discount rates (0-3-6%).
ResultsA program carried out with coverage of 80% and tests performed every 3 years generates annual costs of €893.000 (discount rate of 3%) compared to the current opportunistic protocol. Scenarios with tests performed every 5 years generate an annual benefit higher than €618.000, depending on the age of accessing the program.
ConclusionsScenarios with coverage lower than 60% or with women over 30 years old having access to the program are not of interest because of the lower health benefits. However, performing tests every 5 years is more economically advantageous than every 3 years, with similar health benefits.
Los programas de salud se diseñan usualmente en base a consideraciones puramente clínicas, obviando, en muchas ocasiones, los costes. Lamentablemente disponemos de recursos limitados, por lo cual deberíamos elegir las opciones sanitarias con mejor relación coste-beneficio. Es en este contexto donde tienen relevancia los estudios de evaluación económica (EE), como herramienta de ayuda a la hora de tomar decisiones con relación al mejor aprovechamiento de los recursos. Por ello, a la hora de diseñar cualquier programa de salud, además de consideraciones de carácter clínico, y otros elementos como la justicia, la equidad, la accesibilidad y la libertad de elección, se deben tener en cuenta los estudios de EE como otro argumento a considerar en la toma de decisiones1.
El cáncer de cuello uterino es el segundo más común a nivel mundial en las mujeres2. Por sus características cumple con los criterios establecidos por el Consejo de la Unión Europea de ser una enfermedad susceptible de diagnóstico precoz sistemático poblacional3,4, lo cual evitará pruebas de cribado innecesarias. Se recomienda la realización previa de EE que orienten sobre los costes reales de la puesta en marcha de un programa de cribado poblacional5.
La mayor parte de EE que existen sobre el cribado de cáncer de cuello uterino se basan en modelos de coste-efectividad o de coste-utilidad6,7. Existen muy pocos análisis coste-beneficio8, por lo que es complicado determinar con seguridad los beneficios de emprender un programa de cribado poblacional en relación con otras posibilidades.
Los objetivos de este trabajo son: 1) realizar el diseño de un programa poblacional de diagnóstico precoz de cáncer de cuello uterino en la Comunidad Autónoma de Cantabria; 2) analizar los costes del programa poblacional propuesto, y 3) evaluar el coste-beneficio del programa de cribado poblacional diseñado.
MétodosPoblaciónEl cribado poblacional para la detección del cáncer de cuello uterino, según la evidencia científica actualmente disponible9,10, se realizará a mujeres entre 21 y 65 años de edad. El Instituto Nacional de Estadística, según el padrón de 2011, informa de 303.249 mujeres en Cantabria: 52.345 menores de 20 años, 61.793 mayores de 66, y 189.111 en el rango de edad objeto de estudio.
EscenariosHemos considerado diferentes escenarios en función de la edad de entrada al programa (21, 25, 30 años), que en todos los casos va a finalizar a los 65 años, el intervalo entre pruebas sucesivas (3 o 5 años), y el porcentaje de cobertura alcanzado (60, 80%). De este modo hemos establecido 6 diferentes escenarios (definidos con precisión más adelante), en los cuales se realizará el análisis coste-beneficio, con referencia a los costes del cribado oportunista de detección precoz de cáncer de cuello uterino en Cantabria11.
Análisis de costes- A)
Directos: incluyen recursos sanitarios de la intervención y consumidos por el paciente y su entorno.
- A.1)
Por carga de enfermedad: emplearemos los datos de costes de cáncer de cuello uterino en Cantabria11.
- A.2)
Del cribado: incluyen costes de consultas de atención primaria aplicando la Orden SAN/12/2011, del material preciso y de la técnica de citología líquida realizada en los Servicios de Anatomía Patológica. Además, se incluyen los costes estimados de gestión administrativa (cartas, ensobrado, trípticos, franqueo, etc.).
- A.1)
- B)
Indirectos: definen pérdidas potenciales de productividad que ocasiona la enfermedad, incluyendo costes derivados de morbimortalidad. Emplearemos los datos de costes derivados de morbimortalidad por cáncer de cuello uterino en Cantabria11. Los costes de mortalidad valoran pérdidas de productividad por muerte prematura, medidos como años potenciales de vida laboral perdida (APVLP): son los que se pierden por fallecer antes de la edad legal de jubilación12.
Cuantifican los costes evitados al poner en marcha el programa poblacional. Pueden ser:
- A)
Directos, en relación con la carga de enfermedad.
- B)
Indirectos, correspondientes a las pérdidas de productividad por muerte prematura e incapacidad. Implica conocer datos de la variación de la incidencia y de las muertes evitadas por la enfermedad al pasar del protocolo oportunista existente al programa poblacional propuesto.
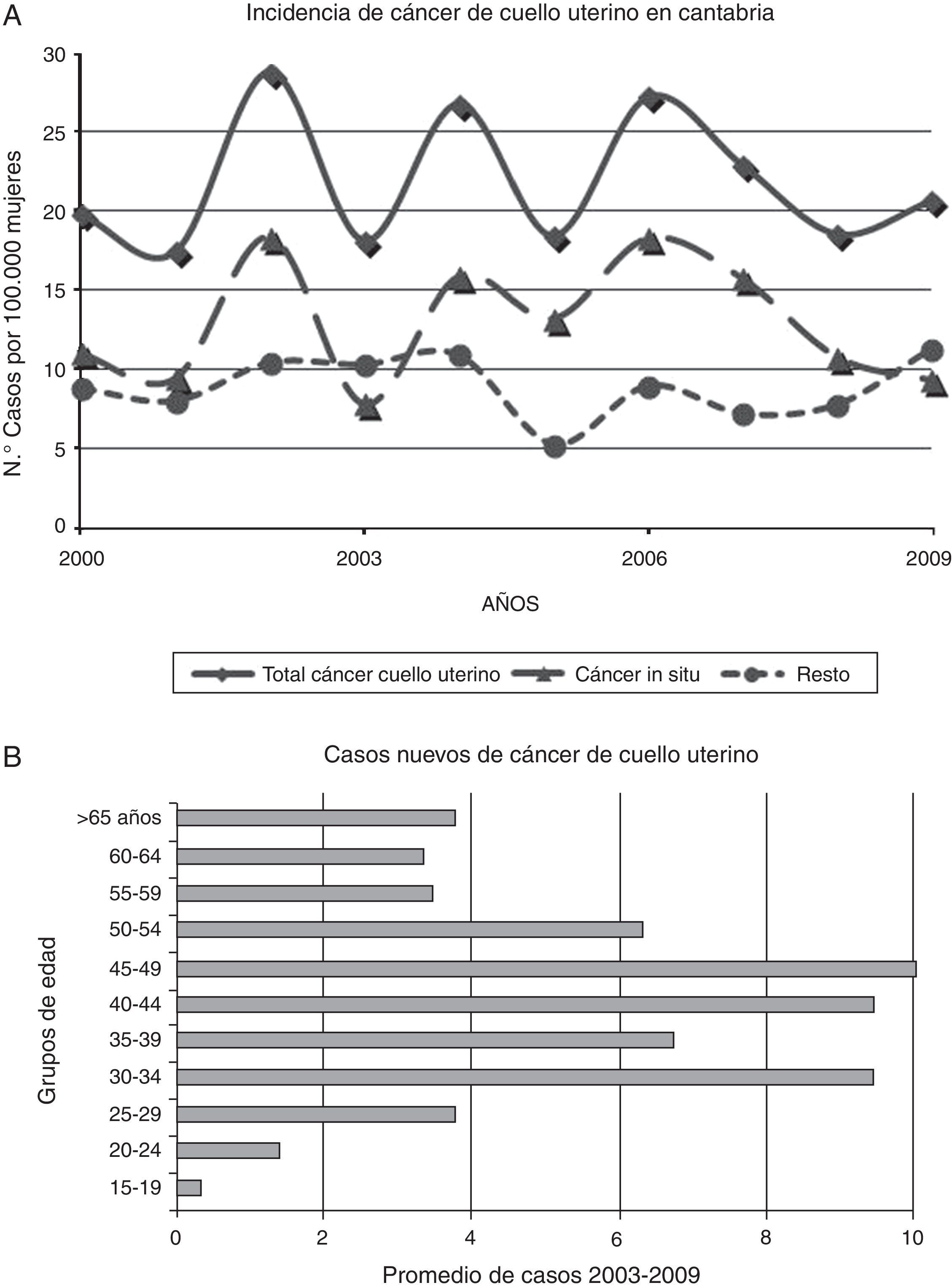
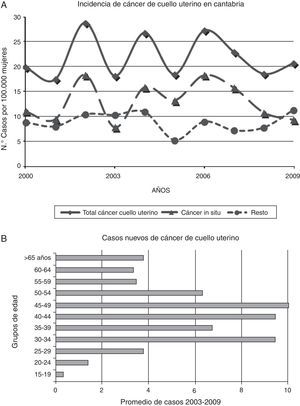
Para estimar los beneficios en salud del programa se han utilizado valores de la literatura8,13,14, fundamentalmente ajustando los datos de entrada del modelo de microsimulación para cáncer cervical del Microsimulation Screening Analysis6,15,16 a los datos de incidencia (fig. 1) y mortalidad de Cantabria11. Este modelo considera la historia natural del cáncer de cuello uterino (superior a 15 años desde su inicio), el tiempo medio de transición entre los diferentes estadios de la enfermedad, la probabilidad de detección con citologías y la reducción de mortalidad cuando se detecta la enfermedad en un determinado estadio. Además, maneja datos de probabilidad de mortalidad por cáncer de cuello uterino según la edad de diagnóstico y los años transcurridos desde la detección de la enfermedad15,16. Según el Microsimulation Screening Analysis, al detectar una lesión en etapa preinvasiva, la tasa de curación es del 100%, y detectada en etapa invasiva, la mortalidad disminuye entre 20-80%, dependiendo del estadio de la enfermedad15.
Diseño del programaEs de elaboración propia. El esquema de actuación se obtiene empleando como datos de referencia las edades de acceso y finalización del programa, la periodicidad de las pruebas a realizar y la incidencia de la enfermedad en Cantabria (referida al número de mujeres), obtenida del Registro de Tumores (Sección de Vigilancia Epidemiológica de la Dirección General de Salud Pública, Consejería de Sanidad y Servicios Sociales, Gobierno de Cantabria), para el periodo entre 2000-2009.
La inclusión simultánea de todas las mujeres en el rango de edad (21-65) es poco adecuado operativamente. Para decidir la forma más pertinente de incluirlas en el programa analizamos los datos de incidencia del cáncer de cuello uterino en Cantabria. Se detectó un promedio anual de 21,9 casos por 100.000 mujeres (13 corresponden a cáncer in situ, que es el grupo que más se puede beneficiar del programa de cribado). El análisis por grupos de edad permite mostrar la presencia de picos de incidencia en los grupos de 30-34; 40-49 y>65 años (fig. 1).
Número de citologías a realizar y momento de accesoSegún la incidencia en Cantabria y la evidencia científica disponible, se ha elegido para el inicio del cribado a las mujeres que durante el año natural de acceso al programa cumplan alguno de los siguientes requisitos: 1) 21 años (edad a la que se recomienda el inicio del cribado); 2) 34 o 49 años (edades con un pico de incidencia en Cantabria), y 3) 64 años (antes de cumplir la edad de abandonar el cribado).
Propuestas de diseño sucesivoLa segunda citología se realizará siempre al año. A partir de la tercera planteamos 2 propuestas de intervalos de citologías:
- A)
Cada 3 años, similar al protocolo oportunista vigente.
- B)
Cada 5 años, avalada por estudios de ámbito internacional17–20 que consideran que un programa de cribado realizado cada 5 años podría ser más coste-efectivo.
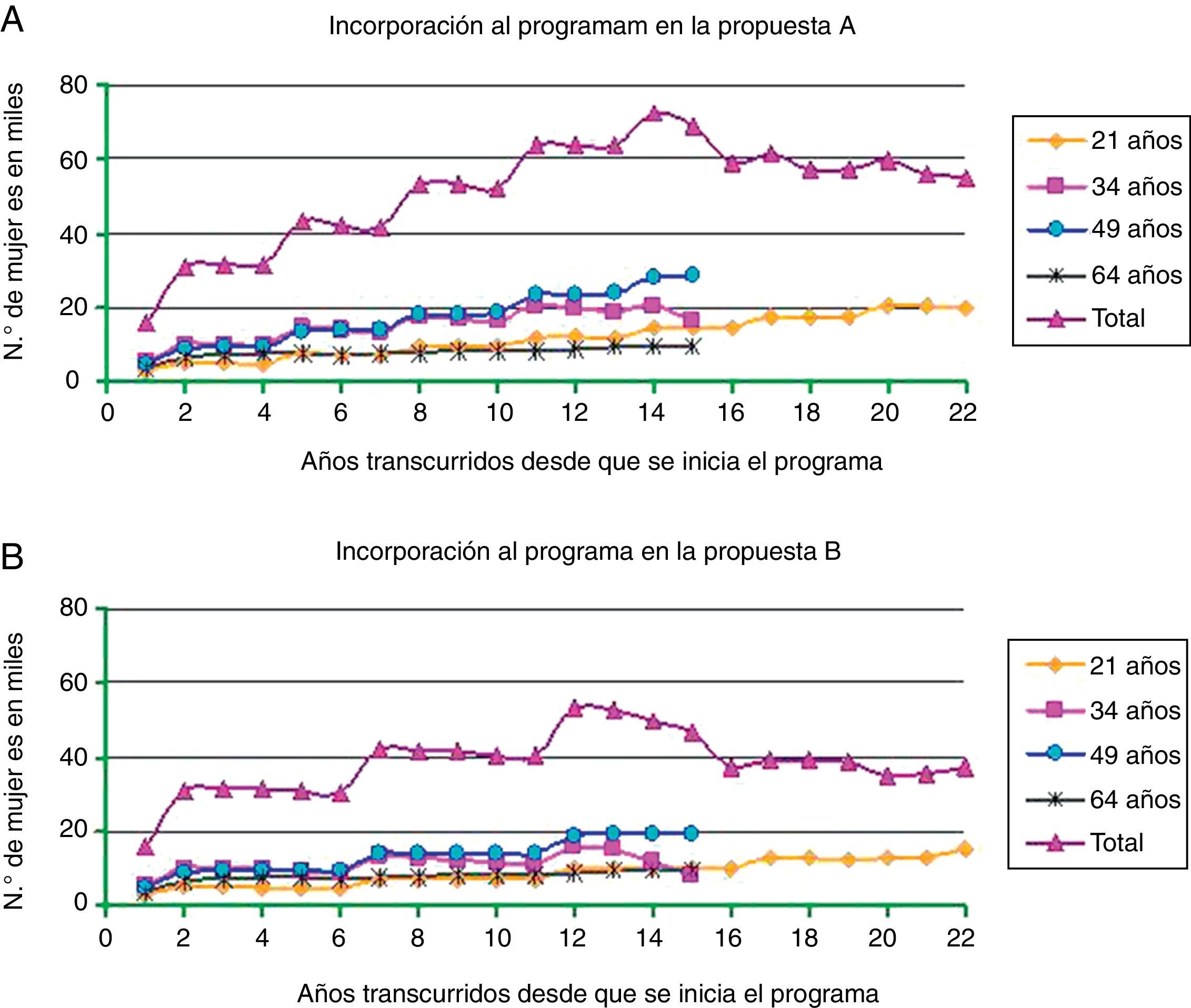
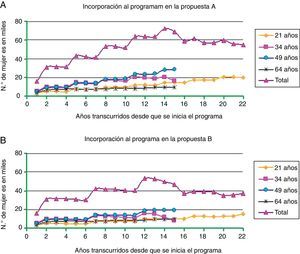
La figura 2 muestra la secuencia de incorporación al programa en ambas propuestas: A y B.
Número de mujeres que se incorporarán anualmente a la realización de citologías al implementar un programa poblacional de cribado de cáncer de cuello uterino. La periodicidad de las citologías sucesivas será cada 3 años en el caso de la propuesta A (A), y cada 5 en la propuesta B (B).
La previsión de citologías a realizar el primer año será de 15.575, que cada año se irá incrementando, con la entrada de nuevas generaciones de mujeres que alcanzan la edad prevista de acceso al programa. A los 5 años el número de citologías varía según cada propuesta. En ambas propuestas, a los 15 años, la participación en el programa poblacional se habrá ofertado al 100% de las mujeres con edades comprendidas entre los 21 y los 65 años. A partir de ese momento el número de citologías a realizar anualmente será un 30% menos en la propuesta B respecto a la A.
Propuestas de participación e informaciónProponemos una invitación mediante carta personalizada a la población diana, acompañada de un tríptico informativo, y un teléfono de contacto para aclarar todas las dudas que puedan presentarse y concertar las citas para la realización de las pruebas. Se puede utilizar la llamada telefónica si pasado un tiempo no acude a realizar la prueba, especialmente en el grupo de 64 años, para evitar la pérdida de mujeres que quizás nunca recibieron la oferta del cribado. La carta de invitación debe incluir el objetivo a cubrir, la población destinataria, la prueba a realizar, dónde y quién debe realizarla, la importancia de participar en el programa, así como la escasez de riesgos de participar en el mismo, y el plazo de tiempo estimado de comunicación de los resultados. El tríptico, que acompañará a la carta, debe de ser breve, claro y conciso; responder a las preguntas: qué, quién, cómo, dónde, cuándo; hacer referencia a los posibles resultados de la prueba y a las opciones de actuación según los mismos.
En el caso de resultados negativos se enviará una carta comunicando este hecho, e indicando la periodicidad de la siguiente prueba. Si el resultado es positivo se contactará de forma telefónica para concertar una entrevista personal con su médico.
Consentimiento informado, confidencialidad y protección de datosParticipar o no en el programa debe ser una decisión individual de cada mujer, tras recibir la información adecuada, y consentir su participación, respetándose en todo el proceso la legalidad vigente (Ley básica 41/2002 de autonomía del paciente, LOPD 15/1999, etc.).
Indicadores de evaluación del programaLa evaluación debe estar planificada de forma periódica, quedando reflejados tanto los indicadores de actividad y resultados como sus fuentes de información y periodicidad. Debe estar diseñada para promover la excelencia de las actuaciones mediante un programa de mejora continua de la calidad. Además, es deseable que el programa disponga de un sistema de garantía de calidad, como las normas ISO.
La evaluación a medio y largo plazo se realizará mediante el análisis periódico de la tasa de incidencia y mortalidad. La evaluación a corto plazo deberá realizarse anualmente a partir de los registros en las historias clínicas electrónicas de atención primaria. Debe incluir la evaluación de actividades (citologías realizadas), de procesos (cobertura, periodicidad, adecuación) y de resultados (participación, detección de lesiones).
ResultadosAnálisis de costesLos posibles beneficios de la puesta en marcha de un programa de cribado poblacional se han estimado a partir de los datos publicados que detallan la cobertura y los costes del protocolo oportunista de detección de cáncer de cuello uterino vigente en Cantabria11, la incidencia de esta enfermedad en dicha comunidad y datos relevantes de la literatura.
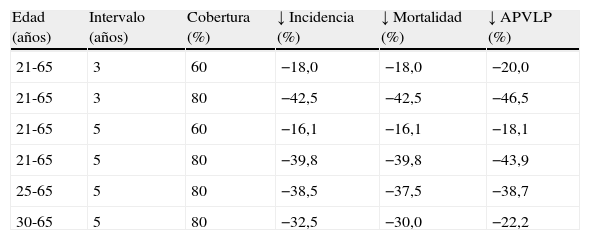
Los beneficios esperados en salud en cuanto a disminución de incidencia, mortalidad y años potenciales de vida laboral perdida con el paso del protocolo oportunista actual a un programa poblacional plenamente establecido se muestran en la tabla 1. El mayor beneficio en salud se obtiene con un programa que tenga elevada cobertura, se inicie a los 21 años, y el intervalo entre pruebas sucesivas sea cada 3 años. El iniciar el programa a los 30 años reduce de forma importante los beneficios en salud.
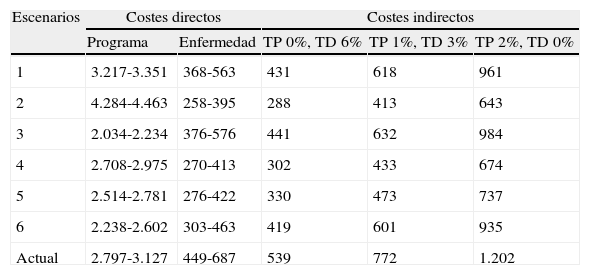
Beneficios en salud del programa poblacional de detección precoz de cáncer de cuello uterino según diferentes variables: edad de inicio, intervalo entre pruebas sucesivas y cobertura
| Edad (años) | Intervalo (años) | Cobertura (%) | ↓ Incidencia (%) | ↓ Mortalidad (%) | ↓ APVLP (%) |
| 21-65 | 3 | 60 | −18,0 | −18,0 | −20,0 |
| 21-65 | 3 | 80 | −42,5 | −42,5 | −46,5 |
| 21-65 | 5 | 60 | −16,1 | −16,1 | −18,1 |
| 21-65 | 5 | 80 | −39,8 | −39,8 | −43,9 |
| 25-65 | 5 | 80 | −38,5 | −37,5 | −38,7 |
| 30-65 | 5 | 80 | −32,5 | −30,0 | −22,2 |
APVLP: años potenciales de vida laboral perdida.
Los costes absolutos anuales (directos e indirectos) en los diferentes escenarios considerados se especifican en la tabla 2, en función del número de citologías a realizar según cada escenario y un valor estimado de coste de citología de 94,97€ (coste unitario y para citología líquida). Se reflejan los costes directos por la carga de la enfermedad y los costes indirectos debidos a mortalidad prematura e incapacidad, estimados según diferentes tasas de descuento (0-3-6%) y productividad (0-1-2%). Para la confección de estos resultados hemos empleado los datos de beneficios en salud de la tabla 1. Se incluyen, además, los datos publicados referidos a costes directos (realización de las pruebas y carga de enfermedad) e indirectos del protocolo oportunista actual de Cantabria11.
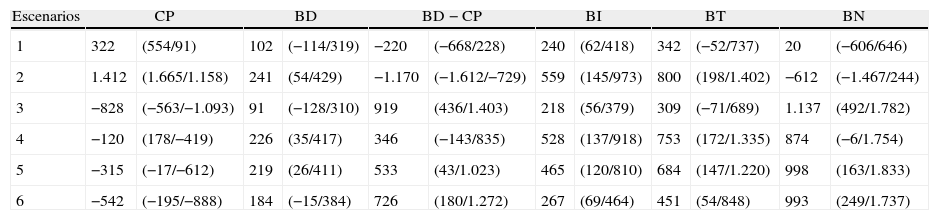
Costes anuales (en miles de euros de 2011) del programa poblacional de diagnóstico precoz de cáncer de cuello uterino propuesto para Cantabria en diferentes escenarios según las variables consideradas: edad de inicio, intervalo entre pruebas sucesivas y cobertura, incluyendo los costes del protocolo oportunista actual
| Escenarios | Costes directos | Costes indirectos | |||
| Programa | Enfermedad | TP 0%, TD 6% | TP 1%, TD 3% | TP 2%, TD 0% | |
| 1 | 3.217-3.351 | 368-563 | 431 | 618 | 961 |
| 2 | 4.284-4.463 | 258-395 | 288 | 413 | 643 |
| 3 | 2.034-2.234 | 376-576 | 441 | 632 | 984 |
| 4 | 2.708-2.975 | 270-413 | 302 | 433 | 674 |
| 5 | 2.514-2.781 | 276-422 | 330 | 473 | 737 |
| 6 | 2.238-2.602 | 303-463 | 419 | 601 | 935 |
| Actual | 2.797-3.127 | 449-687 | 539 | 772 | 1.202 |
E: escenarios; TD: tasa de descuento; TP: tasa de productividad.
Escenarios: 1: edad de inicio 21, intervalo cada 3 años y cobertura del 60%. 2: edad de inicio 21, intervalo cada 3 años y cobertura del 80%. 3: edad de inicio 21, intervalo cada 5 años y cobertura del 60%. 4: edad de inicio 21, intervalo cada 5 años y cobertura del 80%. 5: edad de inicio 25, intervalo cada 5 años y cobertura del 80%. 6: edad de inicio 30, intervalo cada 5 años y cobertura del 80%.
En la tabla 3 se muestran los costes y beneficios anuales relativos del programa poblacional de diagnóstico precoz de cáncer de cuello uterino para Cantabria versus el protocolo oportunista actual. Los costes relativos del programa se refieren a la diferencia que puede existir entre los costes de cada uno de los escenarios propuestos y el protocolo oportunista vigente. Los resultados negativos significan que los costes con el programa propuesto son menores que en la situación actual con el protocolo oportunista. Los beneficios directos expresan la diferencia entre los costes por la carga de la enfermedad en la actualidad y después de la puesta en marcha del programa poblacional. La columna relativa a beneficios directos−costes del programa muestra los beneficios del programa sin considerar los beneficios indirectos. Estos últimos muestran el beneficio del programa poblacional debido a la disminución de mortalidad prematura e incapacidad por la implantación del programa. Los beneficios totales suponen la suma de los directos e indirectos, y finalmente los beneficios netos descuentan de los beneficios totales el coste del programa. Para cada situación hemos mostrado la media junto con los valores extremos del rango de cada escenario.
Costes y beneficios anuales (en miles de euros de 2011) del programa poblacional de diagnóstico precoz de cáncer de cuello uterino propuesto para Cantabria en 6 posibles escenarios, en relación con el protocolo oportunista actual, según las variables consideradas: edad de inicio, intervalos entre pruebas sucesivas y cobertura
| Escenarios | CP | BD | BD−CP | BI | BT | BN | ||||||
| 1 | 322 | (554/91) | 102 | (−114/319) | −220 | (−668/228) | 240 | (62/418) | 342 | (−52/737) | 20 | (−606/646) |
| 2 | 1.412 | (1.665/1.158) | 241 | (54/429) | −1.170 | (−1.612/−729) | 559 | (145/973) | 800 | (198/1.402) | −612 | (−1.467/244) |
| 3 | −828 | (−563/−1.093) | 91 | (−128/310) | 919 | (436/1.403) | 218 | (56/379) | 309 | (−71/689) | 1.137 | (492/1.782) |
| 4 | −120 | (178/−419) | 226 | (35/417) | 346 | (−143/835) | 528 | (137/918) | 753 | (172/1.335) | 874 | (−6/1.754) |
| 5 | −315 | (−17/−612) | 219 | (26/411) | 533 | (43/1.023) | 465 | (120/810) | 684 | (147/1.220) | 998 | (163/1.833) |
| 6 | −542 | (−195/−888) | 184 | (−15/384) | 726 | (180/1.272) | 267 | (69/464) | 451 | (54/848) | 993 | (249/1.737) |
BD: beneficios directos; BI: beneficios indirectos; BN: beneficio neto del programa (BT−CP); BT: beneficios totales (BD+BI); CP: coste del programa; E: escenarios.
Escenarios: 1: edad de inicio 21, intervalo cada 3 años y cobertura del 60%. 2: edad de inicio 21, intervalo cada 3 años y cobertura del 80%. 3: edad de inicio 21, intervalo cada 5 años y cobertura del 60%. 4: edad de inicio 21, intervalo cada 5 años y cobertura del 80%. 5: edad de inicio 25, intervalo cada 5 años y cobertura del 80%. 6: edad de inicio 30, intervalo cada 5 años y cobertura del 80%.
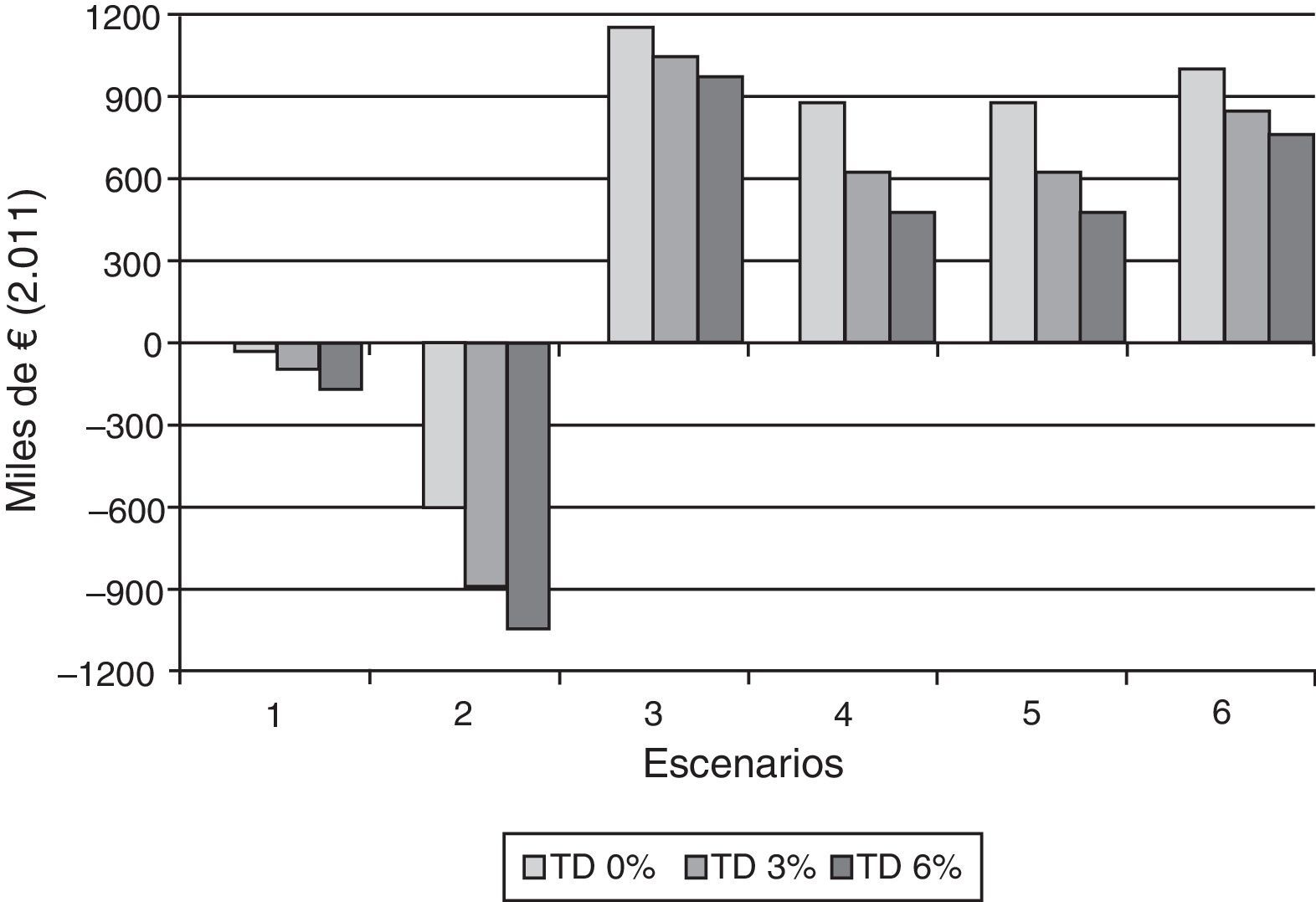
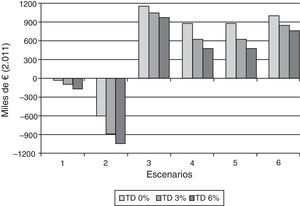
La figura 3 presenta los datos de los beneficios netos anuales evaluados según el análisis de sensibilidad para las medias, considerando diferentes tasas de descuento. Los escenarios 1 y 2 con intervalo entre pruebas cada 3 años representan la situación más aproximada al protocolo vigente, que como muestra la figura 3 en un futuro generará un incremento de costes anuales de 100.000€ y 893.000€, respectivamente, con una tasa de descuento del 3%. Desde el punto de vista económico los escenarios más beneficiosos serán aquellos en los cuales los intervalos entre pruebas sean de 5 años. Con cobertura del 80%, el beneficio anual según se inicie el programa a los 21 o 25 años es de 618.000€ y 767.000€, respectivamente. Desde el punto de vista económico, el mayor beneficio se obtiene al disminuir la cobertura al 60% (tabla 3), pero a costa de disminuir los beneficios en salud, respecto a los otros escenarios considerados (tabla 1).
Beneficios netos anuales del programa poblacional de detección precoz de cáncer de cuello uterino, según el análisis de sensibilidad realizado con diferentes tasas de descuento (TD): 0-3-6% en diferentes escenarios: 1: edad de inicio 21, intervalo cada 3 años y cobertura del 60%. 2: edad de inicio 21, intervalo cada 3 años y cobertura del 80%. 3: edad de inicio 21, intervalo cada 5 años y cobertura del 60%. 4: edad de inicio 21, intervalo cada 5 años y cobertura del 80%. 5: edad de inicio 25, intervalo cada 5 años y cobertura del 80%. 6: edad de inicio 30, intervalo cada 5 años y cobertura del 80%.
Un análisis coste-beneficio implica realizar estimaciones sobre variables sujetas a incertidumbre, como son la historia natural de la enfermedad, su prevalencia5, y la sensibilidad de las pruebas de detección5,21. Existe experiencia en la aplicación de técnicas de modelización para programas de cribado6,14. Hemos aplicado un modelo cogiendo información de entrada de otros ya publicados15, sobre variables epidemiológicas y la efectividad de las distintas pruebas que se pueden realizar16, obteniendo resultados similares a algunos publicados en la literatura22.
La incidencia de cáncer de cuello uterino se asocia con relaciones sexuales que son cada vez más precoces23, lo cual apoya el inicio de los programas de cribado poblacional a edades tempranas, tal y como recomienda el Consejo de la Unión Europea24. Lo más aconsejable es comenzar el cribado a los 21-25 años. Iniciarlo a los 30 años no ofrece peores resultados desde el punto de vista económico, pero sí peores resultados en cuanto a beneficio en salud (tabla 1), por lo cual se puede descartar como edad de comienzo del cribado. Según los datos del Registro de Tumores de Cantabria hay un incremento de mortalidad por cáncer de cuello uterino en mujeres mayores de 65 años11. Si tenemos en cuenta este hecho, la historia natural de la enfermedad (15-20 años) y la esperanza de vida al nacer de las mujeres de Cantabria (85,7 años) sería aconsejable estudiar la posibilidad de ampliar la edad de cribado hasta los 70 años. En nuestro trabajo no hemos considerado esta opción, pero sería interesante hacer las estimaciones económicas correspondientes.
El intervalo entre cribados es un tema controvertido17–20,25. Se ha valorado su influencia en la incidencia y mortalidad de la enfermedad, así como en la eficiencia de los programas de cribado, concluyendo que es innecesario realizar pruebas sucesivas con intervalos inferiores a 5 años17–20,25. La baja incidencia de cáncer de cuello uterino en Cantabria hace que sus costes sanitarios sean bajos. Por ello, son interesantes las propuestas de diseño de un programa poblacional en las que el número de citologías no aumente en relación con la situación actual, generando mayor beneficio económico un programa de cribado con intervalos entre pruebas de 5 años.
En los resultados de nuestra EE hemos obtenido que es más beneficioso un programa que inicia el cribado a los 21 o 25 años de edad, con intervalo entre citologías sucesivas de 5 años. En esta situación, con mayor cobertura que actualmente, no se incrementa el número de citologías a realizar. Una cobertura baja podría provocar que no disminuyan los costes debidos a la carga de la enfermedad. Hay que destacar que un programa con intervalo entre pruebas cada 5 años produce beneficios cuando se consideran solo los costes directos, es decir, incluso sin tener en cuenta los beneficios indirectos debidos a mortalidad prematura e incapacidad.
La reciente introducción de la vacuna frente al virus del papiloma humano no supondrá la interrupción del cribado de cáncer de cuello uterino, dado que no todas las mujeres están en la edad diana de la vacuna, y el efecto de la misma sobre las tasas de cáncer no se manifestará hasta transcurridos 15-20 años26. El programa de vacunación coexistiendo con el de cribado es una intervención coste-efectiva, ya que los costes adicionales por la introducción de la vacuna se traducen en ahorro al no tener que tratar los casos evitados27. Por otro lado, se desconoce el comportamiento del virus y si habrá un desplazamiento de los serotipos relacionados con el cáncer.
Los programas de cribado organizado mejoran la accesibilidad de la población al sistema sanitario, a pesar de lo cual hasta un 10% de las mujeres seguirán sin realizarse cribados6,15, lo que nos debe hacer intensificar nuestros esfuerzos para llegar a esa parte de la población. Se han propuesto diferentes fórmulas para incrementar la participación y cobertura28. Nosotros destacamos la importancia de la llamada telefónica si pasado un tiempo razonable la mujer no se ha puesto en contacto con los profesionales sanitarios.
Los resultados se deben comunicar de forma clara, reduciendo la ansiedad en las pacientes29. Es complicado comunicarlos sin una entrevista personal, en particular cuando se trata de resultados inesperados o no deseados. Sin embargo, hay que tener en cuenta que lo más probable es que en la mayoría de los casos el resultado de la prueba de cribado será normal. Por ello nos inclinamos por la opción de enviar una carta por correo para los casos con resultado negativo y reservar la entrevista personal para aquellos casos que precisen la realización de pruebas complementarias u otro tipo de tratamiento, considerando para el futuro la posibilidad de emplear las nuevas tecnologías, cada vez más implantadas.
La existencia de un protocolo de cribado oportunista desde hace años es una fortaleza a la hora de implantar un programa organizado. Una encuesta a la población diana previa a la introducción del nuevo programa puede ser de gran utilidad, proporcionando información sobre las causas de aceptación o no, lo que facilitará solucionar los posibles problemas antes de su puesta en marcha. Como en todo programa sanitario bien diseñado deben estar previstos los mecanismos adecuados de evaluación para asegurar que los objetivos se cumplen y que el programa mantiene su eficiencia a lo largo de su desarrollo4. Por supuesto, una encuesta de satisfacción una vez instaurado será, asimismo, muy importante.
La actual crisis económica, que afecta también a la prevención primaria del cáncer, debe hacernos replantear tanto estilos de vida como programas de cribado30. Transformar protocolos de cribado oportunistas en programas poblacionales con la suficiente garantía de calidad permitirá mejorar la accesibilidad, la efectividad y, sobre todo, la eficiencia, evitando la realización de pruebas innecesarias. Las EE, como la aquí presentada, permiten justificar en todo caso, y especialmente en tiempos de crisis, la pertinencia de la implementación de este tipo de programas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores quieren agradecer a la Dra. María Carmen Ramos Barrón (MD., PhD.) y a D. Gabriel Gómez Rey (BA., MS.), sus estimables comentarios y sugerencias aportadas tras la revisión del manuscrito.