Las adenopatías son un motivo de consulta frecuente en atención primaria. La mayor parte de los pacientes que consultan por adenopatía periférica tienen una causa fácilmente identificable y suele tratarse de procesos benignos y autolimitados. La cuestión clave para el médico de atención primaria es identificar los casos que pueden obedecer a enfermedades potencialmente graves o malignas. Datos de la historia clínica y exploración física, así como una adecuada valoración de los síntomas y signos acompañantes, son fundamentales para establecer el diagnóstico. Presentamos un caso clínico de aparición de adenopatías en cuello, cuál fue su diagnóstico y evolución.
Lymphadenopathies (swollen lymph glands) are a common cause of consultation in the Primary care setting. Most of the patients seen with peripheral lymph nodes have an easily identifiable cause, and are usually a benign and self-limiting process. The critical challenge for the primary care physician is to identify the cases that may be secondary to malignancies or other serious conditions. A complete history and a thorough physical help determine whether the lymph nodes are of benign or malignant origin. We present a clinical case and the diagnosis and outcome of a patient with swollen lymph glands.
La mayor parte de los pacientes que consultan por adenopatía periférica tienen una causa fácilmente identificable y suele tratarse de un proceso benigno y autolimitado. La incidencia de linfadenopatía inexplicada en la población general se estima en un 0,6% anual, de estos menos del 1,1% tiene una enfermedad maligna1. La probabilidad de malignidad aumenta con la edad.
El cuerpo humano tiene aproximadamente 600 ganglios linfáticos, pero en personas sanas normalmente sólo son palpables los que se localizan en las regiones submandibular, axilar o inguinal2.
Caso clínicoVarón de 60 años, sin antecedentes médicos ni quirúrgicos de interés, no fumador. Consulta por tumoración supraclavicular izquierda, de un día de evolución. El día antes el paciente había acudido a urgencias hospitalarias por haber notado sensación disneica mientras montaba en bicicleta, junto con aparición de lesiones cutáneas en brazos y lóbulos de las orejas, eritematosas, de aproximadamente 1cm de diámetro y que se resolvieron en media hora aproximadamente. Por otro lado, había notado aumento de tamaño del testículo derecho desde hacía 2 meses. Tras ser valorado en el hospital, el paciente había sido dado de alta con el diagnóstico de probable hidrocele (tras valoración por urología). En la analítica realizada en el hospital, destacaba una LDH elevada (1.733 UI/l) y la presencia de un fenómeno de Rouleaux. Ante el motivo de consulta del paciente, se realizó una concienzuda anamnesis y una minuciosa exploración física. El paciente no presentaba síndrome constitucional ni había tenido fiebre. Desde hacía varios meses, refería episodios de minutos de duración, consistentes en cianosis en pulpejos de los dedos, nariz y lóbulos de las orejas tras la exposición al frío. No refería tratamientos médicos previos ni hábitos tóxicos, ni contacto con animales ni relaciones sexuales de riesgo. En la exploración física no presentaba lesiones cutáneas. Destacaba una tumoración en la fosa supraclavicular izquierda, compatible con un conglomerado de adenopatías de más de 2cm de diámetro, móviles, no dolorosas y de consistencia elástica. Asimismo, se palpaban varias adenopatías de aproximadamente 1cm de diámetro en la axila izquierda, móviles y no dolorosas. El abdomen del paciente era blando y depresible; ae palpaba el hígado a 1cm del reborde costal derecho y el bazo a 10cm del reborde costal izquierdo. El testículo derecho estaba aumentado de tamaño y presentaba consistencia pétrea, no era doloroso a la palpación. Ante estos hallazgos, el paciente fue derivado a urgencias del hospital.
A su llegada al hospital, se le realizó nueva analítica (bioquímica, hemograma y coagulación), que mostró fenómeno de Rouleaux y hematíes aglutinados, probablemente por interferencia por aglutininas frías. Se intentó realizar una extensión de sangre periférica tras calentamiento, persistiendo la aglutinación, lo que dificultó determinar la morfología. En la bioquímica destacaba una LDH de 1.363 UI/l.
El paciente ingresó en el servicio de medicina interna donde se realizó analítica completa con hierro, ferritina, vitamina B12, ácido fólico, inmunoglobulinas, factor reumatoide y anticuerpos antinucleares, que resultaron normales. Presentaba anemia (hemoglobina, 10,5g/dl; VCM, 82 fl). Además, se realizaron serologías para virus de Epstein-Barr, citomegalovirus, VIH, virus de hepatitis B y C, que resultaron negativas. La radiografía de tórax mostraba posibles adenopatías paratraqueales izquierdas. La tomografía computarizada mostró adenopatías supraclaviculares, mediastínicas, retrocrurales, retroperitoneales e inguinales, así como esplenomegalia heterogénea, hallazgos compatibles con un proceso linfoproliferativo como primera posibilidad diagnóstica. Se solicitó ecografía testicular, que objetivó testículo derecho aumentado de tamaño, hipoecogénico y heterogéneo, con lesiones nodulares en su interior y que en el Doppler color mostraba vascularización, con aspecto de una tumoración testicular derecha difusa, a descartar procesos inflamatorios que pudieran tener aspecto similar.
El paciente fue trasladado al servicio de hematología para continuar el estudio. Se realizó test de Coombs directo que fue negativo. Las crioaglutininas fueron positivas, de especificidad anti-H. La electroforesis mostró patrón normal. En el inmunofenotipo de sangre periférica se identificaba un 8% de células B con negatividad para CD5 y restricción de cadena ligera kappa de alta intensidad, compatible con criterios de infiltración por proceso linfoproliferativo. El rastreo corporal con galio 67 mostró múltiples depósitos patológicos de radiotrazador a nivel supraclavicular y laterocervical izquierdo, mediastino superior y medio, región paravertebral izquierda y captación focal en el área teórica del bazo; a nivel del abdomen, desde mesogastrio, destacaba una extensa captación lineal que se extendía hacia la región inguinal derecha y hacia la zona escrotal. La citología de médula ósea mostró hiperplasia eritroide sin evidenciar infiltración por proceso linfoproliferativo y patrón de hierro aparentemente asociado a proceso crónico. En la biopsia de médula ósea se encontró infiltración local por proceso linfoproliferativo B, altamente indicativo de linfoma folicular. El inmunofenotipo de médula ósea mostró médula infiltrada por un 3% de células del proceso base. Se realizó también biopsia de adenopatía supraclavicular izquierda con presencia de linfoma B difuso de células grandes (el 80% del tejido) y linfoma folicular de grado III (el 20% del tejido); el inmunofenotipo tumoral era: CD20 positivo, ciclina D1 negativo, P53 negativo y Ki-67 muy alto. La anatomía patológica de líquido cefalorraquídeo fue negativa para malignidad.
Finalmente, se estableció el diagnóstico de linfoma no hodgkiniano B difuso de células grandes, probablemente transformado desde linfoma folicular de grado III, estadio IV-B, con síndrome de Raynaud secundario a crioaglutininas en título elevado.
Durante el ingreso en el servicio de hematología, las adenopatías progresaron clínicamente, con fiebre y sudoración intermitente. Se inició tratamiento con quimioterapia (protocolo para linfomas de alto grado de tipo CHOP).
DiscusiónEl término linfadenopatía o adenopatía hace referencia a los ganglios linfáticos anormales en cuanto a tamaño, consistencia o número.
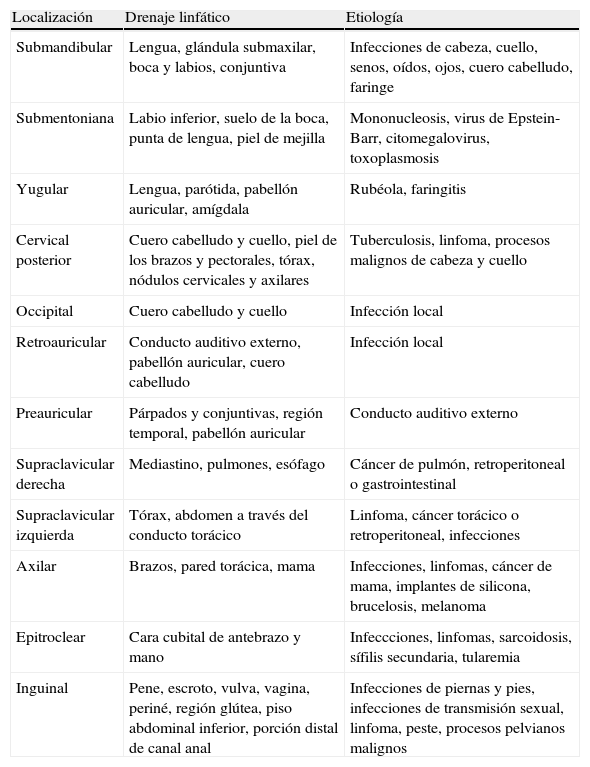
Podemos hablar de adenopatía localizada cuando existe afectación de una sola cadena ganglionar y de linfadenopatía generalizada, cuando están afectadas dos o más cadenas ganglionares. Esta diferenciación es muy importante para poder establecer un diagnóstico diferencial. Ante adenopatías localizadas, se debe tener en cuenta los territorios que drenan hacia los ganglios y los procesos patológicos que pueden afectar cada zona3, teniendo en cuenta que una adenopatía localizada puede ser la primera manifestación de enfermedades que posteriormente cursan con linfadenopatía generalizada. Las características de cada territorio ganglionar y su etiología se describen en la tabla 1.
Grupos de ganglios linfáticos: localización, drenaje linfático y etiología
| Localización | Drenaje linfático | Etiología |
| Submandibular | Lengua, glándula submaxilar, boca y labios, conjuntiva | Infecciones de cabeza, cuello, senos, oídos, ojos, cuero cabelludo, faringe |
| Submentoniana | Labio inferior, suelo de la boca, punta de lengua, piel de mejilla | Mononucleosis, virus de Epstein-Barr, citomegalovirus, toxoplasmosis |
| Yugular | Lengua, parótida, pabellón auricular, amígdala | Rubéola, faringitis |
| Cervical posterior | Cuero cabelludo y cuello, piel de los brazos y pectorales, tórax, nódulos cervicales y axilares | Tuberculosis, linfoma, procesos malignos de cabeza y cuello |
| Occipital | Cuero cabelludo y cuello | Infección local |
| Retroauricular | Conducto auditivo externo, pabellón auricular, cuero cabelludo | Infección local |
| Preauricular | Párpados y conjuntivas, región temporal, pabellón auricular | Conducto auditivo externo |
| Supraclavicular derecha | Mediastino, pulmones, esófago | Cáncer de pulmón, retroperitoneal o gastrointestinal |
| Supraclavicular izquierda | Tórax, abdomen a través del conducto torácico | Linfoma, cáncer torácico o retroperitoneal, infecciones |
| Axilar | Brazos, pared torácica, mama | Infecciones, linfomas, cáncer de mama, implantes de silicona, brucelosis, melanoma |
| Epitroclear | Cara cubital de antebrazo y mano | Infeccciones, linfomas, sarcoidosis, sífilis secundaria, tularemia |
| Inguinal | Pene, escroto, vulva, vagina, periné, región glútea, piso abdominal inferior, porción distal de canal anal | Infecciones de piernas y pies, infecciones de transmisión sexual, linfoma, peste, procesos pelvianos malignos |
Tomado de Ferrer R3.
Ante la presencia de una adenopatía, es fundamental realizar una adecuada anamnesis y una detallada exploración física. La tasa de etiologías malignas aumenta con la edad y cuando la duración es menor de 2 semanas o la adenopatía se ha mantenido estable durante más de 1 año, existe bajo riesgo de proceso neoplásico4. El crecimiento rápido (días) es indicativo de enfermedad infecciosa o de hemopatía maligna, si es lento, señala una tuberculosis o neoplasia. Hay que investigar sobre la exposición a animales, picaduras de insectos, el uso crónico de medicaciones, contactos infecciosos, historia de infecciones recurrentes, viajes recientes, exposiciones ambientales (tabaco, alcohol, radiación ultravioleta), exposiciones profesionales, historia sexual, sida, historia familiar5, etc. La presencia de fiebre inexplicada, sudoración nocturna, pérdida de peso superior al 10% y prurito pueden indicar un linfoma. Artralgias, mialgias o erupciones cutáneas orientan hacia enfermedad viral. Hay que interrogar sobre la presencia de síntomas relacionados con la región orofaríngea. En lo referente a la exploración física, hay que indagar sobre la presencia de fiebre y signos de infección, esplenomegalia, lesiones cutáneas o exantema y diátesis hemorrágica. Hay que valorar el área otorrinolaríngea, sobre todo si existen adenopatías en la región cervical. Siempre se considerarán patológicas las adenopatías de las regiones supraclavicular, mediastínica, epitroclear y poplítea (estas últimas en ausencia de lesión local que las justifique)6. Es importante definir las características generales de las adenopatías (localización, tamaño, consistencia, dureza, elasticidad, simetría y movilidad o adherencia a planos adyacentes). Las adenopatías inflamatorias suelen ser dolorosas, a veces fluctúan, la piel puede estar roja o caliente, y suelen ser asimétricas. Las neoplásicas suelen ser duras, adheridas a planos profundos, no dolorosas y con tendencia a formar conglomerados. En los linfomas la consistencia es elástica, son móviles, indoloras, múltiples y, con frecuencia, simétricas, a veces de crecimiento muy rápido (días o incluso horas). No existe un tamaño a partir del cual un ganglio se considere patológico, pero hay que estar alerta ante los ganglios mayores de 1,5-2cm de diámetro, cuando persisten más de 3 semanas, de consistencia dura y en ausencia de infección e inflamación que lo justifique.
Las diversas causas de linfadenopatía periférica se describen en la tabla 2.
Causas de linfadenopatía periférica
| Infecciones: |
| • Bacterianas: faringitis estresptocócica, infecciones cutáneas, tularemia, peste, enfermedad por arañazo de gato, difteria, chancroide, brucelosis, linfogranuloma venéreo, fiebre tifoidea |
| • Virales: virus de la inmunodeficiencia humana, virus de Epstein-Barr, virus herpes, citomegalovirus, paperas, sarampión, rubéola, hepatitis B, dengue |
| • Micobacterias: tuberculosis y micobacterias atípicas |
| • Hongos: histoplasmosis, coccidiomicosis, criptococosis |
| • Protozoos: toxoplasmosis, leishmaniasis |
| • Espiroquetas: sífilis secundaria, enfermedad de Lyme |
| Neoplasias: tumor de células escamosas de cabeza y cuello, metástasis, linfomas, leucemias |
| Enfermedades linfoproliferativas: linfadenopatía angioinmunoblástica con disproteinemia, enfermedad linfoproliferativa autoinmunitaria, enfermedad de Rosai-Dorfman, linfocitosis hemofagocítica |
| Endocrinas: hipotiroidismo, enfermedad de Addison |
| Inmunológicas: enfermedad del suero, reacciones a medicamentos |
| Fármacos: alopurinol, atenolol, captopril, carbamazepina, cefalosporinas, sales de oro, hidralazina, penicilina, fenitoína, primidona, quinidina, sulfonamidas, sulindac |
| Miscelánea: sarcoidosis, enfermedades de almacenamiento de lípidos, amiloidosis, histiocitosis, enfermedades crónicas granulomatosas, enfermedad de Castleman, enfermedad de Kikuchi, enfermedad de Kawasaki, seudotumor inflamatorio, lupus eritematoso sistémico, artritis reumatoide, enfermedad de Still, dermatomiositis, síndrome de Churg-Strauss |
Tomado de Redondo J. Actitud ante una linfadenopatía localizada. Jano. 2009 Noviembre [citado 28 Dic 2010]. Disponible en: http://www.jano.es/ficheros/sumarios/1/0/1752/31/00310033_LR.pdf.
Ante una linfadenopatía, según la sospecha clínica y de forma individualizada, pueden ser necesarias pruebas complementarias. Inicialmente, se puede realizar hemograma completo con velocidad de sedimentación glomerular, pruebas de función hepática, serologías, prueba de Mantoux, radiografía de tórax y estudio inmunológico (factor reumatoide, anticuerpos antinucleares y anti-ADN y proteinograma). Posteriormente, se puede realizar biopsia ganglionar, citología ganglionar mediante punción aspirativa con aguja fina (PAAF), tomografía computarizada y resonancia magnética. La biopsia ganglionar sigue siendo el método más importante para el diagnóstico de la adenopatía de causa no explicada.
En atención primaria, lo primordial es identificar las adenopatías que pueden ser secundarias a procesos malignos o enfermedades potencialmente graves. Conocer los factores de riesgo de malignidad es fundamental para determinar el manejo de las linfadenopatías inexplicadas. De forma general, los pacientes con adenopatía localizada deben ser observados durante 2 o 3 semanas, si no existe ningún dato que haga sospechar un proceso maligno.