Siglas empleadas
AAT: alfa-1 antitripsina.
ATS: American Thoracic Society.
CI: corticoide inhalado.
CRVP: cirugía de reducción de volumen pulmonar.
EPOC: enfermedad pulmonar obstructiva crónica.
ERS: European Respiratory Society.
FEV1: volumen forzado espirado en el primer segundo.
FVC: capacidad vital forzada.
GOLD: Global Initiative for Obstructive Lung Disease.
LABA: ß2-agonistas de acción prolongada.
MRC: Medical Research Council.
OCD: oxigenoterapia crónica domiciliaria.
OMS: Organización Mundial de la Salud.
PaO2: presión parcial de oxígeno en sangre arterial.
PaCO2: presión parcial de dióxido de carbono en sangre arterial.
SABA: ß2-agonistas de acción corta.
SaO2: saturación de oxígeno en sangre arterial.
SpO2: saturación de oxígeno medida por pulsioximetría.
SEPAR: Sociedad Española de Neumología y Cirugía Torácica.
Hace 3 años que presentamos a la comunidad científica el primer documento de Consenso sobre enfermedad pulmonar obstructiva crónica (EPOC) en Andalucía. El documento se presentó en los congresos de las 3 sociedades autoras del mismo y se publicó en las revistas órganos de expresión de cada una de las sociedades. Ese documento pretendía incorporar de una forma ágil, resumida y equilibrada la mayor evidencia existente en el diagnóstico y tratamiento de esta enfermedad, tamizada por la experiencia en la práctica clínica y el criterio de todos los profesionales expertos en la materia que elaboraron el mismo. Por tanto, como su propio nombre indica, recoge la opinión consensuada de las 3 sociedades en cada uno de los apartados incluidos. No pretendía en ningún momento ser una guía de práctica clínica al uso, ni una alternativa al proceso asistencial integrado EPOC, sino precisamente un documento de posicionamiento y consejo en relación con el diagnóstico, tratamiento y seguimiento de la enfermedad que venía a complementar lo recogido en el proceso. Consideramos que el interés que despertó fue bastante elevado, aunque, como también indicamos, quedaba sujeto a la crítica y valoración por parte de todos nuestros compañeros. Aquel trabajo inició una fructífera colaboración entre nuestras 3 sociedades científicas que ha dado a luz varios documentos de gran interés, como han sido el documento de consenso sobre espirometrías y asma bronquial. Además hemos iniciado un camino al que se han unido otras sociedades que participan de alguna manera en el control de esta enfermedad y que en el futuro dará nuevos resultados muy satisfactorios.
Desde el comienzo de este trabajo asumimos el compromiso de actualizar los contenidos, en un intervalo temporal y con la celeridad que fuera conveniente. Como fruto de esta actualización nace este nuevo documento que no sólo incluye una revisión profunda del anterior, sino que actualiza el previo con nuevas evidencias, e intenta mejorar y aclarar algunos puntos que pudieron haber quedado más oscuros en el anterior documento.
Es necesario recordar que la EPOC es una patología crónica muy prevalente, manteniéndose, según los últimos datos, en niveles similares a los que teníamos anteriormente. Esta situación además puede mantenerse en el futuro, dado que como es conocido, esta enfermedad está indefectiblemente unida a la prevalencia de tabaquismo y esta última no parece haber descendido en nuestra comunidad y nación en la medida de lo deseado en los últimos años. Asimismo, a pesar de los esfuerzos realizados, la EPOC sigue siendo infradiagnosticada e infratratada de forma similar a lo que sucedía en años previos, lo que sigue indicando la importancia de la concienciación y colaboración entre todos los profesionales implicados, administración sanitaria y sociedad en general.
Como es conocido, para el diagnóstico de esta enfermedad es condición imprescindible la realización de espirometrías fiables, siendo el criterio funcional la puerta de entrada recogida en el Proceso Asistencial Integrado EPOC. Persisten aún importantes problemas para poder efectuar esta exploración con todos los criterios de calidad exigidos.
Como indica la evidencia científica, un diagnóstico precoz y un correcto abordaje terapéutico pueden mejorar el curso de la enfermedad, por lo que nosotros como médicos tenemos una responsabilidad fundamental en conseguir este objetivo.
Por último, es necesario destacar, como en ocasiones anteriores, el excelente ambiente de colaboración, cordialidad y responsabilidad en el que se han desarrollado las sesiones de trabajo de todos los profesionales participantes. Asimismo destacamos la corrección, cortesía y comportamiento exquisito de los responsables de Boehringer Ingelheim en el apoyo a este trabajo. Como en anteriores ocasiones creemos que esta iniciativa marca una línea nítida, fuera de toda crítica y totalmente ética de colaboración entre la industria farmacéutica, las sociedades científicas y los profesionales sanitarios.
Deseamos continuar en esta línea de colaboración que dé respuestas a nuestros compañeros en la solución de problemas que se presentan en la diaria y que pueda contribuir de una forma real y tangible a la mejor asistencia y beneficio para nuestros pacientes.
IntroducciónLa enfermedad pulmonar obstructiva crónica (EPOC) se caracteriza por la presencia de obstrucción crónica, progresiva y no totalmente reversible al flujo aéreo, causada fundamentalmente por una reacción inflamatoria anormal frente al humo del tabaco. Es una enfermedad prevenible y tratable con algunos efectos extrapulmonares significativos que pueden contribuir a la gravedad de los pacientes1. La exposición a otros tóxicos inhalados también puede producir EPOC, pero esta causa es muy poco frecuente en nuestro medio. Por consiguiente, el diagnóstico de la enfermedad se establece sobre la base del antecedente de consumo de tabaco y la demostración de una obstrucción no reversible mediante una espirometría forzada2.
El conocimiento de la enfermedad ha evolucionado considerablemente en los últimos años y hoy en día se considera una enfermedad multicomponente en la que conceptos clásicos, como bronquitis crónica y enfisema, y otros más novedosos, como afectación sistémica o hipertensión pulmonar, constituyen distintas manifestaciones de la enfermedad.
La EPOC es una enfermedad directamente ligada al consumo de tabaco. En Europa, aproximadamente un 35% de la población adulta es fumadora. En España, según los datos de la última Encuesta Nacional de Salud de 2006 la prevalencia del consumo de tabaco en la población de 16 y más años es del 30% (diaria el 27%) y hay un 21% de ex fumadores3. En la encuesta andaluza de salud del año 2007 la prevalencia de fumadores a diario fue del 31,1%4. El estudio epidemiológico de la EPOC en España (IBERPOC)5 demostró que en la población con edad comprendida entre 40 y 70 años la prevalencia global de EPOC es del 9,1%, con una relación varón/mujer de 4:1. En el estudio más reciente EPI-SCAN, realizado en 10 ciudades de nuestro país, la prevalencia ha sido del 10,2% en población de 40 a 80 años6, con una relación varón/mujer de 3:1. Esta prevalencia aumenta con la edad, el consumo acumulado de tabaco y el bajo nivel educacional. Así, en pacientes de más de 70 años y consumo acumulado mayor de 30 paquetes/año, la prevalencia es del 50%. En este estudio la EPOC sigue siendo una enfermedad infradiagnosticada, ya que sólo el 27% de los pacientes identificados en el estudio habían sido diagnosticados previamente. En este sentido, se ha modificado muy poco la situación en relación con el anterior estudio IBERPOC, en el que la proporción era del 22%.
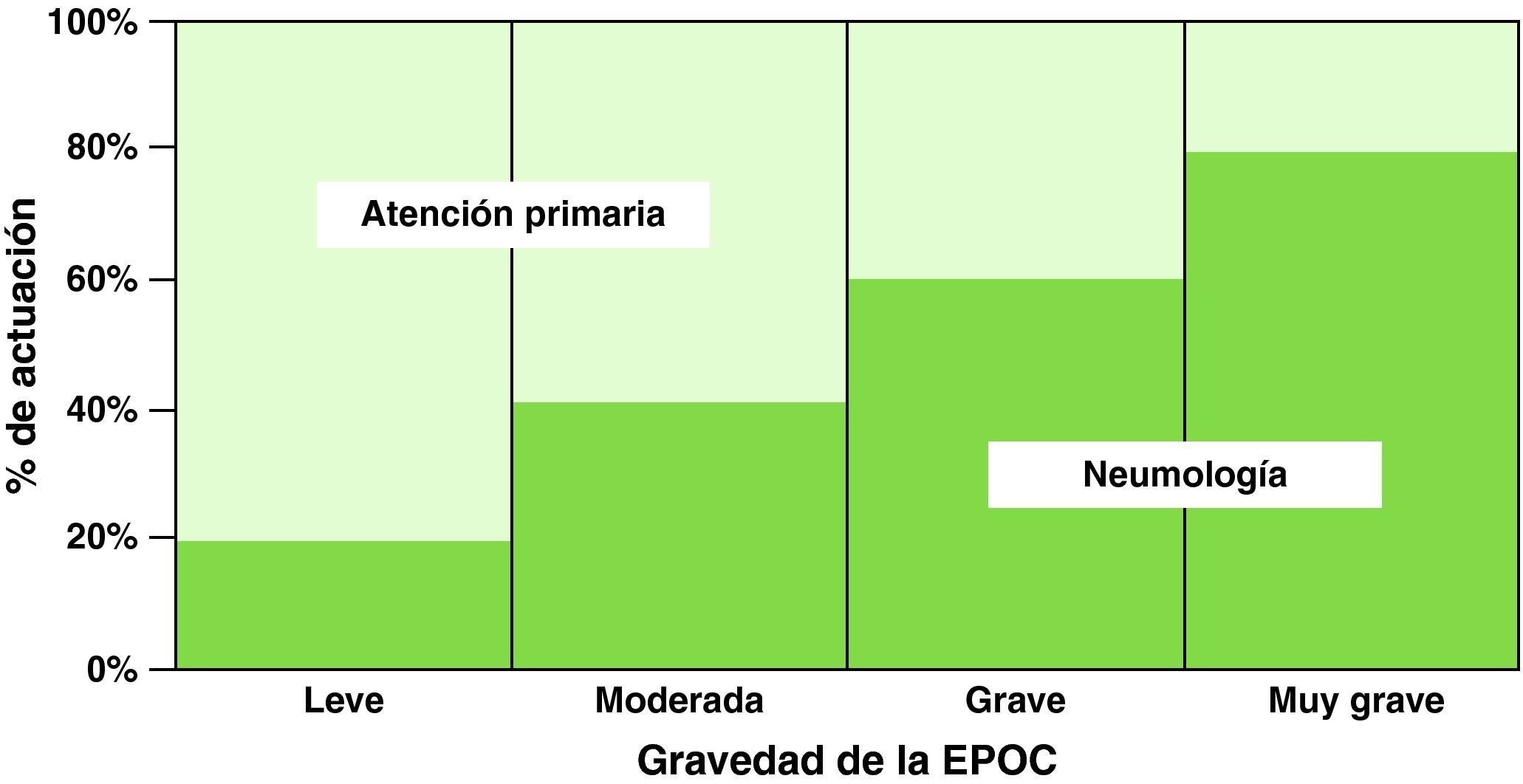
Por otra parte, la EPOC representa la cuarta causa de mortalidad en los países desarrollados, con una tasa global de 33 por 100.000 habitantes, que se eleva a 176 por 100.000 habitantes en los sujetos mayores de 75 años. Es causante del 10-15% del total de visitas de atención primaria, el 30-35% de las consultas externas de neumología y supone el 7-8% de los ingresos hospitalarios7. Junto a los trastornos cerebrovasculares, la EPOC es el proceso no quirúrgico cuya atención hospitalaria genera más costes. Tratar la EPOC cuesta 3.000 millones de € al año a la sanidad española (2,5% del presupuesto de Sanidad y 0,2% del producto interior bruto), por lo que supone una carga muy importante al sistema sanitario7. En Andalucía, se ha estimado que los ingresos por EPOC producen un coste mínimo de 27 millones de euros al año8.
Todos los datos expresados con anterioridad indican la importancia de un diagnóstico precoz y correcto de la enfermedad, para lo cual es indispensable la realización de espirometrías de calidad. El apoyo para dejar el tabaco sigue siendo la actuación que más incide en la evolución de la enfermedad, por lo que debemos emplear todas las posibilidades terapéuticas actualmente disponibles (incluido el apoyo psicológico y el tratamiento farmacológico en los casos necesarios) para conseguir la deshabituación. Además, con las estrategias actuales de terapia farmacológica9, como después se indicará, la enfermedad puede frenarse e incluso mostrar datos de mejoría funcional con un tratamiento continuado y correcto.
En definitiva, con un diagnóstico precoz, un adecuado tratamiento y seguimiento puede mejorar de forma notable la morbimortalidad y la calidad de vida del paciente. Para ello es fundamental una buena coordinación de todos los profesionales implicados, asegurando una atención sanitaria adecuada y de calidad.
DiagnósticoLas manifestaciones clínicas de esta enfermedad son inespecíficas. Los motivos más frecuentes para acudir a consulta son la disnea de esfuerzo o algún episodio de agudización. Por ello, el diagnóstico de EPOC se debe considerar en cualquier paciente fumador o ex fumador que presente tos, aumento de la producción de esputo o disnea, etc. (tabla 1)10. El grado de exposición al tabaco deberá ser cuantificado mediante el cálculo del consumo acumulado medido en paquetes-añoa1. Estos síntomas por sí mismos no son diagnósticos de EPOC, pero la presencia de varios de ellos aumenta la probabilidad de presentar la enfermedad. Frecuentemente los pacientes con EPOC pueden permanecer asintomáticos hasta estadios avanzados de la enfermedad. Además, los síntomas tienen una pobre correlación con el grado de obstrucción11,12.
Indicadores para considerar el diagnóstico de enfermedad pulmonar obstructiva crónica
| Disnea | Aparece en las fases más avanzadas de la enfermedad y se desarrolla de forma progresiva hasta limitar la actividad física diariaEs persistente y usualmente aumenta con el ejercicioEl sujeto la describe como un aumento del esfuerzo para respirar, hambre de aire |
| Tos crónica | Puede ser intermitente e improductiva |
| Expectoración crónica | Pueden presentar cualquier patrón de expectoración |
| Historia de exposición | Humo de tabacoPolvos ocupacionales y químicosHumos de combustibles |
Tomada de la Estrategia Global para el Diagnóstico, Tratamiento y Prevención de la Enfermedad Pulmonar Obstructiva Crónica, 20071.
La disnea es el síntoma principal de consulta y el que mayor pérdida de calidad de vida produce. La disnea es persistente, progresiva, empeora con el ejercicio y responde a un origen multifactorial (aumento del trabajo respiratorio, hipoxemia, hipercapnia, desnutrición e hipertensión pulmonar, entre otros). Es recomendable cuantificar el grado de disnea según la escala modificada del Medical Research Council (MRC; tabla 2)13.
Escala modificada de la MRC
| 0. Ausencia de disnea excepto al realizar ejercicio intenso |
| 1. Disnea al andar deprisa en llano, o al andar subiendo una pendiente poco pronunciada |
| 2. La disnea le produce una incapacidad de mantener el paso de otras personas de la misma edad caminando en llano o tener que parar a descansar al andar en llano al propio paso |
| 3. La disnea hace que tenga que parar a descansar al andar unos 90 metros o después de pocos minutos de andar en llano |
| 4. La disnea impide al paciente salir de casa o aparece con actividades como vestirse o desvestirse |
De Fletcher et al.13
La tos inicialmente puede ser intermitente, aunque más tarde aparece a diario y de predominio matutino. La ausencia de tos y/o expectoración no excluye el diagnóstico de EPOC. Pueden presentarse también otros síntomas inespecíficos como sibilancias u opresión torácica. En los estadios avanzados de la enfermedad son comunes la pérdida de peso, la anorexia y los síntomas de depresión y ansiedad.
En estadios iniciales la exploración física suele ser anodina y los signos de limitación del flujo aéreo pocas veces no son patentes hasta estadios avanzados de la enfermedad, por lo que su sensibilidad y especificidad son bajas11,12.
En la historia clínica debe constar también el número de agudizaciones en el año previo, las comorbilidades asociadas y una aproximación al estado nutricional mediante el índice de masa corporal (IMC).
Una vez establecida la sospecha clínica, el diagnóstico debe ser confirmado mediante espirometría forzada. Esta exploración debe realizarse a todo paciente con síntomas respiratorios crónicos o a todo fumador con un consumo acumulado de tabaco ≥ 10 paquetes-año14. La espirometría es una prueba básica en el estudio de las enfermedades respiratorias pero su utilidad puede verse mermada si no es realizada siguiendo unos criterios de calidad estandarizados15.
El diagnóstico de EPOC se establece por una relación volumen espirado forzado en el primer segundo/capacidad vital forzada (FEV1/FVC) < 0,7 tras una prueba broncodilatadora en la fase estable de la enfermedad en un paciente con un contexto clínico adecuado, que incluye la presencia de síntomas y la exposición a un tóxico inhalado que, en nuestro medio, es el humo del tabaco. Una prueba broncodilatadora se considera positiva si mejora el FEV1 al menos un 12% y siempre que la diferencia sea mayor de 200ml1,2. La prueba broncodilatadora se debe realizar con 400μg de salbutamol o 1.000μg de terbutalina. La espirometría es imprescindible para el diagnóstico, evaluación de la gravedad y seguimiento de la EPOC1,2.
En las fases iniciales de la enfermedad puede haber reducción leve del flujo aéreo con FEV1 dentro de los valores de referencia, reflejándose la obstrucción en la disminución de la relación FEV1/FVC. Por el contrario, en fases avanzadas puede disminuir la FVC por atrapamiento aéreo, por lo que esta relación no es un buen índice de gravedad ni es útil para el seguimiento1,2.
Recientemente se ha descrito el volumen espirado forzado durante los 6 primeros segundos (FEV6) de la espirometría como marcador de la FVC. Hay evidencias que demuestran la utilidad del cociente FEV1/FEV6 para el diagnóstico de un patrón funcional obstructivo, dada su buena correlación con el FEV1/FVC. Existen dispositivos que miden el FEV6 y que podrían utilizarse como herramienta de cribado para el diagnóstico de la enfermedad por su gran valor predictivo negativo, en aquellos centros que no dispongan de espirometría16. No obstante, el empleo del FEV6 es un método de cribado, por lo que la confirmación diagnóstica y la estadificación de la enfermedad deben realizarse siempre mediante una espirometría forzada.
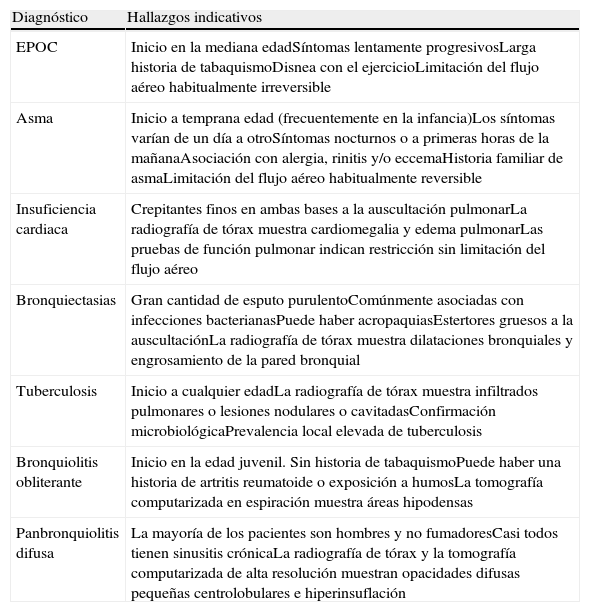
La EPOC debe diferenciarse de otras enfermedades que también cursan con obstrucción crónica al flujo aéreo pero que tienen una causa específica (Tabla 3). La más importante que debe tenerse en cuenta es el asma bronquial, no solo por su prevalencia, sino también porque en algunos pacientes ambas enfermedades pueden coexistir, no siendo siempre posible establecer una distinción clara entre ambas.
Recomendaciones sobre el diagnóstico de la EPOC:
- •
El diagnóstico de EPOC se establece sobre la base del antecedente del consumo de tabaco y la demostración de una obstrucción al flujo aéreo no completamente reversible en fase de estabilidad clínica.
- •
El diagnóstico de obstrucción al flujo aéreo no completamente reversible se establece con un cociente FEV1/FVC < 0,7 obtenido mediante una espirometría forzada tras prueba broncodilatadora y realizada en fase de estabilidad clínica.
- •
Se recomienda cuantificar el consumo acumulado de tabaco en paquetes-año en todos los pacientes, siendo paq-año=(cig-día / 20) × años fumando.
- •
Se recomienda cuantificar el grado de disnea según la escala modificada del Medical Research Council en todos los pacientes.
Recomendaciones sobre la espirometría en el diagnóstico de EPOC:
- •
La espirometría es imprescindible para el diagnóstico de la enfermedad, la valoración del grado de severidad y el seguimiento de los pacientes.
- •
Debe realizarse una espirometría a todo paciente fumador con síntomas respiratorios crónicos o con un consumo acumulado de tabaco ≥ 10 paquetes-año.
- •
Todos los centros que traten a estos pacientes deben disponer de espirómetro.
- •
Es imprescindible que los espirómetros estén debidamente calibrados a diario.
- •
Es imprescindible que los técnicos que realicen las espirometrías dispongan de una adecuada formación y experiencia y que dispongan del tiempo necesario para llevarlas a cabo correctamente.
- •
Se recomienda realizar una prueba broncodilatadora a todos los pacientes que estén siendo evaluados por EPOC, independientemente de los valores espirométricos basales obtenidos.
- •
Se recomienda realizar la prueba broncodilatadora con 400μg de salbutamol o 1.000μg de terbutalina.
- •
Se considera que la prueba broncodilatadora es positiva si el FEV1 experimenta un aumento relativo del 12% o superior, siempre que la diferencia sea mayor de 200ml.
- •
Existen dispositivos que miden el FEV6 y que podrían utilizarse como herramienta de cribado para el diagnóstico de la enfermedad por su alto valor predictivo negativo, en aquellos centros que no dispongan de espirometría. No obstante, la confirmación debe realizarse mediante una espirometría forzada.
Diagnóstico diferencial de la enfermedad pulmonar obstructiva crónica
| Diagnóstico | Hallazgos indicativos |
| EPOC | Inicio en la mediana edadSíntomas lentamente progresivosLarga historia de tabaquismoDisnea con el ejercicioLimitación del flujo aéreo habitualmente irreversible |
| Asma | Inicio a temprana edad (frecuentemente en la infancia)Los síntomas varían de un día a otroSíntomas nocturnos o a primeras horas de la mañanaAsociación con alergia, rinitis y/o eccemaHistoria familiar de asmaLimitación del flujo aéreo habitualmente reversible |
| Insuficiencia cardiaca | Crepitantes finos en ambas bases a la auscultación pulmonarLa radiografía de tórax muestra cardiomegalia y edema pulmonarLas pruebas de función pulmonar indican restricción sin limitación del flujo aéreo |
| Bronquiectasias | Gran cantidad de esputo purulentoComúnmente asociadas con infecciones bacterianasPuede haber acropaquiasEstertores gruesos a la auscultaciónLa radiografía de tórax muestra dilataciones bronquiales y engrosamiento de la pared bronquial |
| Tuberculosis | Inicio a cualquier edadLa radiografía de tórax muestra infiltrados pulmonares o lesiones nodulares o cavitadasConfirmación microbiológicaPrevalencia local elevada de tuberculosis |
| Bronquiolitis obliterante | Inicio en la edad juvenil. Sin historia de tabaquismoPuede haber una historia de artritis reumatoide o exposición a humosLa tomografía computarizada en espiración muestra áreas hipodensas |
| Panbronquiolitis difusa | La mayoría de los pacientes son hombres y no fumadoresCasi todos tienen sinusitis crónicaLa radiografía de tórax y la tomografía computarizada de alta resolución muestran opacidades difusas pequeñas centrolobulares e hiperinsuflación |
Modificada de Estrategia Global para el Diagnóstico, Tratamiento y Prevención de la Enfermedad Pulmonar Obstructiva Crónica, 20071.
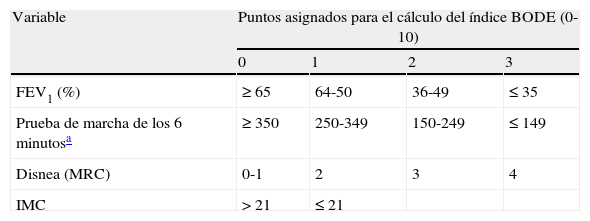
En el momento actual la gravedad de la EPOC se establece mediante la espirometría y se recomienda seguir la actual clasificación de la GOLD1 (tabla 4). Sin embargo, dado el carácter heterogéneo y sistémico de la EPOC puede ser muy conveniente tener presentes también, además del FEV1, otras variables como el intercambio gaseoso, los volúmenes pulmonares, la percepción de los síntomas, la capacidad de ejercicio, la frecuencia de las agudizaciones, el IMC o índices combinados como el BODE (tabla 5)17. Aunque el índice BODE ha demostrado ser un buen marcador pronóstico, por el momento no se ha incorporado en el algoritmo de toma de decisiones en el tratamiento de la EPOC, por lo que su uso está reservado para la valoración de los candidatos a trasplante y para investigación. En relación al trasplante de pulmón, actualmente se recomienda remitir a valoración por el centro trasplantador con 5 puntos de la escala BODE, mientras que con 7 puntos se recomienda valorar la inclusión del paciente en programa pre-trasplante18.
Índice BODE. Variables incluidas y puntos de corte
| Variable | Puntos asignados para el cálculo del índice BODE (0-10) | |||
| 0 | 1 | 2 | 3 | |
| FEV1 (%) | ≥ 65 | 64-50 | 36-49 | ≤ 35 |
| Prueba de marcha de los 6 minutosa | ≥ 350 | 250-349 | 150-249 | ≤ 149 |
| Disnea (MRC) | 0-1 | 2 | 3 | 4 |
| IMC | > 21 | ≤ 21 | ||
FEV1 (%): volumen espirado en el primer segundo tras broncodilatación expresado en porcentaje del predicho; IMC: índice de masa corporal.
Modificada de Celli et al.17
Recientemente se han descrito índices más fáciles de elaborar que eliminan la necesidad de realizar la prueba de marcha de 6 min, entre los que se encuentran el BODEx (IMC, grado de obstrucción, disnea y exacerbaciones)19 y el ADO (edad, disnea y grado de obstrucción)20, que permite calcular el riesgo de mortalidad en un paciente concreto. Estos índices son más sencillos de aplicar en atención primaria y especializada.
Recomendaciones sobre la valoración de la gravedad de la EPOC:
- •
Se recomienda establecer el grado de severidad de la enfermedad según el consenso GOLD.
- •
El índice BODE debe emplearse para la evaluación de los candidatos a trasplante pulmonar o en el ámbito de la investigación.
- •
El índice ADO (edad, disnea y grado de obstrucción) que permite calcular el riesgo de mortalidad en un paciente concreto y elimina la necesidad de realizar la prueba de marcha de los 6 min para su cálculo, por lo que es un índice aplicable a pacientes concretos en atención primaria y especializada.
Aunque la radiografía simple del tórax no es diagnóstica en la EPOC es de gran valor para excluir diagnósticos alternativos, por lo que es imprescindible en la evaluación inicial.
Tomografía computarizada de tóraxNo se recomienda el uso sistemático de esta técnica de imagen, excepto si se sospechan bronquiectasias o neoplasia broncopulmonar, en la valoración del enfisema y en la evaluación de pacientes subsidiarios de tratamientos quirúrgicos como la bullectomía o la cirugía de reducción de volumen pulmonar (CRVP) y el trasplante de pulmón21,22.
Valoración de la oxigenación (gasometría arterial y pulsioximetría)La gasometría arterial es de gran importancia en pacientes con EPOC avanzada. Su objetivo es estadificar la severidad de la enfermedad y establecer la indicación y control de la oxigenoterapia crónica domiciliaria. En pacientes con un FEV1 < 50%, con síntomas o signos indicativos de insuficiencia respiratoria o cardiaca derecha se recomienda la valoración del grado de oxigenación mediante pulsioximetría23. Se recomienda la realización de una gasometría arterial en aquellos que presenten una saturación de oxígeno medida por pulsioximetría (SpO2) inferior al 92% o sospechemos un aumento de la PaCO22,9. Se recomienda que todos los centros sanitarios que atiendan a pacientes con EPOC dispongan de pulsioximetría.
Otras pruebas de función pulmonarLa determinación de los volúmenes pulmonares y de la difusión de monóxido de carbono es útil en el diagnóstico de enfisema y en la evaluación de pacientes en los que se ha indicado bullectomía, CRVP o trasplante pulmonar. La medición de la capacidad de difusión de monóxido de carbono también está indicada cuando se sospecha hipertensión pulmonar. La medida de la capacidad inspiratoria podría ser de utilidad en el futuro para la valoración y el seguimiento del grado de hiperinsuflación estática del paciente con EPOC. Otras mediciones, como el flujo mesoespiratorio o el flujo pico no tienen relevancia en la valoración funcional de la EPOC. En la evaluación sistemática de los pacientes con EPOC tampoco se aconseja realizar estudios de la distensibilidad pulmonar ni de la función muscular respiratoria. En cuanto a las pruebas de esfuerzo, como la prueba de marcha de los 6 min, su realización estará indicada en el estudio de pacientes con disnea desproporcionada al grado de obstrucción espirométrica, para valorar la eficacia de nuevos tratamientos, en los programas de rehabilitación respiratoria, en la indicación de oxigenoterapia portátil, en la valoración del riesgo quirúrgico en la resección pulmonar, en la valoración de la capacidad laboral y en cualquier paciente con EPOC muy sintomática a pesar de tratamiento óptimo, o actividad física disminuida.
Cuestionarios de calidad de vidaLa cuantificación del impacto de la enfermedad en la calidad de vida relacionada con la salud puede realizarse mediante cuestionarios genéricos o específicos. Se recomienda el uso de cuestionarios específicos, de los que existen dos en versión española24,25. Estos cuestionarios (St. George's Respiratory Questionnaire y Chronic Respiratory Disease Questionnaire) son útiles en trabajos de investigación pero su aplicabilidad en la práctica clínica es limitada ya que están diseñados para aplicarse a poblaciones de pacientes2,9. Recientemente se han diseñado 2 nuevos cuestionarios que permiten evaluar los cambios en el estado de salud de pacientes concretos. Estos cuestionarios, el COPD Assessment Test (CAT)26 y el Clinical COPD Questionnaire (CCQ)27, son sencillos de aplicar y están en evaluación para ver su aplicabilidad en pacientes concretos.
Otras pruebas- a)
Hemograma: se recomienda la realización de un hemograma en el momento del diagnóstico de la enfermedad y ante la sospecha de poliglobulia, anemia u otras alteraciones hematológicas.
- b)
Alfa-1 antitripsina (AAT): actualmente se recomienda que a todos los pacientes con EPOC se les realice, por lo menos una vez en la vida, una determinación de las concentraciones de AAT28,29. En los casos en los que la AAT esté descendida se deberá investigar el fenotipo30.
- c)
Cultivo de esputo: puede ser de utilidad en los pacientes con esputo purulento persistente en fase estable para caracterizar la flora bacteriana colonizante, o bien en aquellos que tengan frecuentes agudizaciones.
- d)
Electrocardiograma (ECG): es poco sensible para valorar la presencia o severidad de la hipertensión pulmonar, pero es útil para detectar alteraciones o complicaciones cardiológicas (arritmias, isquemia, etc.).
- e)
Ecocardiograma: indicado si se sospecha hipertensión pulmonar significativa y para el estudio de comorbilidad cardiaca.
- f)
Estudios del sueño (poligrafía respiratoria/polisomnografía): se deberá indicar su realización cuando se sospeche la coexistencia de síndrome de apnea-hipoapnea del sueño y si se evidencia poliglobulia y/o signos de insuficiencia cardiaca derecha no justificados por el grado de afectación de la función pulmonar.
- g)
A pesar de la gran cantidad de publicaciones sobre los marcadores inflamatorios locales y sistémicos, por el momento no disponemos de ningún marcador que pueda ser empleado en la práctica clínica diaria con fines diagnósticos o terapéuticos.
Pruebas de imagen:
- •
La radiografía simple del tórax no es diagnóstica de EPOC en ningún caso.
- •
A todos los pacientes en estudio por EPOC se les debe realizar una radiografía simple del tórax en proyección posterioanterior y lateral.
- •
No se recomienda el uso de la tomografía computarizada del tórax de rutina en los pacientes con EPOC.
- •
Se recomienda realizar una tomografía computarizada del tórax para el estudio de bronquiectasias, la valoración del enfisema, si se sospecha neoplasia broncopulmonar y en la evaluación de pacientes subsidiarios de tratamientos quirúrgicos.
Otras exploraciones funcionales:
- •
En pacientes con un FEV1 < 50%, con síntomas o signos indicativos de insuficiencia respiratoria o cardiaca derecha se recomienda la valoración del grado de oxigenación mediante pulsioximetría. Se recomienda la realización de una gasometría arterial en aquellos que presenten una SpO2 inferior al 92% o sospechemos un aumento de la presión de dióxido de carbono en sangre arterial (PaCO2).
- •
Todos los centros que traten a estos pacientes deben disponer de un pulsioxímetro.
- •
Se recomienda la determinación de volúmenes pulmonares estáticos y de la capacidad de difusión del monóxido de carbono para valoración del grado de enfisema y en la evaluación de pacientes subsidiarios de tratamientos quirúrgicos.
- •
Otras exploraciones funcionales como el flujo mesoespiratorio, el flujo pico, la medición de la distensibilidad o de la función muscular respiratoria no se recomiendan ni para el diagnóstico ni para la evaluación de la progresión de la enfermedad.
- •
Se recomienda la realización de pruebas de esfuerzo para estudio de disnea desproporcionada al grado de obstrucción, en los programas de rehabilitación respiratoria, en la indicación de oxigenoterapia portátil, en la valoración del riesgo quirúrgico en la resección pulmonar, en la valoración de la capacidad laboral, en cualquier paciente con EPOC muy sintomática a pesar de tratamiento óptimo y en investigación.
Exploraciones adicionales:
- •
Se recomienda el uso de cuestionarios de calidad de vida exclusivamente para investigación. Existen nuevos cuestionarios con un potencial uso en la clínica habitual que están actualmente en evaluación.
- •
Se recomienda la realización de un hemograma a todos los pacientes que estén en evaluación de su EPOC.
- •
Se recomienda que a todos los pacientes con EPOC se les realice, por lo menos una vez en la vida, una determinación de las concentraciones séricas de AAT.
- •
Se recomienda la realización de cultivos de esputo en aquellos pacientes que en fase estable tengan esputo purulento persistente o bien aquellos que tengan frecuentes agudizaciones.
- •
Se recomienda la realización de un electrocardiograma en la valoración inicial del paciente y en caso de episodios clínicos indicativos de tener un origen cardiológico.
- •
Se recomienda la realización de un ecocardiograma solo en los casos en los que se sospeche hipertensión pulmonar y para el estudio de comorbilidad cardiaca.
- •
Se recomienda la realización de un estudio de sueño (poligrafía respiratoria o polisomnografía) en los casos en que se sospeche un trastorno respiratorio durante el sueño.
El tratamiento de la enfermedad durante los periodos de estabilidad clínica debe ser integral, progresivo y escalonado en función de los síntomas, el grado de obstrucción y la frecuencia de las agudizaciones. Los objetivos del tratamiento están resumidos en la tabla 6. Los medicamentos más útiles son los broncodilatadores, siendo la vía inhalada la de elección1. Es fundamental revisar la técnica de inhalación con todos los dispositivos que se utilicen y asegurar el uso de cámaras espaciadoras en caso de que se haya indicado tratamiento con cartuchos presurizados. El tratamiento integral de la enfermedad incluye aspectos farmacológicos y no farmacológicos cuya importancia es equiparable con objeto de obtener beneficios en la mejoría de los síntomas, la calidad de vida y la supervivencia. Por tanto, además del tratamiento farmacológico, durante las próximas páginas se abordarán las principales recomendaciones en el tratamiento de la enfermedad, incluyendo aspectos como la deshabituación tabáquica, la rehabilitación respiratoria, la oxigenoterapia o la administración de vacunas.
Recomendaciones generales del tratamiento en fase estable:
- •
El tratamiento debe ser integral, progresivo y escalonado en función de los síntomas, el grado de obstrucción y la frecuencia de agudizaciones.
- •
Los medicamentos más útiles son los broncodilatadores.
- •
La vía inhalada es la de elección.
- •
Es fundamental revisar la técnica de inhalación en todos los dispositivos y asegurar el uso de cámaras espaciadoras en caso de que se haya indicado tratamiento con cartuchos presurizados.
- •
El tratamiento no farmacológico es tan importante como el farmacológico y se debe llevar a cabo en todos los pacientes.
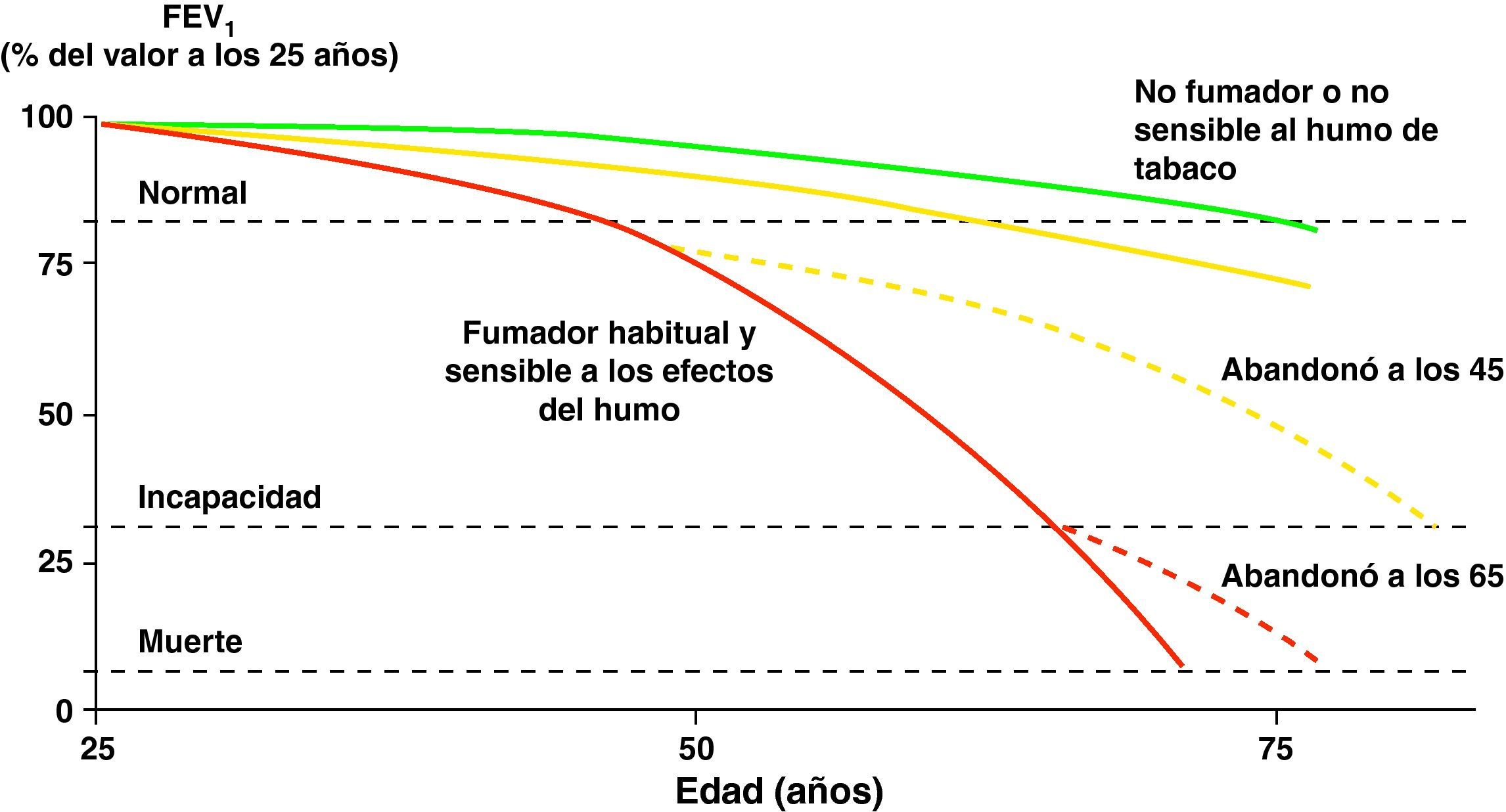
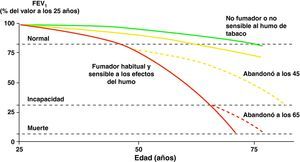
El humo del tabaco es el factor de riesgo más importante para el desarrollo de la EPOC en nuestro medio31. La deshabituación tabáquica es, en consecuencia, la medida más eficaz para evitar la aparición y la progresión de la EPOC (fig. 1)1,32–34.
Historia natural de la enfermedad pulmonar obstructiva crónica. Modificado de Fletcher y Peto10.
En la actualidad existen numerosas guías para la deshabituación tabáquica35,36 y diversas revisiones sobre el tabaquismo en los pacientes con EPOC37. Durante el abordaje del tabaquismo en los pacientes con EPOC es importante tener presente algunas particularidades.
En primer lugar, los pacientes diagnosticados de EPOC están más motivados para dejar de fumar38. El porcentaje de abstinencia en este grupo de fumadores es mayor que en los fumadores con espirometría normal. Por ello, es necesario plantear una estrategia de deshabituación a todos los pacientes con EPOC en el momento del diagnóstico39.
En segundo lugar, los pacientes fumadores con EPOC presentan una mayor dependencia manifestada por un mayor consumo y nivel de monóxido de carbono en el aire espirado40. Esto supone que en muchos casos sea necesario un tratamiento psicológico y farmacológico junto a un seguimiento más estrecho.
En tercer lugar, en la EPOC se aprecia una mayor prevalencia de enfermedades psiquiátricas, sobre todo depresión, en la mayoría de los casos encubierta. Se ha demostrado que la nicotina ejerce también un efecto antidepresivo y por tanto estos enfermos con sintomatología depresiva asociada tienen un mayor reforzamiento del consumo, presentando un problema más en la deshabituación41. La terapia con bupropión puede ser una opción en este tipo de enfermos, siempre que no existan contraindicaciones, ya que esta molécula une a su capacidad de atenuación del síndrome de abstinencia un efecto antidepresivo.
En cuarto lugar, la comorbilidad es muy frecuente en esta enfermedad, observando a menudo otras enfermedades crónicas asociadas como hipertensión arterial, cardiopatía isquémica, diabetes mellitus, etc., lo que puede condicionar la elección del tratamiento de deshabituación42.
Por último, el ingreso en un hospital es un factor añadido que motiva al paciente a dejar de fumar. Los trabajos publicados sobre programas de deshabituación en pacientes ingresados demuestran un mayor porcentaje de éxitos en comparación con grupos controles, siempre que se mantenga un seguimiento del paciente un mes después del alta hospitalaria43.
Métodos de deshabituación tabáquicaLas actuaciones de los médicos en este sentido tienen una gran repercusión sobre la sanidad pública. La intervención mínima es la realización de un consejo firme, serio, breve y personalizado. Con esta intervención mínima se consiguen tasas de abstinencia del 5-10%. Por este motivo, se recomienda que sea realizada en todos los pacientes con EPOC que fumen.
En una revisión sistemática publicada en la Cochrane Library se demostró la eficacia del tratamiento psicológico unido a medidas farmacológicas (terapia sustitutiva con nicotina) para la deshabituación de estos pacientes, siendo más eficaz la unión de psicoterapia y la terapia sustitutiva con nicotina que la psicoterapia sola. Actualmente, tanto TSN como bupropión y vareniclina han sido aprobados para el tratamiento del tabaquismo y su uso se puede hacer en la EPOC con buenos resultados44–46.
Recomendaciones generales para la deshabituación tabáquica:
- •
En todos los pacientes con EPOC fumadores se debe hacer una intervención antitabaco mínima y ofertar además un programa de deshabituación que incluya tratamiento farmacológico.
- •
Actualmente, tanto terapia sustitutiva con nicotina, como bupropión y vareniclina han sido aprobados para el tratamiento del tabaquismo y su uso se puede hacer en la EPOC con buenos resultados.
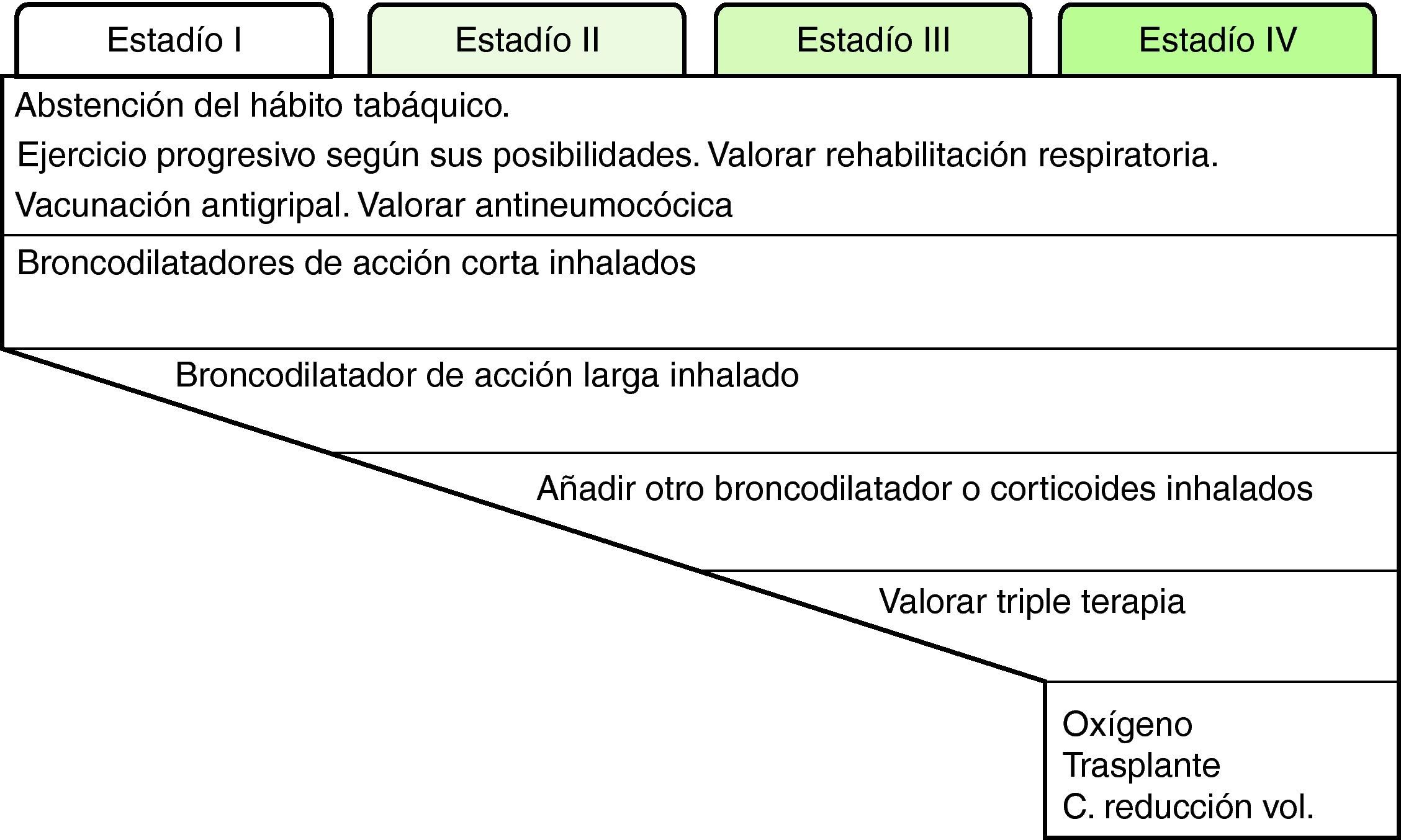
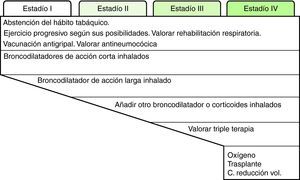
Cada día existe más información de que el FEV1, aun siendo un muy buen parámetro pronóstico, no explica por sí solo el pronóstico de la enfermedad, lo cual sugiere que el tratamiento debería basarse en los fenotipos o formas clínicas de los pacientes con EPOC. Intentar establecer los fenotipos de los pacientes en función de la clínica (síntomas y su progresión, frecuencia y gravedad de las agudizaciones), IMC, función pulmonar (FEV1, volúmenes pulmonares, prueba de difusión de monóxido de carbono), tolerancia al ejercicio (prueba de 6 min marcha) y tomografía computarizada de tórax, desde un punto de vista clínico y práctico nos podría ayudar a identificar patrones o tipos básicos de EPOC en los que aplicar tratamientos personalizados47. Sin embargo, a pesar de la importancia del abordaje fenotípico de la enfermedad, por el momento el declive del FEV1 continúa siendo el parámetro clave para el tratamiento de los pacientes. El tratamiento escalonado de la EPOC estable queda resumido en la figura 2.
Broncodilatadores de acción cortaLos broncodilatadores de acción corta han demostrado mejoría de la disnea, de la tolerancia al ejercicio y del FEV148. Son los de elección a demanda para pacientes poco sintomáticos. Los disponibles en nuestro país son salbutamol, terbutalina y bromuro de ipratropio. Los ß2-agonistas tienen un inicio de acción más rápido que el ipratropio, pero este tiene un efecto más prolongado. Para la elección de cualquiera de ellos tendremos presente su pauta de administración, los efectos adversos de estos fármacos y las comorbilidades del paciente (antecedentes cardiovasculares, síntomas prostáticos avanzados). La dosis recomendada de salbutamol es 200-400μg cada 4 a 6 h, la de terbutalina 500μg cada 8 h y la de ipratropio 20-80μg cada 6 a 8 h.
Si no existe mejoría de los síntomas, algunas guías aconsejan realizar un ensayo de prueba con salbutamol más ipratropio49. No obstante, nuestra recomendación en este tipo de pacientes que no mejoran o con síntomas persistentes es iniciar tratamiento con broncodilatadores de acción prolongada.
Recomendaciones sobre broncodilatadores de acción corta:
- •
Los broncodilatadores de acción corta (salbutamol, terbutalina y bromuro de ipratropio) están indicados en pacientes poco sintomáticos y como medicación de rescate en pacientes más graves.
- •
Para la elección de cualquiera de ellos es necesario tener presente su pauta de administración, sus efectos adversos y las comorbilidades del paciente.
- •
Si no existe mejoría de la clínica, se recomienda iniciar tratamiento con broncodilatadores de acción prolongada.
Los broncodilatadores de acción prolongada son más eficaces que los de acción corta50. Han demostrado que mejoran la función pulmonar, la disnea, la calidad de vida, la cumplimentación, la capacidad de ejercicio y que disminuyen la frecuencia de agudizaciones51,52. Son de elección en pacientes con síntomas persistentes, que afectan a las actividades de su vida diaria y que no están controlados con broncodilatadores de acción corta, los cuales se deben emplear a demanda como medicación de rescate. Si el paciente está en tratamiento con tiotropio se aconseja usar ß2-agonistas de acción corta como medicación de rescate53.
Algunos pacientes con obstrucción moderada-severa infravaloran sus síntomas. En estos pacientes paucisintomáticos se aconseja indicar un tratamiento con broncodilatadores de acción prolongada y realizar un seguimiento para evaluar su respuesta clínica y/o funcional antes de mantener un tratamiento a largo plazo.
Salmeterol y formoterol son ß2-agonistas y el tiotropio un anticolinérgico. Tiotropio ha demostrado ser superior a ipratropio en cuanto a mejoría de función pulmonar, síntomas, calidad de vida y reducción de agudizaciones54. No hay estudios que demuestren diferencias entre los ß2-agonistas de acción prolongada (LABA) salmeterol y formoterol. Por tanto, para la elección de cualquiera de estos broncodilatadores se deben tener en cuenta su posología, sus efectos adversos y las comorbilidades del paciente. Un reciente metaanálisis sobre ensayos clínicos que comparan salmeterol y tiotropio concluye que ambos fármacos son similares en sus efectos sobre agudizaciones, disnea y calidad de vida, aunque el beneficio en FEV1 es significativamente mayor para tiotropio52.
Recientemente se ha publicado el estudio UPLIFT, un ensayo clínico de 4 años de duración55 comparando tiotropio contra grupo control (tratado con el resto de la medicación inhalada habitual), en el que se demostró que tiotropio mejoraba en síntomas, función pulmonar, agudizaciones, calidad de vida y mortalidad comparado con el grupo control56, con un efecto beneficioso sobre la comorbilidad vascular y presentando un buen perfil de seguridad. Este estudio no observó diferencias en el declive del FEV1, salvo para los pacientes en estadio II57. Por tanto, tiotropio ha demostrado efectos clínicos beneficiosos en pacientes con EPOC mantenidos durante los 4 años de estudio.
En aquellos pacientes que persistan sintomáticos, con disnea o intolerancia al ejercicio, la asociación de 2 fármacos broncodilatadores de distinta familia podría ser beneficiosa dado su diferente mecanismo de acción. Aunque los resultados de los ensayos clínicos no son concluyentes, existen estudios que muestran efectos complementarios cuando se asocian salmeterol o formoterol y tiotropio. Estos estudios han demostrado que se produce una mayor rapidez de acción que tiotropio solo y mayor broncodilatación58–62. En el caso del formoterol también se ha demostrado una disminución del uso de medicación de rescate58,61,62.
En un reciente ensayo clínico63 la asociación de tiotropio y salmeterol no demostró mejorías significativas ni en FEV1 ni en la tasa de hospitalizaciones comparada con tiotropio más placebo. Estos resultados contrastan, sin embargo, con los obtenidos en el ensayo de van Noord et al.62 en el que la adición de formoterol a tiotropio consiguió mejorías significativas, no solo en el FEV1 sino también en la capacidad inspiratoria. Por el momento, la asociación de ambos tipos de broncodilatadores puede ser una opción terapéutica dentro del tratamiento escalonado de pacientes con EPOC moderada que persistan sintomáticos con un solo broncodilatador, aunque precisamos de más estudios a largo plazo que aporten datos sobre eficacia y seguridad.
Recomendaciones sobre broncodilatadores de acción prolongada:
- •
Los broncodilatadores de acción prolongada están indicados en pacientes con síntomas persistentes, que afectan a las actividades de su vida diaria y que no están controlados con broncodilatadores de acción corta.
- •
En los casos en los que se inicie tratamiento con broncodilatadores de acción prolongada se deben mantener los de acción corta como medicación de rescate. Si el paciente está en tratamiento con tiotropio se aconseja usar ß2-agonistas de acción corta como medicación de rescate.
- •
En caso de pacientes paucisintomáticos con obstrucción moderada-severa se aconseja indicar un tratamiento con broncodilatadores de acción prolongada y realizar un seguimiento para evaluar su respuesta clínica y/o funcional antes de mantener un tratamiento a largo plazo.
- •
No existen evidencias que indiquen una mayor eficacia de un grupo farmacológico frente a otro. Por tanto, para la elección de cualquier broncodilatador de acción prolongada se deben tener en cuenta su posología, sus efectos adversos y las comorbilidades del paciente.
- •
Tiotropio ha demostrado efectos clínicos beneficiosos en pacientes con EPOC mantenidos durante los 4 años de estudio, confirmando su papel como broncodilatador de primera línea.
- •
Aunque no existen datos definitivos sobre el efecto aditivo de ambos grupos farmacológicos (ß2-agonistas y anticolinérgicos), la asociación de 2 broncodilatadores de distinta familia puede ser una opción terapéutica dentro del tratamiento escalonado de pacientes con EPOC moderada que se mantengan sintomáticos con un solo broncodilatador.
El uso de corticoides inhalados (CI) reduce el número de agudizaciones y mejora la calidad de vida64. La evidencia obtenida de varios ensayos clínicos amplios de hasta 3 años de duración nos muestra que los CI no tienen un efecto en el declive del FEV1 en ninguno de los grados de severidad de la enfermedad65–68.
Los CI nunca deben utilizarse como monoterapia en la EPOC y siempre serán añadidos al tratamiento broncodilador de base. La respuesta a los CI inhalados no es uniforme y tampoco es predecible por la respuesta a glucocorticoides sistémicos o a la prueba broncodilatadora65,69.
Se ha descrito un aumento de las agudizaciones en algunos casos al retirar el tratamiento con CI70. Parece que factores como la edad, el tabaquismo activo, ser mujer o tener una prueba broncodilatadora positiva a pesar de dicho tratamiento con CI, son factores de riesgo para que aumenten las agudizaciones al retirar los corticoides inhalados71. Por tanto, habrá que tener especial cautela en estos casos72. Si al prescindir de ellos aumentaran las agudizaciones, se deben reintroducir de nuevo en el tratamiento.
Aunque los CI son bastante seguros es necesario recordar la presentación de efectos adversos locales (candidiasis y disfonía) que pueden ser reducidos mediante una correcta técnica inhalatoria y el uso de cámaras espaciadoras. Aunque los estudios sobre osteoporosis y riesgo de fracturas son discrepantes, las últimas revisiones sistemáticas indican que los pocos estudios que existen a largo plazo no muestran un aumento del riesgo de fractura64,73.
En cuanto a otros efectos adversos, recientes estudios comunican una mayor frecuencia de infecciones del tracto respiratorio inferior, en especial neumonías de la comunidad74. En 2 metaanálisis se asocia el uso de cualquier CI, de forma significativa, con un aumento de riesgo de neumonía75,76. El más reciente, de Singh et al., estima un riesgo relativo para cualquier tipo de neumonía de 1,6 y para neumonía grave de 1,71, aunque sin aumento de la mortalidad asociada a la neumonía76. Esta relación se ha asociado al uso de altas dosis del corticoide, la duración del tratamiento, el grado de severidad de la enfermedad y el uso de terapia combinada en un solo dispositivo75. Otra revisión sistemática también encuentra un mayor riesgo relativo de neumonía, de 1,63, en el grupo tratado con LABA + CI frente al tratado solo con LABA77. Un metaanálisis que evalúa solamente el tratamiento con budesonida (800μg/día con estudios a un año), no muestra aumento del riesgo de neumonía en pacientes con EPOC durante el periodo de tratamiento78. En cualquier caso, hacen falta más estudios para esclarecer la asociación de los distintos CI, con el riesgo de infecciones respiratorias de vías bajas.
Combinación fija de corticoides inhalados y ß2-agonistas de acción prolongadaNumerosos estudios demuestran que la combinación de LABA + CI produce una mejoría en la función pulmonar, de la calidad de vida y una reducción de las agudizaciones, comparados con la administración de cada componente de manera aislada. Esta mejoría se ha demostrado tanto con la combinación de salmeterol/fluticasona como con formoterol/budesonida79–84.
Están indicados en EPOC grave (FEV1 < 50%) con frecuentes agudizaciones (≥ 2 anuales). Tras los resultados del estudio TORCH84 esta indicación se ha ampliado a EPOC con FEV1 < 60% para la combinación salmeterol-fluticasona. Sin embargo, un metaanálisis reciente solo ha demostrado una disminución de las agudizaciones con la combinación de LABA + CI, frente a monoterapia con LABA o CI en pacientes con FEV1< 40%85. Por tanto, no está claro el límite de función pulmonar a partir del cual deben indicarse e uso de los CI en la EPOC estable.
La dosis apropiada de CI en tratamiento combinado en la EPOC no ha sido definida. La evidencia disponible sobre terapia combinada se basa en estudios realizados con las dosis de 500 y 1.000μg al día con fluticasona82,84 o de 400 y 800μg al día con budesonida81,83,86, aunque no existen estudios comparativos que permitan establecer la dosis óptima recomendada de CI en combinación con los LABA en los pacientes con EPOC.
Asociación de una combinación fija de corticoides inhalados y ß2-agonistas de acción prolongada y tiotropioAlgunos estudios recientes han evaluado el uso de tratamiento combinado junto con tiotropio. Estos estudios han demostrado que la triple terapia mejora la función pulmonar, la calidad de vida, el número de agudizaciones y el tiempo hasta la primera agudización, en pacientes con EPOC de grado severo o muy severo55,63,87,88. El estudio OPTIMAL demostró que la asociación de tiotropio con una combinación fija de salmeterol/fluticasona disminuyó el número de hospitalizaciones y mejoró la calidad de vida63. Actualmente, se recomienda el uso de la triple terapia en pacientes con síntomas persistentes o frecuentes agudizaciones a pesar de tratamiento broncodilatador o combinado adecuado, aunque se precisan más estudios sobre su eficacia y seguridad a largo plazo.
Recomendaciones sobre los corticoides inhalados:
- •
El uso de CI reduce el número de agudizaciones y mejora la calidad de vida.
- •
La respuesta a los CI inhalados no es uniforme y tampoco es predecible por la respuesta a glucocorticoides sistémicos o a la prueba broncodilatadora.
- •
Los CI nunca deben utilizarse como monoterapia en la EPOC y siempre serán añadidos al tratamiento broncodilatador de base.
- •
En caso de plantearse una retirada, se deben tener en cuenta factores de riesgo para una agudización como la edad, el ser fumador activo, ser mujer o tener una prueba broncodilatadora positiva a pesar del tratamiento con CI.
- •
Recientes estudios comunican una mayor frecuencia de infecciones del tracto respiratorio inferior, en especial neumonías de la comunidad.
- •
Esta relación entre CI y neumonías se ha asociado al uso de altas dosis del corticoide, la duración del tratamiento, el grado de severidad de la enfermedad y el uso de terapia combinada en un solo dispositivo.
Recomendaciones sobre la combinación fija de corticoides inhalados y ß2-agonistas de acción prolongada:
- •
Numerosos estudios demuestran que la combinación de LABA+CI produce una mejoría en la función pulmonar, de la calidad de vida y una reducción de las agudizaciones, comparados con la administración de cada componente de manera aislada. Esta mejoría se ha demostrado tanto con la combinación de salmeterol/fluticasona como con formoterol/budesonida.
- •
Añadir CI a un broncodilatador de acción prolongada está indicado en EPOC grave (FEV1 < 50%) con frecuentes agudizaciones (≥2 anuales) y en aquellos pacientes con síntomas persistentes. Tras los resultados del estudio TORCH esta indicación se ha ampliado para la combinación salmeterol-fluticasona a EPOC con FEV1 < 60% y frecuentes agudizaciones. Sin embargo, no está claro el límite de función pulmonar a partir del cual deben indicarse e uso de los CI en la EPOC estable.
- •
La dosis apropiada de CI en tratamiento combinado en la EPOC no ha sido definida. La evidencia disponible sobre terapia combinada se basa en estudios realizados con las dosis de 500 y 1.000μg al día con fluticasona o de 400 y 800μg al día con budesonida.
Recomendaciones sobre la combinación fija de corticoides inhalados y ß2-agonistas de acción prolongada y tiotropio:
- •
Actualmente, se recomienda el uso de la triple terapia en pacientes con síntomas persistentes o frecuentes agudizaciones a pesar de tratamiento broncodilatador o combinado adecuado, aunque se precisan más estudios sobre su eficacia y seguridad a largo plazo.
La utilización de este grupo farmacológico ha disminuido paulatinamente desde la aparición de los broncodilatadores de acción prolongada. En general todas las recomendaciones y normativas proponen su utilización, cuando con otros broncodilatadores no se controlan los síntomas de forma adecuada1,2, siempre que al introducirlas se observe una mejoría clínica significativa sin la aparición de efectos secundarios destacables.
Mucolíticos y antioxidantesLa utilización de fármacos mucolíticos continúa siendo bastante cuestionada y aunque no existen evidencias concluyentes, pueden ser utilizados de forma continuada en aquellos pacientes con esputo viscoso difícil de expectorar si se constata mejoría de dichos síntomas89,90.
La administración de N-acetil cisteína o carbocisteína puede reducir el número de agudizaciones, sobre todo en pacientes no tratados con CI89,91, por lo que debe considerarse su uso en pacientes con EPOC moderada-grave en los que los CI no son prescritos por alguna razón.
AntitusígenosSu uso de forma regular está contraindicado en la EPOC estable.
Estimulantes respiratoriosNo hay evidencia de que bismesilato de almitrina y doxapran aporten ningún beneficio al tratamiento del paciente EPOC en fase estable. Ambos fármacos pueden producir efectos secundarios neurológicos periféricos.
Recomendaciones sobre otros tratamientos farmacológicos:
- •
El empleo de metilxantinas (teofilina, mepifilina o aminofilina) se valorará en pacientes con síntomas progresivos a pesar de un tratamiento adecuado siempre que al introducirlas se observe una mejoría clínica significativa sin la aparición de efectos secundarios destacables.
- •
Los mucolíticos pueden ser utilizados de forma continuada en aquellos pacientes con esputo viscoso difícil de expectorar si se constata mejoría de dichos síntomas.
- •
Debe considerarse el uso de N-acetilcisteína o carbocisteína en pacientes con EPOC moderada-grave y agudizaciones frecuentes en los que los CI no son prescritos por alguna razón.
- •
Antitusígenos y estimulantes respiratorios no están indicados en el tratamiento de la EPOC estable.
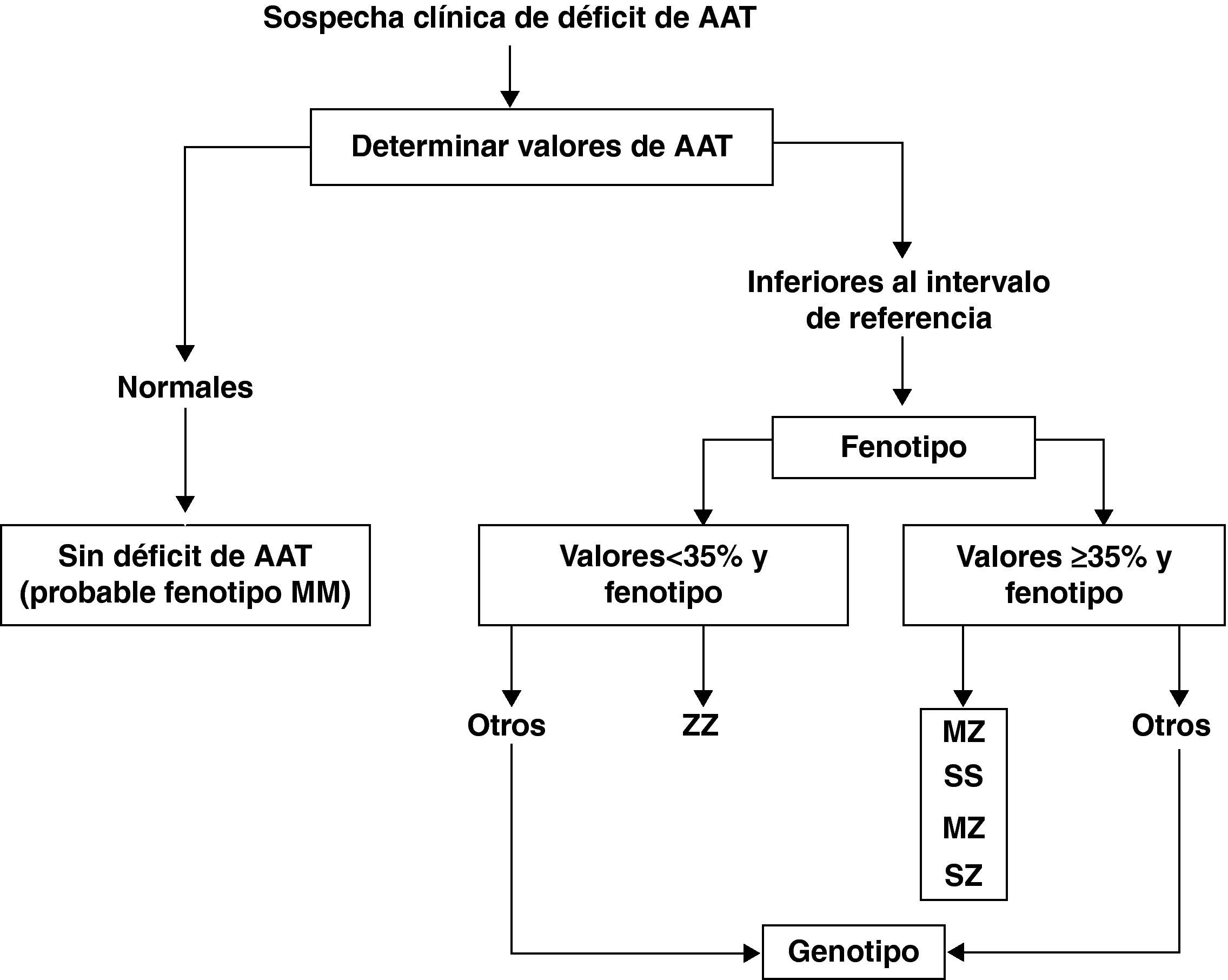
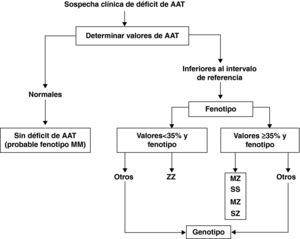
El déficit de AAT puede producir daño hepático y pulmonar. La afectación pulmonar se debe a que los valores séricos y tisulares de AAT están muy disminuidos y son insuficientes para neutralizar las proteasas, facilitando el desarrollo de enfisema pulmonar en adultos con déficit de AAT grave (ZZ y otros fenotipos deficientes). El déficit de AAT es responsable del 1-2% de todos los casos de enfisema pero solo el 10% de los pacientes con déficit de AAT grave están diagnosticados debido al bajo índice de sospecha clínica30. Por ello, es importante llamar la atención de todos los médicos acerca de las recomendaciones de la OMS y de las sociedades científicas de Neumología, que indican que se debe determinar la AAT a todos los pacientes con EPOC al menos una vez en la vida29. En aquellos pacientes con niveles séricos inferiores al intervalo de referencia se recomienda la investigación del fenotipo. El análisis molecular del gen de la AAT es el método de referencia para identificar las variantes alélicas poco frecuentes y para el estudio de los casos en los que no existe concordancia entre los valores séricos de AAT y el fenotipo (fig. 3).
Algoritmo diagnóstico en el déficit de alfa-1 antitripsina (AAT). Tomada de Vidal et al.30
Los enfermos suelen presentar síntomas habituales de la EPOC pero de inicio más precoz debiendo sospecharse por tanto en pacientes con una manifestación temprana de la enfermedad (tabla 7).
Candidatos para determinar valores de alfa-1 antitripsina
| 1. Enfermedad pulmonar obstructiva crónica2. Adultos con bronquiectasias3. Asma del adulto parcialmente reversible4. Familiares consanguíneos de individuos con déficit conocido de alfa-1 antitripsina5. Clínica de disnea y tos crónica en muchos miembros de una familia6. Hepatopatía de causa desconocida7. Disminución del pico de alfa-1 proteína en el proteinograma8. Paniculitis o vasculitis multiorgánica de causa desconocida |
Los sujetos con déficit de AAT asintomáticos con función respiratoria normal no precisan tratamiento. Aquellos otros con EPOC deben tratarse con las medidas farmacológicas y no farmacológicas comunes a cualquier EPOC según su gravedad. Desde 1987 se dispone de AAT procedente de plasma de donantes para administración intravenosa y ha demostrado que mantiene su actividad enzimática en plasma y a nivel alveolar. Es un tratamiento muy seguro y no se ha encontrado ningún caso de transmisión de hepatitis, VIH o enfermedad mediada por priones. El tratamiento sustitutivo solamente está indicado en pacientes con enfisema pulmonar con déficit grave de AAT (fenotipo PiZZ o variantes raras deficitarias) no fumadores o ex fumadores de más de 6 meses. En la actualidad disponemos en España de 2 preparados de AAT procedente de plasma humano para su administración intravenosa: Prolastina® y Trypsone®. Aunque en la ficha técnica se recomienda el tratamiento con dosis de 60 mg/kg/semana, diversos estudios han demostrado la eficacia y seguridad de otras pautas30. El Registro Español de déficit de AAT recomendó la pauta de 180 mg/kg durante 21 días ya que consigue mantener los niveles de AAT superiores a las consideradas protectoras durante aproximadamente un 85% del tiempo entre dosis y es más cómodo para el paciente30.
En cuanto a su efectividad, los datos que se conocen derivan de estudios comparativos de seguimiento. Estos estudios muestran una disminución significativa en el descenso del FEV1 en pacientes con un FEV1 del 30-65%92, un menor declive del FEV1 durante el periodo de tratamiento93, una reducción del 36% en la mortalidad94, una reducción del número de agudizaciones95.), una reducción de la progresión del enfisema medido como pérdida de densidad pulmonar mediante tomografía computarizada96, una menor mortalidad y una reducción del número de agudizaciones95.
Recomendaciones sobre el déficit de alfa-1 antitripsina:
- •
Se recomienda la determinación del nivel sérico de AAT en todos los pacientes con EPOC al menos una vez en la vida y el estudio del fenotipo o genotipo en el caso de estar disminuido.
- •
Los sujetos con DAAT asintomáticos con función respiratoria normal no precisan tratamiento. Aquellos otros con EPOC deben tratarse con las medidas farmacológicas y no farmacológicas comunes a cualquier EPOC según su gravedad.
- •
El tratamiento sustitutivo con AAT procedente de plasma humano está indicado solo en pacientes con enfisema pulmonar con déficit grave de AAT (fenotipo PiZZ o variantes raras deficitarias) no fumadores o ex fumadores de más de 6 meses.
La oxigenoterapia crónica domiciliaria (OCD) es la principal medida terapéutica junto con la abstinencia tabáquica que ha demostrado mejorar la supervivencia de los pacientes con EPOC. Dos estudios en la década de 198097,98, ratificados en una revisión Cochrane99, demostraron que la terapia con oxígeno mejoraba las expectativas de vida de los pacientes con hipoxemia crónica. Los resultados de estos estudios marcaron las directrices actuales de la oxigenoterapia en el tratamiento de la EPOC.
Además de la evidencia de la supervivencia en la EPOC, la OCD ha demostrado otros efectos beneficiosos en pacientes con insuficiencia respiratoria crónica como son la reducción de la poliglobulia y la disminución o estabilización de la hipertensión pulmonar100–102, la reducción del número y días de hospitalización103, así como efectos sobre la capacidad de ejercicio, el sueño y el rendimiento cognitivo104.
El objetivo de la oxigenoterapia es aumentar la presión parcial arterial de oxígeno (PaO2) hasta 60mmHg en reposo, el sueño y el ejercicio, con objeto de asegurar un aporte de oxígeno adecuado a los tejidos. Por tanto, no está indicada en pacientes con hipoxemia leve o moderada (PaO2 > 60 mmHg)105.
Las indicaciones de la OCD en la EPOC son pacientes con PaO2 < 55mmHg o bien en aquellos con PaO2 entre 55 y 60mmHg si existe evidencia de hipertensión pulmonar, insuficiencia cardíaca derecha o poliglobulia1,2.
Para conseguir los efectos clínicos deseados es necesario administrarla en dosis adecuada y durante el tiempo necesario (mínimo 15 h al día), por lo que es esencial lograr una buena adherencia al tratamiento97,98. Las fuentes de administración de oxígeno, los dispositivos de aplicación y los riesgos de la terapia con oxígeno vienen recogidas en normativas específicas como las de SEPAR106.
La gasometría arterial es el método de elección para establecer la indicación de OCD y debe realizarse según las normativas actuales107. La saturación arterial de oxígeno medida mediante pulsioximetría no sustituye a la gasometría a la hora de prescribir la OCD, pero puede ser un buen método para seleccionar a los pacientes candidatos a realizarse una gasometría arterial y para establecer la dosis de oxígeno necesaria, siempre y cuando se tengan en cuenta las relaciones que afectan a la curva de disociación de la hemoglobina y la relación entre saturación arterial y capilar108.
Existe controversia sobre la indicación de la OCD en situaciones de hipoxemia intermitente como la que aparece exclusivamente durante el sueño o durante el ejercicio109. Aunque en estos pacientes no se ha demostrado el efecto de la OCD sobre la supervivencia99,110, es posible que sea beneficiosa en el resto de parámetros clínicos descritos99,111. Por tanto, se recomienda iniciar OCD durante el sueño en pacientes EPOC con más del 30% del tiempo de sueño con una SaO2 < 90% si se acompaña de hipertensión pulmonar, insuficiencia cardiaca derecha o poliglobulia y siempre que se haya descartado un síndrome de apneas-hipopneas durante el sueño. Durante la realización de ejercicio puede plantearse su indicación cuando exista desaturación mantenida < 88% durante la prueba de marcha de los 6 min, siempre que se demuestre mejoría en la disnea medida por la escala de Borg o de un 10% en la distancia recorrida en la prueba al repetirla con oxígeno portátil.
Recomendaciones sobre la oxigenoterapia crónica domiciliaria:
- •
Las indicaciones de la OCD en la EPOC son pacientes con PaO2 < 55mmHg o bien en aquellos con PaO2 entre 55 y 60mmHg si existe evidencia de hipertensión pulmonar, insuficiencia cardiaca derecha o poliglobulia.
- •
Para conseguir los efectos clínicos deseados es necesario administrarla en dosis adecuada y durante el tiempo necesario (mínimo 15 h al día), por lo que es esencial lograr una buena adherencia al tratamiento.
- •
La gasometría arterial es el método de elección para establecer la indicación de OCD.
- •
La pulsioximetría puede ser un buen método para seleccionar a los pacientes candidatos a realizarse una gasometría arterial y para establecer la dosis de oxígeno necesaria.
- •
Se recomienda iniciar OCD durante el sueño en pacientes EPOC con más del 30% del tiempo de sueño con una SaO2 < 90% si se acompaña de hipertensión pulmonar, insuficiencia cardiaca derecha o poliglobulia y siempre que se haya descartado un síndrome de apneas-hipopneas durante el sueño.
- •
Durante la realización de ejercicio puede plantearse su indicación cuando exista desaturación mantenida < 88% durante la prueba de marcha de 6 min, siempre que se demuestre mejoría en la disnea medida por la escala de Borg o de un 10% en la distancia recorrida en la prueba al repetirlo con oxígeno portátil.
Aunque actualmente no hay evidencias para recomendar su uso de manera generalizada en la EPOC estable112, es posible que algún grupo de pacientes se beneficie de la ventilación mecánica domiciliaria. Esta ventilación se suele aplicar mediante soporte de presión (BIPAP). Según el último consenso internacional disponible, la ventilación estaría indicada en los pacientes con hipercapnia diurna severa > 55mmHg o aquellos con hipercapnia entre 50 y 54mmHg junto con desaturaciones nocturnas a pesar de tratamiento con oxígeno (a ≥ 2 lpm) o ≥ 2 hospitalizaciones anuales por insuficiencia respiratoria global113.
Recomendaciones sobre la ventilación mecánica no invasiva en la EPOC estable:
- •
Está indicada en los pacientes con hipercapnia diurna severa > 55mmHg o aquellos con hipercapnia entre 50 y 54mmHg junto con desaturaciones nocturnas a pesar de tratamiento con oxígeno (flujo ≥ 2 lpm) o ≥ 2 hospitalizaciones anuales por insuficiencia respiratoria global.
La vacuna antigripal ha demostrado ser eficaz para reducir la morbilidad y mortalidad asociada a la epidemia por Influenza y los gastos sanitarios derivados de la misma. La administración anual de la vacuna antigripal reduce la mortalidad y el número de hospitalizaciones durante los periodos epidémicos, por lo que debe recomendarse a todos los pacientes con EPOC2.
La vacunación se realizará anualmente, con las cepas recomendadas por la OMS (2 cepas del tipo A y una del tipo B, detectadas el año anterior)114. La mejor época de vacunación es en octubre y noviembre, con dosis única.
Está contraindicada en caso de hipersensibilidad a proteínas del huevo o pollo, aminoglucósidos utilizados en su producción y excipientes incluidos en ella. Se recomienda aplazar la vacunación unos días si coexiste enfermedad febril o infección aguda.
Vacuna antineumocócicaLa vacuna antineumocócica de 23 serotipos es eficaz en individuos inmunocompetentes para evitar la enfermedad neumocócica invasiva y la neumonía bacteriémica, recomendándose en pacientes mayores de 65 años114. En pacientes con EPOC menores de 65 años la vacuna antineumocócica ha demostrado además ser eficaz para prevenir las neumonías de la comunidad, sobre todo en pacientes con FEV1 < 40%115. Debe ofrecerse al paciente con EPOC de 65 o más años y a los menores de esta edad con obstrucción grave2.
La dosis es de 0,5ml por vía intramuscular o subcutánea. Se recomienda su administración simultánea con la vacuna antigripal, pero con lugares de inoculación diferentes. El uso conjunto de ambas vacunas puede tener un efecto sinérgico y reducir las formas más graves de neumonía2.
En cuanto a la revacunación sus indicaciones no están claras. A pesar de las restricciones que incluyen las recomendaciones de los CDC en Estados Unidos, se debe recomendar tras 5 años a todos los vacunados previamente.
Otras vacunacionesNo existe suficiente evidencia para recomendar el uso de vacunas frente a Haemophilus influenzae ni de vacunas microbianas polivalentes2.
Recomendaciones sobre las vacunaciones:
- •
Se recomienda la vacunación antigripal en todos los pacientes con EPOC.
- •
La vacuna antineumocócica debe ofrecerse al paciente con EPOC de 65 o más años y a los menores de esta edad con obstrucción grave. Se debe revacunar tras 5 años a todos los vacunados previamente.
- •
Se recomienda la administración simultánea de las vacunas antineumocócica y antigripal, pero con lugares de inoculación diferentes.
La disnea que padecen los pacientes con EPOC hace que los pacientes se hagan progresivamente más sedentarios. Esta falta de ejercicio junto con otros factores produce un descondicionamiento muscular con debilidad y pérdida de masa muscular que a su vez incrementa la sensación de disnea. Por ello, evitar el sedentarismo y estimular la actividad y el ejercicio físico cotidiano es beneficioso para romper este círculo vicioso1,2.
Una actividad física regular parece reducir la pérdida de función pulmonar en los fumadores y disminuir el riesgo de desarrollar EPOC116. El entrenamiento al ejercicio mejora la disnea, la capacidad de resistencia al esfuerzo y la calidad de vida. Además, los programas de rehabilitación disminuyen la utilización de los servicios sanitarios117 y parece asociarse con una más lenta disminución de la función pulmonar y con un aumento de la supervivencia118,119. Estos efectos del entrenamiento al ejercicio han sido demostrados en numerosos ensayos clínicos recogidos en varios metaanálisis para todos los estadios de la enfermedad120–123. Por este motivo, el presente documento junto con todas las sociedades científicas y guías de práctica clínica recomiendan el entrenamiento al ejercicio como una parte fundamental de la rehabilitación respiratoria y del tratamiento de la enfermedad1,2,124. En concreto, la rehabilitación respiratoria debería ofertarse a todos los pacientes que tras un tratamiento farmacológico óptimo sigan limitados por síntomas.
En los programas de rehabilitación suelen distinguirse distintos componentes, que con frecuencia se utilizan combinados. Factores como el grupo muscular entrenado, la duración del programa, así como la frecuencia e intensidad de las sesiones, son determinantes para conseguir el efecto deseado.
El componente más validado es el entrenamiento muscular a resistencia que incluya ejercicio de extremidades inferiores, en general en bicicleta ergométrica o tapiz rodante123,124. Las evidencias de la utilización aislada de la rehabilitación aeróbica de extremidades superiores son menos manifiestas, pero parece razonable incorporarla al programa de entrenamiento de miembros inferiores, realizándose en estos casos con bicicleta de brazos o pequeños pesos125.
Los programas basados en el entrenamiento a fuerza pueden ser una alternativa válida en estos pacientes con buenos resultados y tolerancia126. Incluso programas mixtos, a fuerza y resistencia, pueden tener efectos más completos fisiológicamente y puede ser la estrategia más adecuada para estos pacientes127.
Aunque programas más prolongados consiguen mejores efectos, se recomienda que la duración mínima del programa sea entre 8 y 12 semanas. Los beneficios de un programa de rehabilitación se mantienen durante varios meses; sin embargo, se recomienda que estos pacientes mantengan una actividad física adecuada una vez concluido el mismo.
La ubicación para la realización de estos programas puede ser variada. Actualmente se han desarrollado programas completos de rehabilitación respiratoria en el hospital, programas de ejercicio en el domicilio con visitas periódicas al hospital o exclusivamente en el domicilio. Los programas en el hospital ofrecen una supervisión directa y adaptación a cada caso. Los programa domiciliarios pueden ser una opción importante para mantener las mejorías conseguidas, haciendo que los pacientes integren el ejercicio en su vida cotidiana, y conseguir un mayor alcance de la rehabilitación respiratoria con costes mucho menores128,129.
La elección entre estas posibilidades dependerá de los recursos disponibles. Siempre que sea posible se remitirá al paciente a un centro con programas de rehabilitación completos. En caso contrario, cualquiera de las otras opciones es también válida. Si no es posible ninguna, al menos se le recomendará al paciente que haga ejercicio de manera regular y progresivo como forma sencilla de rehabilitación respiratoria con objeto de evitar el sedentarismo y favorecer el ejercicio físico cotidiano o simplemente andar a diario puede ser beneficioso y debería recomendarse de forma general a todos los pacientes con EPOC130.
Recomendaciones sobre la rehabilitación respiratoria:
- •
La rehabilitación respiratoria debería ofertarse a todos los pacientes que tras un tratamiento farmacológico óptimo sigan limitados por síntomas.
- •
La duración mínima debe ser de 8-12 semanas con un entrenamiento que incluya, al menos, entrenamiento a resistencia de miembros inferiores añadiendo, si es posible, los miembros superiores y el entrenamiento a fuerza.
- •
El tipo de programa (hospitalario, ambulatorio o mixto) debe ser el más completo posible, dentro de las posibilidades de cada centro.
- •
Independientemente de las posibilidades de programas de rehabilitación existentes en cada centro, a todos los pacientes se les debe recomendar ejercicio diario y progresivo según sus posibilidades.
La educación del paciente EPOC constituye un elemento fundamental de la rehabilitación respiratoria y del tratamiento de la EPOC. El paciente debe conocer la enfermedad que presenta, aprender las habilidades sobre el manejo del tratamiento y adoptar una actitud participativa para afrontar su enfermedad131. Los programas de educación tienen que ser individualizados y estar dirigidos al paciente y también a la familia, con unos contenidos que abarquen, al menos, los siguientes aspectos:
- •
Aspectos relevantes sobre su enfermedad.
- •
Medidas para aliviar sus síntomas.
- •
Tabaquismo activo y pasivo y contaminación ambiental.
- •
Actividad física y nutrición.
- •
Reconocimiento precoz de las agudizaciones y medidas a realizar.
- •
Conocimiento de los dispositivos y técnica inhalatoria.
- •
Oxigenoterapia y ventilación domiciliaria.
- •
Conocimientos de los recursos de la comunidad.
La intervención educacional corresponde a todos los profesionales implicados en la atención a estos pacientes. En este sentido recomendamos incluir la educación de pacientes con EPOC en las consultas de enfermería.
Recomendaciones sobre la educación:
- •
La educación del paciente con EPOC constituye un elemento fundamental de la rehabilitación respiratoria y del tratamiento de la EPOC.
- •
Los programas de educación tienen que ser individualizados y estar dirigidos al paciente y también a la familia, incluyendo los contenidos definidos en el presente consenso.
- •
La intervención educacional corresponde a todos los profesionales implicados en la atención a estos pacientes.
La pérdida de peso contribuye a una disminución de la tolerancia al esfuerzo y al empeoramiento de la calidad de vida, siendo un indicador pronóstico de morbimortalidad demostrado. Por el contrario, la obesidad aumenta la hipoventilación y disminuye la capacidad de ejercicio. Por estos motivos, es necesario mantener un peso y un estado nutricional dentro de unos límites razonables.
Es recomendable realizar una evaluación del estado nutricional en la EPOC al diagnóstico y durante su seguimiento. Se recomienda la medida del IMC como parámetro de mayor utilidad (rango normal entre 22 y 27).
En los casos de pérdida de peso no justificada o si el IMC está por debajo de 22kg/m2, será preciso evaluar de forma detallada la ingesta habitual de alimentos. Lo más racional es conseguir que los pacientes realicen una dieta equilibrada para mantener un peso adecuado. Si persiste la alteración, se debe remitir al especialista correspondiente.
Tratamiento quirúrgicoEn los pacientes con EPOC muy grave la cirugía (bullectomía, CRVP y trasplante pulmonar) puede mejorar la tolerancia al esfuerzo, la función pulmonar, la disnea y la calidad de vida relacionada con la salud. Ello requiere una adecuada selección de los pacientes.
BullectomíaEstá indicada en pacientes con FEV1 > 40%, FVC normal o ligeramente disminuido cuando las ampollas ocupan más de un tercio del hemitórax correspondiente, comprimen el tejido pulmonar adyacente o el paciente tiene una disnea progresiva. Es preciso señalar que las recomendaciones están basadas en estudios no controlados132. Otras indicaciones son la abscesificación de la ampolla, hemoptisis grave o neumotórax persistente.
Cirugía de reducción del volumen pulmonarLa CRVP consiste en la resección de las regiones pulmonares con mayor destrucción de tejido pulmonar. Con ello se pretende facilitar que el resto del parénquima se expanda mejorando la fuerza de retracción elástica y el intercambio gaseoso. Puede ser una alternativa al trasplante pulmonar en pacientes muy seleccionados.
La CRVP se indica en pacientes con enfisema de distribución heterogénea y de predominio en lóbulos superiores que tienen baja tolerancia al esfuerzo y con FEV1 y DLCO > 20%. En este grupo este proceder quirúrgico mejora la supervivencia a los 4 años, la tolerancia al ejercicio y la calidad de vida. La CRVP no aporta beneficio si el enfisema es homogéneo, no predomina en lóbulos superiores o presenta un FEV1 o DLCO < 20%133. La CRVP es una alternativa al trasplante pulmonar en pacientes muy seleccionados; sin embargo, dada la limitada disponibilidad de donantes en la actualidad, podría ser considerada como un tratamiento definitivo en muchos casos.
La reducción de volumen pulmonar por vía endoscópica mediante la colocación de válvulas endobronquiales134,135, instilación de agentes fibrosantes136 o ablación térmica137 son considerados tratamientos en fase de experimentación.
Trasplante pulmonarEl objetivo del trasplante es mejorar la supervivencia. Además, ha demostrado que puede mejorar la calidad de vida, la tolerancia al esfuerzo, la función pulmonar y el intercambio gaseoso por lo que debe ser considerado en pacientes con EPOC muy grave y deterioro progresivo a pesar de un tratamiento médico óptimo (abandono del tabaco, tratamiento broncodilatador, oxigenoterapia y rehabilitación).
La actual normativa de trasplante recomienda derivar a un paciente para trasplante cuando tenga un BODE > 5. La indicación de trasplante está establecida actualmente con índice BODE ≥ 7 o bien tener un BODE inferior con uno de los siguientes: una historia de hospitalizaciones por fracasos respiratorios hipercápnicos severos, hipertensión pulmonar, cor pulmonale o ambos a pesar de OCD, una función pulmonar con FEV1 < 20% junto con difusión < 20% o bien una distribución homogénea del enfisema18.
Recomendaciones sobre el tratamiento quirúrgico:
- •
La bullectomía está indicada en pacientes con FEV1 > 40%, FVC normal o ligeramente disminuido cuando las ampollas ocupan más de un tercio del hemitórax correspondiente, comprimen el tejido pulmonar adyacente o el paciente tiene una disnea progresiva.
- •
La CRVP se indica en pacientes con enfisema de distribución heterogénea y de predominio en lóbulos superiores que tienen baja tolerancia al esfuerzo y con FEV1 y DLCO > 20%.
- •
La actual normativa de trasplante recomienda derivar a un paciente para trasplante cuando tenga un BODE > 5.
- •
La indicación de trasplante está establecida actualmente con índice BODE ≥ 7 o bien tener un BODE inferior con uno de los siguientes: una historia de hospitalizaciones por fracasos respiratorios hipercápnicos severos, hipertensión pulmonar, cor pulmonale o ambos a pesar de OCD, una función pulmonar con FEV1 < 20% junto con difusión < 20% o bien una distribución homogénea del enfisema.
Una agudización de la EPOC (AEPOC) es un evento en el desarrollo natural de la enfermedad, que conlleva un cambio agudo en la situación clínica basal del paciente más allá de la variabilidad diaria, que cursa con aumento de la disnea, de la expectoración, la purulencia del esputo o cualquier combinación de estos 3 síntomas y que precisa un cambio en el tratamiento138.
Las AEPOC se han relacionado con un deterioro en la calidad de vida del paciente, y el número de agudizaciones sufridas influye en el pronóstico de la enfermedad139, por lo que su prevención y tratamiento constituyen uno de los objetivos del tratamiento de la EPOC (tabla 6).
Las causas más frecuentes de AEPOC son:
- a)
Infecciones (50-70%) de las que las bacterias constituyen alrededor del 60%. Fundamentalmente se aíslan Haemophilus influenzae, Streptococcus pneumoniae, Moraxella catarrhalis y Chlamydia pneumoniae. En pacientes con EPOC grave y frecuentes agudizaciones la infección puede estar causada por Pseudomonas aeruginosa. Los virus constituyen el 40% restante.
- b)
Otras causas (30-50%) que se han relacionado son: factores ambientales, polución atmosférica, inadecuado tratamiento o incumplimiento del mismo, toma de sedantes, etc. Hasta en un tercio de los casos la causa no puede ser identificada.
Existen otros procesos patológicos que pueden simular una agudización pero que no deben ser definidos como tales entre los que se incluyen: neumotórax, insuficiencia cardiaca, cardiopatía isquémica, tromboembolia pulmonar, arritmias, anemia y neoplasia pulmonar, entre otros1,2. Se estima que del 10 al 30% de los pacientes con una aparente agudización de EPOC no van a responder al tratamiento1; en los que deben tenerse en cuenta estos diagnósticos alternativos.
Diagnóstico de la AEPOCEl diagnóstico de la AEPOC es clínico. El síntoma más importante es el aumento de la disnea, que puede ir acompañada de aumento de tos y expectoración o de cambios en la coloración del esputo. Dentro del proceso diagnóstico es importante valorar la gravedad de la AEPOC, sin embargo no existe una clasificación unánime para la gradación de la severidad de la misma. En la valoración de la severidad de la AEPOC lo más importante es decidir si su gravedad es de suficiente entidad como para derivarla a un centro de urgencias o si puede ser tratada de forma ambulatoria. Para tomar esta decisión se deben considerar los criterios de gravedad resumidos en la tabla 8. De esta manera, se puede considerar la severidad de la agudización según el consenso ATS-ERS140:
- •
Leve, aquella que no presenta criterios de gravedad y que por tanto puede ser manejada ambulatoriamente.
- •
Moderada-grave, la que presenta criterios de gravedad y por tanto precisa de atención por un servicio de urgencias.
- •
Grave, la que precisa ingreso hospitalario.
- •
Muy grave, la que precisa ingreso en UCI.
Criterios de gravedad de las agudizaciones de la enfermedad pulmonar obstructiva crónica
| Cianosis intensaDatos de encefalopatía hipercápnica como disminución del nivel de conciencia o asterixisFrecuencia respiratoria > 25 rpmFrecuencia cardiaca > 110 lpmRespiración paradójicaUso de la musculatura accesoria de la respiraciónSignos de fracaso muscular ventilatorioSignos de insuficiencia cardiaca derechaFracaso del tratamiento inicial |
En la valoración de la gravedad es importante tener presente algunas circunstancias que deben hacernos estar alerta por ser factores de riesgo para presentar criterios de gravedad, como las resumidas en la tabla 9. Además de la presencia de criterios de gravedad, aquellos pacientes con AEPOC en los que sea preciso descartar otras enfermedades responsables del empeoramiento o imposibilidad de tratar la enfermedad en el domicilio deberán ser derivados a un centro hospitalario.
Factores de riesgo para presentar criterios de gravedad en una agudización de la enfermedad pulmonar obstructiva crónica
| Edad > 70 añosComorbilidades asociadas: diabetes mellitus, cirrosis hepática, insuficiencia renal crónica y cardiopatíaDisnea importanteTres o más agudizaciones en el último añoHistoria de fracasos terapéuticos anterioresMalas condiciones sociales del entorno familiar y domiciliarioMayor grado de severidad de la EPOC |
En las AEPOC leves sin criterios de gravedad habitualmente no es necesario realizar ninguna exploración complementaria. En aquellas que presenten algún criterio de gravedad y sean por tanto derivadas a un servicio de urgencias es necesario realizar los siguientes estudios complementarios:
- •
Hemograma: existencia de poliglobulia, anemia o leucocitosis.
- •
Bioquímica: alteraciones hidroelectrolíticas, de las enzimas hepáticas o cardiacas, hiperglucemia o dímero-D (sospecha de tromboembolia pulmonar).
- •
Radiografía de tórax: útil para descartar neumonía, neumotórax, etc.
- •
Electrocardiograma: útil para evaluar signos de sobrecarga aguda o crónica de cavidades derechas, arritmias o isquemia.
- •
Gasometría arterial: imprescindible en las agudizaciones graves y siempre que la SpO2 sea inferior a 92%.
- •
Cultivo de esputo: indicado en pacientes con antecedentes de ingreso hospitalario previo, tratamiento antibiótico en los últimos 3 meses o antecedentes de colonización o infección por gérmenes no habituales o con factores de riesgo para ello.
Recomendaciones sobre diagnóstico de la AEPOC:
- •
El diagnóstico de la AEPOC es clínico. Dentro del proceso diagnóstico es importante valorar los criterios de gravedad, con objeto de decidir si la AEPOC debe derivarse a un centro de urgencias o puede ser tratada de forma ambulatoria.
- •
Las AEPOC leves sin criterios de gravedad habitualmente no precisan realizar ninguna exploración complementaria.
- •
Dentro del hospital es necesario realizar al menos: analítica general, radiografía del tórax, electrocardiograma y gasometría arterial. Además, se debe realizar un cultivo de esputo en determinadas circunstancias resumidas en el texto.
El algoritmo de tratamiento de la AEPOC queda resumido en la figura 42. En el caso de AEPOC leves o moderadas que se traten de forma ambulatoria deben ser reevaluados tras 48-72 h para decidir si se debe o no derivar al paciente a un centro hospitalario o si precisa algún cambio en el tratamiento1,2.
Algoritmo de manejo de la agudización de la EPOC. Modificado del consenso SEPAR 20072.
En caso de precisar ingreso hospitalario el alta se puede considerar siempre que el paciente presente estabilidad clínica y gasométrica, no necesite medicación intravenosa, sea capaz de manejar su enfermedad en el domicilio. Existen alternativas de altas precoces que se acompañan de programas de atención domiciliaria o consultas de atención rápida con resultados satisfactorios141. El paciente deberá realizar controles estrechos por su dispositivo de atención primaria que permitan, entre otros, el control del descenso de los corticoides sistémicos y las complicaciones asociadas como cambios en la glucemia y las cifras tensionales y el uso correcto del tratamiento de su enfermedad con especial cuidado en la duración del tratamiento antibiótico, la cumplimentación y técnica del tratamiento inhalado y la oxigenoterapia. La primera revisión por el neumólogo se hará como máximo a los 15 días tras el alta en pacientes con EPOC grave-muy grave, con frecuentes agudizaciones y/o reingresadores. Cuando el paciente requiera oxigenoterapia domiciliaria al alta, la gasometría arterial deberá ser repetida en situación clínica estable, no antes de 2 meses después del alta, para determinar si es candidato a oxigenoterapia crónica domiciliaria.
La hospitalización a domicilio en pacientes seleccionados (sin insuficiencia respiratoria, sin comorbilidades graves, con buen soporte familiar y con pH normal) puede disminuir las visitas a urgencias y los costes sanitarios. No obstante, la generalización de esta modalidad asistencial en estos pacientes requiere de más estudios y de una organización sanitaria específica y estructurada para ello142.
Tratamiento broncodilatador en la AEPOCDurante la agudización no se interrumpirá el tratamiento que el paciente utilice habitualmente siempre que la situación clínica lo permita. La primera opción farmacológica en la AEPOC debe ser la intensificación del tratamiento broncodilatador. Para esto se suelen emplear broncodilatadores de acción corta aumentando la dosis y la frecuencia de las inhalaciones. Por lo general, los ß2-agonistas de acción corta son los más usados por su rapidez de acción143. Sin embargo, no existe suficiente evidencia en cuanto a diferencias en la eficacia broncodilatadora entre estos y los anticolinérgicos144. En cuanto a la asociación de ambos broncodilatadores, aunque no hay evidencias disponibles de sus beneficios adicionales144, es frecuente su asociación y se recomiendan especialmente en AEPOC con criterios de gravedad o con respuesta incompleta inicial, por sus efectos sinérgicos en cuanto a su acción broncodilatadora.
En lo referente a los sistemas de inhalación, se deben emplear cartuchos presurizados con cámara espaciadora, ya que la eficacia de estos frente a la terapia nebulizada no ha demostrado ser diferente145. No obstante, en aquellos pacientes con criterios de gravedad, especialmente los pacientes muy taquipneicos o incapaces de utilizar correctamente el sistema presurizado, es preferible emplear terapia nebulizada durante las primeras horas para garantizar un adecuado depósito del fármaco.
La terapia nebulizada se suele administrar mediante nebulizadores neumáticos con oxígeno o con aire. El uso de uno u otro gas dependerá del estado del intercambio gaseoso del paciente. Aunque el breve espacio de tiempo que dura la nebulización no ha demostrado empeorar la situación clínica del paciente, algunos autores prefieren emplear aire o nebulizadores ultrasónicos en caso de insuficiencia respiratoria hipercápnica.
CorticoidesLos corticoides sistémicos han demostrado ser beneficiosos en el tratamiento de la AEPOC. Acortan el tiempo de recuperación, mejoran la función pulmonar, reducen el riesgo de recidiva y la estancia hospitalaria. Por esto, se deben administrar a todos los pacientes con criterios de gravedad o con FEV1 < 50%. En la AEPOC leve/moderada se recomienda su uso si existe hiperreactividad bronquial o cuando la evolución inicial no es favorable. La dosis óptima y la duración del tratamiento no han sido establecidas. Las actuales normativas recomiendan emplear 0,5 mg/kg/día que suele corresponder con dosis entre 30 y 40 mg/día de prednisona o equivalente. La duración del tratamiento suele ser durante 7-10 días y no más de 2 semanas146. En estos casos, no es necesario realizar una pauta descendente.
La vía de administración puede ser intravenosa u oral y no se han encontrado diferencias significativas en el pronóstico de la AEPOC entre ambas147. No obstante, en los pacientes ingresados suelen administrarse por vía intravenosa durante los primeros días por la comodidad de tener un acceso venoso garantizado.
Diversos estudios apuntan a que la budesonida nebulizada pueden ser una alternativa en pacientes que no los estén tomando previamente y presenten agudizaciones moderadas-grave, sin acidosis respiratoria148,149. Sin embargo, son necesarios más estudios que evalúen esta opción terapéutica.
AntibioticoterapiaNo todas las AEPOC son de causa bacteriana y por tanto no tienen necesariamente que ser tratadas con antibióticos150. Los antibióticos están indicados en aquellos pacientes que presenten la tríada de aumento de la disnea, aumento del volumen del esputo y purulencia del mismo, o bien en aquellos con 2 de estos síntomas, siempre que uno sea la purulencia del esputo. Además, también se administra en aquellas AEPOC graves que requieran ventilación mecánica1. El uso de antibióticos en EPOC moderada-grave agudizados con incremento de la tos y purulencia del esputo reduce la mortalidad a corto plazo en un 73% y el riesgo de fracaso terapéutico en un 53%151.
La elección del tratamiento antibiótico queda resumida en la tabla 10152. La elección del antibiótico se basará en la gravedad de la EPOC, la presencia de comorbilidades (diabetes mellitus, cirrosis hepática, insuficiencia renal crónica y cardiopatía), los patrones de resistencia bacteriana de la zona y el riesgo de participación de P. aeruginosa (hospitalización reciente, administración de antibióticos en los 3 últimos meses o en más de 4 ocasiones en el último año, colonización crónica por P. aeruginosa o aislamiento en agudización previa). También se tendrán en cuenta los efectos secundarios, el coste y su perfil farmacocinético y farmacodinámico. La duración y las dosis del tratamiento antibiótico dependerán del agente elegido. Tradicionalmente se han empleado ciclos de entre 7-10 días. Recientemente se ha indicado que algunos antibióticos podrían ser igualmente eficaces con tratamientos cortos153.
Pautas de tratamiento antibiótico empírico recomendadas en las agudizaciones de la enfermedad pulmonar obstructiva crónica
| Severidad | Factores riesgo | Microorganismos | Antibióticos | Alternativa |
| FEV1 > 50% | Sin comorbilidad | H. influenzaeS. pneumoniaeM. catarrhalis | Amoxicilina-ácido clavulánico durante 7 díasa | Cefalosporinas 3.a generación oralesb durante 5-7 días |
| Con comorbilidad | H. influenzaeS. pneumoniaeEnterobacterias | Moxifloxacino o levofloxacino durante 5 días | Amoxicilina-ácido clavulánico durante 7 díasa | |
| FEV1 ≤ 50% | Sin riesgo de P. aeruginosa | |||
| Con riesgo de P. aeruginosa | Los mismos más P. aeruginosa | Levofloxacino o ciprofloxacino durante 10 días | Betalactámico activo frente a P. aeruginosac durante 10 días |
Modificada de Sociedad Española de Quimioterapia (SEQ); Sociedad Española de Neumología y Cirugía Torácica (SEPAR); Sociedad Española de Medicina de Urgencias y Emergencias (SEMES); Sociedad Española de Medicina General (SEMG); Sociedad Española de Medicina Rural y Generalista (SEMERGEN); Sociedad Española de Medicina Interna (SEMI)152.
No se recomienda el uso sistemático de metilxantinas en las AEPOC ya que no ejercen mayor efecto broncodilatador que los broncodilatadores de acción corta y su uso conlleva riesgo de importantes efectos secundarios1,2. Pueden ser usados en pacientes que no han tenido una respuesta favorable al tratamiento con otros fármacos broncodilatadores y siempre en el medio hospitalario154.
OxigenoterapiaEl objetivo de esta terapia es garantizar una adecuada oxigenación a los tejidos, por lo que se debe administrar en pacientes en AEPOC en situación de insuficiencia respiratoria.
Se recomienda su administración mediante mascarillas tipo Venturi ya que proporcionan una fracción inspiratoria de oxígeno estable. En general, se consigue con FiO2 entre el 24 y 28%, suficiente para alcanzar una PaO2 superior a 60mmHg o SpO2 superior a 92%.
Se recomienda realizar una nueva gasometría a los 30-60 min de instaurado el tratamiento, para valorar la situación del intercambio gaseoso, especialmente el grado de retención de CO2 y acidosis respiratoria. Esta valoración tiene que ser realizada mediante gasometría arterial en todos los casos. En caso de presentar depresión respiratoria se deberá evaluar al paciente para ver si procede ajustar la dosis de oxígeno o instaurar ventilación mecánica no invasiva.
En caso de que el paciente ya presente insuficiencia respiratoria crónica en fase estable, la administración de oxigenoterapia seguirá las mismas pautas, prestando especial atención al pH durante la evaluación.
Una vez el paciente esté más estable y el pH sea normal, la oxigenoterapia puede ser administrada con gafas nasales y controlarse mediante pulsioximetría.
Ventilación mecánica no invasivaLa ventilación mecánica no invasiva es una modalidad de soporte ventilatorio que ha demostrado mejorar la supervivencia, disminuir la estancia y reducir el número de intubaciones en los pacientes con AEPOC en situación de insuficiencia respiratoria global con acidosis respiratoria. Estos beneficios se han demostrado al aplicarse tanto en la UCI como en la planta de hospitalización convencional155.
Está indicada en pacientes con AEPOC severa que presenten insuficiencia respiratoria global con acidosis respiratoria a pesar de un tratamiento correcto156. La ventilación mecánica no invasiva no es un sustituto de la ventilación invasiva, por lo que está contraindicada si el paciente requiere esta última, salvo que se hayan desestimado maniobras de resucitación invasivas.
La modalidad más empleada es la ventilación a presión positiva limitada por 2 niveles de presión (BIPAP)157. Para su aplicación es necesario contar con los recursos materiales y humanos necesarios, siendo indispensable un personal con el conocimiento, el tiempo y la experiencia suficientes para garantizar su éxito y evitar sus complicaciones158.
Uno de los indicadores pronósticos más importantes es la respuesta a la misma durante las primeras horas159, por lo que es necesario establecer una adecuada monitorización que sea constante inicialmente y hacer un control gasométrico tras las primeras horas de ventilación.
Recomendaciones sobre tratamiento de la AEPOC:
- •
En el caso de AEPOC leves sin criterios de gravedad deben ser tratadas de forma ambulatoria como primera opción y reevaluados tras 48-72 h.
- •
En caso de ser ingresado por una AEPOC, el alta se puede considerar siempre que el paciente presente estabilidad clínica y gasométrica, sea capaz de manejar su enfermedad en el domicilio.
- •
Tras el alta el paciente deberá realizar controles estrechos por su dispositivo de atención primaria.
- •
La primera revisión por el neumólogo se hará como máximo a los 15 días tras el alta en pacientes con EPOC grave-muy grave, con frecuentes agudizaciones y/o reingresadores.
Recomendaciones sobre tratamiento farmacológico de la AEPOC:
- •
La primera opción farmacológica en la AEPOC debe ser la intensificación del tratamiento broncodilatador.
- •
Aunque no existe evidencia sobre la distinta eficacia de los fármacos broncodilatadores, por lo general, los ß2-agonistas de acción corta son los más usados por su rapidez de acción.
- •
Se recomienda asociar distintos broncodilatadores de acción corta en AEPOC con criterios de gravedad o con respuesta incompleta inicial.
- •
Los cartuchos presurizados con cámara espaciadora han demostrado ser igual de eficaces que la terapia nebulizada. Esta se recomienda en pacientes con criterios de gravedad, especialmente en aquellos muy taquipneicos.
- •
Los corticoides sistémicos se deben administrar a todos los pacientes con criterios de gravedad o con FEV1 < 50%. En la AEPOC leve/moderada se recomienda su uso si existe hiperreactividad bronquial o cuando la evolución inicial no es favorable. La dosis recomendada es 30-40 mg/día de prednisona o equivalente durante 7-10 días.
- •
No se recomienda el uso sistemático de metilxantinas en las AEPOC.
- •
No todas las AEPOC son de causa bacteriana y por tanto no tienen necesariamente que ser tratadas con antibióticos.
- •
Los antibióticos están indicados en aquellos pacientes que presenten la tríada de aumento de la disnea, aumento del volumen del esputo y purulencia del mismo, o bien en aquellos con 2 de estos síntomas, siempre que uno sea la purulencia del esputo. Además, también se administra en aquellas AEPOC graves que requieran ventilación mecánica.
- •
La elección del antibiótico se basará en la gravedad de la EPOC, la presencia de comorbilidades, los patrones de resistencia bacteriana de la zona, los efectos secundarios y el riesgo de participación de P. aeruginosa.
Recomendaciones sobre oxigenoterapia y ventilación no invasiva en la AEPOC:
- •
La oxigenoterapia se debe administrar en pacientes en AEPOC moderada-grave en situación de insuficiencia respiratoria.
- •
En la fase aguda, se recomienda su administración mediante mascarillas tipo Venturi ya que proporcionan una fracción inspiratoria de oxígeno estable.
- •
Una vez instaurada, se recomienda realizar una nueva gasometría a los 30-60 min de instaurado el tratamiento, para valorar la situación del intercambio gaseoso.
- •
La ventilación mecánica no invasiva está indicada en pacientes con AEPOC severa que presenten insuficiencia respiratoria global con acidosis respiratoria a pesar de un tratamiento correcto y que no presenten ninguna contraindicación.
- •
Para su aplicación es necesario contar con los recursos materiales y humanos necesarios, siendo indispensable un personal con el conocimiento, tiempo y experiencia suficientes para garantizar su éxito y evitar sus complicaciones.
- •
Es necesario establecer una adecuada monitorización que sea constante durante las primeras horas y hacer un control gasométrico tras las primeras horas de ventilación.
La atención y seguimiento de estos pacientes es una responsabilidad compartida entre atención primaria y neumología, siendo fundamental la comunicación y coordinación entre ambos niveles asistenciales (fig. 5). Siguiendo las recomendaciones de la Estrategia del Sistema Nacional de Salud se deben establecer programas coordinados entre atención primaria y especializada y otros centros y residencias para facilitar el manejo integral de la persona con EPOC (tratamiento, seguimiento, recuperación del paciente y en el final de la vida)160. Para ello sería conveniente la utilización de protocolos consensuados, en donde además del médico esté implicado el personal de enfermería participando con los planes de cuidados, para conseguir que se cumplan los objetivos del tratamiento de la EPOC (tabla 6). Estos protocolos deben incluir una evaluación multidimensional de la EPOC que incluya la exposición a factores de riesgo, pruebas a realizar, valoración de la progresión, evaluación de las complicaciones de la enfermedad, tratamientos farmacológicos y no farmacológicos, historia de agudizaciones y comorbilidades.
Relación entre neumología y atención primaria en el seguimiento de la EPOC. Modificada de SEPAR-ALAT2.
Las actividades en el seguimiento del paciente con EPOC quedan recogidas en la tabla 11. El seguimiento clínico del paciente con EPOC leve puede efectuarse correctamente en atención primaria, siendo recomendable consultar con el neumólogo para excluir otras enfermedades, reforzar el cese del hábito tabáquico, tratar las complicaciones, optimizar el tratamiento o para indicar tratamientos más complejos en pacientes con EPOC grave (tabla 12)2.
Actividades de seguimiento del paciente con enfermedad pulmonar obstructiva crónica
| Intervención para el cese del tabaquismoValorar la progresión de la clínica en situación estableValorar el número y la severidad de las agudizacionesRealizar intervenciones en educación sanitaria: Información de la enfermedad (paciente/familia) Consejo antitabaco y alcohol Técnica de inhalación Ejercicio y dieta adecuadosValoración del tratamiento, su cumplimentación, sus efectos secundarios e interaccionesValoración periódica de exploraciones complementariasValoración de la revisión del tratamiento incluyendo el farmacológico y no farmacológicoEstablecer las necesidades de vacunación y oxigenoterapia |
Recomendaciones de derivación desde atención primaria a neumología
| Diagnóstico inicial, salvo que haya disponibilidad de espirometría adecuada en atención primariaDudas en el diagnóstico y tratamientoMala respuesta al tratamientoEvaluación periódica de pacientes con enfermedad moderada-graveTratamiento del tabaquismo en pacientes con fracasos previosPresencia de cor pulmonaleIndicación de oxigenoterapia crónica domiciliariaPrescripción de rehabilitación respiratoriaPresencia de ampollas o enfisemaPacientes jóvenes con sospecha de déficit de alfa-1-antitripsinaValoración de incapacidad laboral y riesgo preoperatorioValoración de posibles tratamientos quirúrgicosDisnea desproporcionada en pacientes con enfermedad moderadaInfecciones bronquiales recurrentes y hemoptisisDescenso acelerado del FEV1 (> 50 ml/año)Realización de pruebas no accesibles en atención primaria |
No existen datos que nos permitan establecer un orden cronológico de pruebas complementarias y controles1. Se recomienda realizar al menos una valoración clínica y funcional anual a todos los pacientes con EPOC con objeto de evaluar la progresión de la enfermedad y valorar posibles cambios de tratamiento. Estos controles deberán ser más estrechos conforme la enfermedad vaya avanzando y aparezca mayor limitación por síntomas, más agudizaciones y deterioro de la función pulmonar. La periodicidad de las revisiones y las pruebas complementarias recomendadas están resumidas en la tabla 13. Además, la determinación de los volúmenes pulmonares y la capacidad de difusión deberán realizarse en la valoración del grado de enfisema.
Recomendaciones sobre seguimiento de los pacientes:
- •
La atención y el seguimiento de estos pacientes es una responsabilidad compartida entre atención primaria y neumología, siendo fundamental la comunicación y coordinación entre ambos niveles asistenciales.
- •
Se recomienda realizar al menos una valoración clínica y funcional anual a todos los pacientes con EPOC con objeto de evaluar la progresión de la enfermedad y valorar posibles cambios de tratamiento.
Recomendaciones para el seguimiento de los pacientes con enfermedad pulmonar obstructiva crónica
| EPOC leve | EPOC moderada | EPOC severa | |
| Visita | Anual | 6-12 meses | 3-6 meses |
| Espirometría | Anual | 6-12 meses | 6-12 meses |
| Gasometríaa o SpO2 | – | 6-12 meses | 6-12 meses |
| ECG | – | – | Anual |
| Prueba de marcha de los 6 min | – | – | Anual |
| Radiografía | – | Anual | Anual |
Recientemente se ha descrito una relación estrecha entre la afectación respiratoria de la EPOC con la afectación de diversa índole en otro órganos, así como su relación con otras enfermedades distintas, ya sean respiratorias o no (tabla 14). Por un lado, los diversos efectos asociados a la enfermedad que afectan a otros órganos se han denominado como efectos sistémicos. Entre estos efectos sistémicos figuran como más relevantes la pérdida de peso, la disfunción muscular, la osteoporosis, la depresión y la inflamación sistémica. Por otro lado, los pacientes con EPOC suelen ser mayores y frecuentemente presentan comorbilidades que también requieren atención médica y que a su vez influyen en la presentación clínica y el pronóstico de la enfermedad. Dichas comorbilidades aumentan el riesgo de hospitalización y mortalidad y el coste de la atención sanitaria, especialmente en los pacientes con EPOC más graves161. Las bases biológicas de la relación entre procesos tan diversos no son conocidas, pero se ha propuesto que un proceso inflamatorio sistémico podría ser el nexo de unión entre ellos162,163. Actualmente existen numerosas revisiones que abarcan las características de estas comorbilidades y efectos sistémicos164. Desde un punto de vista práctico, se recomienda que en la evaluación de los pacientes con EPOC se tengan en cuenta la presencia de otras enfermedades respiratorias y sistémicas que pueden influir en la presentación clínica o el pronóstico de la enfermedad, con objeto de administrar sus medidas de prevención y tratamientos correspondientes a cada especialidad médica.
Principales manifestaciones sistémicas y comorbilidades de los pacientes con enfermedad pulmonar obstructiva crónica
| Pérdida de masa muscularCaquexia: pérdida de masa libre de grasaCáncer de pulmónHipertensión pulmonarCardiopatía isquémica: disfunción endotelialInsuficiencia cardiaca congestivaOsteoporosisAnemia normocíticaDiabetesSíndrome metabólicoSíndrome de apnea obstructiva del sueñoDepresión |
Con la colaboración de Boehringer.
Autores (por orden alfabético de apellidos):
| Francisco Javier Álvarez Gutiérrez | Hospital Universitario Virgen del Rocío. Sevilla. |
| Manolo Arenas Gordillo | Hospital de Jerez. Jerez de la Frontera. Cádiz. |
| Aurelio Arnedillo Muñoz | Hospital Universitario Puerta del Mar. Cádiz. |
| Vidal Barchilón Cohen | Centro de Salud Rodríguez Arias. San Fernando. Cádiz. |
| Francisco Casas Maldonado | Hospital Universitario San Cecilio. Granada. |
| José Fernández Guerra | Hospital Costa del Sol. Marbella. Málaga. |
| Juan Sergio Fernández Ruiz | Centro de Salud de Armilla. Armilla. Granada. |
| Alberto González Jiménez | Centro de Salud de Dña. Mercedes de Dos Hermanas. Dos Hermanas. Sevilla. |
| Antonio Hidalgo Requena | Centro de Salud Lucena I. Lucena, Córdoba. |
| Manuel Jiménez de la Cruz | Centro de Salud Casería de Montijo. Granada. |
| José Luis López-Campos Bodineau | Hospital Universitario Virgen del Rocío. Sevilla. |
| Manuel Lubián López | Centro de Salud Rodríguez Arias. San Fernando. Cádiz. |
| Francisco Marín Sánchez | Hospital Universitario Virgen de la Victoria. Málaga. |
| Ana Morán Rodríguez | UGC-DCCU Cádiz-San Fernando. Distrito Bahía de Cádiz-La Janda. Cádiz. |
| Francisco Ortega Ruiz | Hospital Universitario Virgen del Rocío. Sevilla. |
| José Antonio Quintano Jiménez | Centro de Salud Lucena I. Lucena, Córdoba. |
| Josefa Rojas Villegas | Hospital de Jerez. Jerez de la Frontera. Cádiz. |
| Miguel Solís de Dios | Centro de Salud de Mairena del Aljarafe. Mairena del Aljarafe. Sevilla. |
| Gregorio Soto Campos | Hospital de Jerez. Jerez de la Frontera. Cádiz. |
| Cristobal Trillo Fernández | Centro de Salud Puerta Blanca. Málaga. |
Comité de Redacción
| Francisco Javier Álvarez Gutiérrez | Hospital Universitario Virgen del Rocío. Sevilla. |
| Vidal Barchilón Cohen | Centro de Salud Rodríguez Arias. San Fernando. Cádiz. |
| Francisco Casas Maldonado | Hospital Universitario San Cecilio. Granada. |
| Alberto González Jiménez | Centro de Salud de Dña. Mercedes de Dos Hermanas. Dos Hermanas. Sevilla. |
| Antonio Hidalgo Requena | Centro de Salud Lucena I. Lucena. Córdoba. |
| José Luis López-Campos Bodineau | Hospital Universitario Virgen del Rocío. Sevilla. |
| Ana Morán Rodríguez | UGC-DCCU Cádiz-San Fernando. Distrito Bahía de Cádiz-La Janda. Cádiz. |
| José Antonio Quintano Jiménez | Centro de Salud Lucena I. Lucena. Córdoba. |
| Cristóbal Trillo Fernández | Centro de Salud Puerta Blanca. Málaga. |
El listado de los miembros del grupo puede encontrarse en el Anexo 1 al final del artículo.