INTRODUCCION
La infección neumocócica es responsable de aproximadamente 70.000-80.000 muertes en los países de Europa Occidental y 40.000 en EE.UU. La incidencia de enfermedad invasora por Streptococcus pneumoniae en países desarrollados está alrededor de 30 casos por 100.000 habitantes y de 80 casos por 100.000 habitantes con edad igual o superior a 65 años1. A finales de los años 80, los Centros para el Control y Prevención de Enfermedades (CDC), el Comité Asesor sobre Prácticas de Inmunización (ACIP) de EE.UU. y la Oficina Regional para Europa de la Organización Mundial de la Salud (OMS) establecieron recomendaciones concretas para la vacunación de los mayores de 65 años y de los grupos considerados de alto riesgo de infección neumocócica. En 1997 se alcanzó en EE.UU. una cobertura vacunal del 45% en personas mayores de 65 años2,3. La vacunación antineumocócica de las personas mayores está recomendada en la mayoría de los países de la Unión Europea y en algunos de ellos como Alemania, Bélgica, Reino Unido, Suecia y ciertas regiones de Italia, se están realizando programas de vacunación específicos en ese grupo de población1. Actualmente en España hay 10 Comunidades Autónomas que tienen establecidos programas de vacunación antineumocócica de las personas mayores de 65 años.
Se debe aceptar que es improbable alcanzar niveles de eficacia global del 90% con la vacuna antineumocócica, que contiene 23 antígenos, cada uno de ellos con diferente capacidad inmunogénica e impacto sobre la prevención de la enfermedad. El cálculo de la eficacia agregada de la vacuna neumocócica se debería realizar mediante la multiplicación de la eficacia individual de cada uno de los 23 antígenos polisacáridos, ajustada por la frecuencia individual de infección de cada uno de los serotipos capsulares1. En la práctica, este cálculo nunca se ha llevado a cabo y, por esta razón, todavía en algunos foros se sigue debatiendo sobre la efectividad de la vacuna en la protección de los grupos de población para los que está indicada. Este artículo realiza una revisión de los ensayos clínicos, estudios experimentales no aleatorizados (cohortes y casos-controles), metaanálisis y de coste-efectividad más relevantes sobre este tema.
ENSAYOS CLINICOS CONTROLADOS
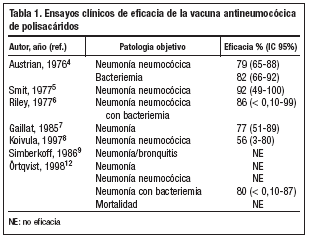
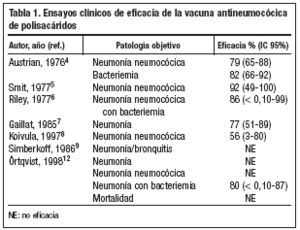
El primer ensayo clínico, doble ciego y controlado con placebo, en el que se evaluó la eficacia de una vacuna polisacarídica de 13 serotipos de S. pneumoniae en la prevención de neumonía y bacteriemia neumocócica, fue realizado en 1976 por Austrian et al4. Se incluyeron en el estudio 4.490 adultos jóvenes con riesgo de infección neumocócica. La eficacia de la vacuna en la prevención de bacteriemia y neumonía neumocócica por serotipos incluidos en la vacuna fue del 82% (intervalo de confianza [IC] 95%: 66-92) y del 78,5% (IC 95%: 65-88), respectivamente. Posteriormente, Smit et al, llevaron a cabo en 1977 un ensayo clínico controlado, que evaluó la eficacia de dos vacunas neumocócicas experimentales de polisacáridos purificados en la prevención de neumonía neumocócica5. La eficacia obtenida en la prevención de neumonía neumocócica fue del 76% (IC 95%: 65-88) para la vacuna de 6 serotipos y del 92% (IC 95%: 49-100) para la de 12 serotipos5. Ese mismo año, Riley et al realizaron un ensayo clínico, doble ciego y controlado con placebo, para evaluar la eficacia de una vacuna neumocócica de 14 polisacáridos en la prevención de neumonía, confirmada mediante aspirado pulmonar y hemocultivo6. La eficacia en la prevención de neumonía neumocócica con bacteriemia fue del 86% (IC 95%: < 0,10-99). El grupo vacunado presentó una reducción del 84% en la incidencia de neumonía confirmada y del 44% en la mortalidad por neumonía6. Gaillat et al, en un ensayo clínico aleatorizado y controlado para evaluar la eficacia de la vacuna neumocócica de 14 serotipos en la prevención de neumonía en personas mayores residentes en instituciones, encontraron una reducción significativa de la incidencia de neumonía en el grupo vacunado. La eficacia de la vacuna en la prevención de neumonía fue del 77% (IC 95%: 51-89)7.
Posteriormente, Koivula et al llevaron a cabo un ensayo clínico, aleatorizado y controlado, en el que se evaluó la eficacia de la vacuna para la prevención de neumonía en personas de 60 o más años8. Se incluyeron en el ensayo 2.837 personas, de los cuales un 47% tenían 70 o más años. Un 31% de los pacientes fueron clasificados como sujetos con "riesgo aumentado de infección neumocócica" (>=70 años de edad, enfermedad pulmonar, institucionalizados, etc.) y un 4% como de "alto riesgo" (cáncer, terapia inmunosupresora, etc.). La eficacia global en la prevención de la neumonía neumocócica en estos dos grupos de pacientes con mayor riesgo fue del 56% (IC 95%: 3-80). Simberkoff et al, realizaron en 1986 un ensayo clínico aleatorizado, doble ciego y controlado con placebo, para evaluar la eficacia de la vacuna neumocócica de 14 polisacáridos en la prevención de la infección neumocócica en pacientes de alto riesgo9. Durante el período de estudio, 36 pacientes en el grupo vacunado y 27 en el control desarrollaron episodios de neumonía neumocócica (confirmada o probable) o de bronquitis. No se demostró eficacia en la prevención de neumonía o bronquitis. El diseño del estudio fue criticado por distintos autores, ya que presentaba diferentes sesgos que impedían obtener conclusiones válidas sobre la eficacia de la vacuna3,10,11. El principal problema era la inclusión de bronquitis como objetivo principal; esta patología representó el 48% de las infecciones neumocócicas incluidas en el análisis final de los resultados. Además, el estudio solamente tenía un poder del 6% para detectar una eficacia del 65% en la prevención de bacteriemia por neumococo3,10,11.
Finalmente, Örtqvist et al, realizaron en 1998 un ensayo clínico aleatorizado, doble-ciego, controlado con placebo, para evaluar la eficacia protectora de la vacuna neumocócica de 23 polisacáridos en neumonía, neumonía neumocócica, neumonía neumocócica con bacteriemia y mortalidad12. Se incluyeron en el estudio un total de 693 pacientes, que habían sido previamente hospitalizados por neumonía adquirida en la comunidad. El riesgo relativo de neumonía neumocócica en el grupo placebo fue 0,78 (IC 95%: 0,4-1,5). Los autores concluyeron que la vacuna no era eficaz en la prevención de neumonía o neumonía neumocócica en sujetos de mediana edad o ancianos. Sin embargo, de los 35 casos de neumonía neumocócica "confirmada", que son el objeto fundamental de las conclusiones, solamente en 6 casos (5 en el grupo placebo) se confirmó el diagnóstico por hemocultivo13. En 8 casos el diagnóstico se realizó por análisis del esputo, técnica que carece de la suficiente sensibilidad y especificidad14. El resto de los pacientes (un total de 21) fueron diagnosticados mediante la respuesta de anticuerpos anti-neumolisina, método analítico que no estaba validado para confirmación del diagnóstico de neumonía neumocócica. Los reactivos fueron desarrollados por los propios investigadores, no habiendo datos disponibles sobre el control de calidad o sobre la capacidad para reproducir el ensayo15. Se presentó un caso de neumonía neumocócica con bacte-riemia en el grupo vacunado (incidencia de 100 casos/100.000 pacientes-año) en comparación con 5 casos en el grupo placebo (600 casos/100.000 pacientes-año), resultado que es consistente con otros estudios que demuestran una eficacia de la vacuna neumocócica de polisacáridos del 50%-70% en la prevención de la enfermedad invasora por neumococo. La tabla 1 presenta un resumen de los ensayos clínicos mencionados.
Metaanálisis
Se han publicado al menos 7 metaanálisis sobre la eficacia de la vacuna antineumocócica polisacarídica en adultos. El primero de ellos fue realizado por Fine et al en 1994, que incluyeron en el análisis solamente ensayos clínicos aleatorizados16. Los resultados indican que la eficacia en la prevención de neumonía neumocócica con bacteriemia y de neumonía neumocócica con bacteriemia por serotipos incluidos en la vacuna fue del 66% y del 83%, respectivamente16. Posteriormente, metaanálisis realizados por Moore (2000) y Cornu (2001) concluyeron que la vacunación reduce significativamente la incidencia de neumonía neumocócica con bacteriemia en adultos con bajo riesgo de infección neumocócica, pero que los ensayos clínicos no podían demostrar la eficacia en personas de alto riesgo (mayores de 55 años o con enfermedades crónicas)17,18. Sin embargo, Hutchinson et al concluyeron que no existía evidencia de que la vacunación fuera menos eficaz en personas mayores de 55 años, personas institucionalizadas o con enfermedades crónicas19. Para Watson et al (2002), la vacunación sería efectiva en la reducción de la mortalidad y de la neumonía de cualquier origen en países no industrializados, pero no en países industrializados20. Mientras Puig-Barberá et al (2002), concluyen que no existe evidencia de efectividad de la vacunación en la reducción de la enfermedad neumocócica en personas mayores de 55 años21. Finalmente, según Dear et al (2003) la vacunación parece no reducir la incidencia de neumonía o muerte en adultos o personas mayores de 55 años, pero los estudios no aleatorizados sugieren que la vacuna es efectiva en reducir la incidencia de enfermedad neumocócica invasora en adultos y personas mayores de 55 años22.
Es decir, múltiples metaanálisis, que incluirían prácticamente los mismos estudios originales, obtienen conclusiones muy diferentes y variadas. En general, el gran problema de los metaanálisis es la propia utilización que los investigadores hacen de los estudios publicados. El resultado final está altamente influenciado por los trabajos que se incluyen o excluyen, los criterios para su elección, cómo se agrupan estos estudios o cuáles son las variables de evaluación que se eligen. Existe un cierto consenso sobre los metaanálisis de ensayos clínicos (estudios prospectivos, controlados y aleatorizados), debido fundamentalmente a su homogeneidad metodológica. Sin embargo, no ocurre lo mismo para los estudios experimentales no aleatorizados, que pueden tener diferentes tipos de diseño. El consenso entre investigadores para su inclusión en el meta-análisis es menor, debido a las dificultades potenciales para valorar su calidad, la presencia de sesgos o el tipo de diseño. Por ejemplo, es difícil aceptar que un estudio caso-control se pueda combinar con un estudio de cohorte prospectivo o un estudio caso-control con controles poblacionales, con controles procedentes del ámbito hospitalario, o cohortes procedentes de diferentes países o distintos ámbitos sociológicos.
Estudios experimentales no aleatorizados (cohortes y casos-controles)
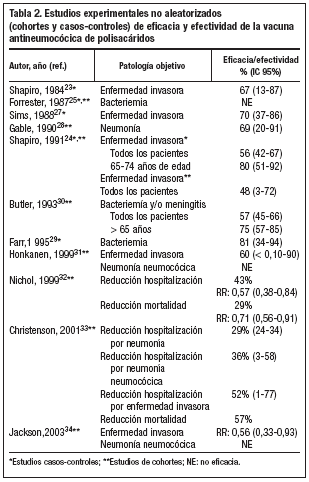
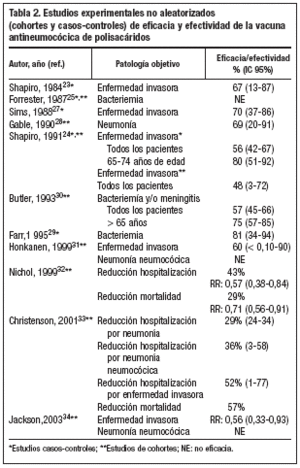
Shapiro et al realizaron en 1984 un estudio caso-control, que evaluó la efectividad de la vacuna neumocócica de 14 polisacáridos en la prevención de infección sistémica en adultos, con factores de riesgo para infección neumocócica23. Obtuvieron una efectividad del 67% (IC 95%: 13-87) en el total de la población estudiada y del 70% en el grupo de población de 55 o más años. Posteriormente, en 1991, este mismo grupo realizó otro estudio de casos y controles, en el que se evaluó la efectividad de dos vacunas neumocócicas de polisacáridos purificados (23 y 14 serotipos de S. pneumoniae) para la prevención de infección sistémica24. La efectividad frente a los serotipos incluidos en la vacuna (o relacionados con éstos) fue del 56% (IC 95%: 42-67). En el grupo de pacientes inmunocompetentes fue del 61% (IC 95%: 42-72) y en el de inmunodeprimidos del 21% (IC 95%: 55-60).Se observó que la efectividad disminuía en relación inversa a la edad de los pacientes y al tiempo transcurrido desde la vacunación. La efectividad en pacientes entre 65 y 74 años era del 71% (IC 95%: 30-88) a los 3-5 años de la vacunación y del 67% (IC 95%: 20-87) a los 2-3 años de la vacunación en pacientes entre 75 y 84 años24.
Forrester et al en un estudio caso-control, realizado en 1987, para evaluar la efectividad protectora de la vacuna neumocócica de 14 polisacáridos sobre la infección sistémica de pacientes adultos de alto riesgo, no encontraron efectividad frente a enfermedad invasora25. Según Spika y los CDC, este estudio presentaba ciertas limitaciones fundamentales, como el registro inadecuado del estado de vacunación de los pacientes incluidos o que los grupos estudiados (casos y controles) no eran homogéneos en relación con la gravedad de sus patologías concomitantes, que impedían la adecuada evaluación de la efectividad26. Un año mas tarde, Sims et al realizaron un estudio de casos y controles en el que encontraron una efectividad de la vacuna neumocócica frente a enfermedad invasora del 70% (IC 95%: 37-86)27. La efectividad en la prevención de neumonía en pacientes de 50 o más años con factores de riesgo de infección neumocócica, fue evaluada por Gable et al en un estudio de cohortes retrospectivo realizado en 199028. Los resultados de este estudio indican que la vacunación se asocia a una reducción significativa de la incidencia de neumonía y que la efectividad en la prevención de neumonía era del 69%28. Un diseño similar fue utilizado por Farr et al en su estudio (1995), que encontró una eficacia del 81% (IC 95%: 34-94) en la prevención de bacteriemia29.
Butler et al realizaron en 1993 un estudio de cohortes retrospectivo, utilizando el Sistema Nacional de Vigilancia de Enfermedad Neumocócica establecido por los CDC en 197830. Este estudio evaluó la eficacia de la vacuna neumocócica de polisacáridos (23 y 14 serotipos de S. pneumoniae) en la prevención de la infección sistémica, mediante el método de análisis de cohorte indirecto. Durante el período de estudio considerado (mayo/78 a abril/92), se incluyeron un total de 2.837 pacientes mayores de 5 años de edad con aislamiento de neumococo en sangre o líquido cefalorraquídeo. La efectividad global en la prevención de enfermedad invasora por serotipos incluidos en la vacuna fue del 57% (IC 95%: 45-66). En personas mayores de 65 años fue del 75% (IC 95%:57-85) y en pacientes con factores de riesgo (diabetes, enfermedad coronaria, insuficiencia cardíaca congestiva, enfermedad pulmonar crónica y asplenia) del 65% al 84%, dependiendo de la patología concomitante. Se observó que la efectividad no disminuía en relación con el tiempo desde la vacunación: era del 70% (IC 95%: 24-89) a los 5-8 años de la vacunación y del 80% (IC 95%: 16-95) cuando habían transcurrido 9 o más años30.
Honkanen et al realizaron un estudio de cohortes prospectivo, en el que se vacunó simultáneamente de gripe y neumocócica a 26.925 personas mayores de 65 años de edad (1999). No se demostró que la vacunación antineumocócica ofreciera protección adicional frente a neumonía. Sin embargo, sí que reducía la incidencia de enfermedad invasora, con una eficacia del 60% (IC 95%: -40-90)31. Los resultados del estudio de cohortes retrospectivo realizado por Nichol et al (1999), indican que la vacunación antineumocócica reduce un 43% las hospitalizaciones por neumonía y un 29% la mortalidad en pacientes con enfermedad pulmonar crónica. En los pacientes que recibieron las vacunas antigripal y neumocócica se observó una reducción del 72% en las hospitalizaciones por neumonía y gripe. La mortalidad se redujo en un 82%32.
Christenson, et al publicaron en 2001 el análisis de un programa de vacunación masivo frente a gripe y neumococo en personas mayores de 65 años, realizado en Estocolmo en 199833. Un total de 76.177 personas de este grupo de población recibió las dos vacunas y se llevó a cabo un seguimiento de 6 meses. Se observó en el grupo vacunado una disminución del 29% (IC 95%: 24-34) de las hospitalizaciones por neumonía de cualquier origen, del 36% (IC 95%: 3-58) de las hospitalizaciones por neumonía neumocócica y del 52% (IC 95%: 1-77) de las hospitalizaciones por enfermedad neumocócica invasora. La mortalidad global en vacunados fue un 57% (IC 95%: 55-60) menor que en no vacunados33. Finalmente, Jackson et al publicaron en 2003 un estudio de cohortes retrospectivo, en el que se evaluó un total de 47.365 personas mayores de 65 años, durante un período de 3 años. La vacunación no modificó el riesgo de neumonía, sin embargo, sí se asoció a una reducción significativa del riesgo de bacteriemia neumocócica (razón de riesgo 0,56; IC 95%: 0,33-0,93)34. La tabla 2 muestra un resumen de los estudios experimentales no aleatorizados mencionados en este apartado.
Coste-efectividad
Diferentes estudios realizados en EE.UU. demostraron que la vacunación antineumocócica presenta una aceptable relación coste-efectividad35-37. Willems en el análisis realizado en 1978 obtuvo una razón coste-efectividad de 1.700 dólares por año de vida ganado ajustado por calidad (AVAC)35. Posteriormente, Sisk en 1983 calculó un coste de 6.200 dólares por AVAC, y Gable en 1990 obtuvo una razón beneficio-coste de 3,628,36. Los resultados de un estudio de Sisk en 1997, que analizó la relación coste-efectividad de la vacuna en la prevención de los episodios de bacteriemia neumocócica, indican que incluso considerando las suposiciones más desfavorables respecto a la vacunación, el coste por AVAC oscilaría entre 35.822 dólares en el grupo de edad de 65-74 años y 598.487 dólares en las personas de 85 o más años38. Además, la disminución en el número de ingresos hospitalarios asociados a la prevención de la bacteriemia, representaba cerca de 20 dólares sobre el total de la reducción de los costes médicos por persona vacunada38. Los autores de este trabajo concluyen que la vacunación de las personas mayores frente al neumococo, es una de las intervenciones sanitarias que han demostrado ser coste-eficientes38. Un estudio realizado en 5 países de la Unión Europea, incluyendo España, demostró que incluso considerando niveles teóricos de efectividad bajos, la vacunación era coste-efectiva en la prevención de la enfermedad neumocócica invasora39. Los resultados de tres estudios de coste-efectividad realizados en España concluyen que la vacunación neumocócica es coste-efectiva en las personas de 65 o más años de edad40.
CONCLUSIONES
La vacuna frente al neumococo 23 polivalente ha evidenciado una efectividad y una evaluación económica positiva en los mayores de 65 años, por lo que, en nuestra opinión, debe recomendarse a toda persona con factores de riesgo (independientemente de la edad) y a los mayores de 65 años con o sin factores de riesgo.
Las personas menores de 65 años deben recibir una dosis transcurridos 5 años de la primera.
Siguiendo a Nichol32 la vacunación frente al neumococo al mismo tiempo que frente a la gripe (durante la campaña correspondiente) supone un incremento considerable de beneficios para los vacunados.