El tratamiento antineoplásico está experimentando una importante evolución debido al auge de la inmunoterapia, lo que se traduce en un constante cambio en el paradigma del abordaje tumoral. La inmunoterapia en algunos tumores es un tratamiento de primera elección y ha permitido cambiar drásticamente el pronóstico de muchos de ellos. Presenta unos efectos adversos muy específicos, derivados de la inhibición de los mecanismos de control de la respuesta inmune. El espectro de toxicidades es complejo y muy diferente al de la quimioterapia convencional. Esto implica que deban ser conocidas por los diversos profesionales de los diferentes niveles asistenciales que potencialmente pueden atender a los pacientes oncológicos. Se requiere de un enfoque multidisciplinar y coordinado que permita diagnósticos y tratamientos precoces de las mismas, representando un claro ejemplo de la imprescindible continuidad asistencial, en la que la Atención Primaria posee un papel central.
Antineoplastic treatment is increasingly being used due to the boom in immunotherapy, which translates into a constant change in the paradigm of the tumour approach. Immunotherapy in some tumours is a first line therapy and has drastically changed the prognosis of many of them. It has some very specific adverse effects, arising from the inhibition of the mechanisms of control of the immune response. The spectrum of toxicities is complex, and very different from that of conventional chemotherapy. This implies that these must be known by the various professionals of the different levels of care that can potentially provide care to cancer patients. A multidisciplinary and coordinated approach is required to enable them to be diagnosed and treated early, representing a clear example of the essential continuity of care, in which Primary Care plays a key role.
En marzo de 2011 se autorizó la comercialización de ipilimumab, el primer fármaco inhibidor del punto de control inmune (en inglés, immune check-point inhibitors), iniciando desde entonces una verdadera revolución en el ámbito de la terapia antineoplásica, con la sucesiva incorporación de nuevos principios activos y la aprobación de las cada vez más numerosas indicaciones de los mismos (tratamiento del melanoma, cáncer de pulmón, cáncer renal, urotelial y linfoma de Hodgkin, entre otros), ya sea en monoterapia o asociados a quimioterapia.
Este cambio en el paradigma del tratamiento oncológico implica aumentos de supervivencias hasta la fecha no alcanzados con la quimioterapia, unos perfiles de respuestas distintos en magnitud y en tiempo y unos perfiles de toxicidades completamente diferentes.
Estos fármacos son anticuerpos dirigidos contra la proteína linfocitaria CTLA-4 como ipilimumab, el receptor de muerte programada (programmed death-1 [PD-1]) como nivolumab y pembrolizumab y su ligando PD-L1: atezolizumab y durvalumab, respectivamente.
Se trata de sistemas de autocontrol de nuestro sistema inmune que son activados anormalmente por las células tumorales para evadirlo. Estas nuevas terapias reactivan la respuesta inmune contra las células tumorales, pero también pueden desencadenar una gran cantidad de efectos adversos inmunorrelacionados.
Desde el punto de vista fisiopatológico se cree que estos se relacionan con procesos de infiltración de tejidos sanos por linfocitos T, como un fenómeno de autoinmunidad. El tiempo de aparición de estos efectos suele seguir un patrón habitual, aunque todas las toxicidades pueden darse en cualquier momento, incluso una vez retirado el tratamiento.
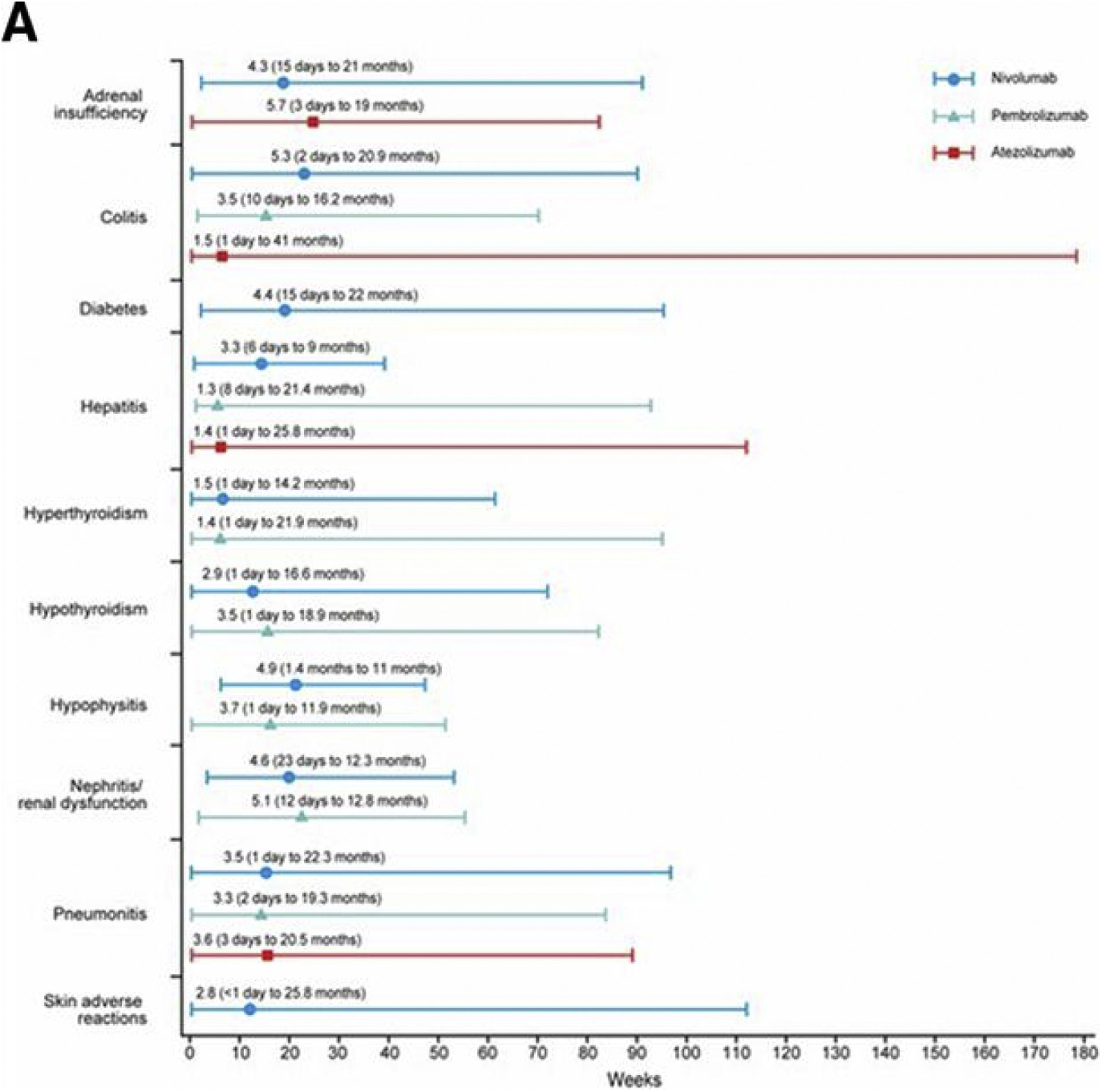
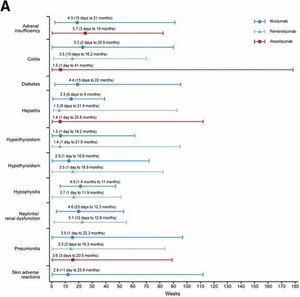
Según el momento de presentación podemos clasificarlos como tempranos (tiempo de inicio menor de 2 meses) y tardíos (posterior a 2 meses). Entre las toxicidades tempranas se encuentran la dermatológica y la gastrointestinal, y entre las tardías se incluyen las endocrinas, las musculoesqueléticas y las pulmonares, entre otras (fig. 1).
Tiempos promedios (meses) de aparición de efectos adversos inmunomediados en pacientes tratados con inhibidores PD-1/PD-L1. Fuente: Daniels et al.14.
En lo que se refiere al perfil de toxicidades de los diversos inmunoterápicos, la incidencia de eventos adversos generales fue comparable entre los inhibidores de PD-1 y de PD-L11. En comparación, en los pacientes tratados con anti-CTLA-4 se observa un mayor riesgo de diarrea y colitis inmunomediada2.
La complejidad de los efectos adversos inmunorrelacionados requiere un abordaje multidisciplinar para poder instaurar, si es necesario, un tratamiento de dichas toxicidades a la mayor brevedad posible. Diagnosticar tardíamente estos efectos adversos podría empeorar el pronóstico e incluso ser potencialmente fatal. Cuando aparece un nuevo síntoma deberemos siempre considerar 3 posibles escenarios: progresión de la neoplasia, una enfermedad intercurrente o una toxicidad secundaria al tratamiento.
Implica que estas nuevas toxicidades deben ser conocidas en todos los ámbitos asistenciales3 a los que un paciente pueda acudir, de modo que se pueda lograr la necesaria coordinación entre los mismos. Asimismo, se deberá instruir adecuadamente a los pacientes y cuidadores para poder reconocer y reportar cualquier síntoma que pudiese permitir una detección precoz de las mismas.
Por todo ello creemos imprescindible que los facultativos de Atención Primaria se familiaricen con estas nuevas terapias y con las mencionadas toxicidades, lo cual es el objeto de esta publicación.
Desarrollo del problemaSe han publicado recientemente diversas guías4-6 para el manejo de las toxicidades ocasionadas por estos fármacos inmunoterápicos, a partir de las cuales describiremos las más relevantes.
Toxicidad dermatológicaA nivel dermatológico destacan el rash maculopapular, el prurito y la dermatitis bullosa. Las dos primeras aparecen en el 4-22% de pacientes tratados con inmunoterapia3.
Rash maculopapularHabitualmente afecta al tronco superior y se puede acompañar de prurito6. Se establecen 3 grados con sus propias recomendaciones6:
- •
Leve (afecta <10% de superficie corporal): se trata con corticoides tópicos de potencia moderada, antihistamínicos orales y emolientes.
- •
Moderado (afectación del 10-30%): se trata con corticoides tópicos de potencia alta, prednisona 0,5-1mg/kg/día, antihistamínicos orales y emolientes.
- •
Grave (>30% de superficie corporal): manejo idéntico a la moderada añadiendo la necesidad de consulta urgente con el dermatólogo4.
Las pautas de prednisona deben mantenerse hasta que al menos la toxicidad disminuya a grado leve para posteriormente efectuar una retirada gradual en 4 semanas.
PruritoLas recomendaciones son las siguientes5:
- •
Leve: corticoides tópicos de alta potencia.
- •
Moderado: añadir a lo anterior antihistamínicos orales.
- •
Severo: iniciar prednisona 0,5-1mg/kg/día e incluso agonistas gabaérgicos como la gabapentina y la pregabalina.
Las recomendaciones son las siguientes:
- •
Leve (afectación <10% superficie corporal): corticoides tópicos de alta potencia.
- •
Moderada y grave (afectación 10-30% y >30% superficie corporal, respectivamente): prednisona 0,5-1mg/kg/día y derivación urgente para evaluación dermatológica.
Dentro de la toxicidad gastrointestinal destacan la diarrea (7-19%) y la colitis (1-3%)3, que puede manifestarse acompañada de dolor abdominal, presencia de sangre o mucosidad en las heces y fiebre en ocasiones.
La diarrea se clasifica como:
- •
Leve (<4 deposiciones diarias y ausencia de síntomas de colitis): se trata con loperamida e hidratación, junto con un seguimiento estricto del paciente.
- •
Moderada (4-6 deposiciones diarias o presencia de síntomas de colitis): se recomienda iniciar metilprednisolona intravenosa (i.v.) 1mg/kg/día e interrumpir el tratamiento.
- •
Grave (>6 deposiciones diarias y síntomas de colitis asociados): se utilizan las recomendaciones para la diarrea moderada y se valora el ingreso hospitalario para un adecuado tratamiento de soporte.
A nivel endocrinológico, la inmunoterapia puede dar lugar a alteraciones tiroideas y al desarrollo de diabetes mellitus tipo 1.
Dentro de las alteraciones tiroideas podemos encontrarnos con cuadros de hipo- o hipertiroidismo, con unas incidencias del 3,9-13,2% y del 0,6-8%, respectivamente, según un reciente metaanálisis7.
En el hipotiroidismo se recomienda determinar la TSH y la T4 cada 4-6 semanas5,6 para su monitorización. En pacientes con valores de TSH<10mU/l y asintomáticos se recomienda únicamente mantener la monitorización. En el caso de pacientes con cifras de TSH>10mU/l y valores de T4 normales se recomienda valorar el empleo de levotiroxina a dosis de 50-100μg/kg en caso de presencia de síntomas6 y derivación a Endocrinología.
En el hipertiroidismo, en el caso de pacientes asintomáticos o con sintomatología leve, el tratamiento se puede continuar, pero con un seguimiento más estrecho de la función tiroidea6 (cada 2-3 semanas). En pacientes con sintomatología moderada se debe valorar, además, la interrupción del tratamiento hasta desaparición de la sintomatología, el empleo de betabloqueantes y derivación a Endocrinología.
Pueden darse casos de tiroiditis transitoria que en un plazo de 2 semanas se resuelva normalizándose la función tiroidea o dando lugar a un hipotiroidismo primario.
Cuando hablamos de la diabetes mellitus tipo 1 como efecto adverso es infrecuente3 (1-2%), pero puede dar lugar a cuadros severos si no se instaura un tratamiento adecuado con insulina. Una vez diagnosticada se recomienda la derivación a una unidad de diabetes para su seguimiento.
Si se detecta una hiperglucemia en ayunas de inicio <200mg/dl y/o antecedentes de diabetes tipo 2 sin presencia de rasgos cetoacidóticos, el tratamiento inmunoterápico puede continuarse, asociado a un seguimiento de las glucemias en el que se incluya la HbA1c.
En caso de evidenciar glucemias en ayunas >250mg/dl, si no hay antecedentes, habría que considerar el diagnóstico de diabetes tipo 1 inducida por el tratamiento y derivar al hospital de referencia si hay evidencia de cetoacidosis. En este caso el tratamiento debe discontinuarse. En cualquiera de estas situaciones es indispensable tener en cuenta la hiperglucemia inducida por corticosteroides5, cuyo empleo es frecuente en el tratamiento de soporte en pacientes oncológicos.
Toxicidad pulmonarA nivel pulmonar está descrita la aparición de cuadros de neumonitis, un efecto adverso poco frecuente (prevalencia del 5%, según las series8) pero que puede tener consecuencias fatales. La neumonitis se diagnostica excluyendo otras etiologías como la infecciosa o complicaciones derivadas de la propia enfermedad oncológica. La sintomatología es inespecífica, manifestándose con disnea y tos. Cualquier síntoma respiratorio debería motivar una evaluación exhaustiva para descartar esta toxicidad pulmonar, dado que se han descrito cuadros con desenlace fatal4. Esta debe incluir una radiografía de tórax, una tomografía axial computarizada y pulsioximetría. Opcionalmente pueden considerarse estudios microbiológicos6.
Desde el punto de vista radiológico no existe un patrón característico de la neumonitis asociada a la inmunoterapia ya que puede manifestarse con un patrón en vidrio deslustrado, de neumonía organizada criptogénica o de tipo intersticial4.
Toxicidad musculoesqueléticaLa inmunoterapia también tiene efectos adversos a nivel musculoesquelético9, como la artritis inflamatoria (caracterizada por dolor articular, rigidez e inflamación tras inactividad o síntomas matutinos que duran más de 30 minutos), la miositis y el síndrome polimialgia-like. La prevalencia de artralgia y mialgia según una reciente revisión9 en ensayos clínicos varió entre el 1-43% y el 2-20%, respectivamente. El tiempo de aparición de estos eventos varía según los diferentes estudios publicados, pero suele ser una toxicidad tardía.
Para las manifestaciones artríticas se recomienda una evaluación reumatológica completa y examen de las articulaciones periféricas, así como pruebas de imagen para descartar metástasis óseas. De igual modo, se debe considerar la determinación de pruebas de laboratorio específicas, como anticuerpos antinucleares, factor reumatoide, anticuerpos antipéptido citrulinado cíclico y marcadores de inflamación como la velocidad de sedimentación globular y la proteína C reactiva6. Se recomienda la derivación para evaluación por Reumatología en caso de sinovitis o sintomatología persistente por más de 4 semanas.
En casos de artralgias leves se recomienda iniciar tratamiento con antiinflamatorios no esteroideos, pero no sería preciso interrumpir el tratamiento5. En caso de no obtener mejoría, se debe considerar el tratamiento con corticoides (10-20mg/día de prednisona). En los cuadros severos se debe remitir para valoración por Reumatología e iniciar prednisona a dosis de 1mg/kg/día.
En el caso de mialgias5 o síntomas de miositis leves (debilidad muscular) se procederá como en el caso anterior, con la recomendación de determinar de manera seriada la creatina-cinasa hasta que los síntomas se hayan resuelto.
Toxicidad neurológicaA nivel neurológico, aunque con una incidencia baja del 2,8%10, el espectro de toxicidades es bastante amplio e incluye, entre otras: miastenia gravis, síndrome de Guillain-Barré, neuropatía periférica, neuropatía autonómica, meningitis aséptica, encefalitis y mielitis transversa.
La miastenia gravis se manifiesta como debilidad muscular y con frecuencia se acompaña de manifestaciones oculares tipo ptosis o visión doble y otros signos como disfagia, disartria y debilidad muscular facial.
En su manejo se recomienda suspender la inmunoterapia hasta la desaparición de los síntomas, administrar corticosteroides (prednisona 1-1,5mg/kg/día por vía oral)6 y derivación para valoración por Neurología.
En el síndrome de Guillain-Barré el manejo consiste en la interrupción del tratamiento y el ingreso hospitalario6. Se recomienda la administración de inmunoglobulinas i.v. en pauta de 0,4g/kg/día durante 5 días.
En cuanto a la neuropatía periférica, esta puede manifestarse como déficit sensorial, motor o mixto, neuropatías craneales (parálisis de Bell), parestesias, hipo- o arreflexia y ataxia sensorial. Se deben descartar otras causas de neuropatía, como diabetes, déficits de vitamina B12 y ácido fólico, entre otras6.
En casos leves6 que no interfieren con la funcionalidad ni las actividades de la vida diaria se puede mantener el tratamiento. En casos moderados con interferencia en la vida diaria y funcional del paciente, se recomienda interrumpir temporalmente el tratamiento y valorar el empleo de prednisona en dosis de 0,5-1mg/kg e instaurar tratamiento con gabapentina, pregabalina o duloxetina para el dolor. En cuadros severos con limitación para el autocuidado, la deambulación e incluso síntomas respiratorios, se recomienda suspender el tratamiento, iniciar metilprednisolona i.v. 2-4mg/kg y el ingreso para su seguimiento por Neurología.
La neuropatía autonómica puede manifestarse con síntomas como estreñimiento severo, náuseas, problemas urinarios, sudoración, reacción pupilar lenta o hipotensión ortostática.
En casos leves, se puede mantener el tratamiento6. En casos moderados, se recomienda interrumpir el tratamiento, valorar el inicio de prednisona en dosis de 0,5-1mg/kg y derivación para evaluación por especialista de Neurología. En casos severos se recomienda la suspensión definitiva de la inmunoterapia, el inicio de metilprednisolona 1g/día durante 3 días, seguido de una retirada gradual mediante esteroides orales y la valoración por el especialista de Neurología.
Como toxicidad está descrita la meningitis aséptica6 y en este caso se debe interrumpir el tratamiento y valorar el inicio de tratamiento antiviral y antibacteriano empírico hasta obtener resultados del examen del líquido cefalorraquídeo. Una vez descartada la etología infecciosa, se debe considerar el tratamiento con prednisona oral 0,5-1mg/kg o metilprednisolona i.v. 1mg/kg si los síntomas son moderados/graves.
En la encefalitis6, al igual que en la meningitis aséptica, es necesario excluir las causas infecciosas, especialmente las virales (virus del herpes simple). Como sintomatología que orienta el diagnóstico destacan la confusión, la disminución del nivel de conciencia y la debilidad focal, entre otros. Se recomienda interrumpir el tratamiento y, si los síntomas son severos o progresivos, se debe valorar el empleo de metilprednisolona i.v. 1g/día durante 3-5 días asociado a inmunoglobulinas i.v. en pauta de 2g/kg durante 5 días. Como en las situaciones anteriormente expuestas, se debe ingresar el paciente para seguimiento por Neurología.
La mielitis transversa6 se caracteriza por un cuadro de debilidad aguda o subaguda o cambios sensoriales bilaterales, a menudo con reflejos tendinosos profundos aumentados. Las recomendaciones en su manejo son idénticas a las mencionadas en la encefalitis.
Toxicidad cardiovascularTambién se han descrito efectos adversos a nivel cardiovascular, incluso en ausencia de factores de riesgo. De acuerdo con un estudio multicéntrico reciente11, la prevalencia observada es del 1% y el tiempo medio de aparición es de 34 días. Esto puede dificultar la consideración de estos tratamientos dentro de los posibles agentes causales durante la evaluación inicial del paciente, lo que podría tener consecuencias fatales. Se puede manifestar como miocarditis, pericarditis, arritmias y disfunción ventricular con insuficiencia cardíaca.
En el manejo6 de estas toxicidades se recomienda suspender definitivamente la inmunoterapia y el inicio precoz de corticosteroides a dosis altas (1-2mg/kg de prednisona vía oral o intravenosa, según los síntomas). En caso de aparecer elevación de troponinas y/o alteraciones de la conducción, se debe ingresar al paciente en una unidad coronaria para un seguimiento estricto.
Toxicidad ocularPueden darse fenómenos de toxicidad ocular caracterizada por visión borrosa, alteraciones en la visión del color, fotofobia, escotomas, dolor asociado al movimiento de los ojos, visión doble, proptosis, sequedad ocular, uveítis e hinchazón palpebral. La sequedad ocular y uveítis son los síntomas más frecuentemente reportados5, con una incidencia variable del 1-24% según las diversas publicaciones12.
En la evaluación y seguimiento de este tipo de toxicidad se requiere la colaboración del especialista de Oftalmología para poder instaurar un tratamiento adecuado a la mayor brevedad5.
En el caso concreto de la uveítis y epiescleritis se establecen las siguientes directrices6: para los cuadros leves (asintomáticos) se puede mantener la inmunoterapia y se recomienda consultar a Oftalmología. En cambio, para los cuadros moderados y graves se recomienda suspender temporalmente el tratamiento hasta la evaluación por Oftalmología y el empleo de corticosteroides tópicos, agentes ciclopléjicos, y corticosteroides sistémicos5.
El tratamiento se puede reanudar una vez que los corticoides sistémicos se han podido retirar. Los corticoides tópicos son compatibles con la reanudación del tratamiento para tratar sintomatología local6.
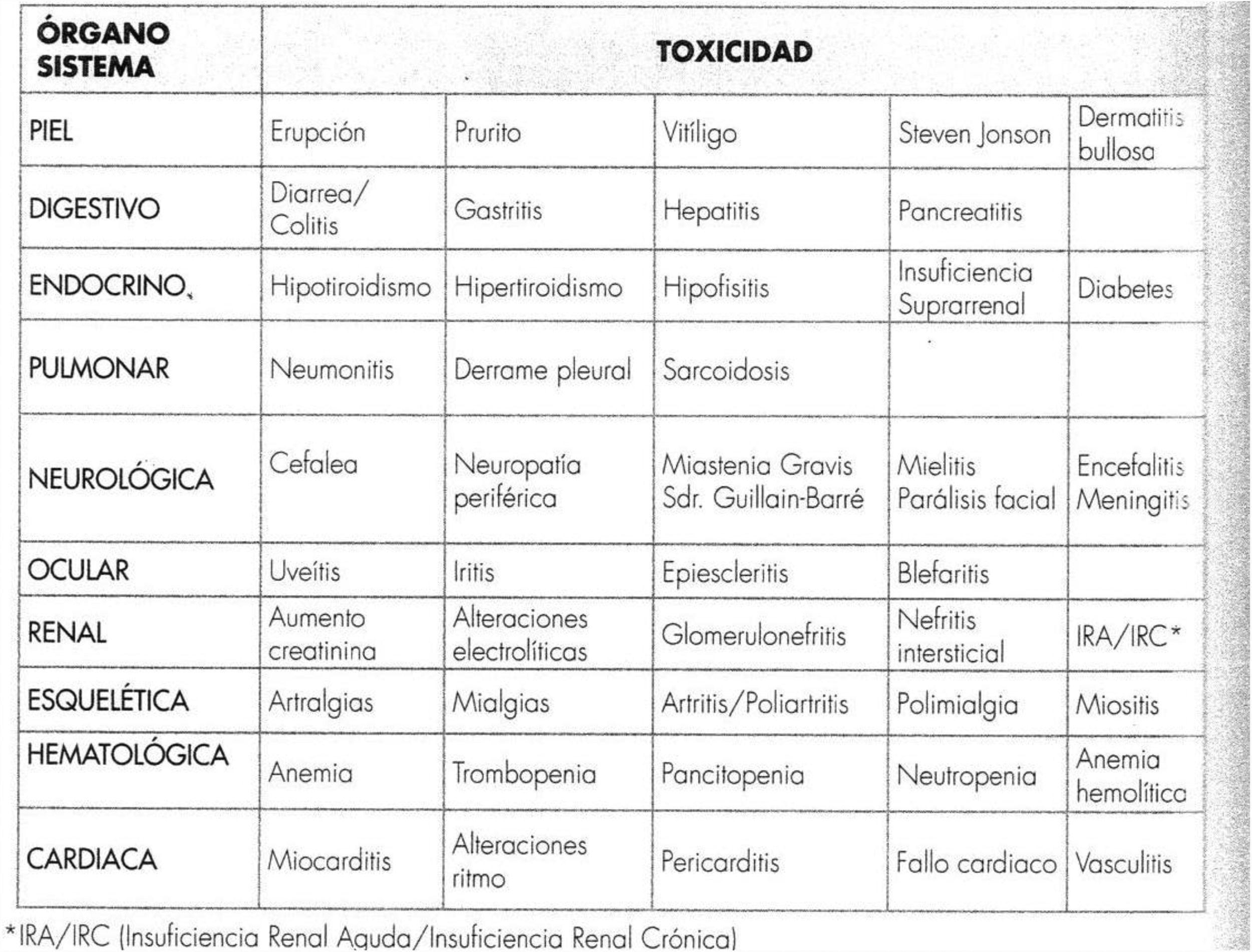
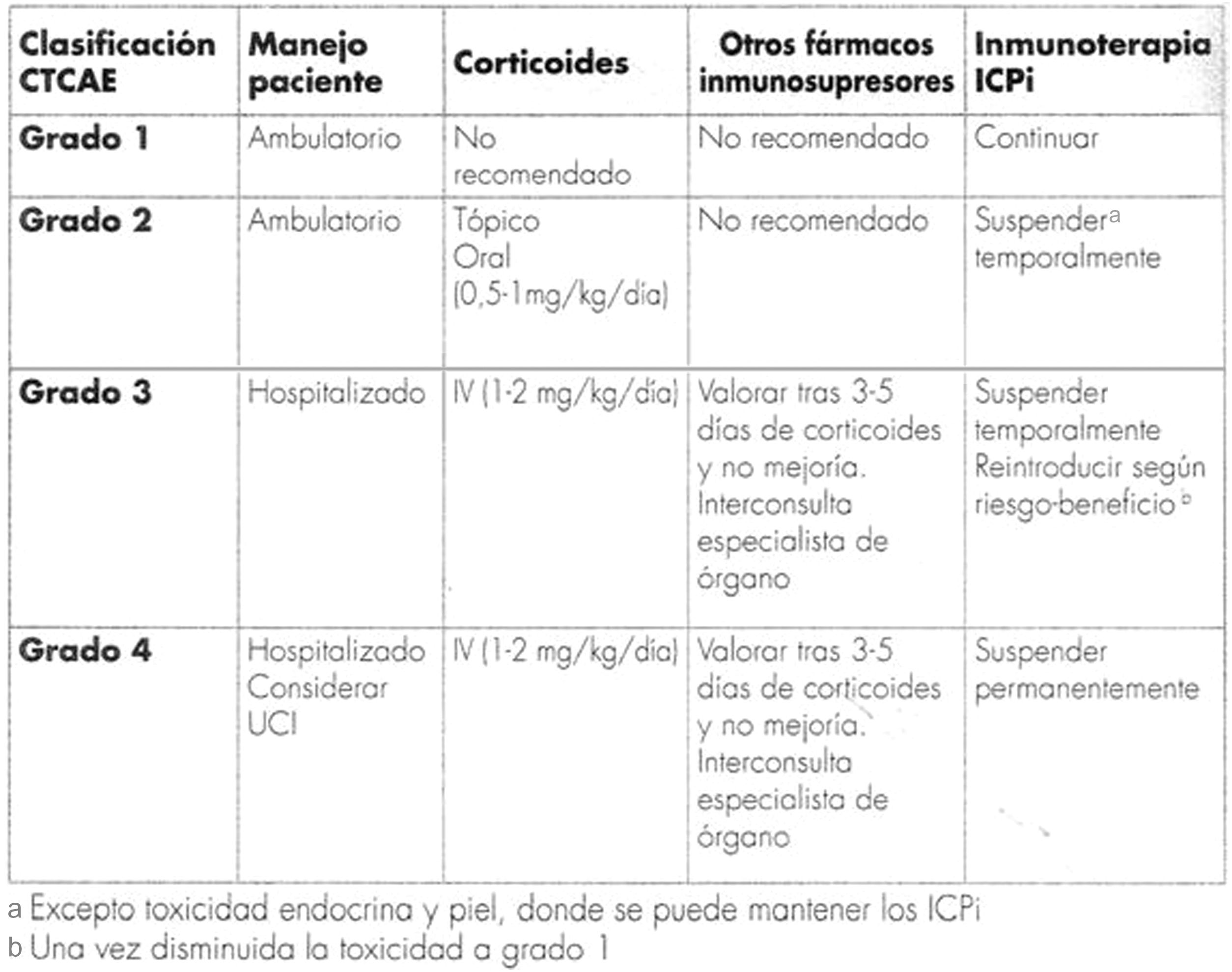
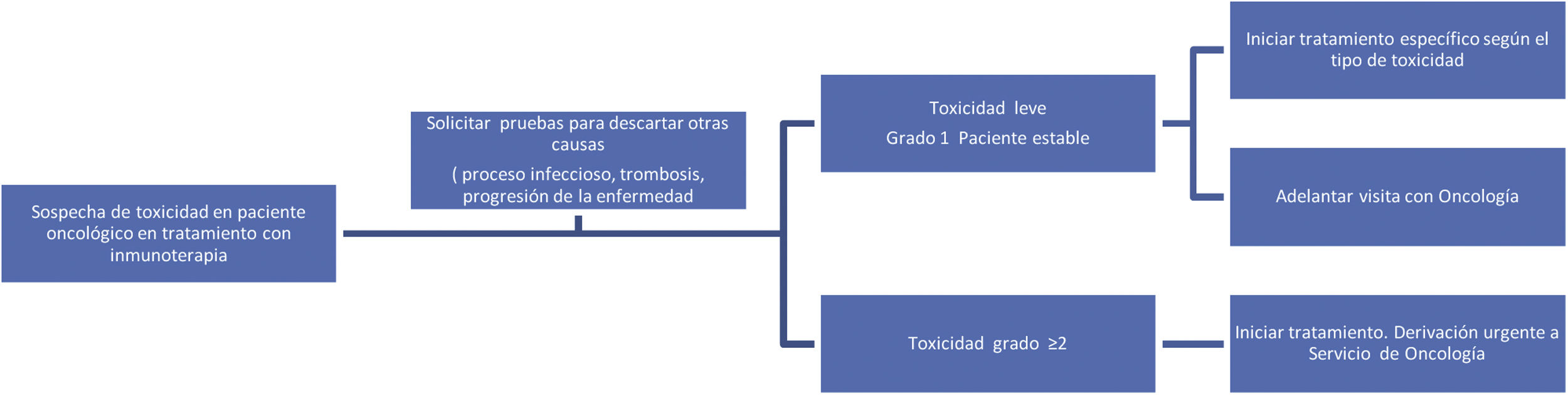
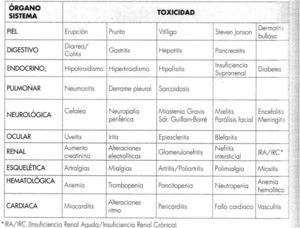
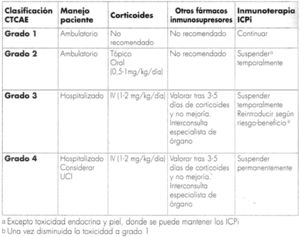
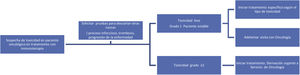
A modo de resumen, en las figuras 2-4, respectivamente, se muestra un esquema de las toxicidades por órganos y sistemas y su manejo en función del grado en que se manifiesten, así como un posible algoritmo para su manejo.
Resumen de toxicidades según órganos y sistemas.
Fuente: Tomado de Antón5. Reproducido con autorización del editor.
El tratamiento mediante inmunoterapia supone un cambio en el paradigma de tratamiento de enfermedades oncohematológicas que comporta un nuevo espectro de toxicidades muy diferentes a las de la quimioterapia convencional. Este nuevo escenario implica necesariamente un cambio en el enfoque tradicional de estas patologías, articulado en niveles asistenciales diferenciados e independientes.
El manejo de estas toxicidades inmunorrelacionadas requiere un abordaje basado en la coordinación de los diversos servicios y ámbitos asistenciales implicados en la asistencia a estos pacientes, dada su potencial complejidad. Champiat et al.13 proponen una estrategia basada en 5 pilares: prevención, anticipación, detección, tratamiento y seguimiento, alguno de los cuales detallaremos a continuación.
En lo que se refiere a la prevención señalan como aspectos claves el conocer estas toxicidades e identificar posibles factores de riesgo (como los antecedentes de enfermedades autoinmunes), además de proporcionar al paciente y familiares una adecuada información escrita sobre las mismas. Incluso mencionan la posibilidad de entregar al paciente una tarjeta identificativa para mostrar cada vez que precise atención por un problema de salud.
En cuanto a la detección13, aspectos como conocer los síntomas y signos de alerta son claves en el diagnóstico diferencial y para evitar demoras en la instauración del tratamiento inmunosupresor a la mayor brevedad. En este manejo es imprescindible la interconsulta con diversos especialistas en función de los órganos y sistemas afectados por las toxicidades.
Todo lo expuesto anteriormente nos lleva al terreno de la continuidad asistencial basada en una coordinación eficiente entre los servicios de Oncología Médica y Atención Primaria.
En este sentido, creemos que sería recomendable que a nivel de la historia clínica de Atención Primaria constase algún tipo de advertencia, como sucede por ejemplo en el caso de alergias o ciertos antecedentes epidemiológicos. Todo ello mientras no se disponga de una adecuada integración en una aplicación informática única de todos los procesos asistenciales, de modo que todas las anotaciones y prescripciones estén unificadas mediante una plataforma informática que permita una visión global de dichos registros.
En esta continuidad, los profesionales de Atención Primaria tienen un papel central en la coordinación del proceso asistencial y por ser en muchas ocasiones la primera referencia para el paciente en cuestiones de salud a nivel de consultas de Medicina de Familia o Urgencias.
Estos profesionales deben formar un equipo multidisciplinar junto con los distintos profesionales de Oncología, Farmacia y otros servicios que puedan contribuir a la prevención, detección y manejo de estas toxicidades.
FinanciaciónLa presente investigación no ha recibido ninguna beca específica de agencias de los sectores público, comercial, o sin ánimo de lucro.
Conflicto de interesesNingún conflicto de intereses.