El foramen oval permeable es la causa más prevalente de ictus criptogénicos en menores de 60 años. Habitualmente cursa de forma asintomática, aunque presenta un alto riesgo de producir embolismo paradójico, y por ello, ictus con resultados indeterminados. Su estudio se debe iniciar en función de la sospecha clínica, e incluye una valoración multidisciplinar y una determinación del tipo de tratamiento a realizar. Las posibilidades terapéuticas van desde el tratamiento conservador (tratamiento antitrombótico indefinido), al cierre percutáneo del mismo (actualmente el más utilizado). Su objetivo primordial es disminuir el número de recidivas de ictus. El tratamiento conservador se reservará para aquellos casos de bajo riesgo embolígeno. La valoración del riesgo debe ser individualizada, basándose fundamentalmente en las características anatómicas del foramen oval permeable y en la clínica del paciente. La utilización de la escala de riesgo The Risk of Paradoxical Embolism será una herramienta a tener en cuenta.
Patent foramen ovale (FOP) is the most prevalent cause of cryptogenic strokes in people under 60 years old. Although it is usually asymptomatic, it has a high risk of producing paradoxical embolism and, therefore, stroke with indeterminate outcomes. The study should be started based on clinical suspicion, and includes a multidisciplinary assessment and a determination of the type of treatment to be performed. The therapeutic possibilities range from conservative treatment (indefinite antithrombotic treatment), to its percutaneous closure (currently the most widely used). The first objective is to decrease the number of stroke recurrences. Conservative treatment should be reserved for those cases of low embolic risk. The risk assessment must be individualised, fundamentally based on the anatomical characteristics of the FOP and the patient clinic picture. The use of the RoPE risk scale (The Risk of Paradoxical Embolism) should be a tool to consider.
Paciente mujer de 55 años, con antecedentes de síncopes ocasionales de características atípicas y auras visuales sin migraña posterior, tabaquismo e hipercolesterolemia poligénica con HDL elevado. Presenta de forma súbita afasia motora y leve hemiparesia derecha de predominio braquial. Tras un estudio exhaustivo en urgencias, y derivada de forma preferente a neurología y cardiología, es diagnosticada de foramen oval permeable (FOP) con aneurisma del septo interauricular. Se procedió al cierre del FOP mediante dispositivo Amplatzer.
Paciente varón de 57 años, deportista habitual y no fumador, sin otros factores de riesgo cardiovascular. Presenta de forma súbita afasia motora con leve hemiparesia derecha de predominio braquial. Tras estudio protocolizado es diagnosticado de FOP sin aneurisma, con criterios de bajo riesgo. Se decide no realizar cierre del FOP, tratándose con antiagregación indefinida (300mg de AAS).
Ambos casos podrían ejemplarizar las diferentes perspectivas que pueden presentarse en la práctica clínica diaria y constituirían una carta de presentación de esta enfermedad.
Con la siguiente revisión sobre el FOP pretendemos actualizar los conocimientos actuales sobre esta entidad, valorar la posibilidad de un diagnóstico precoz, enfocar su diagnóstico definitivo y proponer cuáles serían las terapias de elección, con una visión fundamentalmente centrada en la atención primaria (AP).
El FOP es un orificio que, durante la vida fetal, permite el paso de la sangre oxigenada de la aurícula derecha a la izquierda. Ello conlleva que los nutrientes procedentes de la placenta y la vena umbilical puedan llegar al organismo del feto. Durante el nacimiento el aumento de la presión en la aurícula izquierda favorece su cierre progresivo. Durante los 2 primeros años de vida las 2 hojas embrionarias (septum primum y septum secundum) se fusionan dejando un residuo llamado fosa oval. Cuando hay una fusión posnatal incompleta de estas estructuras se forma un FOP, que en la gran mayoría de las ocasiones cursará de forma asintomática1.
Desarrollo del temaPrevalencia y etiologíaLa prevalencia de FOP, según estudios realizados en autopsias, puede llegar a ser del 25% en población general asintomática2. La verdadera importancia de la presencia de un FOP radica en la posibilidad de convertirse en una fuente de ictus de características isquémicas asociado a embolias paradójicas.
En España el ictus es la primera causa de muerte de origen cardiovascular en mujeres y la segunda en hombres, tras la cardiopatía isquémica3. El ictus criptogénico (IC) se define como un infarto cerebral que no se atribuye a aterosclerosis de grandes vasos, enfermedad de arterias pequeñas o embolia, a pesar de una amplia y exhaustiva búsqueda analítica, vascular, neurológica y cardíaca. A pesar de ello hasta un 30% son clasificados como de origen indeterminado o IC y, entre ellos, un 40% tienen un FOP implicado como causa potencial de embolia paradójica, alcanzando el 50% en pacientes jóvenes4. En dichos pacientes (<55-60 años) constituye la principal causa de ictus de causa indeterminada1.
Aunque el FOP, como se ha referido anteriormente, cursa de forma asintomática y solo es descubierto cuando se produce el ictus, se han asociado algunos procesos sintomáticos y entidades nosológicas con una mayor prevalencia de FOP. Así la migraña, el síndrome platipnea-ortodesoxia, o el síndrome de descompresión (SDC) en buceadores o personas que practican submarinismo son claro ejemplo de ello1.
La relación entre migraña y presencia de un FOP es controvertida. Los mecanismos nociceptivos etiológicos podrían estar relacionados con liberación de sustancias vasoactivas y con microémbolos que impactan en zonas cerebrales sensibles5. Por un lado se ha documentado un mayor número de migrañas (se duplica su prevalencia) entre la población afectada de un FOP, sobre todo en casos de migraña con aura6. En un estudio7 los pacientes estudiados por IC que presentaban FOP fueron un 59%, aumentando a un 79% si presentaban migraña sin aura, y a un 93% en caso de migraña con aura. Además algunas revisiones6,8 indican cómo diferentes estudios observacionales han objetivado una disminución del número de migrañas tras el cierre del FOP, aunque en ellos se obtuvieron resultados positivos (número de crisis, duración, etc.), esta respuesta fue mitigada porque no se consiguió la resolución completa de los ataques de migraña ni la tasa final de respuesta8. En contraposición, los 3 ensayos clínicos realizados hasta la fecha para objetivar este hecho han dado resultados negativos (objetivos finales primarios definidos como resolución de la migraña y una reducción mayor del 50% en los días de migraña al año)6. Un aspecto no resuelto es si la presencia de aura migrañosa podría ser un elemento diferenciador. Un metaánalisis9 en el que se diferenciaba entre migraña con aura y sin aura estableció la posibilidad de que solo los pacientes afectos de migraña con aura se beneficiarían tras el cierre del FOP. Ello implicaría que la presencia de aura fuera un dato a tener en cuenta a la hora de establecer una selección clínica individualizada. En cualquier caso, en la actualidad no se recomienda el cierre de FOP como tratamiento preventivo para la migraña1,6.
Otra entidad asociada al FOP es el SDC. Está asociado a buceadores que realizan un ascenso rápido desde varios metros de profundidad, y se basa en los síntomas ocasionados por burbujas vasculares y extravasculares que a nivel pulmonar producen microémbolos, y que en el caso de un FOP la embolia paradójica puede causar síntomas neurológicos y cutáneos característicos de este síndrome. Las recomendaciones sugeridas para buceadores con FOP e historia de SDC incluyen el cese del buceo y la consideración del cierre de FOP1.
Como hemos comentado con anterioridad el FOP suele pasar desapercibido hasta que no se produce un evento agudo, dada su escasa probabilidad de detección precoz, al cursar en el mayor número de los casos de forma asintomática. Así los síntomas neurológicos isquémicos producidos pueden ser de escasa duración, con poca afectación motora, o erróneamente catalogados y/o asociados con otros diagnósticos (hemianopsias homónimas, auras visuales sin migraña10, ansiedad, crisis epilépticas5 o migraña inducida por anticonceptivos11.
En el aspecto clínico surge la duda sobre si el ictus diagnosticado en pacientes con FOP tiene algunas peculiaridades respecto al resto de los ictus de etiología aterotrombótica o embolígena, que pudiera constituir un efecto diferenciador. Recordemos que este ictus está ocasionado por una embolia paradójica y las evidencias que apoyan esta etiología incluyen: infartos de ubicación cortical, ictus en distribuciones vasculares múltiples e infartos de diferente antigüedad en el mismo territorio vascular1. En cualquier caso, no existe un patrón característico de isquemia cerebral en pruebas de imagen que sea característico de esta enfermedad.
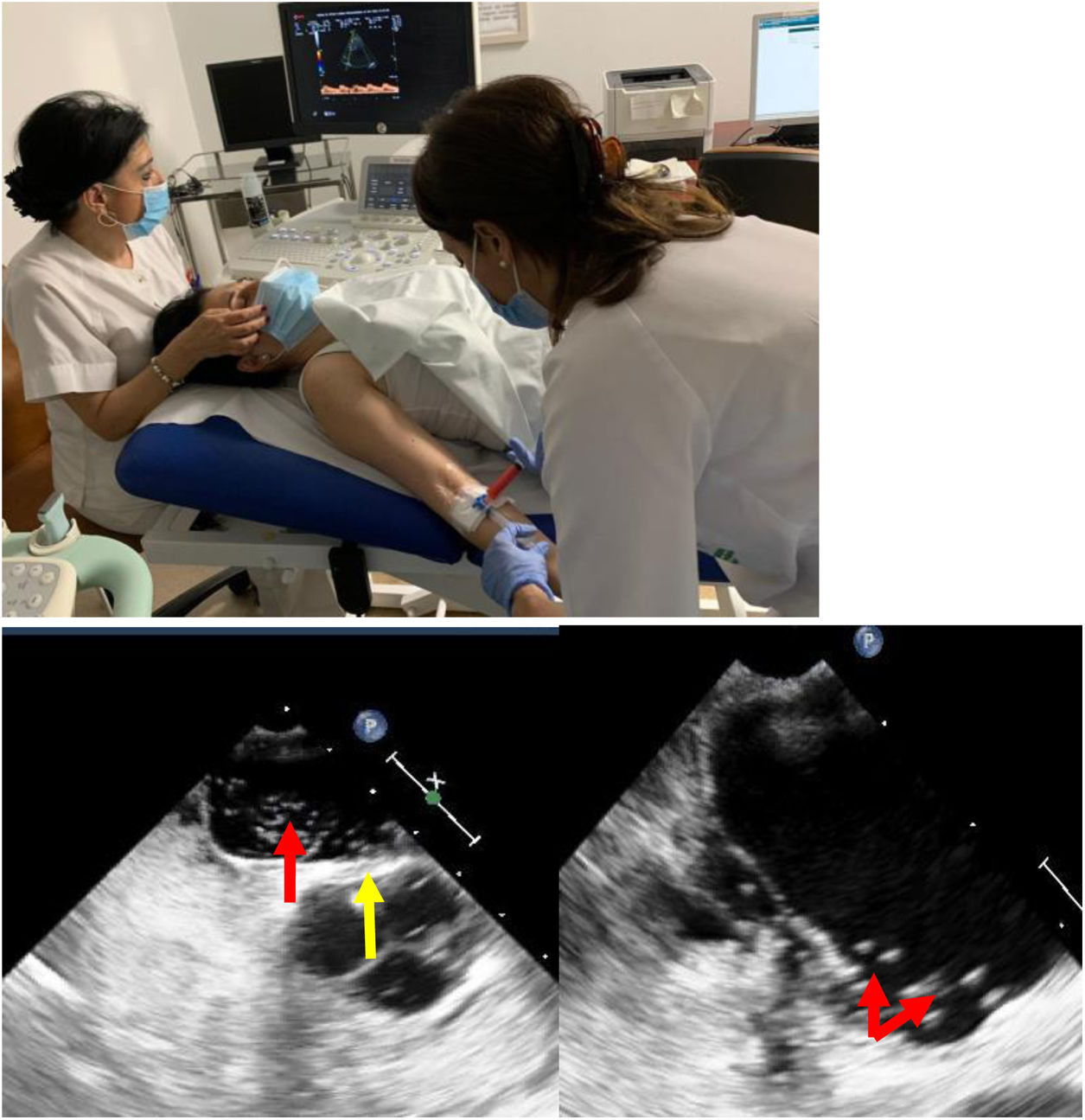
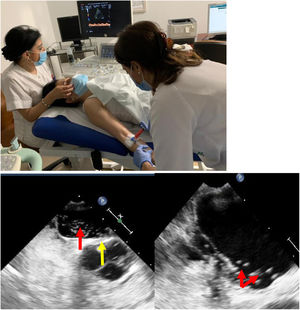
Diagnóstico del foramen oval permeableLa combinación del Doppler transcraneal (DTC), la ecocardiografía transtorácica (ETT) y la ecocardiografía transesofágica (ETE), implementadas con test de burbujas en situación basal y tras maniobra de Valsalva, completarían las pruebas diagnósticas disponibles12 (fig. 1).
Pruebas diagnósticas en FOP.
a) Doppler transcraneal con test de burbujas. b) Ecocardiografía: FOP con aneurisma del tabique interauricular. Izquierda: tabique protruyendo (flecha amarilla) y pase de burbujas a través del FOP (flecha roja). Derecha: aurícula izquierda con numerosas burbujas (flechas).
Imágenes cedidas por la Unidad de Ictus y Laboratorio de Neurosonografía. Servicio de Neurología. Unidad de Ecocardiografía. Servicio de Cardiología. Hospital Reina Sofía de Córdoba.
El DTC es un método seguro y con buenos resultados para detectar la existencia de un shunt derecha-izquierda intracardiaco. Se debe asociar siempre al test de burbujas. Este test, que no precisa de una técnica excesivamente compleja, se realiza canalizando una vía periférica braquial y perfundiendo en bolo un suero fisiológico (suero salino sonicado), o contraste no yodado (habitualmente gelafundina al 4%). Se debe agitar durante su perfusión, para crear microburbujas, y realizar maniobras de Valsalva para favorecer la apertura de la comunicación. Esta situación permite documentar la existencia de FOP mediante efecto Doppler con un transductor interpuesto al nivel de la ventana temporal. Si existe un shunt derecha-izquierda auricular se puede detectar mediante ultrasonidos, por las turbulencias que el flujo provoca coincidiendo con la instilación del suero (fig. 1a).
El DTC, aunque presenta obvias limitaciones a la hora de detectar características estructurales adicionales del shunt y de la morfología cardíaca13, es más sensible que el TEE (96%/89%), e igual de específico en comparación con la ETT o la ETE. Por ello, y refrendando el posicionamiento europeo, debería constituirse como la técnica de cribado o de diagnóstico inicial del FOP14.
La ETT puede ser suficiente para completar el diagnóstico de FOP (siendo una prueba con una mayor disponibilidad y que ocasiona menos molestias al paciente que la ETE), aunque la prueba que se considera patrón oro en la actualidad es la ETE, realizadas ambas con test de burbujas y maniobras de Valsalva (fig. 1b). Esta técnica tiene mayor sensibilidad para la detección de determinadas anomalías, como la presencia de otros defectos en el tabique (septos multiperforados), comunicación interauricular o aneurisma del tabique interauricular. De igual modo nos informará ante la presencia de una red de Chiari o una válvula de Eustaquio redundante, así como de la longitud del túnel del FOP y su grado de separación. Dichas circunstancias se asocian en algunos estudios a un mayor beneficio del cierre del FOP cuando la separación es amplia (>4mm) y el túnel es largo (>10mm)15.
Una reciente revisión analizó qué cambios anatómicos obtendrían diferencias significativas respecto al mayor riesgo de ictus. Una mayor altura del FOP medida durante maniobra de Valsalva, una mayor distancia de excursión septal, así como un aneurisma septal y un shunt grande D-I fueron los hallazgos que se asociaron de forma significativa16.
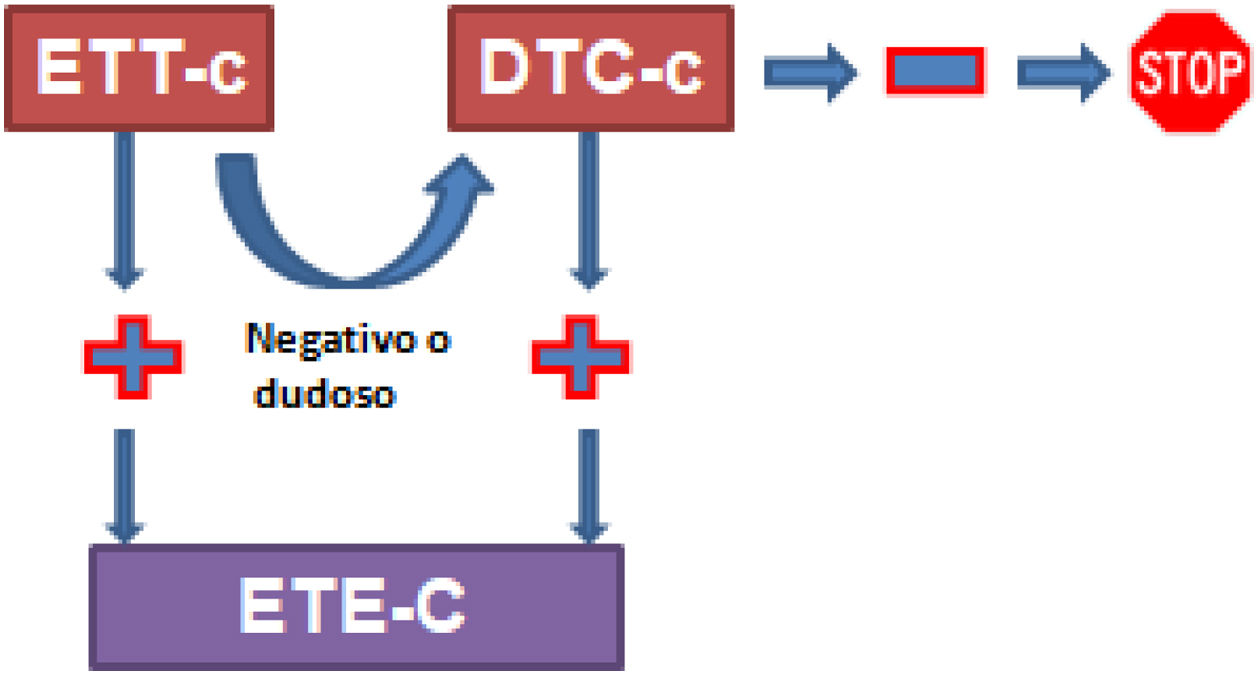
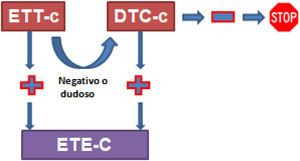
Los diferentes metaanálisis publicados comparando la DTC, la ETT y la ETE presentan un alto grado de inconsistencia y una baja calidad de la evidencia. Por ello deberemos valorar la combinación de las 3 técnicas para mejorar la fiabilidad diagnóstica (fig. 2).
Diagnóstico de FOP.
DTC-c: Doppler transcraneal con contraste; ETE-c: ecocardiografía transesofágica con contraste; ETT-c: ecocardiografía transtorácica con contraste.
Tomada de Pristipino et al.14.
Es obvio que algunas guías nos recuerdan que no deberemos clasificar como IC un episodio embolígeno en el que se sospeche de que el FOP desempeña un papel patogénico1,14.
Los datos clínicos y sociodemográficos que nos harían sospechar del FOP como causa etiológica de ictus serían:
- •
Edad precoz en el momento de la presentación (<55-60 años).
- •
Criterios de riesgo anatómico del FOP antes descritos.
- •
Ausencia de otros factores de riesgo vascular (diabetes, HTA, tabaquismo, etc.).
- •
Presencia concomitante de un embolismo pulmonar o de una trombosis venosa profunda.
- •
Otros factores que pudieran predisponer a la formación de un trombo (viaje reciente, inmovilización prolongada, etc.).
- •
Tipo de ictus (cortical, múltiples localizaciones, etc.).
- •
Ante estas situaciones clínicas sospecharemos que el FOP es causante del ictus14.
En definitiva, el diagnóstico de este síndrome debe contemplar un abordaje multidisciplinar que incluya la sospecha clínica por el médico de familia, la valoración de diferentes especialistas hospitalarios (neurología, cardiología, ecocardiografista, medicina interna, radiología, etc.) y la realización de técnicas complementarias que permitan, por un lado, descartar causas posibles de ictus, y por otro realizar un diagnóstico definitivo del mismo. Con ello decidiremos, de forma individualizada y con la decisión ulterior del paciente previamente informado, qué actuación terapéutica sería la más recomendable14 (tabla 1).
Evaluación del ictus isquémico criptogénico Adaptado por el autor de referencia 1
| Condición | Pruebas recomendadas |
|---|---|
| Alteraciones de la coagulación | Recuento completo sanguíneo, factor V Leiden, proteína C y S, antitrombina iii y homocisteína, mutación de la protrombina G 20210, anticuerpos antifosfolípidos |
| Fibrilación auricular | Monitorización ECG continua>30 días |
| Trombos cardiacos, vegetaciones o tumores; estenosis mitral | ETT y ETE (si ETT es normal), TAC coronaria o RNM (si esta última no es aclaratoria y hay alta sospecha) |
| Enfermedad aterosclerótica cerebral | TAC cerebral y angiorresonancia si es necesario |
| Enfermedad arterial carotídea | Doppler carotídeo, TAC cerebral y angiorresonancia, si es necesario |
| Placa ateroma aorta | ETE o AngioTAC |
| Disección arterial | TAC con angiografía torácica o cervical (si hay disección proximal) |
| Trombosis de senos venosos cerebrales | Resonancia magnética venosa cerebral |
| Síndrome de May-Turner | Resonancia magnética venosa pélvica |
Adaptada de Collado et al.1.
El debate, desde hace varias décadas, gira en torno a la mayor o menor eficacia de un tratamiento conservador farmacológico (antiagregación y/o anticoagulación), frente a un tratamiento intervencionista (cierre percutáneo del FOP), asociado o no a un tratamiento antitrombótico posterior.
Recientes publicaciones con resúmenes de autores nacionales pueden ser muy didácticas para aclararnos las situaciones en las que los pacientes con FOP se beneficiarían del cierre percutáneo frente al tratamiento médico17,18.
Hasta hace muy poco tiempo la decisión terapéutica estaba basada en una pobre evidencia sustentada en estudios descriptivos y en un número pequeño de ensayos clínicos. En 2017 la situación cambió notablemente tras la publicación (en el mismo número de la revista New England Journal of Medicine) de 3 ensayos clínicos. Estos ensayos clínicos mostraron el mayor beneficio del cierre percutáneo del FOP respecto al tratamiento médico en pacientes con IC asociado a FOP19–21. En estos ensayos clínicos RESPECT, REDUCE y CLOSE trial el cierre percutáneo transcatéter redujo la tasa de ictus isquémico recurrente en un 45%, 77% y 97%, respectivamente, frente a la terapia conservadora (antiagregante y/o anticoagulante). Como limitaciones a los mismos señalar que el beneficio solo era aplicable a pacientes con criterios «de alto riesgo», exigiendo un número necesario a tratar (NNT) elevado (130 pacientes)22. Por ello, y a pesar de los beneficios comentados, persisten lagunas que impiden generalizar la indicación terapéutica y exigen individualizar la indicación en cada paciente.
Múltiples metaanálisis posteriores23–32 redundaron en los mismos resultados, con disminución significativa en el objetivo primario, que habitualmente fueron la recidiva del ictus, AIT o una combinación de ambos, en los pacientes aleatorizados a la estrategia intervencionista. Algunos de ellos no obtuvieron beneficios respecto a recidivas para los accidentes isquémicos transitorios (AIT)24,26,29,32. Como aspecto negativo conviene resaltar el incremento de la presencia de arritmias, sobre todo de fibrilación auricular (FA), y las limitaciones de los propios estudios mencionadas en estas revisiones, como las de no ser estudios doble ciego, la heterogeneidad del tipo de dispositivo, las diversas terapias antitrombóticas utilizadas, el ser ensayos clínicos cruzados y el número pequeño de eventos finales (ictus, AIT) objetivados al finalizar los estudios.
Respecto a la FA la práctica totalidad de los estudios muestran un incremento de dicha arritmia en los pacientes tratados con dispositivos implantables. Respecto a las características de presentación se produjeron sobre todo en las primeras semanas tras el cierre, fueron de corta duración y habitualmente transitorias.
Algún estudio ha documentado una menor posibilidad de FA con el dispositivo Amplatzer frente a otros tipos de dispositivos33, pero en cambio, respecto al objetivo primario (reincidencia de ictus), un reciente metaanálisis no ha encontrado diferencias significativas entre los diversos tipos de dispositivos (Amplatzer, STARFlex y GORE)26.
Por todo ello, la decisión terapéutica debe ser individualizada (fig. 3)34, y en aquellos pacientes que han sufrido un IC, basarse en la respuesta a 2 preguntas14,18: ¿cuál es la probabilidad de que el FOP del paciente sea la causa del ictus o, por el contrario, un hallazgo incidental?, y ¿cuál es el riesgo de recurrencia?
Algoritmo propuesto para la toma de decisión en pacientes con ictus criptogénico y presencia de FOP.
Tomada de referencia Cruz y Vera34.
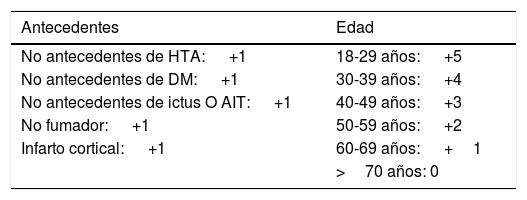
Respecto a la primera de las cuestiones, aunque con anterioridad ya ha sido contestada, sería conveniente ampliar la información con los datos de la escala The Risk of Paradoxical Embolism (RoPE)35 por su implicación en ambas respuestas (tabla 2).
Escala de RoPE (score 0-10)35. Alto riesgo>6
| Antecedentes | Edad |
|---|---|
| No antecedentes de HTA: +1 | 18-29 años: +5 |
| No antecedentes de DM: +1 | 30-39 años: +4 |
| No antecedentes de ictus O AIT: +1 | 40-49 años: +3 |
| No fumador: +1 | 50-59 años: +2 |
| Infarto cortical: +1 | 60-69 años: +1 |
| >70 años: 0 |
La escala de RoPE se desarrolló para calcular la probabilidad de que el FOP sea responsable del ictus, y por tanto debe usarse en pacientes con IC que tienen FOP y ninguna otra causa convincente de ictus.
Por consenso se ha determinado que una puntuación superior a 6 se identifique con mayor riesgo de recurrencia. La fracción de ACV atribuible al FOP para una puntuación de 7, 8 y 9 es 72%, 84% y 88%, respectivamente1. En cualquier caso, y según el consenso europeo, la escala RoPE solo debe ser parte de una evaluación individual integral, necesitándose más estudios de validación de esta escala14.
Respecto a la segunda de las cuestiones conviene recordar que la mayor parte de los factores que se han descrito como de alto riesgo para la recidiva coinciden con los factores que, de por sí, se asocian a la causalidad del FOP en el ictus14,15,20, y entre otros serían:
- •
Factores anatómicos de la comunicación: Presencia de válvula de Eustaquio, red de Chiari o canal del FOP extenso, derivación de derecha a izquierda>30microburbujas por ETT o ETE, o la existencia de un aneurisma del septo interauricular (base≥15mm, excursión total>10mm) por ETT.
- •
Aspectos clínicos sugestivos de embolia paradójica: coincidencia con maniobra de Valsalva, inmovilización prolongada, síndrome de la clase turista, estados de trombofilia, etc.36.
- •
Edad menor de 55-60 años, siendo los menores de 55 años los que más se benefician del cierre del FOP en comparación con edades superiores37.
- •
Ausencia de factores de riesgo cardiovascular clásicos.
¿Existen estudios que hayan comparado la eficacia de la antiagregación, la anticoagulación oral (ACO), y la terapia intervencionista (más antiagregación indefinida)? Un metanálisis en red comparó estas 3 posibilidades con evidencia tipo GRADE, llegando a la conclusión de que probablemente el cierre percutáneo del FOP es superior a la terapia antiagregante sola, pero sin diferencias frente a la terapia ACO (aunque con un significativo porcentaje de sangrado mayor para esta última). También se observó una mayor incidencia de FA en el grupo de cierre de FOP38.
¿Qué ocurre a largo plazo en los pacientes sometidos a terapia intervencionista? ¿Cuál sería la duración recomendada respecto a la antiagregación? Un estudio recopilativo39 mostró los resultados clínicos a 10 años tras el cierre del FOP. En el seguimiento se objetivó una baja tasa de ictus (1%) y un 2% de hemorragias mayores (todos ellos en pacientes con terapia antiagregante). Una quinta parte de los pacientes interrumpieron el tratamiento antitrombótico durante el periodo de seguimiento (la mayoría en el primer año posterior al cierre del FOP), lo que no se asoció a un aumento de los eventos isquémicos en el seguimiento. Este mismo grupo analizó durante una mediana de 8 años40 los efectos beneficiosos de la duración prolongada de la antiagregación en el grupo que suspendió precozmente la misma, sin encontrar diferencias frente a los que continuaron durante todo el seguimiento. En sus conclusiones indican que el tratamiento temporal (y no indefinido) podría ser razonable en estos pacientes de bajo riesgo cardiovascular. Según el posicionamiento europeo14, tras el cierre del FOP la pauta sería iniciar doble antiagregación entre uno y 6 meses y continuar con antiagregación simple un mínimo de 2 años, con recomendación de 5 años. Sin embargo, en la práctica clínica diaria la doble antiagregación generalmente se usa durante 6 a 8 semanas, seguido de una terapia antiplaquetaria única entre 6 meses y un un año41. En cualquier caso faltan estudios a largo plazo que concreten la duración adecuada y parece prudente valorar a cada paciente de forma individual.
¿Cuál sería la dosis recomendada de antiagregación? Los estudios consultados recomiendan aspirina a dosis de 81-325mg/d42. Si bien, algún estudio reciente ha objetivado buenos resultados con dosis más bajas (100mg/d) durante 6 meses43.
¿Qué resultados se obtienen en los pacientes que no fueron candidatos al cierre del FOP y que fueron tratados con antitrombóticos? Una reciente revisión42 abordó la disyuntiva de utilizar ACO o antiagregantes. En sus conclusiones, y aunque hubo una menor incidencia de ictus entre los pacientes que tomaban ACO, los autores creen que estas diferencias son escasas y no permiten concluir una opción definitiva, emplazando a la realización de un ensayo clínico con ambos comparadores. Según el consenso europeo, ante un bajo riesgo de hemorragia se podrá optar por un anticoagulante, asegurándonos con ello un correcto control de anti vitamina K. Esto incluye los casos de alto riesgo de recidiva en los que se escoge un tratamiento conservador. Para el resto de pacientes se aconseja antiagregación14.
Y, por último ¿hay que recomendar a todos los pacientes sometidos a terapia intervencionista un tratamiento antitrombótico? Dado que la actuación intervencionista sigue basándose en pacientes de alto riesgo de recidiva, todas las revisiones aconsejan asociar tratamiento antitrombótico de forma indefinida. Un reciente metaanálisis ha comprobado que la anticoagulación no consiguió ningún beneficio neto en la prevención del ictus recurrente, y se asoció con un riesgo no significativo mayor de hemorragia mayor. Hay una posible excepción: aquellos pacientes con una puntuación de RoPE elevada, los cuales sí alcanzaron significación estadística para la anticoagulación (disminución del riesgo de ictus recurrente)44.
Según un reciente editorial publicado en la Revista Española de Cardiología45 actualmente la opción intervencionista se plantea como la mejor estrategia terapéutica en los pacientes con FOP y antecedentes de ictus, sobre todo en los definidos previamente como de alto riesgo; este cribado del FOP debería realizarse en todos los casos de embolia sistémica, incluso en presencia de una causa probable como la FA; con ello podemos prevenir un ictus en un periodo de entre 2 a 20 años. A pesar de algunas autorías, como esta, claramente a favor de dicho cierre, no debemos olvidar que algunos metanálisis han encontrado superioridad en la recidiva de ictus, pero no así en la recidiva de AIT, y coinciden en la individualización para tomar la decisión terapéutica más adecuada, contando con la opinión de cada paciente24,26,29,32,46.
Conclusiones más relevantesEl FOP es la causa más prevalente de ictus en pacientes menores de 55-60 años, constituyendo casi la mitad de los ictus hasta ese momento llamados criptogénicos.
Su estudio debe conllevar un abordaje multidisciplinar que incluya varios profesionales, siendo primordial la actuación temprana del médico de AP en su sospecha y estudio inicial.
Aunque es asintomático en la mayoría de las ocasiones, la presencia auras migrañosas complejas, crisis epilépticas no filiadas, síntomas por descompresión, AIT o ictus (sobre todo en edades precoces) deben hacernos sospechar su presencia.
El diagnóstico se iniciará con una prueba de alta sensibilidad, el DTC con infusión de suero salino agitado y, si es positivo, completándolo con una ETT y ETE (también con test de burbujas).
En este momento la terapia de elección es la intervencionista (cierre del FOP), asociado a antiagregación, un mínimo de 6 meses, debiendo valorar individualmente la duración de la misma en función del riesgo de cada paciente.
Agradecimientos al Dr. García Criado y al Dr. Pérula de Torres por su revisión de la actualización, y a la Dra. Portillo Rivero y al Dr. Martín Ruiz Ortiz de los Servicios de Neurología y Cardiología del Hospital Reina Sofía de Córdoba por dicha revisión y por facilitar las fotografías de las pruebas de imagen en el FOP.