Identificar los factores condicionantes del pie de riesgo (PR) comparando 2 métodos de evaluación (cualitativo y cuantitativo) para neuropatía, arteriopatía y deformidades del pie. Concordancia entre alteraciones detectadas y registradas en el historial clínico (HC).
Material y métodosEstudio observacional. Ámbito: 2 centros de atención primaria del Instituto Catalán Salud.
PoblaciónQuinientos treinta y dos pacientes con diabetes, ambos sexos >18 años con registros del PR y consentimiento informado.
MedicionesNeuropatía: valoración síntomas (NSS) y signos discapacidad (NDS). Arteriopatía: índice tobillo brazo (ITB), cuestionario Edimburgo, pulsos pedios. Deformidades pie: pedigrafía. Valores de referencia cuantitativos: Neuropatía definida: NDS>6 puntos o 3-5 y NSS>5 puntos. ITB: valor normalidad (0,90-1,30).
ResultadosMujeres: 46,42%; edad media: 67,29 años (DE: 7,69). Ciento cincuenta y tres pacientes sin complicaciones neurovasculares.
CualitativoSin diferenciar manifestaciones clínicas: 252 pacientes presentaron neuropatía; 99 pacientes presentaron ITB alterado; 28 pacientes presentaron complicaciones y 101 pacientes cuestionario Edimburgo alterado.
CuantitativoDiferenciando manifestaciones clínicas: del grupo neuropatía, 110 pacientes solo presentaron síntomas; 46 pacientes presentaron neuropatía definida y 96 pacientes puntuación NDS y NSS, sin criterios neuropatía definida.
ITB alterado52, solo ITB>1,30; 47, solo ITB<0,90; 12, asociaron neuropatía e ITB>1,30 y 16 con ITB<0,90. Cuestionario Edimburgo: 47 pacientes presentaron clínica atípica y 54, típica.
Concordancia entre alteraciones neurovasculares cuantitativas y registradas r=0,32 para neuropatía y r=0,21 en arteriopatía. El punto de presión sobre el 5.° metatarso se asoció a neuropatía cuantitativa: OR: 2,32 (1,188-4,546); p=0,01.
ConclusiónLa evaluación, identificando manifestaciones clínicas, mejora la identificación del PR aunque necesitamos más investigación.
Identify conditioning factors of the foot risk (FR) by comparing two evaluation methods (qualitative and quantitative) for neuropathy, arteriopathy, foot deformities. Concordance between detected the alterations and registered in clinical history (CH).
Material and methodsIt is an observational study. Ambit: in two primary care centers of the Catalan Health Institute.
PopulationFive hundred thirty-two patients with diabetes, both >18 years with FR records and informed consent.
MeasurementsNeuropathy: symptom assessment (NSS) and signs of disability (NDS). Arteriopathy: Index ABI. Edinburgh Questionnaire, fart pulses. Foot deformities: Pedigraphy. Quantitative reference: Values Defined neuropathy: NDS>6 points or 3-5 and NSS>5 points.
ITBNormal value (.90-1.30).
ResultsWomen, 46.42%. Middle ages, 67.29 years (SD 7.69). One hundred fifty-three patients did not present neurovascular alterations.
QualitativeWithout differentiating clinical manifestations: 252, patients presented neuropathy; 99, altered ITB; 28, two complications and 101, Edinburgh Quiz: altered.
QuantitativeDifferentiating clinical manifestations: among the neuropathy group; 110, patients only presented symptoms; 46, definite neuropathy. In 96, NDS and NSS scores without defined neuropathy criteria.
Altered ABI52, only ABI>1.30; 47, ABI<.90; 12, associated neuropathy and ABI>1.30 and 16, with ABI<.90. Edinburgh questionnaire: 47, presented atypical symptoms and 26, typical.
Agreement, between quantitative and recorded neurovascular alterations r=.32 for neuropathy and r=.21 in arteriopathy. The pressure point on the 5th metatarsal, was associated with quantitative neuropathy: OR: 2.32 (1.188–4.546), P=.01.
ConclusionThe evaluation, identifying clinical manifestations, improves the identification of FR, although we need more research.
El pie diabético (PD), es el resultado de un complejo proceso multifactorial asociado a las complicaciones crónicas de la diabetes mellitus (DM).
Se manifiesta por la presencia de uno o más factores condicionantes: neuropatía (NP), arteriopatía (ART), deformidades del pie (DFP) y/o un manejo ineficaz de la DM por parte del paciente o su entorno, concluyendo en 2 situaciones clínicas diferenciadas; pacientes con PD activo (úlcera activa en el pie) y pacientes con pie de riesgo (PR), sin úlcera activa en el pie1–3.
La prevalencia del PD en España se sitúa en el 3%4, presentando un coste directo entre los 1.465€ a los 5.031€5 y una elevada morbimortalidad, descenso de la actividad cotidiana, aislamiento social, depresión y reducción de la esperanza de vida1,6,7.
Para reducir el impacto socioeconómico del PD, la prevención se distribuye entre niveles asistenciales2,3. En el nivel superior se encuentra la atención multidisciplinar en el entorno hospitalario, y en el nivel básico la atención primaria y la atención podológica1,3.
En el nivel superior, la prevención se orienta a reducir el número de amputaciones mayores con una tasa de curación del PD del 70%, aunque presenta una tendencia al incremento del PD recurrente y amputaciones menores dentro del primer año de curación8–10. En el nivel básico, la prevención del PD se centra en el cribado, categorización del PR y cuidados del pie, manteniendo un canal de comunicación entre niveles asistenciales que garantiza una continuidad asistencial de los PR1,11−13.
Actualmente, la atención primaria, se responsabiliza del cribado anual del PR en el paciente con DM mediante una exploración básica de los pies que incluye: valoración de NP mediante sensibilidad presora y vibratoria (sensible/insensible). ART: palpación de pulsos pedios (presentes/ausentes), observación de callosidades o DFP (sí/no), La prevención podológica se centra en el control de afecciones ungueales, callosidades y tratamiento ortopodológico de las deformidades1,3.
La importancia de una categorización precoz del PR en atención primaria, invita a profundizar en otras estrategias de evaluación como la mejora del actual modelo de cribado. En esta línea, nuestro centro participó en el estudio TERMOPIEDI, relacionado con la temperatura plantar y los factores condicionantes del PR14. Todos los pacientes incluidos, tenían diagnóstico de DM tipo 2 y registros previos del PR en historial clínico informatizado (HCI).
Para el actual estudio se han recuperado los datos de todos los participantes del estudio TERMOPIEDI relacionados con síntomas y signos neurovasculares, agrupados por valoración cuantitativa (diferenciando las manifestaciones clínicas)14, método similar a la de otros autores15–17. Nos proponemos conocer, si esta metodología, mejora la identificación del PR en comparación a la valoración cualitativa (agrupando las diferentes manifestaciones clínicas) como se describen en otras publicaciones1,11,13.
ObjetivosPrincipal: identificar los factores condicionantes del PR comparando 2 métodos de evaluación (cualitativo y cuantitativo), para neuropatía, arteriopatía y deformidades del pie.
Secundarios: concordancia entre alteraciones neurovasculares cuantitativas y registradas en HCI. Asociación de deformidades del pie y polineuropatía diabética (PND) detectada.
Material y métodosEl estudio TERMOPIEDI se ejecutó entre los meses de marzo a septiembre del 2014 en 2 centros de atención primaria pertenecientes al Instituto Catalán de Salud.
Sobre una población de 2.500 pacientes mayores de 18 años y diagnosticados de DM2, se incluyeron 532 pacientes aleatorios de ambos sexos que dieron su consentimiento informado y disponían de registros previos de valoración del pie PR, representando el 21,28% de la población censada.
El diseño y la metodología aplicada se describen ampliamente en una publicación anterior14. En el presente documento, resumiremos el procedimiento empleado y mostraremos los resultados obtenidos en base a los objetivos planteados.
Para evaluar la NP, se recuperó información sobre síntomas y signos de neuropatía, adaptando el modelo de puntuación de Young et al. (1993)15 a las posibilidades de la atención primaria.
Síntomas de NP: se evaluó mediante el cuestionario sintomático reducido de neuropatía, Neuropathy Symptom Score (NSS), con un rango de puntuación entre 0 (ausencia de síntomas) a 9 puntos (máxima alteración sintomática)15.
Signos de NP: se incorporó la sensibilidad presora a la escala de valoración de discapacidad sensitiva, Neuropathy Disability Score (NDS). Se aceptó una reducción de la puntuación de los reflejos alterados, de 2 puntos a 1 punto, conservando el rango original entre 0 (máxima capacidad sensitiva), a 5 puntos (máxima discapacidad), por cada pie15–17.
Para establecer la presencia de NP, los resultados de la población estudiada, se agruparon en las categorías diagnósticas del Consejo de Toronto de «Posibilidad y probabilidad» Tesfaye et al. (2010)18.
Como «Posible» NP, se consideró la presencia de síntomas (≥1 punto cuestionario NSS) o signos de discapacidad (≥1 punto escala NDS).
Como «Probable» polineuropatía (PND), se valoraron síntomas y signos mediante las puntuaciones NSS y NDS adaptada, en base a cualquiera de los siguientes supuestos14–17:
«Puntuación NDS 3-5 puntos y puntuación de NSS>5 puntos».
«Puntuación NDS≥6 puntos y puntuación NSS de 0 a 9 puntos».
Determinación de ART: siguiendo las recomendaciones de la Sociedad Americana de Cardiología19, se valoró la presencia/ausencia de pulso pedio, tibial posterior y el índice tobillo brazo (ITB) en cada extremidad inferior mediante doppler de mano Huntleihg SD2 y sonda vascular EASY de 8MHz, considerando valor de normalidad entre 0,90-1,30.
Los síntomas de claudicación intermitente, se categorizaron mediante el cuestionario de Edimburgo: sin alteración (sin clínica). Alterado (clínica típica o atípica)20.
Las DFP se detectaron mediante pedigrafía plantar en bipedestación definidas como: puntos de presión plantar (hiperpigmentación delimitada sobre prominencias óseas plantares). Alteraciones del apoyo plantar (huella de pie plano, cavo, valgo o varo). Alteración en la alineación de los dedos del pie (hallux valgus, quinto varo)14.
De la HCI se recogieron datos antropométricos, control metabólico y complicaciones crónicas de la DM2 registradas (retinopatía, nefropatía, neuropatía, arteriopatía o claudicación intermitente, PD y amputación).
Las variables se definieron según modelo de valoraciónIndependientes: valoración cualitativa de NP definida como «Posible» (presencia de síntomas o signos alterados). ART, ITB alterado (<0,90 o >1,30) o ausencia de algún pulso pedio o tibial posterior. Cuestionario de Edimburgo alterado (sí/no). DFP definidas como: desalineación de los dedos, puntos de presión plantar, alteraciones del apoyo plantar (sí/no).
Dependientes: valoración cuantitativa de NP definida como «Probable» PNP, según los supuestos definidos (sí/no). ART: calcificación si ITB>1,30; obstructiva si ITB<0,9; en cualquier extremidad. Clínica de claudicación intermitente (atípica, típica). DFP: partes del pie con presencia de puntos de presión plantar (antepie, mediopie y retropié) (sí/no) y tipo de huella plantar (pie plano, cavo, valgo, varo).
Secundarias: edad en años. Sexo (varón/mujer), índice de masa corporal (IMC), última hemoglobina glicosilada (HbA1c), última glucemia basal, presencia de complicaciones de la DM2 en la HCI (retinopatía, nefropatía, NP, ART o claudicación intermitente, PD, amputación) (sí/no).
Análisis estadísticoSe estudió la homogeneidad de la muestra mediante la prueba de Kolmogorov-Smirnov.
Las variables cuantitativas se describieron mediante mediana y rango intercuartil y las cualitativas mediante frecuencias y porcentajes.
En el estudio bivariante la relación de las variables cuantitativas se analizó mediante la correlación de Spearman y el análisisde las variables cualitativas mediante Chi-cuadrado.
La medida de acuerdo entre PND y ART cuantitativas y las registradas en la HCI, se estudió mediante el índice de Kappa aplicando la categorización propuesta por Landis y Kock.
Se realizó un análisis de regresión logística entre los grupos, sin complicaciones y PND, tomando como referencia la presencia de PND sí/no ajustado por edad, sexo, control metabólico existente en la HCI y deformidades del pie detectadas. Se utilizó el paquete estadístico SPSS® 20 para Windows.
El estudio TERMOPIEDI fue financiado por la Sociedad Catalana de Medicina Familiar (CAMFIC) en la XIV Convocatoria de Ayudas a la Investigación 2013, Proyecto FAP 1301 y aprobado por el Comité Científico del Instituto Universitario de Investigación Jordi Gol (número: P13/086). Todos los pacientes incluidos, firmaron el consentimiento informado y se han tenido en cuenta las normas de la revista Semergen en la elaboración del presente manuscrito.
ResultadosSe estudiaron los 532 pacientes incluidos en el estudio TERMOPIEDI. El 46,42% fueron mujeres. La edad media fue de 67,29 años; la desviación estándar: 7,69 y el rango entre 41 a 86 años. En la tabla 1 se muestran las características de la población agrupados por tipo de valoración neurovascular y registros del HCI.
Distribución de la muestra por tipo de valoración y registros del historial clínico informatizado
| Valoración cualitativa | Grupo sin alterción N=154; 28,94% | Alteraciones neuropáticas | Alterciones arteriales | Alteraciones neurovasculares | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Grupo neuropatía: N=252; 47,18% | Grupo arteriopatía: N=99; 18,60% | Grupo neurovascular: N=28; 5,26% | |||||||||||||||
| Valoración cuantitativa | Solo síntomas (NSS) | Sin clasificar (GSC) | Neuropatía definida (PND) | Solo calcificado ITB>1,30 | Solo isquémico ITB <0,9 | PND+ITB >1,30 | PND+ITB <0,90 | Total N=532 | |||||||||
| N | Frecia. | N | Frecia. | N | Frecia. | N | Frecia. | N | Frecia. | N | Frecia. | N | Frecia. | N | Frecia. | ||
| Sexoa | |||||||||||||||||
| Varón | 91 | 58,8 | 42 | 38,2 | 50 | 52 | 19 | 41,3 | 29 | 55,8 | 32 | 68,1 | 8 | 66,7 | 14 | 87,5 | 285 |
| Mujer | 63 | 41,2 | 68 | 61,8 | 46 | 48 | 27 | 58,7 | 23 | 44,2 | 15 | 31,9 | 4 | 33,3 | 2 | 12,5 | 247 |
| Antropométricob | |||||||||||||||||
| Edad (años) | 66 | 8 | 66 | 9 | 69 | 10 | 68,6 | 8 | 71,5 | 11 | 69 | 13 | 70,16 | 8 | 72,18 | 5 | 532 |
| IMC | 29,9 | 6 | 30,7 | 7 | 31,1 | 7 | 31,4 | 4 | 30 | 5 | 30,7 | 8 | 29,79 | 2 | 30,03 | 5,3 | |
| Control metabólicob | |||||||||||||||||
| Glucemia | 137 | 36 | 142,5 | 59 | 143,5 | 55 | 141 | 39 | 157,5 | 53 | 150 | 60 | 144,5 | 49 | 144,8 | 62 | |
| HbA1c | 6,6 | 0,9 | 6,9 | 1,5 | 7,1 | 1,9 | 7,2 | 1,1 | 7,1 | 1,5 | 7,3 | 1,5 | 6,9 | 0,9 | 7,4 | 1,6 | |
| Complicaciones DM2 registradasc | |||||||||||||||||
| Retinopatía | 7 | 16,7 | 10 | 23,8 | 5 | 11,9 | 6 | 14,3 | 0 | 0 | 6 | 14,3 | 4 | 9,5 | 4 | 9,5 | 42 |
| Nefropatía | 6 | 13,4 | 9 | 20,1 | 6 | 13,4 | 4 | 8,8 | 4 | 8,8 | 7 | 15,5 | 3 | 6,6 | 6 | 13,4 | 45 |
| Neuropatía | 3 | 7,4 | 5 | 11,7 | 3 | 7,4 | 15 | 35,5 | 2 | 4,7 | 6 | 14,3 | 2 | 4,7 | 6 | 14,3 | 42 |
| Arteriopatía | 4 | 11,3 | 1 | 2,7 | 5 | 13,8 | 2 | 5,6 | 1 | 2,7 | 15 | 41,6 | 2 | 5,6 | 6 | 16,7 | 36 |
| Pie diabético | 0 | 0 | 0 | 0 | 1 | 9,1 | 3 | 27,2 | 0 | 0 | 0 | 0 | 2 | 18,2 | 5 | 45,5 | 11 |
| Amputación | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 25 | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 75 | 4 |
| Cuestionario Edimburgoc | |||||||||||||||||
| Sin cínica | 148 | 27,8 | 88 | 16,54 | 80 | 15,03 | 37 | 6,35 | 43 | 80,8 | 24 | 4,51 | 7 | 1,31 | 4 | 0,75 | 431 |
| Típica | 3 | 0,56 | 11 | 2,06 | 6 | 1,12 | 1 | 0,18 | 2 | 0,37 | 17 | 3,19 | 5 | 0,93 | 9 | 1,69 | 54 |
| Atípica | 3 | 0,56 | 14 | 2,63 | 8 | 1,5 | 8 | 1,5 | 4 | 0,75 | 6 | 1,12 | 1 | 0,18 | 3 | 0,56 | 47 |
Valoración cualitativa: distribución de la muestra sin diferenciar las manifestaciones clínicas de las alteraciones neurovasculares (Sí/No).
Valoración cuantitativa: distribución de la muestra por manifestaciones clínicas de alteraciones neurovasculares.
No hubo homogeneidad entre los grupos detectados y las variables cuantitativas. Kolmogorov-Smirnov (0,02). Sperman>0,05 (no significativo).
Los porcentajes se han truncado a 1 decimal.
DM2: diabetes mellitus 2; IMC: índice de masa corporal; ITB: índice tobillo brazo; Frecia: frecuencia; GSC: grupo sin
clasificar; N: valor absoluto; NSS: escala de síntomas de neuropatía; PND: polineuropatía diabética.
En 153 pacientes no se detectaron alteraciones neurovasculares, se consideró «grupo sin complicaciones». Como «Posible» NP se detectaron 252 pacientes, se consideró «grupo neuropático». En 99 pacientes solo se presentó ITB alterado (<0,90 o >1,30), se consideró «grupo arteriopatía» y 28 pacientes presentaban «Posible» neuropatía y arteriopatía, se consideró «grupo neurovascular».
En 101 pacientes (18,99%), presentaron alteración del cuestionario de Edimburgo. Solo 3 pacientes (0,56%) presentaron pulsos débiles en la extremidad inferior derecha.
Valoración neurovascular cuantitativa (diferenciando las manifestaciones clínicas)Entre el grupo neuropático, se detectaron 3 manifestaciones clínicas diferenciadas: En 110 pacientes, solo presentaron síntomas de neuropatía (puntuación: NSS>1 punto). Grupo sintomático: 96 pacientes presentaron asociación de síntomas (NSS<5 puntos) y signos alterados (NDS: <3 puntos). Grupo sin clasificar y 46 pacientes, solo presentaban «Probable» PND definida. Grupo polineuropatía.
Entre los 99 pacientes del Grupo arteriopatía, 52 solo presentaron ITB>1,30. Grupo calcificado y 47, ITB<0,9. Grupo isquemia. De los 101 pacientes con cuestionario de Edimburgo alterado: 47, presentaron clínica atípica y 54, típica, de los cuales, 26 se agruparon con ITB<0,90 (tabla 1).
Los 28 pacientes del Grupo neurovascular, se distribuyeron en: 12 asociados a ITB>130 y 16 a ITB<0,90. Grupo neuroisquémico.
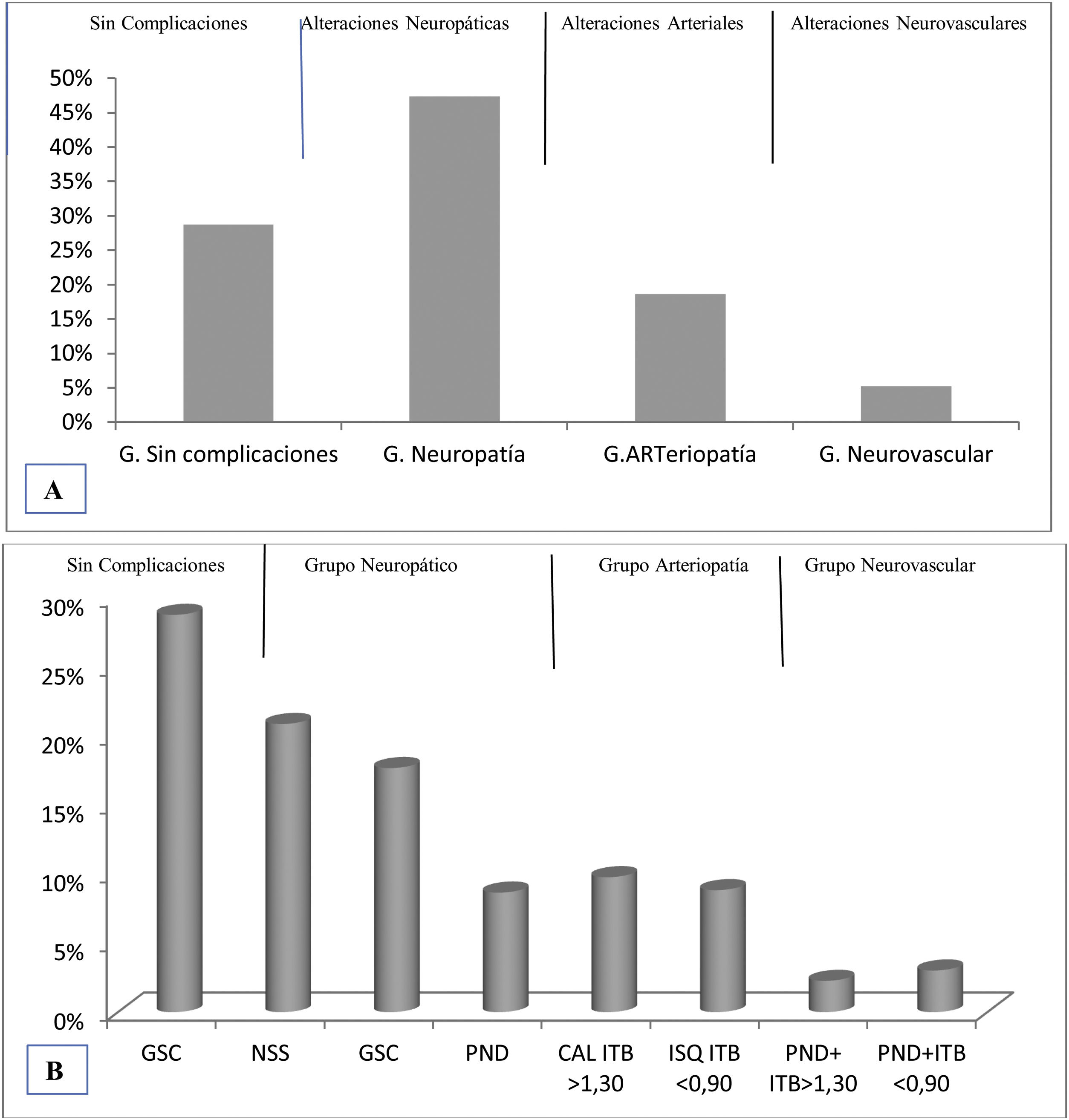
En la figura 1 se muestra la distribución de frecuencias por tipo de la valoración neurovascular.
Distribución de frecuencias por tipos de valoración neurovascular para toda la muestra. A) Valoración neurovascular cualitativa (sin diferenciar manifestaciones clínicas). B) Valoración neurovascular cuantitativa (diferenciando manifestaciones clínicas.
A) SC: sin alteraciones neurovasculares detectadas. GN: presencia de síntomas o signos alterados de neuropatía. GART: presencia de ITB alterado (<0,90 o >1,30) GN+ART presencia de neuropatía e ITB alterado.
B) SC: sin alteraciones neurovasculares detectadas. NSS: solo presencia de síntomas de neuropatía. GSC: grupo sin clasificar con presencia de signos y síntomas alterados de Neuropatía sin alcanzar las puntuaciones definitorias para la PND. PND: presencia de polineuropatía.
Entre los registros existentes en la HCI y los grupos detectados de forma cuantitativa (tabla 1), en el grupo Sin complicaciones, 7 pacientes tenían registros de alteraciones neurovasculares. El 75% de los pacientes con registros de amputación y el 45% con PD, se detectaron en el Grupo neuroisquémico.
En el análisis bivariante (tabla 2), los pacientes con PND presentaron 7,4 y 7, 5 veces mayor asociación con PD y amputación menor, frente al 2,7 y 3,1 de pacientes con ITB<0,9.
Correlación entre valoración neurovascular cuantitativa y de complicaciones de la DM presentes en historial clínico informatizado
| Diagnósticos existentes en HCI | Neuropatía detectada | Arteriopatía detectada | ||||
|---|---|---|---|---|---|---|
| OR IC 95% | Valor de pa | Kappa | OR IC 95% | Valor de pa | Kappa | |
| Retinopatía | 2,30 (1,37-3,86) | 0,002 | 0,156 | 1,45 (0,91-2,28) | 0,134 | 0,053 |
| Nefropatía | 2,72 (1,66-4,43) | <0,001 | 0,127 | 2,03(1,40-2,92 | 0,001 | 0,123 |
| Neuropatía | 5,26 (3,60-7,68) | <0,001 | 0,32b | 2,15 (1,21-3,82) | 0,013 | 0,08 |
| Arteriopatía | 1,68 (1,10-2,55) | 0,024 | 0,1 | 3, 21(2,40-4,28) | <0,001 | 0,35b |
| Pie diabético | 7,40 (5,50- 9,94) | <0,001 | 0,20b | 2,76 (1,72-4,43) | 0,002 | 0,06 |
| Amputación | 7,54 (6,06-9,38) | <0,001 | 0,09 | 3,19 (1,77-5,74) | 0,016 | 0,032 |
DM: diabetes mellitus; HCI: historial clínico informado; IC 95%: intervalo de confianza del 95%; OR: odds ratio.
La medida de acuerdo, entre las alteraciones neurovasculares cuantitativas y las registradas en HCI fue de K=0,32 para los pacientes con PND, y de K=0,21 para la ART, incluyendo los pacientes con solo CAL. Los pacientes con solo ISQ, la medida de acuerdo fue de K=0,35 (tabla 2).
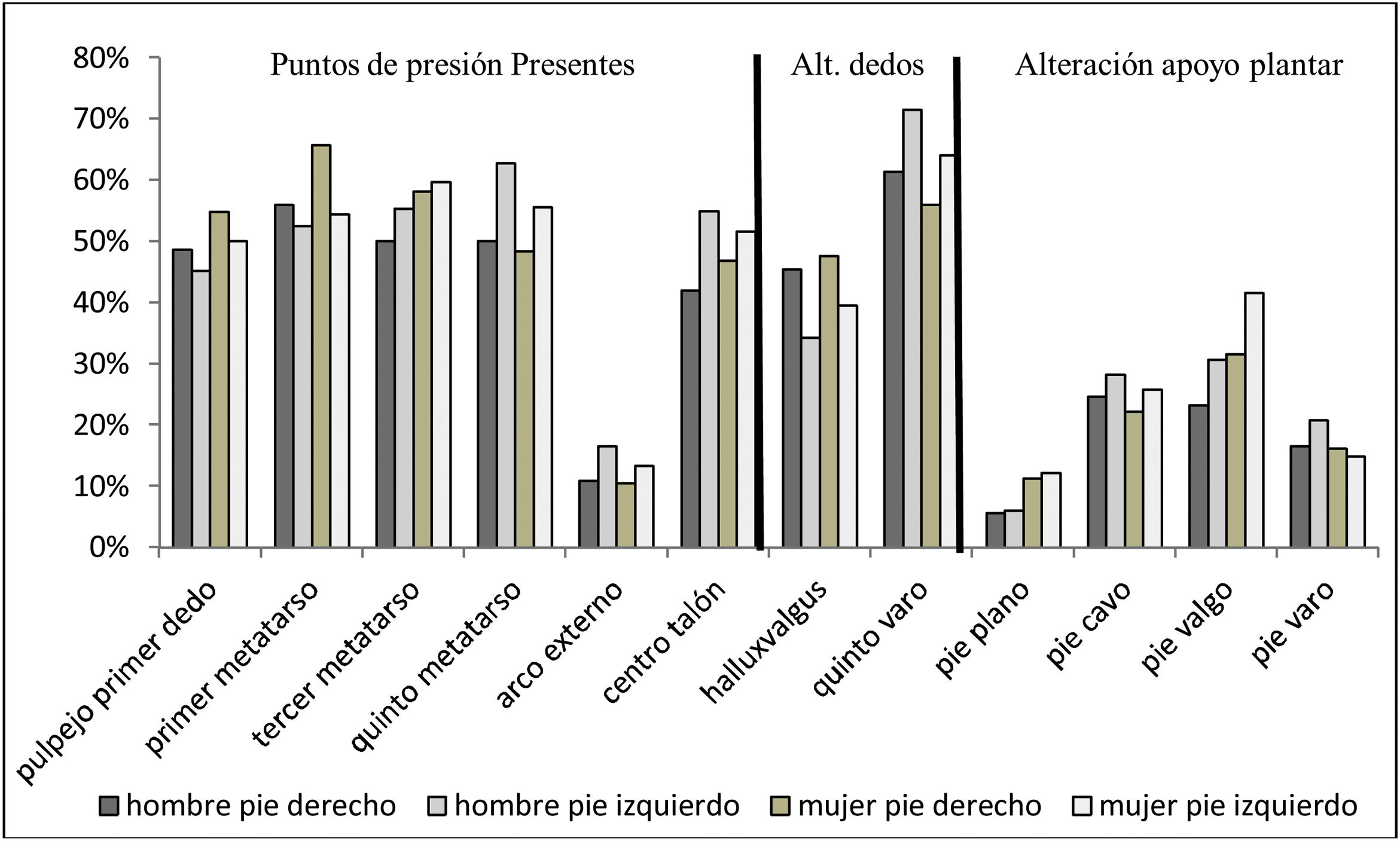
En la figura 2 se muestra la distribución de las frecuencias de las DFP por pies y sexos. El pie valgo se asoció con mayor fortaleza al sexo femenino (p=0,009).
Distribución de frecuencias de alteraciones del pie por sexo.
Alt.: alteración. Las mujeres presentaron mayor porcentaje de alteración respecto a los varones en primer metatarso p=0,02; pie plano derecho p=0,01; pie valgo derecho p=0,03 y pie plano izquierdo p=0,01. El resto de deformidades, no hubo asociación significativa p≥0,05.
En la tabla 3 se muestra la asociación entre DFP y PND. Los pacientes con PND presentaron mayor porcentaje de deformidades en el ante pie que los pacientes sin PND p≤0,05.
Deformidades del pie detectadas mediante pedigrafía plantar asociadas a PND
| Deformidades presentes | PND detectada | |||||
|---|---|---|---|---|---|---|
| N total | Presente | Ausente | Valor de p | |||
| N | Porcentaje | N | Porcentaje | |||
| Pie derecho | ||||||
| Pulpejo primer dedo derecho | 322 | 30 | 40,54 | 244 | 53,30 | 0,042a |
| Primer meta derecho | 283 | 49 | 66,22 | 273 | 59,60 | 0,28 |
| Tercer meta derecho | 262 | 40 | 54,05 | 246 | 53,70 | 0,956 |
| Quinto meta derecho | 57 | 48 | 64,86 | 214 | 46,70 | 0,004a |
| Arco externo derecho | 262 | 10 | 13,51 | 47 | 10,30 | 0,401 |
| Talón derecho | 235 | 32 | 43,24 | 203 | 44,30 | 0,862 |
| Hallux derecho | 247 | 35 | 47,30 | 212 | 46,30 | 0,872 |
| Quinto varo derecho | 313 | 46 | 62,16 | 267 | 58,30 | 0,531 |
| Pie plano derecho | 44 | 6 | 8,11 | 38 | 8,30 | 0,956 |
| Pie cavo derecho | 125 | 22 | 29,73 | 103 | 22,50 | 0,173 |
| Pie valgo derecho | 144 | 20 | 27,03 | 124 | 27,10 | 0,993 |
| Pie varo derecho | 87 | 11 | 14,86 | 76 | 16,60 | 0,709 |
| Pie izquierdo | ||||||
| Pulpejo primer dedo izquierdo | 252 | 35 | 47,30 | 217 | 47,40 | 0,989 |
| Primer meta izquierdo | 284 | 44 | 59,46 | 240 | 52,40 | 0,259 |
| Tercer meta izquierdo | 305 | 46 | 62,16 | 259 | 56,60 | 0,365 |
| Quinto meta izquierdo | 316 | 49 | 66,22 | 267 | 58,30 | 0,198 |
| Arco externo izquierdo | 80 | 17 | 22,97 | 63 | 13,80 | 0,040a |
| Talón izquierdo | 248 | 39 | 52,70 | 245 | 53,50 | 0,899 |
| Hallux izquierdo | 195 | 35 | 47,30 | 160 | 34,90 | 0,041a |
| Quinto varo izquierdo | 362 | 54 | 72,97 | 308 | 67,20 | 0,327 |
| Pie plano izquierdo | 47 | 6 | 8,11 | 41 | 9,00 | 0,812 |
| Pie cavo izquierdo | 144 | 23 | 31,08 | 121 | 26,40 | 0,402 |
| Pie valgo izquierdo | 190 | 26 | 35,14 | 164 | 35,80 | 0,911 |
| Pie varo izquierdo | 96 | 14 | 18,92 | 82 | 17,90 | 0,833 |
PND: polineuropatía definida.
En el análisis multivariante, la edad >75 años y la HbA1c>7,5% se relacionaron con la presencia de PND: OR: 6,71; IC 95%: 1,34-33,63; p=0,02 para la edad, y OR; 8,92; IC 95%: 2,116-37,637; p=0,003 para la HbA1c. En relación a las DFP, la presencia del punto de presión plantar en la 5.ª articulación metatarso falángica del pie derecho, se relacionó con PND, OR: 2,32; IC 95%: 1,275-5,14; p=0,01 (tabla 4).
Modelo de regresión entre grupo sin complicaciones y grupo polineuropatía definida detectada
| Modelo simple | Ajustado por edad y sexo | Modelo multivariante | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| OR | IC 95% | Valor de p | OR | IC 95% | Valor de p | OR | IC 95% | Valor de p | ||
| Deformidades del pie | Pulpejo primer dedo derechoa | 2,09 | (1,165-3,739) | 0,013 | 3,02 | (1,393-6,553) | 0,005 | 2,32 | (1,188-4,546) | 0,014 |
| 5.ª articulación metatarsofalángica derechob | 1,92 | (1,062-3,456) | 0,031 | 2,77 | (1,216-6,294) | 0,015 | 2,56 | (1,275-5,149) | 0,008 | |
| Hallux valgus izquierdo | 1,84 | (1,022-3,329) | 0,042 | 1,82 | (0,780-4,247) | 0,166 | 2,41 | (0,886-6,579) | 0,085 | |
| Antropométricas | Edad (75-85 años)b | 4,50 | (1,117-18,132) | 0,034 | 9,02 | (1,665-48,875) | 0,011 | 6,71 | (1,340-33,634) | 0,021 |
| Sexo mujer | 1,16 | (0,664-2,035) | 0,598 | 1,06 | (0,539-2,091) | 0,863 | 0,90 | (0,415-1,949) | 0,789 | |
| Control metabólico | Glucemia <151mg/dla | 2,44 | (0,690-8,657) | 0,166 | 3,06 | (1,032-9,054) | 0,040 | 6,62 | (1,209-36,192) | 0,029 |
| HbA1c>7,5b | 2,35 | (0,840-6,554) | 0,104 | 3,27 | (0.129-83,04) | 0,470 | 8,92 | (2,116-37,637) | 0,003 | |
IC 95%: intervalo de confianza del 95%; OR: odds ratio.
El modelo de valoración cuantitativa, ha mostrado distintas manifestaciones clínicas dentro de la misma enfermedad de la DM. Posiblemente, asociadas a la evolución del complejo proceso del PD.
Como innovación, la incorporación de la sensibilidad presora a la puntuación NDS, incrementa a dos, las pruebas relacionadas con estimulación de fibra fina (sensibilidad térmica y dolorosa)2,11,21 y manteniendo las de fibra gruesa (sensibilidad presora y vibratoria)1,3,11,12, recomendadas en el actual modelo cribado del PR.
Por otro lado, la puntuación conjunta de NSS y NDS, nos permite aplicar la máxima categoría diagnóstica en atención primaria18 de «Probabilidad», diferenciando tres grupos de pacientes. Entre ellos, un Grupo sin clasificar (tabla 1), con una puntuación de alteraciones neuropáticas presentes, pero inferior a las definidas para la PND15–17, lo que probablemente represente, un estado evolutivo hacia la PND que, hasta ahora, no se ha tenido en cuenta en el actual modelo de cribado1,3,11,22.
Actualmente, el cribado neurovascular del PR en atención primaria se realiza siguiendo las recomendaciones del IWGDF 20191,3,11,13 mediante valoración cualitativa centrada en el pie sensible o insensible y la presencia o ausencia de pulsos pedios. Por otro lado, la ADA (2021)2, centra la valoración neurovascular en la persona con DM, mediante examen de signos y síntomas que incluya, inervación de fibra fina y gruesa2,21 y el ITB se recomienda en mayores de 50 años o con factores de riesgo cardiovascular2,3,19. En nuestro caso, la valoración cuantitativa sigue las recomendaciones de ambas agrupaciones.
Nuestro modelo de valoración cualitativa (fig. 1A) presenta una prevalencia de neuropatía del 47,18%, inferior al 50-52% que aportaron otros autores2,9,10,12,13. Con el mismo examen clínico, aplicando la valoración cuantitativa de síntomas y signos definidos para la PND14–19 (fig. 1B), muestra una prevalencia del 13,9%, cercano al 15% documentado por Chawla et al. (2013)23 y bastante inferior al de Cabezas-Cerrato (1998), del 26,7% en atención primaria17. Posiblemente, debido a las características de la muestra y a las mejoras del control de la DM12.
Teniendo en cuenta que, la neuropatía es el principal factor predisponente del PD1,2,11,22, en el estudio de cohortes de Abott et al. (2002)16, una puntuación >6 puntos en la escala de signos NDS, se mostró mejor predictor del PD en relación a la sensibilidad presora y vibratoria por separado. Por consiguiente, la modificación de la escala NDS y la valoración cuantitativa del PR, podría suponer una considerable mejora en atención primaria.
Tal como muestra la figura 1B, la situación clínica del ITB, permite diferenciar pacientes con isquemia o con calcificación arterial. Aunque la calcificación arterial no se considera factor agravante del PD2,6,9,12, sí se relaciona con nefropatía, calcificaciones coronarias y un riesgo incrementado de amputación1,3,24–26. Estos pacientes, al igual que los pacientes del Grupo sin clasificar, deberían identificarse en la HCI, beneficiándose de las medidas de control de sus factores de riesgo cardiovascular y prevención del PD en atención primaria1,3,12.
Otra innovación que presenta nuestro estudio es el uso de la pedigrafía plantar. Con el pedígrafo se ha objetivado la mayor frecuencia de deformidades localizadas en el antepie (fig. 2), y con mayor presencia en PND (tabla 3). Zona considerada, de alto riesgo para el PD recurrente y sus complicaciones7–10. Si bien solo hemos podido relacionar la neuropatía con los picos de presión27, en la quinta articulación metatarso falángica del pie derecho (p=0,004) (tabla 3), y con una probabilidad del OR: 2,32 (1,18-4,54) p=0,01 (tabla 4). En este caso, la incorporación del pedígrafo en atención primaria, podría mejorar la derivación preventiva multidisciplinar.
Como limitaciones, la ausencia de datos que pudieran interferir en las alteraciones neurovasculares de la población estudiada como estilos de vida, duración de la DM1,2,7,11 o la falta de otros medios no invasivos para determinar la ART en atención primaria27, podrían significar importantes limitaciones. No obstante, a pesar de estas limitaciones, nuestros resultados se han podido comparar a los de otros autores.
En nuestra serie, ser mayor de 75 años y una HbA1c>7,5%, también se correlacionaron con PND definida11,12. Por otro lado, la determinación del ITB con Doppler manual conlleva la identificación de los pulsos pedios y tibial posterior1,3,19. En nuestra serie, solo el 0,56% presentaron alteración de pulsos distales.
Como fortaleza, la valoración cuantitativa de ART presentó una escasa concordancia entre el ITB alterado y el diagnóstico de ART existente en HCI (Kappa=0,35), similar a los resultados de Pita-Fernández et al. (2017)28, con un K=0,33. Si bien las valoraciones cualitativas (síntomas y pulsos distales) no descartan la presencia o ausencia del ITB alterado, deberían considerarse prioritarias para objetivar el tipo de derivación especializada de los pacientes con DM e ITB alterado29.
Considerando que nuestros pacientes disponían de valoración estándar del PR en la HCI1,3,11,12, la escasa concordancia entre las alteraciones neurovasculares detectadas (tabla 2) y las registradas, podría suponer un infra diagnóstico de PNP y ART en nuestro entorno. Circunstancias que justifican la necesidad de validar esta metodología cuantitativa aplicable en AP para beneficio de los pacientes con DM y reforzar, el liderazgo de la atención primaria en la prevención multidisciplinar del PD1–3.
ConclusionesExiste, una diferencia de prevalencia de los condicionantes del PR en función del método de valoración neurovascular aplicados en AP. Nuestro modelo de valoración cuantitativo, mejora la identificación del PR frente al modelo cualitativo. Se necesitan estudios de validación para implementar este modelo de valoración.
Consideraciones éticasTodos los pacientes incluidos firmaron el consentimiento informado y se han tenido en cuenta las normas de la revista Semergen en la elaboración del presente manuscrito.
Se han tenido en cuenta las recomendaciones de la Declaración de Helsinki de la AMM —Principios éticos para las investigaciones médicas en seres humanos—, 64.ª Asamblea General, Fortaleza, Brasil, octubre 2013. Universidad de Navarra Centro de documentación de Bioética. Consultado en: http://www.redsamid.net/archivos/201606/2013-declaracion-helsinki-brasil.pdf?1
FinanciaciónEl estudio TERMOPIEDI fue financiado por la Sociedad Catalana de Medicina Familiar (CAMFIC) en la XIV Convocatoria de Ayudas a la Investigación 2013, Proyecto FAP 1301 y aprobado por el Comité Científico del Instituto Universitario de Investigación Jordi Gol (número: P13/086).
Conflicto de interesesLos firmantes declaran no tener ningún conflicto de intereses.