INTRODUCCIÓN
Definición
La Organización Mundial de la Salud (OMS) define la infertilidad como aquella situación referida a la pareja en la cual no sobreviene un embarazo tras un año sin la utilización de sistemas anticonceptivos1.
A nivel general existe confusión entre el término infertilidad y esterilidad. Desde el punto de vista médico, se define la esterilidad cuando la pareja, tras un año de relaciones sin tomar medidas de protección, no consigue un embarazo. Se entiende como infertilidad a la que padece una pareja que consigue una gestación que no llega a término con un recién nacido normal.
En los últimos años el manejo diagnóstico y terapéutico de la pareja infértil ha adquirido especial trascendencia. Por un lado, el aumento de la esperanza de vida junto al cambio social de la vida en pareja. Por otra parte, la mayor implicación del urólogo al no considerarse la infertilidad como un problema meramente femenino.
Todo ello hace que pueda considerarse una necesidad social el invertir todo el esfuerzo necesario en lograr que aquellas parejas que deseen descendencia la puedan conseguir.
Recuerdo anatómico
El aparato reproductor del varón está diseñado para la producción, maduración, almacenamiento e introducción en el tracto genital femenino de esperma con vistas a la fertilización. Éste se compone de2,3:
1. Órgano glandular o testículo, con una doble función: exocrina, la espermatogénesis, y otra endocrina, la producción de andrógenos.
2. La vía seminal, destinada al transporte y maduración de los espermatozoides. Está constituida por el epidídimo, el conducto deferente, el conducto eyaculador y la uretra.
3. El pene, mediante el cual el esperma se deposita en la vagina.
4. Glándulas accesorias, encargadas de segregar un medio líquido que se mezcla con los espermatozoides constituyendo el plasma seminal:
Vesículas seminales: no almacenan esperma sino que segregan un líquido viscoso, de pH alcalino, rico en fructosa (que es la fuente de energía para la motilidad de los espermatozoides después de la eyaculación). Su secreción constituye la mayor parte del volumen del semen.
Próstata: mantiene una secreción continua de pH ácido, constituida por ácido cítrico, fosfatasas, zinc. El contenido enzimático prostático contribuye a la licuación del coágulo de semen. Aporta un 20% del volumen del semen.
Glándulas bulbouretrales de Cowper: estos dos órganos glandulares segregan un líquido viscoso de aspecto mucinoide el cual se vacía en la uretra en el acto de la eyaculación. Aporta el 2-5% del volumen del semen.
Glándulas uretrales de Littre: de número variable, segregan un líquido viscoso que actúa como lubricante previamente a la eyaculación.
Epidemiología y etiología
Cerca del 25% de parejas no consiguen embarazo en el primer año, de quienes el 15% buscan tratamiento médico y menos del 5% permanecen sin buscar hijos. La infertilidad afecta tanto a hombres como mujeres. Éstas contribuyen en un 50%, los hombres en un 30% y ambos en el 20% restante.
La infertilidad masculina puede ser el resultado de anormalidades urogenitales congénitas o adquiridas, infecciones del tracto genital, elevada temperatura escrotal (varicocele), factores endocrinos, causas genéticas o factores inmunológicos. No se encuentra factor causal en el 60-75% de los casos (infertilidad masculina idiopática). En este último caso los varones tienen exploración física y pruebas de laboratorio normales. El análisis del semen revela un descenso del número de espermatozoides (oligozoospermia), descenso de la motilidad (astenozoospermia) y pueden encontrarse formas anormales (teratozoospermia). Estas anormalidades se conocen como síndrome oligo-asteno-teratozoospermia (OAT). En la tabla 1 se resumen las principales causas de infertilidad masculina.
Factores pronósticos
Los principales factores que influyen en el pronóstico son:
Duración de la infertilidad.
Infertilidad primaria o secundaria.
Resultados del análisis del semen.
Edad y capacidad fértil de la pareja femenina.
Cuando la duración de la infertilidad excede de 4 años, el índice de concepción por mes es sólo del 1,5%. El índice de concepción por mes o tasa de embarazo por mes es el número de embarazos conseguidos por mes por cada 100 embarazos. Se considera una tasa de embarazo por mes como normal, para una pareja cuya edad materna esté comprendida entre 20 y 30 años, del 20%.
La fertilidad de una mujer de 35 años es sólo del 50% del potencial fértil de una mujer de 25 años. A los 38 años se reduce al 25% y a los 40 años es menor del 5%. La edad de la mujer es el factor individual más importante en la obtención de resultados en la reproducción asistida4.
Recomendaciones
Se recomienda que la pareja sea investigada simultáneamente.
Es importante obtener información acerca de la duración de la infertilidad, el antecedente de embarazos previos y la edad de la mujer.
INVESTIGACIONES
Análisis del semen
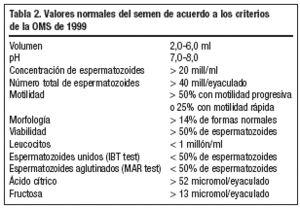
El examen andrológico estaría indicado si el análisis del semen muestra anormalidades (tabla 2).
Si los valores son normales, de acuerdo a los criterios de la OMS de 19995, un único análisis debería ser suficiente. Continuar con más investigaciones andrológicas estaría sólo indicado si los resultados son anormales en al menos dos pruebas sucesivas realizadas con 2-3 meses de diferencia1.
Es importante distinguir entre oligozoospermia (menos de 20 millones de espermatozoides/ml), astenozoospermia (menos de 50% de espermatozoides móviles) y teratozoospermia (menos del 14% de formas normales). A menudo las tres patologías ocurren simultáneamente, constituyendo el síndrome OAT. En casos extremos de síndrome OAT (menos de 1 millón/ml), como en azoospermia, hay un aumento en la incidencia de obstrucción del tracto genital masculino y anormalidades genéticas.
FALLO ESPERMATOGÉNICO PRIMARIO
Definición
El fallo espermatogénico primario (FEP) es definido por aquella alteración en la espermatogénesis causada por una condición diferente del nivel hipotálamo-hipofisario. Las formas graves de FEP tienen diferentes etiologías pero se presentan clínicamente como azoospermia no obstructiva.
La prevalencia de azoospermia en la población general se estima en el 2%6. La histología testicular mostrará diferentes grados de alteraciones espermatogénicas, desde daño tubular a hipoespermatogénesis. Hasta en casos de síndrome de sólo células de Sertoli (SCOS) es posible encontrar túbulos seminíferos con algún grado de espermatogénesis. El SCOS fue descrito por primera vez por
del Castillo (dando su nombre a este síndrome), como un
fallo testicular primario demostrando ausencia completa de células germinales y sin anormalidades de las células de Sertoli ni de Leydig7.
Dependiendo de la gravedad del proceso, los niveles de hormona foliculoestimulante (FSH) pueden estar elevados y los testes pueden estar disminuidos de tamaño y/o consistencia. Antes de la era del ICSI (inyección intracitoplasmática de espermatozoides), los niveles aumentados de FSH eran considerados un signo de fallo espermatogénico grave y no se indicaban otros procesos diagnósticos. Se ha demostrado que el ICSI8 podría también ser usado para tratar algunos casos de azoospermia no obstructiva o testicular. Sin embargo, cerca del 20% de estos casos están asociados con anormalidades cromosómicas o translocaciones genéticas del cromosoma Yq.
Etiología
Las causas de FEP se muestran en la tabla 3.
Morfología testicular
La alteración de la espermatogénesis más grave se caracteriza por esclerosis completa, donde no hay células presentes en los túbulos seminíferos.
En términos de gravedad esta alteración es seguida por aplasia completa de células germinales, SCOS o síndrome Del Castillo, donde los túbulos seminíferos están generalmente disminuidos de tamaño.
Otra alteración grave es la detención completa de la maduración espermática, caracterizada por población normal de células de Leydig y Sertoli, espermatogonias y espermatozitos, pero ausencia de espermátides y espermatozoides. Formas menos graves de alteración en la espermatogénesis incluyen hipoespermatogénesis, detención parcial de la maduración, SCOS focal y patrones mixtos.
La prevalencia estimada de azoospermia no obstructiva, determinada por biopsia testicular, está en rangos del 40% al 60%9. Para su estandarización se sugiere la utilización de sistemas de puntuación10.
Historia y examen físico
Los hallazgos típicos de la historia y el examen físico en un paciente con fallo espermático son: criptorquidia, torsión, infección genitourinaria, trauma testicular, exposición a contaminantes, medicación gonadotóxica, radioterapia y/o quimioterapia, cáncer testicular, ausencia de testes, caracteres sexuales secundarios anormales, ginecomastia, varicocele, anormalidades en el tamaño y volumen testicular.
Investigaciones
Las investigaciones rutinarias incluyen:
Análisis del semen: en azoospermias no obstructivas el análisis del semen mostrará volumen de eyaculado normal y azoospermia11.
Determinación hormonal: generalmente los niveles de FSH se correlacionan principalmente con el número de espermatogonias. Cuando estas células están ausentes o marcadamente disminuidas, los valores de FSH están generalmente elevados. Cuando el número de espermatogonias es normal pero hay obstrucción completa de espermatocitos o espermátides, los valores de FSH están dentro del rango normal. Sin embargo, en un paciente concreto, los niveles de FSH no proporcionan una predicción exacta del grado de espermatogénesis12,13. Datos preliminares indican una fuerte correlación entre niveles bajos de inhibina B y daño espermático14, aunque actualmente no se considera necesaria la determinación rutinaria de inhibina B.
Combinación de azoospermia obstructiva y no obstructiva: algunos pacientes azoospérmicos pueden presentar una combinación de patología obstructiva y no obstructiva e incremento de niveles de FSH15. Se recomienda por tanto realizar biopsia testicular en pacientes azoospérmicos con niveles altos de FSH, que se conoce o sospecha tienen obstrucción del tracto seminal, o cuando el tamaño y consistencia de un teste ha disminuido.
Biopsia testicular: está indicada en pacientes sin factores evidentes (FSH y volumen testicular normal), para diferenciar entre azoospermia obstructiva y no obstructiva. Es decir, con fines diagnósticos.
Puede también realizarse como parte de un proceso terapéutico en pacientes con evidencia clínica de azoospermia no obstructiva que deciden someterse a ICSI. Cerca del 50-60% de varones con azoospermia no obstructiva tienen algún túbulo seminífero con espermatozoides que pueden ser usados para ICSI16-18.
Tratamiento
La extracción de esperma testicular e ICSI fueron introducidos por Palermo en 19928 para el tratamiento de azoospermias obstructivas19-21. Esta técnica podría también ser usada en varones azoospérmicos que parecen tener ausencia de espermatogénesis22. Si se detectaban espermatozoides en la biopsia testicular, el ICSI con espermatozoides frescos o criopreservados se podría proponer a la pareja.
El cariotipo y el cribaje de deleciones del cromosoma Yq están indicados para analizar algunas consecuencias terapéuticas en la descendencia. Si se detectan anormalidades genéticas, la pareja debe ser correctamente informada y asesorada.
Técnicas de recuperación de espermatozoides de testículo y epidídimo para ICSI
En la actualidad, los espermatozoides del epidídimo y testículo pueden ser utilizados en técnicas de reproducción asistida con perspectivas de embarazo aceptables (tabla 4).
Métodos de recuperación de espermatozoides del epidídimo
El primer embarazo conseguido tras fecundación in vitro (FIV) con espermatozoides aspirados microquirúrgicamente del epidídimo fue publicado en 199523. En 1997 se obtuvieron los primeros embarazos recurriendo a esta estrategia para el tratamiento de la agenesia bilateral de conductos deferentes24.
Las indicaciones actuales para la recuperación de espermatozoides del epidídimo para técnicas de reproducción aistida son:
Agenesia bilateral de conductos deferentes.
Obstrucciones de la vía seminal imposibles de reparar mediante cirugía de la vía seminal.
Fallo de la reconstrucción microquirúrgica de la vía seminal o de la resección transuretral de conductos eyaculadores.
Azoospermia obstructiva asociada a una indicación femenina para FIV o a una edad avanzada de la mujer.
Aspiración microquirúrgica de espermatozoides de epidídimo.
Esta técnica se realiza actualmente con bloqueo anestésico del cordón espermático, abriendo el escroto y exteriorizando su contenido. Con ayuda de un microscopio se incide la túnica epididimaria exponiendo sus túbulos y aspirando el fluido epididimario con una micropipeta conectada a una jeringuilla de cristal.
En tractos genitales obstruidos, los espermatozoides con mayor movilidad se encuentran en las regiones más proximales del epidídimo, contrariamente al patrón normal de maduración espermática en ausencia de obstrucción25.
La combinación de aspiración microquirúrgica de espermatozoides de epidídimo (MESA) y FIV mostraba una tasa de gestación de sólo el 11%. Con la introducción del ICSI se mejoraron significativamente estos resultados, consiguiendo una tasa de gestación del 47%26.
Los mínimos requerimientos en cuanto al número y calidad de espermatozoides para realizar ICSI permiten la congelación de aquéllos recuperados del epidídimo sobrantes tras un primer ciclo de ICSI. No se han detectado diferencias en los resultados del ICSI con espermatozoides de epidídimo frescos o congelados27.
Aspiración percutánea de espermatozoides de epidídimo. Se suele realizar bajo bloqueo anestésico del cordón espermático. Con los dedos pulgar e índice se fija la cabeza del epidídimo dirigiendo a continuación una aguja tipo butterfly calibre 21 conectada a una jeringuilla hacia la cabeza del epidídimo.
Entre las ventajas de la aspiración percutánea de espermatozoides de epidídimo (PESA) frente a la MESA destacan:
Es menos invasiva.
La relación coste-efectividad es mejor.
Es fácil de realizar.
No compromete futuras repeticiones del procedimiento.
Sin embargo, no carece de críticas28:
Al ser un procedimiento ciego puede lesionarse la vascularización.
La calidad de las muestras es mejor tras MESA y por tanto mayor probabilidad de criopreservar.
Aspiración macroscópica de espermatozoides de epidídimo. Esta técnica también se realiza con bloqueo anestésico del cordón espermático. Tras una pequeña incisión escrotal en polo superior de testículo localizamos la cabeza del epidídimo. Se puncionan los túbulos epididimarios bajo visión directa con una aguja tipo butterfly del calibre 21 conectada a una jeringuilla con medio de cultivo, de manera similar a la PESA29. El procedimiento se puede repetir hasta comprobar que la calidad de la muestra es adecuada.
Métodos de recuperación de espermatozoides de testículo
Azoospermia obstructiva. En algunos pacientes con azoospermia obstructiva no se pueden recuperar espermatozoides del epidídimo por diversas razones: fibrosis escrotal grave posquirúrgica o inflamatoria que imposibilite exponer adecuadamente el epidídimo, obstrucciones proximales al epidídimo o ausencia de epidídimo. En estos pacientes la única fuente de espermatozoides es el testículo.
Tradicionalmente se consideraba que los espermatozoides testiculares carecían de capacidad de fecundación debido a su inmovilidad e inmadurez, hasta que en 1993 se publicó el primer embarazo tras ICSI con espermatozoides de testículo30.
La extracción de espermatozoides del testículo (TESE) por biopsia testicular abierta se realiza con la misma técnica que la utilizada para las biopsias testiculares diagnósticas.
Los espermatozoides testiculares habitualmente muestran sólo una movilidad débil; sin embargo, a veces se observan espermatozoides con movilidad progresiva. La movilidad espermática mejora notablemente tras añadir al medio unas gotas de solución de pentoxifilina o, simplemente, tras 1 ó 2 horas de incubación.
Las tasas de fecundación, división embrionaria y embarazos tras ICSI con espermatozoides testiculares son similares a las obtenidas tras ICSI con espermatozoides de epidídimo y eyaculado31,32.
Azoospermia secretora. En series de biopsias testiculares de pacientes con azoospermia secretora y niveles de FSH marcadamente elevados (mayores de 30 mUI/ml), se comprobó que en casi la mitad de las biopsias había pequeños focos de parénquima testicular con espermatogénesis preservada33. La recuperación de este escaso número de espermatozoides del testículo para ICSI es posible, habiéndose comunicado embarazos y nacidos vivos34, incluso en pacientes con niveles elevados de FSH sérica35.
No se conoce con exactitud por qué estos pacientes permanecen azoospérmicos a pesar de la existencia de focos de espermatogénesis conservada en sus testículos. Probablemente existe un umbral cuantitativo mínimo para la espermatogénesis que se debe superar para que los espermatozoides lleguen a alcanzar el eyaculado, estimándose en 4-6 espermátides maduras por túbulo36.
En estos pacientes con azoospermia secretora es necesario realizar biopsias testiculares múltiples para aumentar la probabilidad de éxito.
Como posibles complicaciones tras TESE en casos de azoospermia secretora podemos encontrar: inflamación o hematoma en el lugar de la biopsia hasta 3-6 meses tras su realización, devascularización testicular permanente y atrofia testicular37 o niveles descendidos de testosterona sérica sólo parcialmente reversibles tras un año de seguimiento.
En series grandes y recientes, las tasas de recuperación de espermatozoides alcanzan aproximadamente el 50%38,39. La ICSI tiene resultados similares utilizando espermatozoides de testículo frescos o criopreservados40,41.
Técnicas percutáneas. El TESA es la aspiración percutánea de espermatozoides de testículo a través de la introducción de una aguja butterfly calibre 21 directamente a través de la piel escrotal en el testículo42. Con una sola vía de entrada es suficiente y la aguja se dirige hacia la rete testis. En pacientes con azoospermia secretora pueden utilizarse múltiples vías de entrada.
En varones con espermatogénesis normal (azoospermia obstructiva), la aspiración testicular percutánea se asocia a altas tasas de recuperación de espermatozoides43,44; en pacientes con azoospermia secretora los resultados, por el contrario, son contradictorios45,46.
Otras indicaciones para la recuperación de espermatozoides testiculares. Los espermatozoides testiculares también se han utilizado con éxito para ICSI en pacientes que sufren de aneyaculación psicógena u orgánica47,48 y en la astenozoospermia total49.
Sin embargo, cuando todos los espermatozoides del eyaculado están muertos (necrozoospermia total), la alternativa es obtener espermatozoides del testículo. Ocasionalmente, los espermatozoides testiculares son móviles y pierden su vitalidad a lo largo del tránsito por la vía seminal, como sucede en pacientes con infección persistente del eyaculado50.
DESÓRDENES GENÉTICOS EN INFERTILIDAD
Anormalidades cromosómicas
La incidencia de anormalidades cromosómicas es aproximadamente del 5,8%51. De éstas, las anomalías en cromosomas sexuales acontecen en un 4,2%, correspondiendo el 1,5% restante a anormalidades autosómicas.
Por medio de técnicas de FIV e ICSI, es posible actualmente que con muy bajos recuentos de espermatozoides se produzcan cambios de paternidad.
Debería ofrecerse el cariotipo a todo hombre con daño en la espermatogénesis que solicita tratamiento de fertilidad por técnicas de FIV/ICSI.
Anormalidades en cromosomas sexuales
El síndrome de Klinefelter es la anormalidad cromosómica sexual más frecuente y una de las formas más comunes de hipogonadismo primario y esterilidad en el varón. Se caracteriza por un fenotipo masculino, testículos hialinizados pequeños y atróficos, azoospermia, ginecomastia y signos de déficit androgénico (poco pelo corporal y facial, poco desarrollo muscular y cuerpo eunucoide).
La función de las células de Leydig está frecuentemente dañada en hombres con síndrome de Klinefelter52. Los niveles de testosterona pueden estar normales o disminuidos, el estradiol normal o aumentado y la FSH aumentada. Sorprendentemente, la libido es a menudo normal a pesar de los niveles bajos de testosterona.
La presencia de células germinales y la producción de esperma son variables. La producción de espermatozoides 24,XY se ha recogido en el 0,9-2,1% de hombres con mosaicismo Klinefelter53,54 y en el 1,36-25% de varones con cariotipo 47,XXY55. Esto podría indicar que algunas células 47,XXY son capaces de conseguir meiosis y producir espermatozoides maduros. Contrariamente, no se conoce si el esperma haploide en pacientes con síndrome de Klinefelter es siempre el resultado de un clon de células normales en una población de mosaico o si, en ciertas circunstancias, algunas células germinales 47,XXY son viables y capaces de producir esperma haploide.
Pacientes con síndrome de Klinefelter tienen incrementada la posibilidad de producir espermatozoides 47,XXY. Cuando se realiza ICSI/FIV se debería realizar un diagnóstico pre-implantación o, si no se dispone, amniocentesis y cariotipo. Aquellos embriones que presenten cariotipo Klinefelter no se deberían implantar.
Anormalidades autosómicas
Es necesario el consejo genético en hombres en los que se conoce un defecto autosómico y preguntar por tratamientos de fertilidad incluyendo FIV/ICSI.
El consejo genético se debería ofrecer a todas las parejas donde se conoce que el hombre padece una anormalidad autosómica en el cariotipo. Cuando surge conflicto entre el deseo de la pareja y el interés del futuro hijo, puede ser éticamente correcto negar el tratamiento. En general, la mejor dirección es estar de acuerdo en el tratamiento con la pareja, exponiendo toda la información acerca del riesgo genético.
Defectos genéticos
Vinculados al cromosoma X
El varón tiene un solo cromosoma X. El defecto puede ser transmitido a sus hijas pero no a sus hijos.
El síndrome de Kallman es una enfermedad autosómica recesiva que asocia: hipogonadismo-hipogonadotrófico idiopático56, anosmia, asimetría facial, criptorquidia, anormalidades renales, etc. Los déficit gonadotróficos aislados pueden ser tratados con sustitución hormonal.
El síndrome de Reifenstein o insensibilidad a los andrógenos es también una enfermedad autosómica recesiva. El defecto en el gen del receptor androgénico está localizado en Xq11-1257. Son varones con niveles de testosterona altos y descensos en los recuentos espermáticos. Se suele asociar a hipospadia u otra anormalidad genital.
Vinculados al cromosoma Y
En el cromosoma Y se han descrito al menos 15 familias de genes involucrados en la espermatogénesis58. Estos genes se localizan en la región eucromática y en la denominada región o factor asociado a azoospermia (AZF).
Se han publicado largas series de microdeleciones del cromosoma Y. Éstas pueden ocurrir en población fértil59, aunque hay más prevalencia en población infértil. La frecuencia de estas deleciones del cromosoma Y entre varones infértiles es del 12% en azoospérmicos y del 3% en oligozoospérmicos60.
Existen cuatro regiones AZF (AZFa, AZFb, AZFc, AZFd) en las que se producen las microdeleciones, aunque ocurren con más frecuencia en la región AZFa-b-c61. En estas regiones se identifican varias familias de genes involucradas en la espermatogénesis, destacando fundamentalmente el gen DAZ, RBM, DFFRY, DBY y XXX. La anormalidad más frecuentemente recogida es la microdeleción en la región AZFc afectando al gen DAZ. El gen DAZ o gen responsable de la espermatogénesis se expresa exclusivamente en el testículo, y se cree que tiene una misión importante en el metabolismo de ARN. Los varones portadores de una microdeleción de este tipo suelen presentar una incapacidad para producir espermatozoides maduros. Sin embargo, no hay una correlación exacta entre deleción DAZ y presencia o ausencia de espermatogénesis.
Los varones con microdeleciones no tienen anormalidades fenotípicas excepto alteraciones en la espermatogénesis61,62. Como sólo existe un cromosoma Y, se puede predecir qué microdeleción podría transmitirse a los descendientes. Esto es raro en población normal, ya que sin ICSI sería poco probable que los hombres con muy bajos recuentos espermáticos fuesen padres.
La realización de la prueba de microdeleciones es actualmente necesaria, salvo en varones con azoospermia obstructiva donde la espermatogénesis debería ser normal. En varones con daño grave en la espermatogénesis se recomienda la prueba de microdeleciones antes del ICSI. La importancia de este hallazgo radica en la necesidad de consejo genético a los pacientes frente a la posibilidad de la transmisión a su descendencia de las microdeleciones: traerá como resultado que todos los fetos varones sean portadores de la misma deleción con el resultado de varones infértiles, siendo por el contrario todas las mujeres normales.
Mutaciones del gen de la fibrosis quística e infertilidad
La fibrosis quística (FQ) es una enfermedad autosómica recesiva ligada al cromosoma 7q. Es la enfermedad genética más frecuente en la raza caucásica.
El gen de la FQ codifica la proteína reguladora de la conductancia transmembranosa de la FQ (CFTR). El producto de este gen, la proteína CFTR, funciona como un canal de cloro. Si esta proteína está defectuosa, se limita el transporte de cloro a través de la membrana celular; el atrapamiento de iones cloro en el interior de la célula provoca una excesiva reabsorción de iones sodio y deseca las secreciones. La mutación más frecuente se produce en la región delta-508.
La ausencia bilateral del conducto deferente se asocia con mutaciones del gen de la FQ, encontrándose en el 2% de varones con azoospermia obstructiva63.
Recomendaciones
Se recomienda la realización de cariotipo a todo varón con daño en la espermatogénesis que va a someterse a tratamiento de fertilidad (FIV/ICSI).
Si existe un daño grave en la espermatogénesis, debería realizarse la prueba de microdeleciones del cromosoma Y.
Si existen anormalidades estructurales de los vasos deferentes, es importante detectar, a él y a su pareja, mutaciones del gen de la FQ. Si ambos son portadores, la pareja debería considerar muy cuidadosamente el ICSI. La probabilidad de un hijo con FQ es del 25% si él es heterocigoto o del 50% si es homocigoto.
AZOOSPERMIA OBSTRUCTIVA
Definición
Es la ausencia de espermatozoides y de células espermatogénicas en semen y orina posteyaculado debido a obstrucción bilateral de los conductos seminales.
Clasificación
Obstrucción intratesticular: afecta al 15%64. Pueden ser congénitas (disyunción entre la rete testis y el conducto eferente) o adquiridas (postinflamatorias o postraumáticas).
Obstrucción epididimal: comprende el 30-67%64,65, constituyendo la causa más frecuente de azoospermia obstructiva. La obstrucción epididimal congénita se manifiesta como ausencia bilateral congénita de vasos deferentes, la cual se asocia a mutaciones del gen de la FQ en el 82% de los casos66. Esta forma se acompaña a menudo de ausencia de la parte distal del epidídimo y agenesia de vesículas seminales.
Otras formas congénitas de obstrucción son más raras: disyunción entre ductos eferentes y cuerpo del epidídimo o agenesia/atresia de una parte del epidídimo.
La azoospermia causada por cirugía puede ocurrir después de la operación de un quiste epididimal.
Obstrucción de vasos deferentes: es la causa más frecuente de obstrucción adquirida (vasectomía).
Obstrucción de los conductos eyaculadores: afecta al 1-3% de varones con azoospermia obstructiva64. La obstrucción quística es generalmente congénita (quistes de los conductos mullerianos o del seno urogenital, de localización media en la próstata). Los quistes intraprostáticos laterales o paramedianos tienen su origen en el conducto de Wolf y raramente se encuentran en la práctica clínica. Las obstrucciones postinflamatorias del conducto eyaculador son generalmente secundarias a uretroprostatitis agudas o crónicas.
Obstrucción funcional distal de los conductos seminales: se atribuye a neuropatía local67. Se observa en pacientes con diabetes mellitus tipo 1 o en la enfermedad renal poliquística.
Manejo diagnóstico
Análisis de semen
Al menos 2 exámenes con un intervalo de 2-3 meses, de acuerdo a los parámetros de la OMS1. Encontraremos un volumen seminal disminuido (menor de 1,5 ml), pH ácido y descenso en los niveles de fructosa.
Historia clínica
Hay que insistir en la presencia de hematospermia, dolor posteyaculatorio, antecedentes de uretritis o prostatitis, síntomas urinarios obstructivos o irritativos, cirugía previa inguinal o traumática e infección sino-pulmonar crónica.
Exploración
Los siguientes hallazgos son indicativos de azoospermia obstructiva:
Al menos un teste mayor de 15 ml de volumen (aunque un volumen testicular pequeño puede ser encontrado en algún paciente con azoospermia obstructiva y fallo testicular parcial concomitante).
Epidídimo alargado y duro.
Nódulos en el epidídimo o vasos deferentes.
Ausencia o atresia parcial de los vasos.
Signos de uretritis.
Anormalidades prostáticas.
Niveles hormonales
La FSH puede ser normal pero no excluye una causa testicular de azoospermia. De hecho, la FSH es normal en el 40% de varones con FEP.
La inhibina B parece tener un alto valor predictivo para la presencia de espermatogénesis normal14.
Ecografía
Son indicativos de obstrucción los siguientes signos: dilatación de la rete testis, engrosamiento del epidídimo con lesiones quísticas o la ausencia de los deferentes.
Nos ayuda también a excluir signos de disgenesia testicular (arquitectura testicular no homogénea y microcalcificaciones).
Biopsia testicular
Indicada para excluir fallo espermatogénico en algunos casos. El simple proceso quirúrgico puede también ser usado para TESE para criopreservación y posterior ICSI, cuando la recanalización quirúrgica no puede ser realizada.
Evaluación del tracto seminal distal
Consiste en canalizar cada vaso deferente e inyectar solución salina con 0,5 ml al 10% de azul de metileno. Si la solución salina pasa fácilmente, la evaluación radiológica con contraste y rayos X podría ser evitada.
Tratamiento
Obstrucción intratesticular
La recanalización de los conductos seminales a este nivel es imposible, por lo que se recomienda TESE o aspiración con aguja fina. Estos espermatozoides pueden ser usados para ICSI o criopreservados.
Obstrucción epididimal
La MESA es recomendada en varones con ausencia bilateral congénita de los deferentes68. En pacientes con obstrucción adquirida, la epididimovasostomía microquirúrgica es lo recomendado.
Obstrucción proximal del deferente
Estaría indicada la realización de vasovasostomía. Cuando los espermatozoides están ausentes en el fluido intraoperatorio, puede estar presente una segunda obstrucción epididimaria, especialmente si el fluido seminal del vaso proximal tiene una apariencia gruesa en "pasta de dientes". La vasoepididimostomía microquirúrgica estaría indicada.
Obstrucción distal del deferente
En el caso de bilateralidad: TESE/MESA.
Obstrucción de los ductos eyaculadores
En obstrucciones postinflamatorias y cuando están englobados en quistes intraprostáticos de línea media: resección transuretral de ductos eyaculatorios69. Como alternativas: MESA, TESE, aspiración del deferente proximal, aspiración de vesículas seminales o la aspiración del quiste guiada por ecografía.
Conclusión
Sospechar lesión obstructiva del tracto seminal en casos de azoospermia u oligozoospermia grave en pacientes con testes de tamaño normal y parámetros endocrinos normales.
Recomendaciones
En obstrucción epididimal: MESA.
En obstrucción del ducto eyaculatorio por quiste prostático de línea media: resección transuretral.
Ante la sospecha de obstrucción adquirida: biopsia testicular y evaluación del ducto seminal distal.
VARICOCELE
Introducción
Desde el punto de vista andrológico, el varicocele tiene una serie de implicaciones:
Fallo en el desarrollo y crecimiento testicular ipsilateral.
Provoca malestar y dolor.
Posible causa de infertilidad.
Clasificación
Desde el punto de vista clínico1 se puede clasificar el varicocele como:
Subclínico: no palpable ni visible con la maniobra de Valsalva pero demostrable mediante exploración con Doppler.
Grado 1: palpable durante el Valsalva.
Grado 2: palpable sin maniobras pero no visible.
Grado 3: palpable y visible sin maniobras.
Diagnóstico
El diagnóstico se realiza mediante examen clínico y confirmado por Doppler color1.
Consideraciones
El varicocele está presente en el 2-22% de adultos70. Es más frecuente en varones infértiles, afectando al 25% de éstos con anormalidades del semen71.
La incidencia de dolor y malestar asociado con el varicocele es del 2-10%72.
La asociación exacta entre infertilidad masculina y varicocele es desconocida. Según datos de la OMS, el varicocele se relaciona con anormalidades del semen, descenso del volumen testicular y descenso en la función de las células de Leydig.
Varios estudios sugieren que las alteraciones en el perfil endocrino de hombres con varicocele (exagerada respuesta al factor estimulante) pueden predecir quiénes se beneficiarán del tratamiento73.
Los adolescentes que reciben tratamiento del varicocele muestran aumento del crecimiento ipsi y contralateral74.
Tratamiento
Existen diversas modalidades (escleroterapia, embolización, cirugía abierta, laparoscopia), aunque el tipo de intervención depende principalmente de la experiencia del cirujano.
Recomendaciones
El tratamiento está recomendado para adolescentes que tienen fallo progresivo en el desarrollo testicular documentado por exámenes clínicos seriados.
No hay evidencia de beneficio en el tratamiento del varicocele en adolescentes que no tienen atrofia testicular ipsilateral ni alteraciones endocrinas.
Estudios controlados y randomizados y metaanálisis de estudios randomizados no encuentran beneficio en la fertilidad después de la ligadura del varicocele en adultos75. El tratamiento del varicocele para la fertilidad no debe de realizarse al menos hasta no exponer al paciente la incertidumbre sobre los beneficios del tratamiento.
INFERTILIDAD MASCULINA IDIOPÁTICA
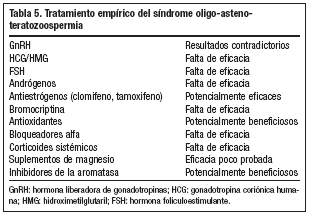
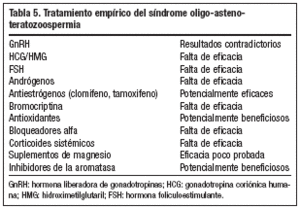
En el estudio de muchos varones con infertilidad se encuentra que tienen una OAT idiopática o también conocida como síndrome OAT. La causa no demostrable de infertilidad masculina se encuentra en un 40-75% de varones infértiles. Se discute el tratamiento médico en estos casos.
Tratamiento empírico
Aunque se ha utilizado una amplia variedad de tratamientos médicos, existe una baja evidencia científica para un planteamiento empírico76 (tabla 5). Existe consenso en que únicamente los estudios controlados y randomizados, con embarazo como parámetro objetivo, pueden ser aceptados para un análisis eficaz. El uso de FSH recombinante humana en pacientes con oligozoospermia idiopática con FSH e inhibina B normal puede ser la elección debatida en el futuro para mejorar la espermatogénesis. Aun así, son necesarios más estudios.
Recomendaciones
El tratamiento médico de varones infértiles sólo puede ser aconsejado en casos de hipogonadismo hipogonadotrófico.
Los fármacos son generalmente ineficaces en el tratamiento de hombres con infertilidad idiopática.
El efecto de algunos tratamientos de infertilidad debería ser valorado frente a la concepción espontánea.
El tamoxifeno y la testosterona pueden incrementar el índice de concepción en una selección de hombres con oligozoospermia idiopática.