INTRODUCCIÓN
La Organización Mundial de la Salud (OMS), al igual que las leyes españolas, apuestan por un uso racional de los medicamentos. Entendemos el medicamento como un "instrumento de salud" y no como un bien de consumo, por lo que su uso debe adecuarse a las necesidades de cada individuo. Sin embargo, el creciente protagonismo de las empresas farmacéuticas conduce a situaciones donde los criterios del mercado pueden entrar en conflicto con los aspectos éticos o las prioridades de Salud Pública1, sobre todo con las más recientes legislaciones sobre publicidad y marketing farmacéutico.
Por otra parte, la OMS ve en la automedicación responsable una fórmula válida de atención a la salud en las sociedades desarrolladas. La automedicación se ha definido de forma clásica como: "el consumo de medicamentos, hierbas y remedios caseros por propia iniciativa o por consejo de otra persona, sin consultar al médico". Hoy en día, la automedicación responsable debería ser entendida como: "la voluntad y capacidad de las personas o pacientes para participar de manera inteligente y autónoma (informados) en las decisiones y en la gestión de las actividades preventivas, diagnósticas y terapéuticas que les atañen"2,3. Según esta definición, para una automedicación responsable es necesario realizar un importante esfuerzo en la formación de la población, en cuanto al manejo de su salud.
En nuestros días, la publicidad muestra a menudo una realidad muchas veces deformada, cuyo único objetivo es favorecer el consumo sin límites de todo tipo de productos, sin reflexionar en los posibles impactos o perjuicios. En los últimos años también se ha fomentado la "cultura de la píldora", es decir, se utilizan los medicamentos de forma que responden a una creencia desmesurada de sus poderes, en lugar de a su propósito sanitario4.
La política de promoción directa a los pacientes para fomentar el consumo de fármacos comenzó con el mercado de medicamentos sin receta, donde lógicamente no es necesaria la intervención del médico; son los medicamentos conocidos en el mundo anglosajón como OTC (over the counter) y en España como EFP (especialidad farmacéutica publicitaria). Éstos son fármacos enfocados al tratamiento de patologías banales o de síntomas menores. Pueden ser anunciados directamente al consumidor en la mayoría de los países occidentales, aunque la regulación y el sistema de autorización de la publicidad es diferente en ellos. Además los medicamentos EFP cumplen la característica común de que no son medicamentos financiables y se pueden dispensar sin receta médica.
Aparte de las EFP, el marketing publicitario de medicamentos de los últimos años ha introducido nuevos conceptos, tales como el de "marcas paraguas", refiriéndose puntualmente a especialidades EFP con nombre comercial similar al original y que, según sus indicaciones, reciben prefijos o sufijos en este nombre. A éstas se les permitiría estar dentro y fuera de la financiación pública (con y sin receta médica) y el principal objetivo para la industria es empujar el mercado de las EFP.
El último concepto al respecto es el de DTCA (direct-to-consumer-advertising) o publicidad directa a los ciudadanos de medicamentos con receta médica, y que por tanto mantienen el mismo nombre comercial que el original. En la actualidad sólo es legal este tipo de publicidad en EE.UU., desde principios de los años 80, y en Nueva Zelanda desde mucho antes, sin que se haya instaurado en ningún país europeo5.
JUSTIFICACIÓN
El gran desarrollo de la industria farmacéutica y la aparición de nuevos conceptos en el marco de la misma hace evidente la necesidad de una puesta al día dirigida a los médicos de Atención Primaria (AP). Son ellos quienes deben enfrentarse todos los días, ya no sólo a esta nueva terminología, sino también a la publicidad directa que le llega al usuario, con las consecuencias y dudas que su utilización puede producir en el mismo. Con este artículo se pretende familiarizar al médico con estos conceptos, con el objetivo posterior de realizar una encuesta desde la Sociedad Española de Medicina Rural y Generalista (SEMERGEN), para conocer sus impresiones y opiniones con respecto a la automedicación responsable, marketing farmacéutico y atención farmacéutica.
AUTOMEDICACIÓN RESPONSABLE
Situación actual de la automedicación en España
En los últimos diez años han existido varios decretos de financiación selectiva que han hecho que determinadas especialidades farmacéuticas, que estaban enfocadas al tra-tamiento de síntomas menores o con una menor utilidad terapéutica, se excluyan de la financiación públca. Al tiempo que estas especialidades se han excluido de la financiación del sistema público, la automedicación en España ha ido aumentando. Por otro lado, se estima que sólo una tercera parte de la población con problemas comunes de salud llega a ser tratada por su médico6.
Según la Encuesta Nacional de Salud de 2001, la automedicación en España representa un 15% del consumo en medicamentos del Sistema Nacional de Salud, y un 8% del gasto público en medicamentos. Además, los resultados hasta ahora obtenidos de la última Encuesta Nacional de Salud en España de 2003 revelan entre otros muchos, los siguientes datos7:
El 53,4% de los ciudadanos consume fármacos, pese a que siete de cada diez afirman encontrarse «bien o muy bien».
En consonancia con el punto anterior, un 23,4% de hombres y un 31,6% de mujeres afirman haber acudido al médico en las últimas dos semanas.
La adquisición de fármacos aumenta con la edad. En concreto, cuando son interrogados al respecto, un 86,4% de los mayores de 65 años confiesa haber tomado algún medicamento en el último año7,8.
El 40% de la denominada automedicación se realiza con fármacos de prescripción; es decir, precisan de receta para su dispensación, pero se obtienen sin ella6.
Enseñar a automedicarse
Conviene resaltar que no toda automedicación es inadecuada por sí misma; se debe abogar por una "automedicación responsable". Las diferencias entre este tipo de automedicación y la clásica se encuentran principalmente en los siguientes puntos:
La automedicación responsable requiere un conocimiento previo de los síntomas (leves y menores) hacia los que van dirigidos los medicamentos (Asociación Médica Mundial, 2002).
Se contrapone a la autoprescripción, o uso indiscriminado de fármacos sin indicación ni supervisión facultativa ("por indicación de un familiar o conocido")9.
Incrementa la autonomía y responsabilidad de las personas en su salud.
Para fomentar una automedicación responsable, el mayor esfuerzo radica en la educación para la salud: "enseñar a automedicarse", que incluye10:
Información sobre la enfermedad: su origen, gravedad y complicaciones: debe usarse un lenguaje sencillo.
Consejo terapéutico sobre el fármaco, la dosis, los efectos adversos, la duración y la actuación a realizar si existe mejoría o agravamiento del proceso patológico. Para ello se requiere un lugar con medios apropiados y asegurar la confidencialidad de los datos.
Educación: qué hacer en episodios similares y qué fármacos tomar; identificación de signos de alarma que obligan a consultar al médico, actitud positiva frente a la auto- observación, favorecer la colaboración y la comunicación.
Para llevar a cabo una formación adecuada en automedicación responsable se precisan una serie de requisitos:
Disponer de profesionales con conocimientos sobre educación para la salud.
Disponer, además, de profesionales con conocimientos sobre la enfermedad, síntomas (detección de síntomas mayores y menores mediante anamnesis, exploración del paciente y establecimiento del diagnóstico de forma adecuada), epidemiología y detección de problemas relacionados con la medicación.
Garantizar el seguimiento del paciente desde su diagnóstico, conocimiento de pluripatología y polimedicación, asegurando la continuidad e integridad de la atención al paciente, lo que requiere de un lugar y medios adecuados.
Con respecto a este tema, concluiremos afirmando que sin una actividad educativa sobre el uso de fármacos, el cambio de legislación sobre la adquisición y publicidad de medicamentos no garantiza una mejor utilización de los mismos.
LA PUBLICIDAD DE MEDICAMENTOS: ESPECIALIDADES FARMACÉUTICAS PUBLICITARIAS
Marco legislativo
En España el marco legislativo por el que se rige la publicidad de medicamentos EFP se basa, fundamentalmente, en las siguientes normativas específicas:
Real Decreto 1416/1994 de 25 de junio11
Regula la publicidad de medicamentos de uso humano, especialmente en lo que se refiere a los principios de seguridad, eficacia y uso racional de los medicamentos, así como a las garantías de información para el público y a la necesidad de autorización sanitaria y evaluación previa a dicha autorización. En cuanto a este Decreto caben destacar tres aspectos:
1) Para que se produzca la autorización de la publicidad de un medicamento son necesarios una serie de requisitos, entre los que cabe señalar un informe del servicio científico de la empresa farmacéutica responsable, en el que se justifica la conformidad con lo señalado en la legislación de la publicidad de dicho medicamento.
2) Es obligatorio no equiparar en el mensaje publicitario el medicamento a otros productos relacionados con la salud, ya sean alimenticios, cosméticos o de cualquier otro tipo.
3) Además hace distinción entre la publicidad de medicamentos destinados al público en general (capítulo II de dicho Real Decreto), y la publicidad dirigida a las personas facultadas para prescribir o dispensar medicamentos (capítulo III).
Real Decreto 2236 de 17 de diciembre de 199312
Regula el etiquetado y prospecto de los medicamentos de origen humano, que en su artículo 7 hace referencia a los EFP, en cuanto a que no se admitirá la denominación de estos medicamentos si ésta es igual o induce a confusión con el de otra especialidad que no tenga la condición de ser publicitaria.
Orden Ministerial de 10 de diciembre de 198513
En ella se especifica qué tipo de medicamentos pueden destinarse como EFP y qué requisitos deben cumplir para ello: deberían ser "especialidades farmacéuticas dirigidas al alivio o tratamiento de síndromes o síntomas menores, que no precisan de la atención médica, con libre uso y dispensación sin receta médica, y deben tener una composición definida, cuyos integrantes han sido sancionados como útiles e inocuos para su uso".
Por su parte, Farmaindustria dispone de:
Código de buenas prácticas para la promoción de los medicamentos
Se adaptó en el año 1992 para que cumpliera las disposiciones introducidas por la Directiva 92/28/CEE y se ajustó de nuevo el 18 de febrero y el 17 de junio de 2003, con la introducción de nuevas medidas, las cuales se aprobaron el 20 de enero de 200414.
Asociación de autocontrol de la publicidad (AAP)
Legitimada para intervenir, administrativa y judicialmente, ante supuestos de publicidad ilícita, de tal forma que las empresas se vigilan unas a otras, y cuando detectan infracciones entre ellas se denuncian y presentan una reclamación (autorregulación).
Pese a esta normativa estricta, cada vez son más frecuentes las violaciones por parte de la industria de las reglamentaciones sobre la publicidad farmacéutica.
Publicidad dirigida a la población general
En una evaluación realizada por Consumers International (organización no gubernamental que congrega grupos de defensa de los consumidores en todo el mundo), realizada en periódicos y revistas de 11 países, se concluye que, en un 98% de los casos, la propaganda no cumplió las normas existentes dirigidas a la protección del consumidor.
Publicidad dirigida a los profesionales
La Escuela Valenciana de Estudios para la Salud realizó un análisis en 1997, llegando a las siguientes conclusiones4:
1) En el 44% de los anuncios de medicamentos se encontró un uso inapropiado de citas bibliográficas.
2) La irregularidad más frecuentemente detectada era la promoción de un fármaco para un grupo de pacientes distinto al que fue evaluado en el ensayo que es citado por el laboratorio.
Con todo ello, se puede concluir que, en la actualidad, las normas que regulan la publicidad destinada a promocionar fármacos, aunque parecen estrictas, no consiguen evitar casos de desinformación de los usuarios o pacientes.
Medicamentos de especialidades farmacéuticas publicitarias en España
La Ley del Medicamento establece tres grupos de especialidades farmacéuticas, en función de su sistema de financiación:
1) Especialidades financiables, con cargo a fondos de la Seguridad Social o a fondos estatales. Estas especialidades tienen un control estricto sobre el precio (precio intervenido) y no se puede hacer publicidad dirigida a la población, sino sólo a los profesionales.
2) Especialidades farmacéuticas publicitarias (EFP). En éstas, el farmacéutico de la oficina de farmacia está autorizado a realizar un descuento, que nunca superará el 10% de lo que marca el envase. Son las únicas especialidades de las que se puede hacer publicidad directa al consumidor.
3) Especialidades reembolsables por la Seguridad Social, no publicitarias y de precio libre (productos dietoterápicos).
El Ministerio de Sanidad es el responsable de aprobar y publicar, mediante una Orden Ministerial (OM), el listado de principios activos susceptibles de ser empleados como EFP. Esta OM se actualiza anualmente, tanto en lo que se refiere a nuevas inclusiones, como exclusiones. Las modificaciones pueden ser a petición de la ANEFP (Asociación Nacional de Especialidades Farmacéuticas Publicitarias, también conocida como Asociación para el Autocuidado de la Salud), de alguna compañía farmacéutica o de la propia Administración. En este sentido, España posee, en cuanto a la legislación de EFP, algunas diferencias importantes con respecto al resto de Europa:
1) Los principios activos susceptibles de integrar una EFP deben estar incluidos en una lista positiva.
2) La publicidad necesita de una autorización previa del Ministerio de Sanidad. En la mayoría de los países europeos se rigen por sistemas de autorregulación (las propias empresas tienen capacidad de control y regulación de la publicidad de medicamentos).
3) España es el único país de la Unión Europea donde coexisten EFP junto a medicamentos de prescripción, con las mismas indicaciones y composición.
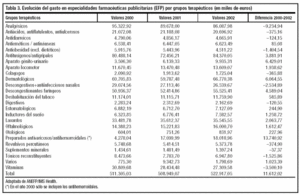
El listado de los grupos terapéuticos que pueden comercializarse como EFP en España se representa en la tabla 1. Contiene más de 300 principios activos, por lo que se ha alcanzado casi el mismo nivel de la Unión Europea. En la última OM 2800/2004 se ha aprobado la inclusión de nueve principios más, que se reflejan en la tabla 2. Entre ellos se incluyen algunos hasta ese momento financiables (por ejemplo, dexclorfeniramina) que, al pasar a EFP, quedan excluidos de la financiación pública, lo que conllevaría al uso mediante receta médica de otras generaciones de antihistamínicos menos conocidas. También se han modificado dosis y restricciones para determinados principios activos, como ha sido el caso del ácido acetilsalicílico, que únicamente se podrá emplear en pacientes mayores de 16 años, tanto en la especialidad comercializada como EFP, como en su indicación mediante receta médica15.
Ventajas e inconvenientes de las especialidades farmacéuticas publicitarias
Las posibles ventajas que pueden ofrecer este tipo de especialidades farmacéuticas son16-18:
1) Fomentar la automedicación responsable.
2) Disminuir los costes: reducir la factura del gasto público, al transferirlo al gasto privado.
3) Ahorrar tiempo al profesional sanitario y al ciudadano, al disminuir el número de consultas de AP por síntomas menores.
Entre los principales inconvenientes del uso de EFP se encuentran:
Los usuarios no reciben siempre una correcta información, lo que hace que tengan que tomar decisiones sobre bases incorrectas y bajo la presión de la publicidad.
Aumento de los costes. La reducción de los costes directos del gasto farmacéutico del Sistema Nacional de Salud (SNS) debe ajustarse por los costes indirectos, derivados de un mayor consumo de medicamentos y de los efectos adversos secundarios a una mala utilización de los mismos.
Medicalización de la vida cotidiana. Aumento de la automedicación irresponsable, con una mayor desconfianza tanto de usuarios como de los profesionales sanitarios.
No permite obtener una información comparativa, ya que los medicamentos que se anuncian son los últimos aparecidos en el mercado y en ningún momento se hace referencia a otros productos igualmente eficaces o a tratamientos alternativos no medicamentosos.
La mayoría de la automedicación en España se realiza con analgésicos y antibióticos, según la Encuesta Nacional de Salud del año 2001, y las influencias sobre el ciudadano de los aspectos negativos de las EFP se reflejan, entre otros, en los siguientes hechos:
En cuanto al uso de analgésicos, la exposición masiva de la sociedad a estos medicamentos se produce en todos los grupos de edad (desde 1994 la venta de analgésicos ha subido un 23%). El 11% de todos los casos de insuficiencia renal es atribuido al consumo de este tipo de medicamentos; además, su abuso en el tratamiento de enfermedades como la cefalea ha derivado en la aparición de nuevas formas clínicas de la misma: cefalea crónica diaria19.
Respecto a los antibióticos, en España, de los 80 millones de envases anuales de antibióticos, el 25% son consumidos en automedicación, siendo uno de los países con mayores tasas de resistencias bacterianas20.
Otros datos que reflejan la necesidad de educación del paciente en automedicación responsable son los siguientes:
El 73% de los usuarios piensan que están capacitados para automedicarse, el 55% admite que la forma más habitual de recomendación es a través de la familia y amigos: automedicación irresponsable21.
Por otro lado, el 35% de los ancianos experimenta reacciones adversas derivadas de su medicación y éstas son el motivo de ingreso hospitalario hasta en un 13% de los casos22.
A modo de conclusión, entre los riesgos que el uso de EFP pueden conllevar en el ciudadano están: el diagnóstico inadecuado por parte de los pacientes a partir de sus síntomas, el retraso en la obtención del tratamiento adecuado, el aumento en la resistencia a antimicrobianos por un uso inadecuado de los mismos, el aumento del coste para los pacientes, la falta de atención a las instrucciones y advertencias de los prospectos, las interacciones farmacológicas y la pérdida de control percibida por el médico sobre la enfermedad y el seguimiento del paciente.
En la mayoría de las ocasiones, la decisión de anunciar un medicamento no es una decisión sanitaria, sino comercial. Por otra parte, los resultados en Salud Pública de las investigaciones sobre marketing de medicamentos son prácticamente inexistentes, aunque sugieren un efecto deletéreo para la salud, a la vez que suponen un incremento de costes sanitarios a largo plazo (aumento de ingresos hospitalarios, etc.)23.
Marco económico de las especialidades farmacéuticas publicitarias
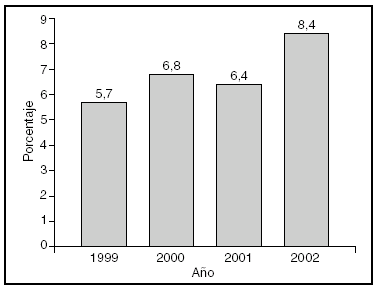
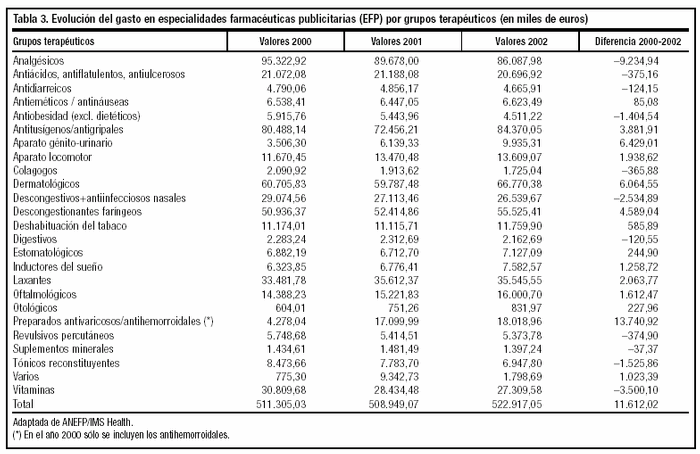
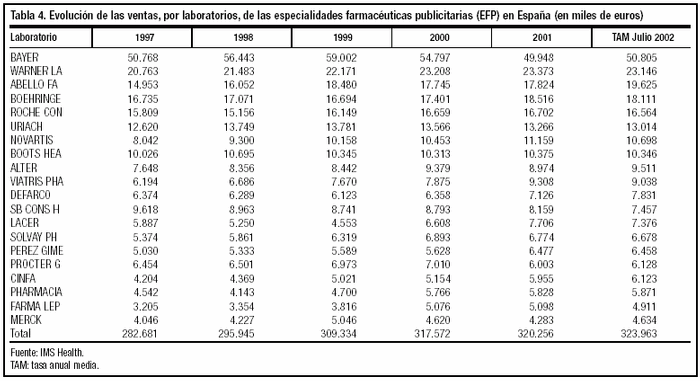
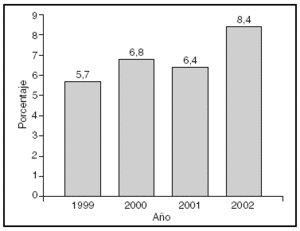
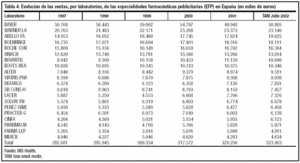
En Europa, el mercado de las EFP representa el 20% del mercado farmacéutico general. En España, según fuentes de ANEFP del año 2002, este porcentaje es menor (8,4% del total de fármacos que se venden anualmente), con una evolución desigual en los últimos cuatro años (fig. 1)24. Las ventas por grupos terapéuticos del mercado de EFP en España, así como la diferencia entre el año 2000 y el 2002 se presentan en la tabla 3 y la evolución de las mismas por laboratorio, en la tabla 425.
Figura 1. Evolución del consumo de especialidades farmacéuticas publicitarias en España (en unidades).
LÍNEAS DE FUTURO: ESPECIALIDADES FARMACÉUTICAS PUBLICITARIAS Y AUTOMEDICACIÓN RESPONSABLE
Futuro legislativo
La Asociación Europea de la Industria de Automedicación tiene entre sus objetivos conseguir la autorización de las marcas paraguas. Esto repercutiría considerablemente en el desarrollo del mercado de las EFP, y en el caso concreto de España daría un gran impulso a este sector. La Agencia Española del Medicamento (AEM) empezó a desarrollar un programa piloto con dos de estos productos, aunque actualmente la Dirección General de la AEM no considera prioritaria la investigación en este sentido26.
Es evidente que la revisión de la legislación farmacéutica que se está llevando a cabo actualmente en la Unión Europea, condicionará el escenario futuro de este tipo de productos. En este sentido, la Comisión Europea está estudiando un informe, elaborado por el G-10 (Grupo de Alto Nivel en Innovación y Provisión de Fármacos que asesora a la Comisión Europea) que defiende:
1) Que se autorice a los fabricantes de medicamentos sin receta no reembolsables, a que puedan establecer sus precios libremente.
2) Que puedan realizar publicidad de los fármacos sin prescripción en todos los medios de comunicación.
3) Que se acepten medidas que incentiven y favorezcan el paso de una especialidad de prescripción médica a especialidad sin receta (switching).
En España, como ya se ha reflejado, la evolución legislativa es más lenta, si bien existen presiones, por parte de distintas asociaciones, para un acercamiento hacia la Unión Europea y hacia una autorregulación de la publicidad y el marketing farmacéutico.
El médico de Atención Primaria y sus implicaciones en la publicidad farmacéutica
El médico de AP debe desempeñar un papel activo en la educación sanitaria de sus pacientes con respecto a la automedicación responsable, ya que ésta requiere un conocimiento previo del paciente y su enfermedad, así como continuidad en el diagnóstico, seguimiento y tratamiento. El médico es el profesional principalmente implicado en in-formar y educar sobre la enfermedad, identificar episodios similares y decidir qué hacer ante la aparición de los mismos (signos de alarma que obligan a consultar de nuevo, etc.).
De igual manera, la implicación del médico de familia en la gestión de los recursos sanitarios debe ser cada vez mayor. El empleo sistemático en la práctica asistencial cotidiana de los medicamentos que produzcan mayores ventajas (clínicas, económicas y humanísticas) y aporten valores terapéuticos adicionales, son líneas básicas en el desarrollo de un sistema de gestión de medicamentos moderno y eficiente, que debe garantizar una prestación de calidad, equitativa y sostenible27.
El farmacéutico y la automedicación responsable
El farmacéutico tiene un papel importante en el consejo terapéutico: información sobre el fármaco, dosis, efectos adversos, duración del tratamiento y qué hacer si no hay mejoría, o por el contrario existe un agravamiento de la sintomatología.
Según la Comisión Central Deontológica de la Organización Médica Colegial (OMC), el papel de estos profesionales quedaría claramente definido: "Del mismo modo que sería imprudente desperdiciar la competencia del farmacéutico en cuanto conocedor de los efectos e interacciones de los medicamentos, sería sumamente imprudente que a ellos se les asignara la capacidad de modificar los planes terapéuticos establecidos por el médico sin el conocimiento y aceptación de éste"28.
Para que el farmacéutico pueda llevar a buen fin el consejo terapéutico, se han de tener presentes una serie de necesidades29:
1) Formación y actualización de conocimientos por parte del farmacéutico.
2) Adecuación de las oficinas de farmacia y de sus profesionales.
3) Sistema informático apropiado y base de datos adecuada.
4) Garantía de confidencialidad y continuidad en la información.
Si bien el paciente puede consultar a uno u otro profesional en materia de educación y consejo terapéutico, hay que dejar claro que el profesional que se relaciona con los problemas de salud es el médico, mientras el referente en cuanto a utilización de medicamentos es el farmacéutico, lo que hace todavía más importante una línea conjunta y un buen entendimiento entre estos profesionales.
Líneas de colaboración: médico de Atención Primariafarmacéutico
El principio de cooperación de farmacéuticos y médicos para optimizar el buen uso de los medicamentos deriva de la obligación profesional de servir mejor a los intereses del paciente y de no causarle daño. Se derivan de este principio varias obligaciones28: en primer lugar, la de comunicarse mutuamente los errores que, en la prescripción o en la dispensación, puedan haberse producido; en segundo lugar, la de ofrecer y aceptar la necesaria información para prevenir la aparición de incompatibilidades o de efectos adversos de medicamentos y para educar convenientemente al paciente en el mejor modo de conducir el tratamiento.
De mutuo acuerdo, farmacéuticos y médicos han de desarrollar modos de cooperación que mejoren la atención de los pacientes, contando con el consentimiento de éstos. Este tipo de cooperación ha de transcurrir siempre por vías de racionalidad y consenso. El médico ha de reconocer al farmacéutico como experto en medicamentos; el farmacéutico no puede olvidar que la medicación se aplica, no a procesos patológicos abstractos, sino a personas concretas con sus peculiaridades individuales.
Con estas premisas establecidas, deben abrirse nuevas puertas y vías de colaboración:
1) A través de avances tecnológicos, tales como la receta electrónica, el acceso por Internet a la oficina de farmacia (comunicación on line) y la posibilidad de una base de datos única, que asegure la confidencialidad de los datos del paciente y el acceso que cada profesional necesita para el desempeño de sus funciones.
2) Fomentando otros aspectos como la figura del farmacéutico como consultor en temas de farmacología y aproximar la oficina de farmacia al sector sanitario público.