CASO CLÍNICO
Se trata de un varón de 41 años con antecedentes patológicos de polinosis con asma y nefrolitiasis. Fumador y bebedor ocasional, sin otros hábitos tóxicos. No tomaba ninguna medicación. Sin alergias medicamentosas.
Consultó por un cuadro de aproximadamente dos semanas de evolución de fiebre sin focalidad, cefalea y escasa tos seca. Refería cuatro semanas antes un episodio de inflamación en el dorso de la mano derecha tras picadura de insecto, resuelta tras tratamiento con prednisolona 40 mg intramuscular en el Servicio de Urgencias. Dos semanas antes presentó clínica de disuria, polaquiuria y tenesmo miccional. Fue diagnosticado de infección urinaria y tratado con norfloxacino y paracetamol durante 7 días, desapareciendo la sintomatología miccional pero persistiendo la fiebre.
El paciente trabajaba como fresador, residía en el medio rural a pocos kilómetros de Madrid desde hacía un mes y medio, sin contacto con ganado de crianza. Cerca de su trabajo merodeaban varios perros vagabundos. Convivía con varias mascotas (dos periquitos y una tortuga). No consumía lácteos no higienizados ni había realizado recientemente viajes al extranjero. Negaba prácticas sexuales de riesgo.
A la exploración el paciente presentaba como datos a destacar fiebre y dolor a la palpación profunda a nivel del hipocondrio izquierdo. Se encontraron dos pequeñas úlceras de fondo eritematoso y blando en pene sin adenopatías regionales. El resto de la exploración fue normal.
Se pidió analítica y serología para estudio de fiebre de origen desconocido, donde aparecieron datos de pancitopenia (hematíes 3,79 x 106/μl, hemoglobina 11,7 g/dl, hematocrito 33,3%, plaquetas 100.000/μl, leucocitos
3.100/μl) y aumento de lipoproteínas de baja densidad (LDH) (511 U/l) y elevación de transaminasas (GOT 57 U/l, GPT 73 U/l, GGT 75 U/l). Se incluyó serología de virus de la inmunodeficiencia humana (VIH) y el laboratorio solicitó una nueva determinación de serología de VIH para confirmar positividad con Western-Blot-ELISA.
Dado que el paciente no mejoraba se remitió a la consulta de Enfermadades Infecciosas para estudio de fiebre de origen desconocido, donde se inició estudio diagnóstico y tratamiento empírico con doxiciclina, ingresando en el hospital cuatro días después ante la falta de respuesta terapéutica.
Al ingreso el paciente presentaba una temperatura de 39 ºC, buen estado general, palidez cutáneo-mucosa y eupnea, sin palparse adenopatías.
El cuello no mostraba hallazgos y la orofaringe era normal.
En cuanto al tórax: auscultación cardiopulmonar: rítmica, sin soplos, con frecuencia ventricular de 104 lpm. Abdomen: hepatomegalia de 4 cm y esplenomegalia de 3 cm.
Las extremidades se mostraban normales.
ANALÍTICA
Hemograma: velocidad de sedimentación globular (VSG): 73, proteína C reativa (PCR): 86,2 ng/l, leucocitos: 2.000/μl (polimorfonucleares 590/μl, linfocitos 945/μl), hemoglobina 10,4 g/dl, volumen corpuscular medio (VCM) 84 fl, plaquetas 103.000/μl.
Bioquímica: GPT 56 U/l, GGT 115 U/l, fosfatasa alcalina 87 U/l, LDH 482 U/l, triglicéridos (TG) 247 mg/dl, colesterol 107 mg/dl, hierro 43 μg/dl, transferrina 169 mg/ dl, ferritina 1.259 ng/nl.
Hemostasia: fibrinógeno 478 mg/dl. El resto normal. Orina elemental: normal.
Frotis de sangre periférica: linfocitos plasmocitoides y linfocitos de menor tamaño, cromatina condensada y algunos de núcleo hendido. Anisocitosis moderada. Policromatófilos.
RADIOLOGÍA
Radiografía de tórax: dentro de los límites normales.
Tomografía axial computarizada toraco-abdómino-pélvica: esplenomegalia homogénea sin lesiones focales. Hígado de morfología y estructura normales. Sin adenopatías.
Ecografía abdominal: esplenomegalia homogénea sin otros hallazgos.
Galio corporal total: sin depósitos patológicos. Gran esplenomegalia.
Ecocardiograma: válvulas normales, sin imágenes de endocarditis bacteriana.
EXPLORACIÓN COMPLEMENTARIA
Hemocultivos x 2: estériles.
Urocultivo < 10.000 Ufc/ml.
Serología a VIH: 1.º ELISA: no se puede descartar la positividad de anticuerpos para VIH. 2.º ELISA y Western-Blot negativo. Carga viral VIH < 1,7 log. CD4 35%, CD8 30%. 3.º ELISA y Western-Blot negativo.
Serología a sífilis y Toxoplasma, Clamydia, Mycoplasma, Legionella, fiebre Q, Brucella, Salmonella, Borrelia, Ag criptocócico virus de la hepatitis C (VHC), virus de la hepatitis B (VHB), virus de Epstein-Barr (VEB), citomegalovirus (CMV).
Serología a parvovirus B19 compatible con infección pasada.
Hemocultivos para Leishmania en incubación.
Serología a Leishmania 1/80 (al ingreso): 1/640 (20 días después).
Auramina en esputo y orina x 2: negativa. Löwestein en incubación.
PPD: negativo (en dos ocasiones).
Hormona estimulante del tiroides (TSH): 0,901. ANOES: negativo.
Factor reumatoide (FR): normal. P y C ANCA: negativo. CEA, CA 15-3, CA 19-9: normales.
Valoración por Oftalmología: no muestra hallazgos patológicos.
HISTOPATOLOGÍA
Médula ósea aspirado: médula con hematopoyesis conservada y claros rasgos reactivos sin evidencia de afectación por parásitos ni infiltrados.
Inmunofenotipo de médula ósea: el porcentaje de blastos de estirpe mieloide está discretamente aumentado. El resto de series sin alteraciones.
Biopsia hepática: tejido hepático con infección por Leishmania.
DIAGNÓSTICO
Leishmaniasis visceral (LV).
EVOLUCIÓN
Tras el diagnóstico de LV se inició tratamiento con Glucantime® por vía intravenosa, al tercer día presentó rash maculopapuloso generalizado compatible con toxicodermia que obligó a suspender los antimoniales y a iniciar anfotericina B liposomal a la dosis de 3 mg/kg/día. El paciente recibió 8 días de anfotericina B liposomal (dosis total 1.800 mg) que suspendió temporalmente por presentar anemia (hemoglobina 6,8 g/dl) e hipopotasemia (2,8 mM/l), completándose el tratamiento tras mejoría analítica.
Se administraron vacunas frente a neumococo, Haemophilus y meningococo A y C.
En la revisión anual se repitió la serología de Leishmania, siendo ésta negativa. Actualmente el paciente se encuentra bien y sus controles son correctos.
DISCUSIÓN
La LV, conocida también como kala-azar, fiebre Dum-Dum y esplenomegalia tropical, es una zoonosis producida por parásitos flagelados. Se trata de una enfermedad infecciosa sistémica, aguda o crónica, que afecta preferentemente al hígado, el bazo, los ganglios y, con menos frecuencia, a otros órganos como el riñón, el aparato digestivo y el sistema nervioso central1-3. Está caracterizada por fiebre, esplenomegalia, leucopenia con monocitosis, hipergammaglobulinemia y emanciación acompañada de debilidad progresiva.
Es una enfermedad muy extendida en más de 88 países. Es excepcional en Australia y endémica en zonas de África, India, Sudamérica y en el litoral mediterráneo (España, Italia, etc.). En España se han descrito focos en Cataluña, Castilla la Mancha y Andalucía4-7.
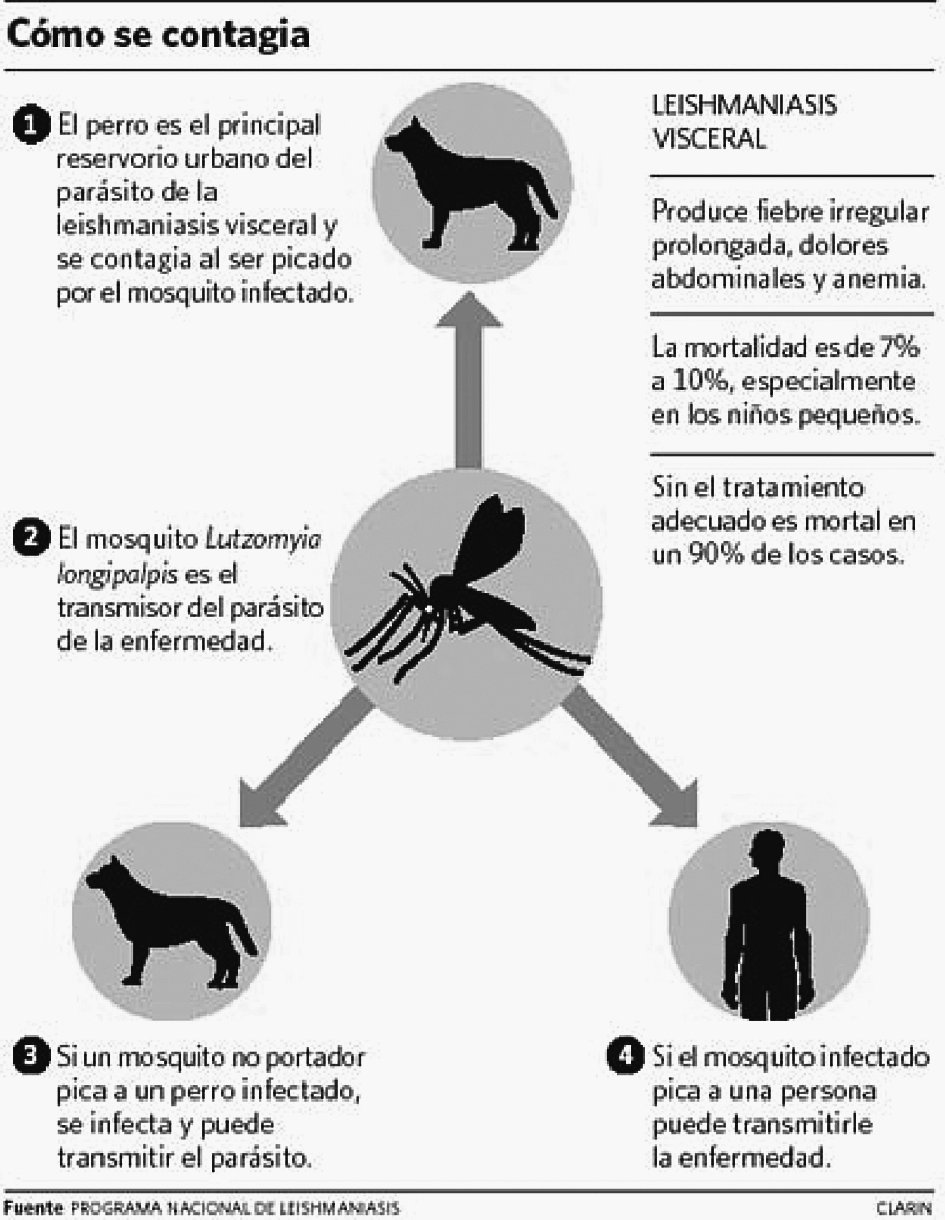
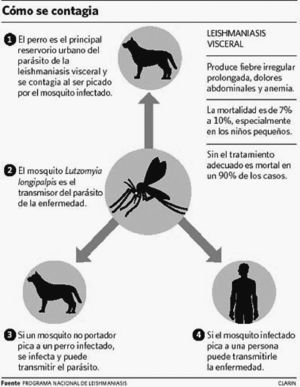
La LV afecta preferentemente a niños, y en los adultos está aumentando su incidencia debido a los casos en pacientes con VIH. El agente causal es la Leishmania donovani. El reservorio son los animales vertebrados (perros, ratas, etc.) y el hombre. El artrópodo vector es el mosquito hembra de la familia Phlebotomidae (mosquito de la arena). Las células parasitadas, en el huésped, son las del sistema reticuloendotelial (SER). Cuando un mosquito adquiere sangre de un animal parasitado ingiere amastigotes, que se multiplican en su tubo digestivo y se transforman en promastigotes (flagelados), que son depositados en la piel del huésped en la pequeña gota de sangre que mana al picar la mosca de la arena. Estos se multiplican en los macrófagos, cerrándose así el ciclo. El hombre puede adquirir la enfermedad cuando entra dentro de este ciclo. El asentamiento de la infección en el perro doméstico constituye un importante reservorio de leishmaniasis en el medio urbano.
Aparte de la inoculación por picadura de flebotomos, la enfermedad puede transmitirse por transfusión sanguínea y hasta por vía sexual, aunque éstas son raras. Se han aislado leishmanias en moco nasal, pero no se ha podido comprobar transmisión directa8 (fig. 1).
Figura 1. Mecanismo de transmisión de la leishmaniasis visceral.
El período de incubación varía entre 8-10 días hasta 4 meses. Se han descrito casos de hasta 12-36 meses9. El curso de la enfermedad subsiguiente está condicionado por la inmunidad celular del huésped, así como por la especie del parásito. El comienzo puede ser agudo, aunque lo habitual es que sea insidioso y con sintomatología atípica.
La inmunosupresión modifica con mucha frecuencia el cuadro clínico, y la enfermedad cursa a menudo subclínica o con escasa sintomatología. El parásito puede quedar quiescente durante largos períodos de tiempo dentro de la célula huésped, en los cuales la enfermedad puede autolimitarse10.
Se presenta con fiebre, típicamente nocturna y, a veces, con dos ascensos diarios, de hasta 40 ºC, acompañada de taquicardia sin signos de toxemia, sudoración, pérdida de peso, hepatoesplenomegalia (60%), con o sin adenomegalias (en un 10% de los enfermos aparecen cirrosis e hipertensión portal) y lesiones cutáneas.
La pancitopenia es característica. La anemia es de origen multifactorial y contribuyen a ella la hemólisis autoinmune, la esplenomegalia y las pérdidas sanguíneas digestivas, agravadas por la trombopenia (que puede originar gingivorragias, otras hemorragias mucosas e incluso púrpura cutánea). Hay gran leucopenia con linfocitosis y monocitosis relativas que explican complicaciones como el noma (por anaerobios), así como infecciones pulmonares e intestinales. También aparecen hipoalbuminemia e hipergammaglobulinemia policlonal (inmunoglobulina [Ig]G e IgM). Otros órganos se ven afectados más raramente: riñón (nefritis intersticial y glomerulonefritis por inmunocomplejos), pulmón, sistema nervioso central (SNC)3,9,11,12.
El edema, la caquexia y la hiperpigmentación (kala-azar significa “fiebre negra”) son manifestaciones tardías.
Las complicaciones más comunes son las infecciones secundarias, como neumonías, infecciones bronquiales, tuberculosis, paludismo, diarrea o mala absorción intestinal, infecciones víricas, infecciones cutáneas bacterianas, otitis media y lesiones bucales.
La trombocitopenia puede ocasionar epistaxis o pérdidas de sangre.La muerte acontece en el 95% de los casos no tratados al año y medio, por caquexia, o una infección secundaria (tuberculosis, neumonía, sepsis, etc.) o hemorragia.
En zonas de paludismo endémico, si la fiebre dura 2 semanas o más y el paciente no responde a los medicamentos antipalúdicos, hay que sospechar un kala-azar.
El cuadro puede ser atípico, sin esplenomegalia, pero con fiebre, emanciación, diarrea, tos o combinaciones de estos síntomas. A veces puede ir precedida, acompañada o seguida de lesiones cutáneas simples (leishmanioma).
El diagnóstico de la enfermedad es, por una parte clínico, con la exclusión diagnóstica de un proceso agranulocitósico o leucémico, el paludismo, sepsis y brucelosis, y por otra de confirmación de la presencia del parásito en los tejidos afectados del huésped. El aspirado medular, la biopsia coxal y la hepática son las más rentables. La punción del bazo, también utilizada, tiene el inconveniente del sangrado por la friabilidad del órgano y las alteraciones hematológicas, aunque en manos expertas es prácticamente inocua y además aumenta la sensibilidad de la prueba comparada con la punción de médula ósea. En casos con cuadro diarreico es útil la biopsia rectal2.
Cuando no se dispone de servicios de laboratorio, como la LV clínica (sintomática) no es benigna ni remite espontáneamente y suele ser mortal si no se trata, debe administrarse un tratamiento apropiado.
Los datos analíticos: anemia, pancitopenia, hipergammaglobulinemia, reafirman la sospecha de la enfermedad. Recientemente se ha introducido el título de anti-cuerpos antileishmania para el diagnóstico. Los métodos serológicos empleados son los de inmunofluorescencia indirecta (IFI), ensayo inmunoenzimático (ELISA) y aglutinación directa12. Los títulos son elevados en pacientes inmunocompetentes, no así en los inmunodeprimidos. Da reacciones cruzadas con la lepra, la enfermedad de Chagas, etc., no siendo problema en nuestro país debido a lo infrecuente de estas entidades. Son sobre todo muy útiles para seguir la evolución terapéutica, ya que los títulos iniciales deberán descender a los 6 meses de tratamiento.
La prueba de la Leishmania, Montenegro, es una intradermorreacción con parásitos atenuados, habitualmente negativa en la LV y positiva en los cuadros asintomáticos y cuando el tratamiento ha sido eficaz. Se utiliza en países endémicos. Produce reacciones cutáneas y sistémicas12, por lo que no se recomienda su utilización.
En cuanto a los métodos diagnósticos para el seguimiento de los pacientes que han sido tratados que no muestran mejoría clínica y/o hematológica o que tienen una recaída clínica, deben repetirse las pruebas de diagnóstico parasitológico para determinar la presencia de Leishmania. Los pacientes parasitológicamente positivos necesitarán un nuevo tratamiento, posiblemente con un régimen modificado, o un medicamento de segunda línea o una combinación de medicamentos.
El diagnóstico diferencial de la leishmaniasis habría que hacerlo con tuberculosis miliar, brucellosis, salmonelosis, esquistosomiasis, endocarditis, mononucleosis, sepsis, linfomas, paludismo, histoplasmosis. La esplenomegalia masiva puede ser una característica de la LV, la hipertensión portal (debida a cirrosis y esquistosomiasis) y el paludismo (debido a una esplenomegalia palúdica hiperreactiva).
El tratamiento de la leishmaniasis se realiza, desde 1935, con antimoniales polivalentes: stibogluconato (Pentostam®) y/o meglumina (Glucantime®), por vía endovenosa o intramuscular. En Europa se utiliza preferentemente meglumina a dosis de 20 mg/kg/día durante 28-30 días. Si la evolución no es favorable se prolonga el tratamiento o se realizan tandas de 15-20 días con períodos de descanso de 15 días. La Organización Mundial de la Salud recomienda dosis máximas de 850 mg/día. La toxicidad se relaciona con alteraciones electrocardiográficas, artralgias, mialgias, trombopenia, anorexia, alteración de enzimas hepáticas y sabor metálico9,12,13.
Tratamiento de las recaídas: se darán dosis más elevadas durante períodos más largos (Pentostam® de 20 mg/kg/día durante 90 días o Glucantime® a las dosis anteriores pero 60 días) y se añadirá una dosis de alopurinol de 24 mg/ kg/día.
En una segunda línea de tratamiento, cuando fallan los antimoniales se utilizan:
– Anfotericina B: administrar 0,5 mg/kg por infusión intravenosa por día, o en días alternos, hasta terminar la dosis total de 20 mg/kg. El principal efecto colateral es la insuficiencia renal; por esta razón, la función renal debe vigilarse semanalmente durante el tratamiento. Puede reducirse hidratando previamente al paciente con una infusión de solución salina normal. Otros efectos colaterales son la fiebre y la anemia.
– Aminosidina: aminoglucósido antileishmaniásico que puede actuar de forma sinérgica con el antimonio pentavalente. Administrar 20 mg/kg por día durante 30 días. Puede ocasionar insuficiencia renal, durante el tratamiento deberían vigilarse la urea y la creatinina. Este fármaco también puede afectar al nervio auditivo y ocasionar sordera de tonos altos.
– Pentamidina: a razón de 4 mg/kg en días alternos durante 11 semanas. Puede ocasionar hipoglucemia, diabetes, insuficiencia renal y pancreatitis.
– Anfotericina liposómica: una dosis total de 20-30 mg/kg administradas en 10-20 días. Es eficaz y muy poco tóxica, pero es muy cara.
– Interferón gamma recombinante: se ha empleado también por su capacidad de incrementar la actividad microbicida de los macrófagos, asociado a antimoniales cuando no son eficaces o fracasan11,14,15.
– Se han utilizado otros medicamentos junto a los antimoniales, como el ketoconazol13, alopurinol16, ciprofloxacino13,17, paramomicina1, etc. No hay aún estudios amplios para justificar su empleo, pero pueden llegar a utilizarse en un futuro.
Para la evaluación de la curación, en el examen clínico efectuado al final del tratamiento debe observarse aumento de peso, disminución de tamaño del bazo y ausencia de fiebre durante al menos 2-3 semanas. La hemoglobina y el recuento leucocitario deben estar en aumento.
La confirmación parasitológica de la curación no es sistemáticamente necesaria y puede reservarse para los casos en que la reacción sea dudosa. Sin embargo, es esencial en el tratamiento de las recaídas.
Una vez terminado el tratamiento, volver a evaluar al paciente al cabo de 1, 3, 6 y 12 meses.
En cuanto al pronóstico, en casos en los que el sistema inmune no se vea afectado la tasa de curación con los medicamentos compuestos de antimonio es alta. La leishmaniosis mucocutánea puede ocasionar una desfiguración apreciable. La muerte se suele presentar por complicaciones, como otras infecciones, más que por la enfermedad en sí.
Correspondencia: M. Caballero Sánchez.
Centro de Salud Barajas.
Avda. de Logroño, 319. 28042 Madrid. España. Correo electrónico: manolics@hotmail.com
Recibido el 23-03-07; aceptado para su publicación el 17-12-07.