Actualización en el tratamiento de la enfermedad renal crónica
Más datosEl papel del sistema renina angiotensina aldosterona (SRAA) en la fisiopatología de la hipertensión arterial, la enfermedad cardiovascular y la enfermedad renal es conocido desde hace años. Los inhibidores del SRAA son el pilar del tratamiento de la enfermedad renal crónica (ERC). Los estudios han demostrado que la terapia con inhibidores de la enzima convertidora de angiotensina (IECA) o con inhibidores de los receptores de angiotensinaII (ARAII) reducen la excreción de albuminuria y ralentizan la progresión de la nefropatía en pacientes con y sin diabetes. En la práctica clínica se recomiendan inhibidores del SRAA como antihipertensivos de elección en pacientes con ERC y albuminuria con o sin diabetes. Además, han demostrado beneficios cardiovasculares más allá del control de la presión arterial. La utilización de inhibidores del SRAA en nefropatías no proteinúricas y en ERC avanzada no está exenta de polémica. El doble bloqueo del SRAA está contraindicado. Por otra parte, es indispensable conocer cómo titular las dosis y evitar los efectos secundarios, principalmente la hiperpotasemia.
The role of the renin angiotensin aldosterone system (RAAS) in the pathophysiology of hypertension, cardiovascular disease and kidney disease has been known for years. RAAS inhibitors have been the mainstay of chronic kidney disease (CKD) treatment. Studies have shown that therapy with angiotensin-converting enzyme inhibitors (ACE inhibitors) or angiotensinII receptor blockers (ARBs) reduce the excretion of albuminuria and slow the progression of kidney disease in patients with and without diabetes. In clinical practice, RAAS inhibitors are recommended as the antihypertensive of choice in patients with CKD and albuminuria with or without diabetes. In addition, they have demonstrated cardiovascular benefits beyond blood pressure control. The use of RAAS inhibitors in non-proteinuric nephropathy and advanced CKD is not without controversy. Double blockade of the RAAS is contraindicated. On the other hand, it is essential to know how to titrate doses and avoid side effects, mainly hyperkalaemia.
En la actualidad, en base a diferentes ensayos clínicos y metaanálisis, existe suficiente evidencia científica que respalda la utilización de la inhibición farmacológica del sistema renina angiotensina aldosterona (SRAA) como un componente esencial de cualquier estrategia cuyo objetivo sea conseguir protección renal en personas con enfermedad renal crónica (ERC). La progresión de la ERC está condicionada en gran medida por factores hemodinámicos y metabólicos, más allá de la enfermedad renal primaria. Las medidas farmacológicas se basan en fármacos antiproteinúricos y antihipertensivos, siendo el primer y más importante escalón terapéutico los agentes bloqueantes del SRAA1.
En general, las guías recomiendan el uso de inhibidores del SRAA, principalmente un inhibidor de la enzima convertidora de angiotensina (IECA) o un antagonista del receptor de angiotensinaII (ARAII), para prevenir la progresión de la ERC. Las guías Kidney Disease Improving Global Outcomes (KDIGO) sobre ERC recomendaron la terapia con IECA o ARAII como tratamiento de primera línea en pacientes con hipertensión y albuminuria para enlentecer la progresión de la ERC2.
Las guías KDIGO de 2012 también recomendaron por primera vez la medición de la excreción urinaria de albúmina en función de la excreción urinaria de creatinina y evitar la utilización de los términos microalbuminuria y macroalbuminuria (evitando la idea de que la albuminuria por debajo de 300mg fuera un hallazgo sin relevancia clínica y resaltando que se trata de una variable continua) para sustituirlo por categoría A1 (albuminuria <30mg/g de creatinina), A2 (albuminuria 30-300mg/g) y A3 (>300mg/g)2. No obstante, gran parte de los estudios revisados y documentos de consenso mantienen ambas terminologías.
Efectos del bloqueo del SRAAInhibidores de la enzima convertidora de la angiotensina (IECA)Los IECA impiden la conversión de angiotensinaI en angiotensinaII mediante la inhibición de la enzima convertidora de la angiotensina evitando la vasoconstricción, que resulta en la disminución de la presión arterial (PA). Aumentan los niveles de bradicinina (con potente acción vasodilatadora) mediante la inhibición de su degradación. El acúmulo de esta sustancia es la causante de ciertos efectos adversos de los IECA, como la tos.
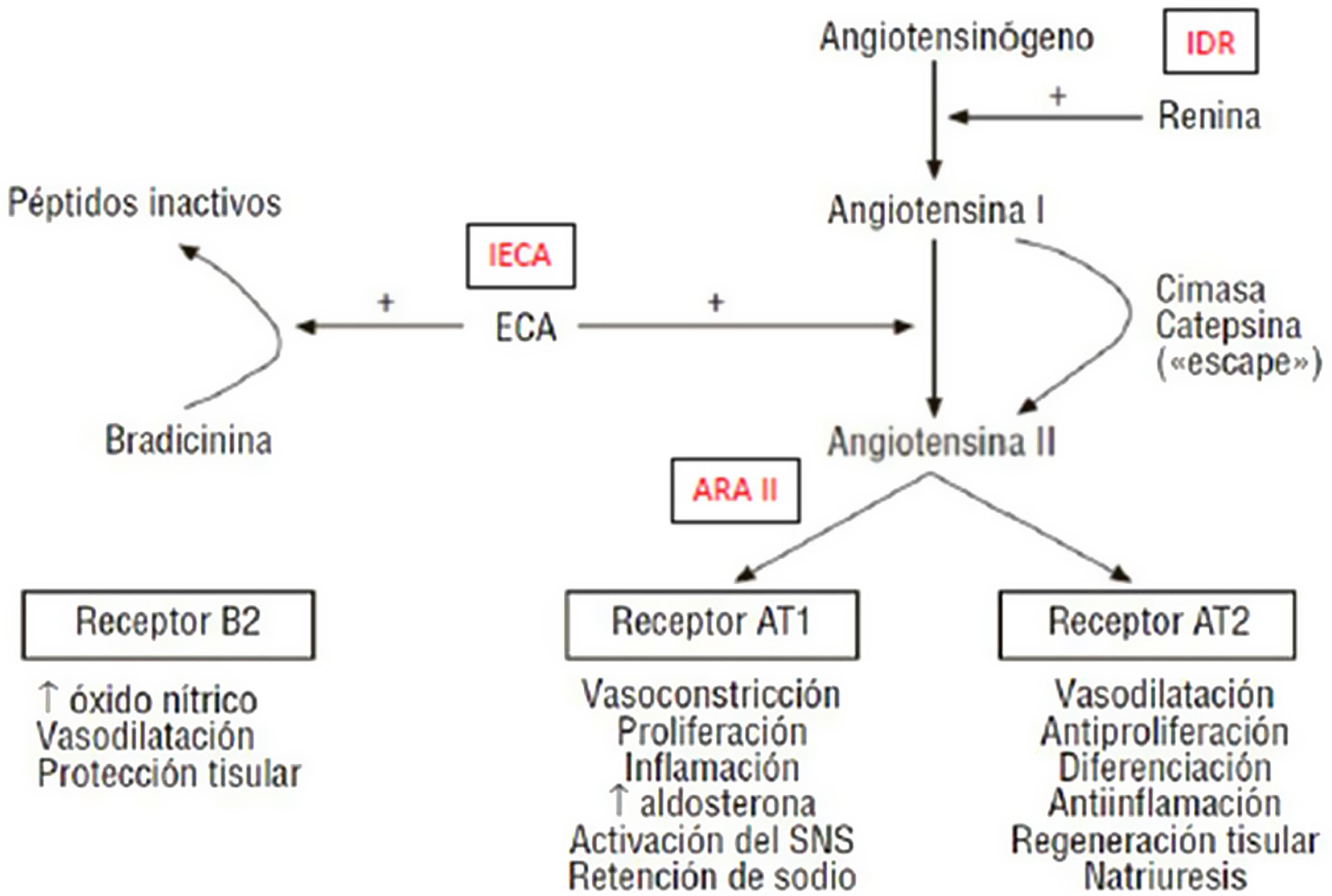
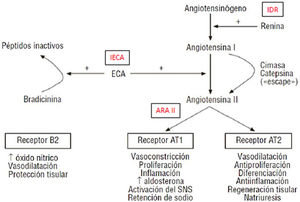
Antagonistas de los receptores de angiotensinaII (ARAII)Los ARAII se unen al receptor de angiotensina1 (AT-1) e inhiben la unión de la angiotensinaII (AT-2) al receptor de angiotensina1, evitando sus importantes efectos negativos (vasoconstricción, síntesis de aldosterona y acciones estimulantes de la proliferación y crecimiento celular), de forma no dependiente de la vía de la enzima convertidora de la angiotensina (fig. 1)3.
Esquema de funcionamiento del eje renina-angiotensina-aldosterona.
ARAII: antagonistas de los receptores de angiotensinaII; AT1, AT2: receptores de la angiotensinaII tipo 1 y tipo 2; ECA: enzima de conversión de angiotensina; IDR: inhibidores directos de la renina; IECA: inhibidores de la enzima convertidora de la angiotensina; SNS: sistema nervioso simpático.
Fuente: adaptado de Galve et al.3.
Si los receptores AT-1 se bloquean, se produce un desplazamiento de la angiotensinaII hacia los receptores AT-2. Como consecuencia, aumenta la liberación de óxido nítrico, de bradicinina y de prostaglandinas (PGE2, PGI2), con acciones vasodilatadoras y antiproliferativas.
Al igual que los IECA, reducen la resistencia vascular renal, aumentan el flujo sanguíneo renal y promueven la excreción de sodio y de agua. Sin embargo, la tasa de filtración glomerular permanece invariable o disminuye ligeramente. Esto se debe al mayor efecto relativo que sobre la dilatación de las arteriolas eferentes glomerulares respecto a las arteriolas aferentes, lo que conduce a una reducción de la presión hidrostática capilar glomerular.
Antagonistas de los receptores mineralocorticoides (ARM)Los ARM muestran efectos antihipertensivos al vincularse competitivamente a los receptores mineralocorticoides en los túbulos distales y colectores de la nefrona e inhibiendo los efectos de los mineralocorticoides. Los ARM excretan sodio y absorben potasio e hidrógeno, lo que resulta en una reducción en el volumen de fluidos circulantes y extracelulares y, por lo tanto, una reducción en la PA y una mejora en el edema.
Inhibidores directos de la renina (IDR)Los IDR actúan sobre la renina, que convierte el angiotensinógeno en angiotensina1. Inhiben la actividad de la renina plasmática, lo que provoca una disminución de la PA.
El bloqueo del SRAA obtenido por cualquiera de los anteriores grupos terapéuticos disminuye la presión intraglomerular. Este efecto puede estar relacionado con la reversión del aumento de la resistencia inducido por la angiotensinaII en la arteriola eferente o posglomerular. La dilatación de la arteriola eferente disminuye la presión intraglomerular independientemente de cualquier cambio en la PA sistémica4.
Además de disminuir la presión intraglomerular, los estudios experimentales sugieren que el efecto beneficioso de los bloqueadores del SRAA puede estar relacionado con otros aspectos, ya que la angiotensinaII es un factor de crecimiento, por lo que directamente, o a través del incremento de la presión glomerular, puede aumentar la liberación de matriz extracelular y colágeno de las células mesangiales y tubulares, promoviendo así la fibrosis glomerular y tubulointersticial5.
El tratamiento de la hipertensión arterial (HTA) fue la primera intervención que demostró ser nefroprotectora. Uno de los primeros metaanálisis en nefrología recogió aspectos como la función renal y la proteinuria inducidas por el tratamiento antihipertensivo en personas con diabetes. El análisis de regresión lineal múltiple indicó que los IECA disminuían la proteinuria independientemente de los cambios en la PA, la duración del tratamiento, el tipo de diabetes o el estadio de la nefropatía, mientras que las reducciones en la proteinuria obtenidas con los restantes antihipertensivos (diuréticos y betabloqueantes) se podrían atribuir únicamente a los cambios en la PA6.
No está claro si las dosis de IECA asociadas al efecto antihipertensivo máximo son las mismas que la requeridas para un efecto antiproteinúrico óptimo7. Respecto a los ARAII, parece haber una relación dosis/efecto, con una mayor reducción de la proteinuria a dosis más altas, tanto en pacientes no diabéticos como en diabéticos8.
No obstante, hay que tener en cuenta que estos fármacos son antihipertensivos, con lo que a mayor dosis, mayor será la reducción de la PA. Además, cualquier situación intercurrente o fármacos concomitantes pueden favorecer en el paciente que los recibe hipotensión o fracaso renal agudo. Por tanto, algunos autores insisten en que las dosis de los IECA y de los ARAII deberían ajustarse a la función renal, a la intensidad de la albuminuria, a la PA y a la edad del paciente y su tolerancia al tratamiento previo9. En la tabla 1 se muestra cómo ajustar la dosis de IECA y ARAII según la función renal.
Ajustes de la dosis de IECA y de ARAII más empleados en la práctica clínica, según la función renal
| Dosis de inicio (mg) | Dosis máxima diaria (mg) | Ajustes de dosis | |
|---|---|---|---|
| Captopril | 12,5-25/8 h | 50/8 h | CrCl 10-50 ml/min: 75% de la dosisCrCl <10 ml/min: 50% de la dosisDiálisis: administrar dosis posdiálisis |
| Enalapril | 5-10/12 h | 20/12 h | CrCl 50-10 ml/min: 75% de la dosisCrCl <10 ml/min: 50% de la dosisDiálisis: administrar dosis posdiálisis |
| Fosinopril | 10/24 h | 80/24 h | No precisa ajuste de dosis |
| Lisinopril | 10 /24 h | 40/24 g | CrCl 10-30 ml/min: 50% de la dosisCrCl <10 ml/min: 2,5 mg/24 hDiálisis: administrar dosis posdiálisis |
| Ramipril | 2.5/24 h | 20/24 h | CrCl <40 ml/min: 25% de la dosisDiálisis: administrar dosis posdiálisis |
| Candesartán | 8-16/24 h | 32/24 h | CrCl <10 ml/min y diálisis: 50% de la dosis |
| Irbesartán | 75-150/24 h | 300/24 h | No precisaDiálisis: iniciar con 75 mg/24 h |
| Losartán | 25-50/24 h | 100/24 h | No precisa |
| Valsartán | 80/24 h | 320/24 h | CrCl <10 ml/min y diálisis: evitar |
La desregulación del SRAA desempeña un papel importante en la patogénesis de la nefropatía diabética. La hiperglucemia se asocia con una producción excesiva de angiotensinaII tras la sobreactivación del SRAA en las células mesangiales glomerulares10. Por lo tanto, los mecanismos para bloquear el SRAA son un objetivo terapéutico importante en personas con diabetes tipo2 (DM2) y nefropatía.
En 1993 se publicaron los resultados del Captopril Collaborative Study Group (CSG), primer gran ensayo clínico prospectivo que mostraba claramente la renoprotección específica atribuible al tratamiento con IECA de forma independiente a la disminución de la PA. Pacientes con diabetes tipo1 (DM1) y nefropatía (excreción de proteínas en orina >0,5g/día y niveles de creatinina sérica <2,5mg/dl) se aleatorizaron para recibir tratamiento con captopril o placebo. El tratamiento con captopril se asoció con una reducción del 50% en el riesgo del criterio de valoración combinado (muerte, diálisis y trasplante renal) y con una reducción del 48% en el riesgo de duplicación de la creatinina sérica11.
Un metaanálisis de 12 estudios en personas con DM1 y nefropatía incipiente tratadas durante al menos un año con IECA mostró reducción de la incidencia de microalbuminuria y del riesgo de progresión de la nefropatía12.
En DM2 con nefropatía establecida, los ensayos clínicos se han llevado a cabo básicamente con ARAII, demostrando que este grupo farmacológico reduce la proteinuria y el ritmo de progresión de la insuficiencia renal (duplicación de la cifra de creatinina sérica o necesidad de diálisis por ERC avanzada). El efecto renoprotector de los IECA respecto a los ARAII ha sido poco estudiado en pacientes diabéticos13. Los datos sobre los efectos renoprotectores de los IECA en DM2 son relativamente ambiguos, aunque la evidencia de beneficio en las primeras etapas de la nefropatía es más consistente.
Disponemos de tres metaanálisis que investigaron el efecto del tratamiento IECA en personas con nefropatía diabética. En pacientes DM2 con albuminuria se observaron reducciones estadísticamente significativas de la albuminuria14. Otro metaanálisis de estudios en pacientes con DM1 y DM2 reveló una reducción del riesgo de progresión de microalbuminuria a macroalbuminuria15. Un tercer metaanálisis incluyó datos de 16 estudios sobre el efecto del tratamiento con IECA frente a placebo y frente a antagonistas del calcio en pacientes con DM1 y DM2, mostrando igualmente reducción del riesgo de microalbuminuria16.
Por tanto, los IECA se recomiendan en pacientes con DM1 y microalbuminuria, incluidos pacientes normotensos, ya que este efecto es independiente de la modificación en la PA. En la actualidad, los datos son insuficientes para respaldar el uso de IECA para prevenir la nefropatía en personas normoalbuminúricas con DM112. Hay suficiente evidencia para recomendar el uso de IECA para reducir la progresión a nefropatía manifiesta en personas con DM2 y albuminuria o para prevenir la albuminuria en personas con HTA. No hay evidencia contundente sobre el beneficio asociado con los IECA en la ralentización de la progresión de la nefropatía manifiesta en personas con DM2 sin albuminuria o sin HTA17.
Respecto a los ARAII, en el año 2001 se publicaron tres interesantes estudios que mostraron de forma clara el papel beneficioso de este grupo farmacológico en la ERC asociada a la DM2.
Los estudios Irbesartan Diabetic Nephropathy Trial (IDNT)18 y Reduction of Endpoints in NIDDM with the AngiotensinII Antagonist (RENAAL)19 incluyeron pacientes con DM2 y nefropatía. En ambos estudios, los tratamientos aleatorizados fueron administrados adicionalmente a su medicación antihipertensiva habitual. El estudio Irbesartan in patients with typeII diabetes and MicroAlbuminuria (IRMA-2)20 comparó dos dosis distintas de ARAII en pacientes con DM2 y microalbuminuria.
En los estudios IDNT18 y RENAAL19 se demostró la eficacia de irbesartán y losartán, respectivamente. Los pacientes que recibieron el tratamiento activo presentaron una reducción significativa del riesgo relativo de progresión de la insuficiencia renal, de necesidad de diálisis-trasplante o de muerte. La población de estudio del IDNT estaba constituida por sujetos diagnosticados de DM2 e HTA y con proteinuria superior a 900mg/día y una creatinina sérica de 1-3,0mg/dl en mujeres y de 1,2-3,0mg/dl en varones. Los pacientes del grupo asignado a irbesartán presentaron un riesgo relativo (RR) no ajustado un 20% (p=0,02) menor que los pacientes del grupo placebo y un 23% (p=0,006) inferior que los pacientes del grupo amlodipino. No existieron diferencias entre el grupo placebo y el grupo tratado con amlodipino.
En el estudio RENAAL se definió nefropatía por la presencia, en dos ocasiones, de un cociente albúmina/creatinina urinaria >300mg/g y un valor de creatinina sérica entre 1,3-3,0mg/dl. El losartán redujo los niveles de proteinuria un 35% (p<0,001) en comparación con placebo.
En el estudio IRMA-220 se demostró que irbesartán a dosis altas (300mg/día) fue eficaz para la prevención del desarrollo de nefropatía establecida en pacientes con DM2, HTA y microalbuminuria (excreción de albúmina de 20-200mg/min). Después del ajuste por el nivel basal de albuminuria y de PA, el cociente de riesgos instantáneos para la nefropatía diabética fue de 0,56 en el grupo de 150mg (intervalo de confianza [IC] del 95%: 0,31-0,99; p=0,05) y 0,32 en el grupo de 300mg (IC95%: 0,15-0,65; p<0,001). Además, el restablecimiento de la normoalbuminuria resultó significativamente más frecuente en el grupo que recibió 300mg/día de irbesartán, apareciendo estos beneficios independientemente de la reducción de la PA.
El estudio Microalbuminuria Reduction with Valsartan (MARVAL)21, que incluyó pacientes con DM2, tanto hipertensos como normotensos, mostró resultados similares a los del IRMA-2, en ambos grupos de pacientes.
En el estudio The Incipient to Overt: AngiotensinII Blocker, Telmisartan Investigation on Type 2 Diabetic Nephropathy (INNOVATION)22, con una población de similares características de la del IRMA-2 y un 31% de normotensos, el tratamiento con telmisartán se asoció con menor tasa de transición a nefropatía establecida (albuminuria >300mg/día) frente a placebo, tras un año de seguimiento. La remisión de la albuminuria ocurrió en el 21,2% con 80mg de telmisartán, en el 12,8% con 40mg de telmisartán y en el 1,2% con placebo (ambas dosis de telmisartán frente a placebo, p<0,001).
En pacientes con diabetes mellitus, las guías KDIGO de manejo de la diabetes mellitus en la ERC23 recomiendan el bloqueo del SRAA en caso de albuminuria e HTA, titulando los fármacos (IECA o ARAII) hasta la máxima dosis tolerada. En el caso de los pacientes con diabetes, albuminuria y PA normal, se puede considerar el tratamiento con un IECA o ARAII.
ERC no diabéticaEsta situación hace referencia a la nefropatía vascular, que comprende principalmente la que aparece en pacientes con nefroesclerosis asociada a la HTA y en menor medida la nefropatía isquémica.
Tras los resultados sobre protección renal con el tratamiento con IECA en la nefropatía diabética, se llevaron a cabo diferentes estudios para investigar el potencial efecto nefroprotector de los IECA en las formas no diabéticas de ERC.
La evidencia de bloqueo del SRAA en el tratamiento de la ERC no diabética es más limitada. Los estudios han demostrado que el tratamiento adecuado de la HTA también es clave para retrasar la progresión de la enfermedad renal no diabética. Las guías KDIGO sobre tratamiento de la HTA en la ERC24 recomiendan iniciar tratamiento con bloqueantes del SRAA (IECA o ARAII) en sujetos no diabéticos con PA elevada, ERC y albuminuria en los estadios G1-G4, A3 (con un nivel de recomendación 1B) y en los estadios G1-G4, A2 (con un nivel de recomendación 2C). Esta última afirmación, debido a que no hay estudios que hayan evaluado específicamente el efecto del bloqueo del SRAA sobre la desaceleración de la progresión de la enfermedad renal en pacientes con ERC sin diabetes y albuminuria entre 30 y 300mg/g.
La evidencia que respalda los datos en pacientes no diabéticos proviene de dos ensayos clínicos relevantes: el Ramipril Efficacy in Nephropathy (REIN)25 y el African American Study of Kidney Disease and Hypertension (AASK)26.
En el estudio REIN se aleatorizó a pacientes con nefropatías crónicas no diabéticas a recibir ramipril o placebo. Los pacientes en la rama de ramipril tuvieron un descenso más lento de la tasa de filtrado glomerular (FG) en comparación con los pacientes aleatorizados a placebo (0,53 [0,08] vs 0,88 [0,13] ml/min, p=0·03) y el efecto fue independiente del nivel de PA alcanzado.
Del mismo modo, el ensayo AASK también mostró un efecto renoprotector superior de los IECA en comparación con otros medicamentos antihipertensivos como los betabloqueantes o los antagonistas del calcio. En comparación con los grupos de metoprolol y amlodipino, el grupo de ramipril tuvo una reducción del objetivo compuesto del 22% (IC95%: 1%-38%; p=0,04) y 38% (IC95%: 14%-56%; p=0,004), respectivamente. Este estudio finalizó precozmente el brazo de amlodipino debido a una disminución más rápida de la del FG en comparación con los grupos de placebo, ramipril y metoprolol.
Un análisis agrupado de 11 ensayos aleatorios mostró que los IECA fueron superiores en la desaceleración de la progresión de la ERC no diabética. Así, el tratamiento con IECA fue más efectivo que los regímenes sin inhibición del SRAA en cuanto a la ralentización de la progresión de la enfermedad renal. Además, el grado de beneficio se correlacionó directamente con el nivel de albuminuria27. De tal manera que los beneficios del tratamiento con IECA parecen ser mayores en personas con proteinuria basal más grave, pero no fueron concluyentes en los sujetos con proteinuria menor a 0,5g/día28,29.
Hasta el momento, ningún ensayo clínico amplio ha investigado los efectos renoprotectores de los ARAII frente a otros antihipertensivos en la ERC no diabética, aunque es razonable esperar que los ARAII proporcionen beneficios renoprotectores similares a los observados en la enfermedad renal diabética. Los estudios en humanos muestran que los IECA y los ARAII tienen beneficios similares sobre la albuminuria y la progresión de la pérdida de la función renal, tanto en la enfermedad renal diabética como en la no diabética. Una revisión Cochrane consideró que la evidencia actual era incierta para la efectividad de los IECA o de los ARAII en pacientes con ERC en estadio1 a3 sin diabetes30. De hecho, como ya se ha mencionado, las guías KDIGO2 recomiendan el tratamiento con IECA o ARAII en adultos con todas las formas de ERC y albuminuria mayor de 300mg/día (o equivalente).
En contraste con sus efectos nefroprotectores en la ERC proteinúrica, los ARAII no parecen ser más beneficiosos que otros agentes antihipertensivos en pacientes no diabéticos con ERC no proteinúrica. Por tanto, su carácter renoprotector y cardioprotector va más allá del efecto antihipertensivo, siendo especialmente eficaces en las nefropatías proteinúricas.
La evidencia no demuestra una eficacia superior de IECA sobre ARAII, o viceversa. La elección entre ambos dependerá de otros factores, como las preferencias de los pacientes, el coste, la disponibilidad de genéricos y los perfiles de efectos secundarios de los fármacos individuales1. La tos inducida por IECA es la causa predominante de intolerancia a esta clase de fármacos, ya que afecta a alrededor del 10% de los pacientes31. Recientemente, un gran estudio observacional (que incluyó aproximadamente dos millones de personas) mostró una mejor tolerancia (menos frecuencia de angioedema, tos o pancreatitis principalmente) a los ARAII frente a los IECA32.
Doble bloqueo del SRAALos IECA y los ARAII bloquean el SRAA en diferentes sitios y, en teoría, el bloqueo dual debería proporcionar un bloqueo efectivo y completo del SRAA.
La terapia combinada con IECA, ARAII o IDR reduce la PA y la albuminuria en mayor medida que la monoterapia en el bloqueo del SRAA. Sin embargo, los ensayos clínicos a largo plazo en pacientes con diabetes y ERC no demostraron ningún beneficio renal o cardiovascular del bloqueo del SRAA con el tratamiento combinado frente al uso único de inhibidores del SRAA. En cambio, la terapia combinada se asoció con una mayor tasa de hiperpotasemia e insuficiencia renal aguda33,34. En un metaanálisis con 17.337 pacientes, los efectos adversos del bloqueo dual revelaron tasas significativamente altas de abandono debido al empeoramiento de la función renal, de la hiperpotasemia y de la hipotensión sintomática35.
Pero el impulso definitivo que llevó a no recomendar el doble bloqueo del SRAA vino de la mano del estudio ONTARGET36. Este ensayo clínico tuvo como objetivo comparar la eficacia de ramipril, telmisartán y la combinación de ambos en pacientes con enfermedad vascular o DM2 de alto riesgo. Mostró que el objetivo primario (entrada a diálisis, duplicación de la creatinina sérica y muerte) ocurrió en 1.412 pacientes del grupo ramipril (16,5%) y en 1.423 pacientes del grupo telmisartán (16,7%; RR: 1,01; IC95%: 0,94 a 1,09). En el grupo de combinación el resultado primario ocurrió en 1.386 pacientes (16,3%; RR: 0,99; IC95%: 0,92 a 1,07); comparado con el grupo de ramipril, había un riesgo aumentado de síntomas hipotensivos (4,8% vs. 1,7%; p<0,001), síncope (0,3% vs. 0,2%; p=0,03) y disfunción renal (13,5% vs. 10,2%; p<0,001).
La confirmación respecto a los riesgos del doble bloqueo del SRAA surgió con los resultados del estudio ALTITUDE34 que incluyó a 8.561 pacientes diabéticos con enfermedad renal que se aleatorizaron a aliskiren 300mg una vez al día o placebo, añadido a un fármaco inhibidor del SRAA a dosis plenas. El estudio fue prematuramente suspendido debido a un aumento en la incidencia de ictus, complicaciones renales e hiperpotasemia en el grupo tratado con aliskiren.
Por tanto, las recomendaciones de todas las guías insisten en utilizar un único agente para bloquear el SRAA. La combinación de un IECA con un ARAII o la combinación de un IECA o ARAII con un IDR es potencialmente perjudicial2,23,24,37. A modo de resumen, en la tabla 2 se recogen los principales estudios realizados con IECA y ARAII en ERC2,38,39.
Resumen de los principales ensayos clínicos que estudian el efecto del bloqueo del SRAA sobre el retraso de la progresión de la ERC
| Estudio | Fármaco/s estudiados | Población estudiada | Tiempo de seguimiento (años) | Resultados |
|---|---|---|---|---|
| CSG | Captopril | DM1 y ERC | 4 | Reducción riesgo de diálisis o muerte |
| REIN | Ramipril | Nefropatía no diabética con proteinuria >1g/24h | 3 | Reducción del riesgo de duplicación del nivel de creatinina o progresión a enfermedad renal avanzada. Reducción de la variable principal un 22% respecto de metoprolol (duplicación de creatinina, ERC estadio 5, muerte). |
| AASK | AmlodipinoRamiprilMetoprolol | Hipertensos de raza negra con nefroangiosclerosis | 3,8 | Reducción del 36% del ritmo de progresión de la ERC con ramipril (vs amlodipino) en pacientes con proteinuria >0,3g/24horas |
| IRMA-2 | Irbesartán | DM2 con microalbuminuria | 2 | Tiempo hasta aparición de nefropatía manifiesta.Reducción del 70% en el desarrollo de proteinuria. |
| IDNT | Irbesartán,Amlodipino | DM2 con nefropatía | 3 | Reducción del 23% del riesgo de duplicar los niveles de creatinina, requerir diálisis o muerte |
| RENAAL | Losartán | DM2 con nefropatía | 3 | Retraso en la progresión de la IRC.Reducción de la variable principal (duplicación de creatinina, ERC estadio 5, muerte) 16% respecto placebo. |
| ONTARGET | Telmisartán,Ramipril,ambos | Mayores de 55 años con DM o enfermedad vascular | 4,6 | Retraso en la progresión de la ERC.No significativo para la variable renal (duplicación de creatinina, ERC estadio 5, muerte). |
| FIDELIO | Finerenona | DM2 con nefropatía | 2,6 | 18% Objetivo compuesto (descenso del 40 % del FGe, ERC avanzada o muerte). |
La espironolactona y el ARM más selectivo, eplerenona, tienen efectos antihipertensivos, cardioprotectores y antiproteinúricos sustanciales incluso en dosis bajas, y en presencia de terapia combinada con IECA y ARAII. Sin embargo, no hay estudios concluyentes que demuestren beneficio en la disminución de la progresión de la ERC en monoterapia. Los ARM se recomiendan como parte del tratamiento de la insuficiencia cardiaca y la HTA resistente, pero su uso suele estar limitado por el desarrollo de hiperpotasemia, sobre todo en personas con FG reducido1.
Pero recientemente se han publicado los resultados del estudio FIDELIO CKD40 en pacientes con ERC y DM2 con finerenona. La finerenona es un nuevo ARM selectivo no esteroideo. En este ensayo los criterios de ERC fueron: cociente albúmina creatinina 30-5.000mg/g, y tasa de FG 25-75ml/min/1,73m2, y debían estar tratados con inhibidores del SRAA a dosis óptimas. Los pacientes de la rama de finerenona tuvieron un menor riesgo de progresión de la ERC o muerte en comparación con placebo, después de una mediana de seguimiento de 2,6años. Aunque la incidencia de hiperpotasemia fue mayor en el grupo de finerenona, la tasa de interrupción por hiperpotasemia fue relativamente baja (2,3%). Al igual que con IECA o ARAII, el potasio sérico y el filtrado glomerular estimado (FGe) se deben volver a medir 4semanas después de iniciar o reiniciar el tratamiento o de aumentar la dosis.
Las guías KDIGO sobre manejo de la DM en la ERC, recientemente publicadas, sugieren la utilización de un ARM no esteroideo con beneficio renal o cardiovascular comprobado para pacientes con DM2, FG ≥25ml/min/1,73m2, concentración sérica normal de potasio y albuminuria a pesar de la dosis máxima tolerada de inhibidor de SRAA23.
Aspectos prácticos del manejo del bloqueo del SRAAComo ya se mencionó, el bloqueo de la acción de la angiotensinaII provoca una disminución de la presión intraglomerular, lo que conlleva una disminución de la tasa de FG y un aumento en el nivel de creatinina sérica. Además, el bloqueo del SRAA inhibe la acción de la aldosterona con mayor propensión a la hiperpotasemia. Esta situación, si se produce, generalmente ocurrirá durante las primeras 2semanas de inicio del tratamiento o modificación de dosis y debe estabilizarse a las 2-4semanas en el contexto de un adecuado aporte de sodio y de líquidos41.
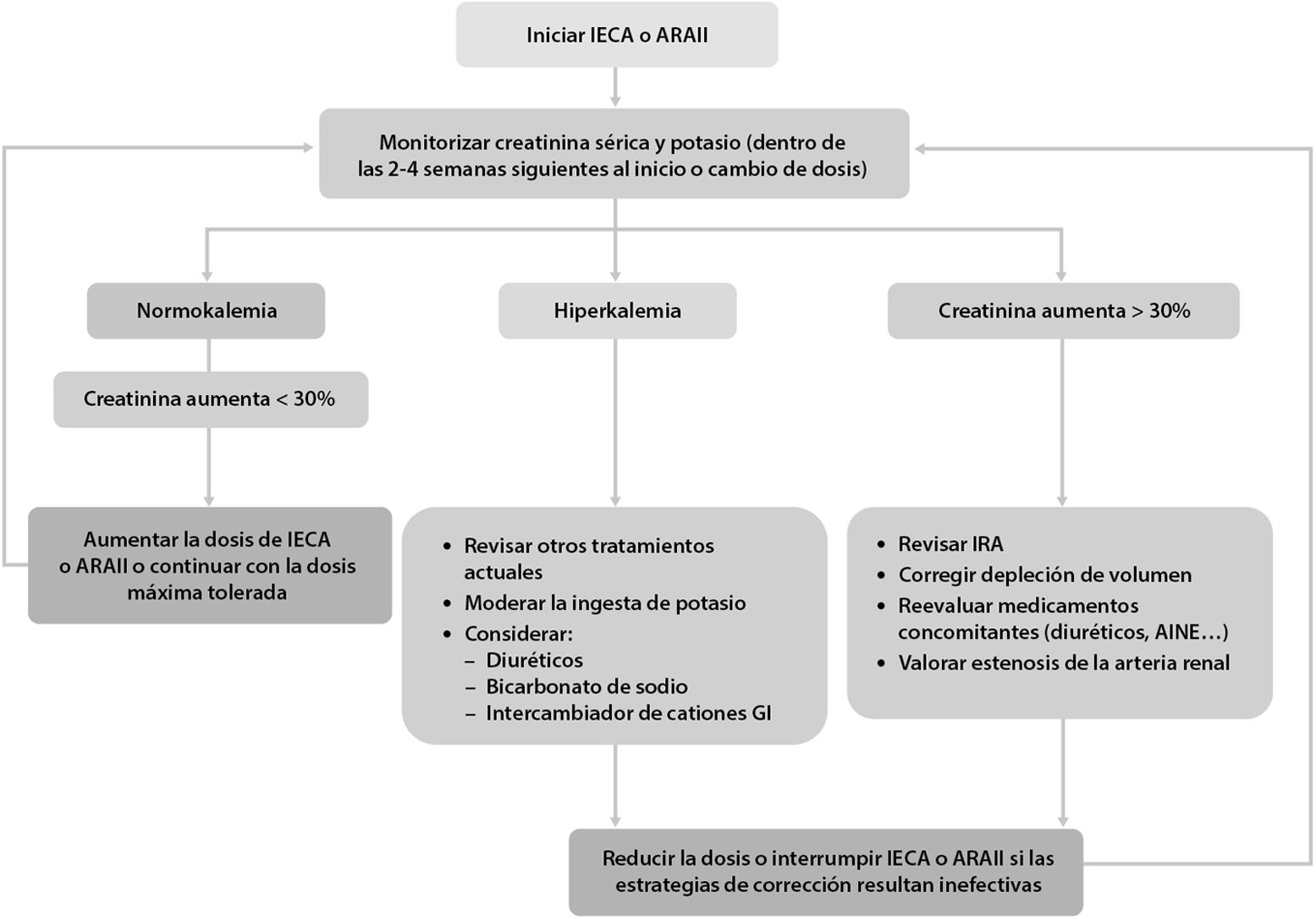
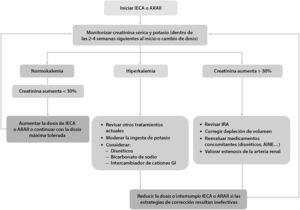
Por tanto, es importante controlar los cambios en la PA, en la creatinina y en el potasio séricos dentro de las 2 a 4semanas posteriores al inicio o al aumento de la dosis de un IECA o ARA. Está indicado continuar la terapia con IECA o ARAII a menos que la creatinina sérica aumente en más del 30%, o el FG estimado (FGe) descienda más del 25%, dentro de las 4semanas posteriores tras iniciar el tratamiento o aumentar la dosis23,37 (fig. 2).
Algoritmo de monitorización del tratamiento con IECA o ARAII en ERC: ajuste de dosis y seguimiento de efectos secundarios
AINE: antiinflamatorios no esteroideos; ARAII: antagonistas de los receptores de angiotensinaII; GI: gastrointestinal; IECA: inhibidores de la enzima convertidora de la angiotensina; IRA: insuficiencia renal aguda.
Si hay una disminución en la tasa de FGe o un aumento de la creatinina sérica después de iniciar o incrementar la dosis de antagonistas del SRAA, pero es menos del 25% (FGe) o del 30% (creatinina sérica) del valor basal, se recomienda repetir la prueba en una a dos semanas sin modificar la dosis. Si el cambio de la tasa de FGe es del 25% o más, o el cambio en la creatinina sérica es del 30% o más, se recomienda:
- •
Investigar otras causas de un deterioro de la función renal, como la hipovolemia o la administración simultánea de otros fármacos que afecten la función renal o incrementen los niveles de potasio (por ejemplo, antiinflamatorios no esteroideos).
- •
Si no se encuentra ninguna otra causa para el deterioro de la función renal, interrumpir el tratamiento con el antagonista del SRAA o reducir la dosis a una dosis más baja previamente tolerada, agregando otro antihipertensivo alternativo si es necesario23,37.
- •
La hiperpotasemia asociada con el uso de un IECA o ARAII a menudo se puede controlar mediante medidas para reducir los niveles séricos de potasio, en lugar de disminuir la dosis o suspender el IECA o el ARAII inmediatamente.
- •
Es necesario reducir la dosis o interrumpir el tratamiento con IECA o ARAII en el contexto de hipotensión sintomática o hiperpotasemia no controlada, a pesar del tratamiento médico, o para reducir los síntomas urémicos mientras se trata la insuficiencia renal aguda (FGe <15ml/min/1,73m2)42.
Los pacientes con DM e HTA tienen un menor riesgo de progresión de la ERC cuando la excreción de albúmina en orina es normal y la evidencia existente no demuestra un beneficio clínico claro de la inhibición del SRAA en la progresión de la ERC en esta población. La presencia de albuminuria y de PA no controlada se asocia con un mayor riesgo de progresión de la ERC y el desarrollo de insuficiencia renal en pacientes con ERC con y sin diabetes. Igualmente, el grado de albuminuria se correlaciona con el incremento de riesgo de progresión de la ERC. Tanto los IECA como los ARAII han demostrado ser efectivos en la reducción de la albuminuria e incluso en la reversión de la albuminuria moderadamente aumentada. Las evidencias en nefropatía no diabética con ARAII son limitadas. Los ARAII no parecen ser más beneficiosos que otros antihipertensivos en la ERC no proteinúrica (tabla 3). Además, se sabe que el efecto reductor de la albuminuria está relacionado con la dosis de IECA/ARAII (pero también incrementa la posibilidad de aparición de efectos secundarios). El bloqueo del SRAA disminuye la tasa de pérdida de la función renal en pacientes con ERC y albuminuria, pero es necesario controlar la función renal y el nivel sérico de potasio. Actualmente, las recomendaciones de las principales guías apoyan el tratamiento con IECA o ARAII en toda persona con ERC diabética o no diabética con albuminuria.
Información sobre el suplementoEste artículo forma parte del suplemento titulado «Actualización en el tratamiento de la enfermedad renal crónica», que ha sido patrocinado por AstraZeneca.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.