La neuropatía de fibras pequeñas es una afectación del sistema nervioso periférico cuya principal manifestación es un cuadro de dolor neuropático crónico, acompañado generalmente de alteraciones del sistema nervioso autónomo. Esta enfermedad afecta a fibras nerviosas mielinizadas (Aδ) y no mielinizadas (C), de pequeño calibre. Sus causas pueden ser primarias o secundarias a trastornos del metabolismo, infecciones, enfermedades autoinmunes, neurológicas o tóxicos. Los estudios neurofisiológicos habituales suelen ser negativos. El diagnóstico puede realizarse con exploraciones complementarias de difícil acceso desde la atención primaria, como la microneurografía, test con estímulos sensitivos y otras, aunque la prueba más utilizada es la biopsia cutánea. El tratamiento debe dirigirse a las causas y/o a los síntomas neurológicos.
Dada la variabilidad de síntomas con los que puede iniciarse, creemos que es importante conocer esta entidad para aumentar la sospecha clínica, orientar el diagnóstico y poder ofrecer la posibilidad de tratamiento.
Small fibre neuropathy is a disorder of the peripheral nervous system for which main clinical manifestation is chronic neuropathic pain, often accompanied by alterations of the autonomic nervous system. This disease affects the small diameter myelinated (Aδ) and non-myelinated nerve fibres (C). Its causes are primary or secondary, such as metabolism defects, infection, and autoimmune, neurological or toxic diseases, among others. Routine neurophysiological tests are usually negative. Diagnosis can be made with complementary tests which are difficult to access from Primary Health Care. These include microneurography, and the sensory stimulation test; but the most used technique is the skin biopsy. Treatment is directed at the causes and the neurological symptoms.
Due to the variability of symptoms that can be presented, the importance of being aware of this condition is emphasised in order to reach a diagnosis and offer the appropriate treatment.
La neuropatía de fibras pequeñas (NFP) es una enfermedad aún no del todo conocida, que se enmarca dentro del capítulo de los síndromes dolorosos crónicos1, que está adquiriendo cada vez más relevancia debido a la repercusión en la calidad de vida de los pacientes que la padecen2. Se trata de una entidad en la cual se ve afectada la función de las pequeñas fibras aferentes mielinizadas Aδ y las fibras no mielinizadas C3,4, siendo la causa más frecuente la diabetes mellitus2,4,5 y la segunda causa más descrita la idiopática. También existen muchas otras etiologías entre las cuales destacan enfermedades metabólicas, infecciosas, autoinmunitarias, e incluso recientemente se han descrito mutaciones en los canales de sodio de las fibras nerviosas afectadas6. Existen 2 formas de presentación clínica: la de polineuropatía de distribución simétrica longitud-dependiente, que característicamente afecta a las extremidades de inicio distal a proximal; es la más conocida, se da en un tercio de los casos y la forma de distribución es no longitud-dependiente, neuropatía mono o multifocal, que muestra un patrón de afectación discontinuo3. Los síntomas más frecuentes son alteraciones sensitivas en la percepción de la temperatura y nocicepción, y pueden asociarse múltiples síntomas autonómicos3. Aunque no existe una prueba de diagnóstico gold-standard se ha determinado que las herramientas más útiles para la el diagnóstico de la NFP son la clínica, la biopsia cutánea, el test cuantitativo sensorial (QST), el test cuantitativo del reflejo axónico sudomotor y la microneurografía1,3. Asimismo, disponemos de algunos algoritmos de aproximación diagnóstica de la NFP que nos pueden resultar de gran ayuda5. Con respecto al tratamiento, hasta nuestros días no existe una terapia específica para la NFP. Es por eso que su manejo principal se basa en el control de los síntomas5.
La NPF es una enfermedad probablemente infradiagnosticada, debido al escaso nivel de sospecha clínica, así como a la dificultad en la confirmación de su diagnóstico, especialmente en las formas que no siguen el patrón de distribución longitud-dependiente. Además, en ocasiones la NFP es susceptible de ser confundida con otras afecciones, como la fibromialgia o las neuropatías de fibras gruesas, debido a que puede compartir algunas manifestaciones clínicas con estas entidades4. Es por esta razón que resulta importante realizar un adecuado diagnóstico diferencial. El objetivo principal de esta revisión es profundizar en la NFP de una forma sintética y práctica, para facilitar su identificación y conocer los avances y estudios de investigación sobre la NFP que se han realizado hasta el momento.
EtiopatogeniaLas fibras nerviosas pequeñas, fibras aferentes escasamente mielinizadas Aδ y no mielinizadas C, del sistema nervioso periférico son sensitivas, las responsables de la transmisión de la temperatura, dolor y prurito a nivel somatosensorial, y en el sistema nervioso autonómico intervienen en las funciones de termorregulación (sudoración), en el sistema cardiovascular, gastrointestinal y genitourinario.
La NFP se caracteriza por la degeneración de las terminaciones nerviosas de estas fibras, aunque también puede haber clínica debido a hiperexcitabilidad, sin encontrarse degeneración a este nivel3.
Los mecanismos por los que las fibras Aδ yC son afectadas no están del todo claros. Pueden ser diversos, de origen metabólico, infeccioso, nutricional, vascular, autoinmune y genético. En el 30-50% de los casos8 no puede identificarse la causa de la NFP, se considera idiopática. En el resto de los casos las NFP asociadas a alteraciones metabólicas son las más frecuentes.
Los nociceptores (mecanorreceptores, termorreceptores en el caso de fibras Aδ, multimodales en el caso de fibras C) se componen de diferentes canales iónicos, entre ellos de canales de Na voltaje dependientes, cuya activación (por frío, calor, modificación de pH, etc.) provoca un potencial de acción. Alteraciones a nivel del microambiente de los nociceptores pueden alterar la activación neuronal. La presencia de moléculas diversas, como la histamina, prostaglandinas, interleucinas, TNF-α, producidas en procesos inflamatorios, etc., u otras condiciones, como la hipoxia a nivel de los nociceptores pueden provocar una hiperexcitabilidad de los mismos, con afectación de los canales iónicos, y favorecer la aparición de fenómenos dolorosos, como la alodinia o hiperalgesia1,3.
Como ya se ha dicho, la causa identificable más frecuente es la diabetes mellitus (30%), cuya conocida complicación neurológica, la polineuropatía diabética, que afecta a fibras mielinizadas de grueso calibre, puede ser precedida por la aparición de NFP. Es conocido el hecho de que el tratamiento hipoglucemiante intensivo e instaurado rápidamente, tanto con hipoglucemiantes orales como con insulina, puede desencadenar una NFP dolorosa8. Otras alteraciones metabólicas que pueden acompañarse de NFP son el hipotiroidismo, la insuficiencia renal crónica avanzada, el síndrome metabólico y la hipertrigliceridemia severa. También se ha descrito NFP en relación con el déficit de vitamina B12. La neuropatía amiloidea, ya sea hereditaria o adquirida, puede presentarse como NFP pura, y afectar en su progresión a fibras neuronales gruesas, así como a diferentes órganos3.
Otro gran grupo de enfermedades que se asocian con la NFP es el de las inmunomediadas, como la sarcoidosis (asociación bien establecida con la NFP2), el síndrome de Sjögren, el lupus eritematoso sistémico, las vasculitis autoinmunes y el síndrome de Raynaud primario, entre otras; y el grupo de las enfermedades infecciosas (VIH, hepatitis C, enfermedad de Chagas, enfermedad de Lyme e influenza). Asimismo, se han descrito cuadros de NFP en relación con agentes tóxicos, como antirretrovirales, quimioterápicos, alcohol e intoxicación por piridoxina.
Un capítulo aparte lo constituyen las NFP hereditarias, entidades muy poco frecuentes en las que han sido descritas mutaciones patogénicas en los genes que codifican los canales de Na (Nav 1.7, Nav 1.8 y Nav 1.9). Estos son los principales canales presentes en las fibras pequeñas del sistema nervioso periférico y del sistema vegetativo, en el axón y en el cuerpo celular, responsables de la transmisión de la información a este nivel. Varios estudios sugieren que son una de las principales estructuras implicadas en la NFP1 y en neuropatías dolorosas periféricas. La presencia de estas mutaciones, que alteran la estructura de estos canales de sodio, pueden ser responsables de un aumento significativo de la sensibilidad a un estímulo. Estas mutaciones genéticas también se han encontrado en algunas de las NFP consideradas inicialmente de origen idiopático. En la tabla 1 se exponen de forma resumida las causas de NFP ya descritas.
Causas de neuropatía de fibras pequeñas
| Primarias |
|---|
| Idiopáticas |
| Neuropatía de fibras pequeñas idiopática |
| Síndrome de la boca ardiente |
| Hereditarias |
| Canalopatías (Mutaciones Nav 1.7, Nav 1.8, Nav 1.9) |
| Enfermedad de Fabry |
| Enfermedad de Tangier |
| Secundarias |
|---|
| Metabólicas |
| Diabetes mellitus/tolerancia alterada a la glucosa |
| Déficit de vitamina B12 |
| Hipotiroidismo/hipertiroidismo |
| Dislipidemia |
| Insuficiencia renal crónica |
| Infecciosas |
| Virus de la inmunodeficiencia humana |
| Hepatitis C |
| Influenza |
| Lepra |
| Enfermedad de Chagas |
| Fármacos |
| Antirretrovirales |
| Quimioterápicos |
| Metronidazol |
| Nitrofurantoína |
| Flecainida |
| Estatinas |
| Vitamina B6 |
| Tóxicos |
| Alcohol |
| Arsénico |
| Talio |
| Amiloidosis |
| Sistémica |
| Familiar (polineuropatía amiloidótica familiar) |
| Inmunomediadas |
| Enfermedad de Sjögren |
| Enfermedad celíaca |
| Sarcoidosis |
| Artritis reumatoide |
| Lupus eritematoso sistémico |
| Vasculitis |
| Enfermedad inflamatoria intestinal |
| Gammapatía monoclonal |
| Sindrome paraneoplásico (n. pulmón) |
| Neurodegenerativas |
| Enfermedad de Parkinson |
| Esclerosis lateral amiotrófica |
Es importante, una vez diagnosticada la presencia de NFP, identificar la posible causa subyacente, ya que el tratamiento de la enfermedad o alteración asociada podría mejorar los síntomas de la neuropatía.
Manifestaciones clínicasLos síntomas de la NFP pueden ser muy variados en intensidad y progresión6, y según el tipo de fibras que se afecten se dividen en neuropáticos y por disfunción autonómica.
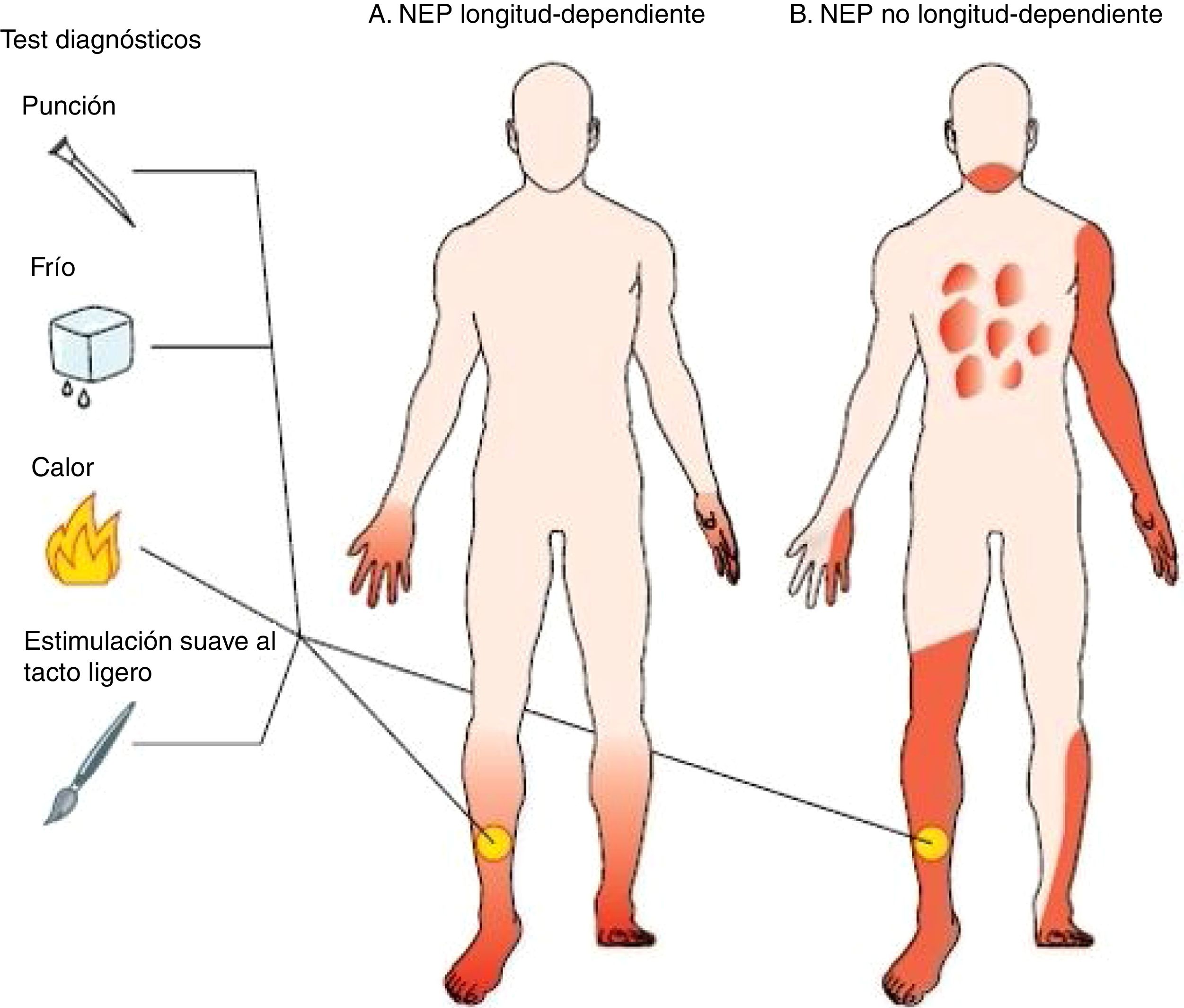
Síntomas neuropáticosGeneralmente la sospecha de esta entidad debe aparecer frente a un cuadro de dolor neuropático, con distribución denominada longitud dependiente, de inicio en las extremidades inferiores, descrito como «quemazón», «pinchazos», «descargas eléctricas» o prurito6, sin desencadenante claro, aunque puede empeorar con el reposo nocturno (lo que recuerda al síndrome de piernas inquietas). Suele progresar proximalmente con patrón de afectación «en guante y calcetín». Pueden aparecer parestesias, disestesias, así como alodinia e hiperalgesia (dolor que empeora con el roce de las sábanas en la cama). Hay estudios que sugieren que el dolor puede seguir un ritmo circadiano, empeorando por la noche7, o con el reposo, pudiendo interferir en la calidad del sueño9. También pueden desencadenarse crisis de dolor al aumentar la temperatura o con el ejercicio (sugiere canalopatías por mutaciones en canales de sodio)6. Este es el patrón habitual, neuropatía distal ascendente, pero también existe otro patrón neuropático, no longitud dependiente, en el que la sintomatología se distribuye como «en parches» en zonas, en las extremidades superiores, el tronco y la cabeza. Podemos observar las diferencias en la distribución anatómica entre las 2 formas de presentación longitud-dependiente y no longitud dependiente en la figura 1. Esta última presentación suele darse más en neuropatía de fibras pequeñas asociadas a enfermedades autoinmunes o inflamatorias. La alteración de la marcha, así como la debilidad en las extremidades inferiores, pueden indicar afectación añadida de fibras nerviosas largas, mielinizadas. Típicamente, en la exploración neurológica no se detectan disminución de la fuerza, alteraciones de los reflejos osteotendinosos ni de la coordinación motora, ya que la sensibilidad táctil, vibratoria y la propiocepción son normales6. Puede detectarse una pérdida de la sensibilidad al pinchazo, o de la sensibilidad térmica a nivel distal, así como alodinia, dolor provocado frente a un estímulo poco intenso (roce con cepillo suave).
Diferencias de distribución anatómica entre la neuropatía de fibras pequeñas longitud-dependiente y no longitud-dependiente.
Tomada de Tekelsen et al.3.
El síntoma más frecuente de este grupo suele ser la disregulación vasomotora, con cambios de coloración azul/púrpura en manos y pies. Otros síntomas pueden ser alteraciones digestivas (diarrea, estreñimiento, gastroparesia) y urinarias (dificultad de vaciar la vejiga o incontinencia), disfunción eréctil, diaforesis, sofocos y síndrome seco. La disregulación neurogénica de los microvasos puede causar taquicardias en reposo, hipotensión postural y síncopes, así como fatiga e incluso alteraciones cognitivas.
Los síntomas en la fibromialgia (FM) pueden ser parcialmente superponibles a los de la NFP. Se han hecho estudios en pacientes diagnosticados de FM y se ha detectado déficit en el funcionamiento de las fibras nerviosas pequeñas, lo que sugiere una asociación, asumiendo que la FM no sea una afectación exclusiva del sistema nervioso central por sensibilización, sino que puede tener asimismo afectación del sistema nervioso periférico6.
DiagnósticoAdemás de la clínica y la exploración física se deben realizar análisis completos para descartar enfermedades causantes como: diabetes mellitus, déficit de vitamina B12 y folatos, alteraciones tiroideas, neoplasias, hepatitis C, VIH, enfermedades reumáticas y gammapatías monoclonales.
Exploraciones neurofisiológicasSe pueden realizar exploraciones electrofisiológicas, pero de la que disponemos habitualmente (electromiografía) no es adecuada para diagnosticar esta enfermedad, ya que evalúa solo el funcionamiento de las fibras gruesas. Suele ser útil para descartar la afectación de este tipo de fibras.
- -
Microneurografía: se basa en el registro de potenciales de acción en nervios periféricos, mediante inserción intraneural de microelectrodos en las fibras pequeñas, detectando la funcionalidad de las mismas. Es una técnica que no es de fácil acceso en la práctica clínica, y debe realizarse por personal experto.
- -
Potenciales evocados. Láser: para detectar anomalías en el funcionamiento de las fibras pequeñas se utilizan los potenciales evocados mediante radiaciones láser, que provocan un estímulo calórico localizado, que excita las fibras nerviosas pequeñas, y registran a nivel central las respuestas inducidas, aunque no diferencian una afectación central de una periférica.
- -
QST: miden la respuesta a estímulos térmicos y mecánicos, detectando umbrales de percepción de calor y frío, que se afectan según patrones específicos en la neuropatía de fibras pequeñas. Detectan, asimismo, hiperalgesia en respuesta a estímulos mecánicos o térmicos no intensos. Es un método no invasivo, pero laborioso6. No diferencia entre afectación al nivel del sistema nervioso central o periférico.
Para valorar la función sudomotora se dispone de diferentes test, entre ellos:
- -
Quantitative sudomotor axon reflex test: mide mediante un sudorímetro el volumen de sudor tras la estimulación cutánea por iontoforesis3.
- -
Sudoscan: es un método cuantitativo que permite evaluar con rapidez la funcionalidad de las glándulas sudoríparas, por reacción electroquímica entre iones cloro presentes en el sudor y electrodos colocados en las palmas y las plantas.
La prueba más utilizada para realizar el diagnóstico es la biopsia cutánea6,8. Se ha estandarizado la zona para realizarla: en la pierna, a 10cm por encima del maléolo lateral. En caso de que la clínica sea unilateral puede tomarse una muestra de la extremidad contralateral para utilizarla como control. La muestra se tiñe con un marcador axonal y se establece un conteo para determinar la densidad de la fibra nerviosa. Una disminución de la densidad de fibras nerviosas epidérmicas apoya al diagnóstico.
Se puede realizar también la biopsia en la planta del pie, sobre todo cuando la clínica se presenta solo en esta zona.
El diagnóstico de sospecha clínica de NFP debe hacerse frente a un cuadro de dolor neuropático distal o en patrones parcheados, acompañado de disfunciones autonómicas, que siempre deben formar parte de la anamnesis.
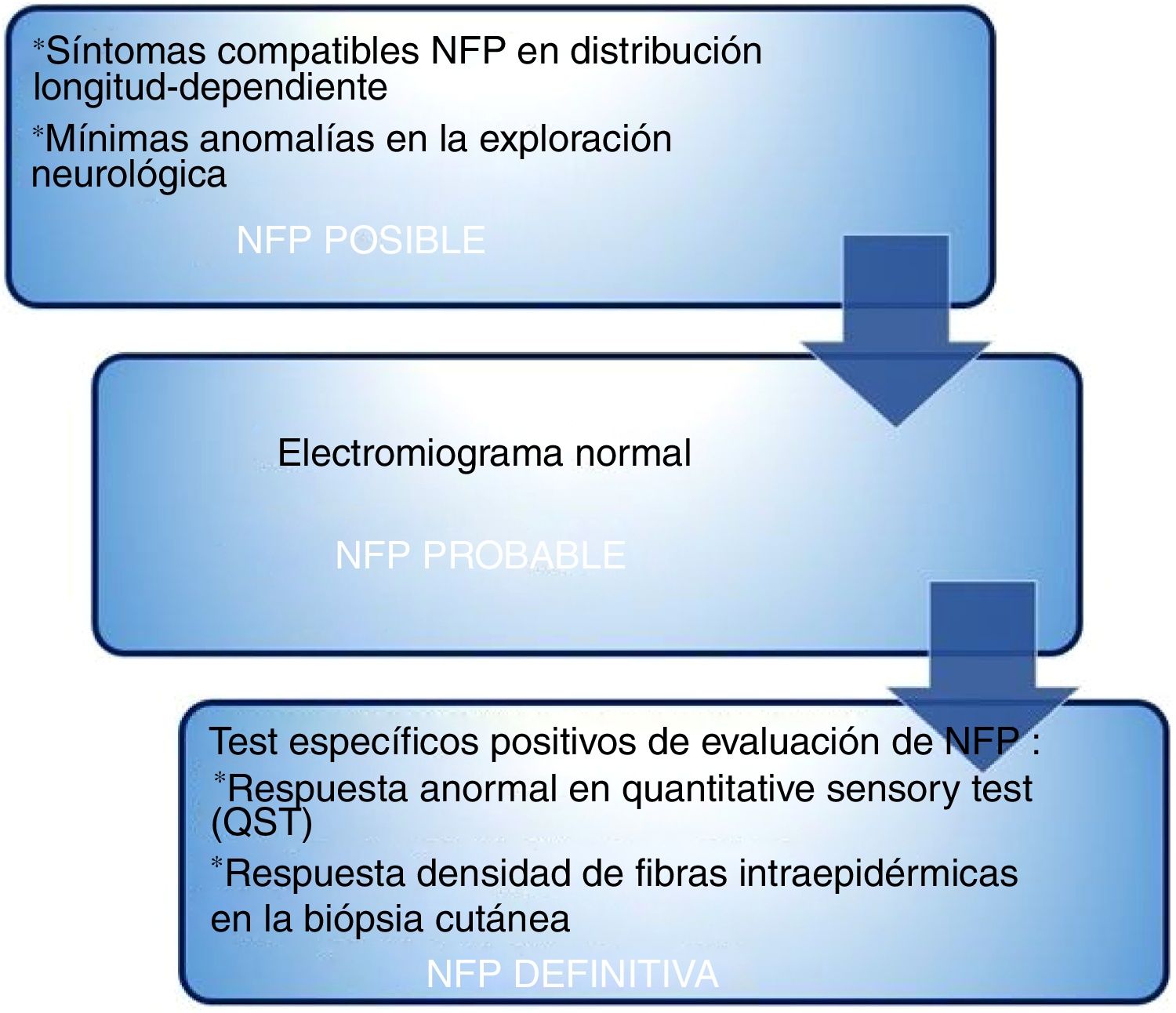
Debemos aclarar que en la mayoría de los pacientes solo con la clínica y exploración física puede ser suficiente para realizar el diagnóstico, y no siempre es necesaria la biopsia cutánea para confirmación. En esta línea algunos autores han clasificado el diagnóstico de la NFP en 3 grados de certeza según la clínica y hallazgos de las exploraciones complementarias en posible, probable y definitivo (fig. 2).
- -
Posible: presencia de síntomas (dolor, quemazón, disestesias, entre otros), siguiendo el patrón longitud-dependiente y/o mínimas anomalías en la exploración física, exceptuando alteraciones en la sensibilidad termoalgésica.
- -
Probable: presencia de síntomas siguiendo el patrón longitud-dependiente y/o mínimas anomalías en la exploración física, con electromiograma normal.
- -
Definitivo: presencia de síntomas siguiendo el patrón longitud-dependiente y/o mínimas anomalías en la exploración física, electromiograma normal y reducción de la densidad de fibras intraepidérmicas en la biopsia cutánea y/o respuesta anormal en el QST7.
[CS1]Algoritmo de los grados de certeza de NFP atendiendo a la clínica y las exploraciones complementarias.
Fuente: Gondim et al.7.
Hay 2 pilares fundamentales en el tratamiento: tratar las causas y los síntomas. Se ha visto que en la neuropatía secundaria a causas inmunomediadas puede haber mejoría clínica de los síntomas tras el tratamiento con glucocorticoides. En algún caso específico de pacientes con celiaquía o síndrome seco se ha objetivado mejoría tras la infusión endovenosa de inmunoglobulinas6. En cuanto a los pacientes diabéticos, al igual que para prevenir otro tipo de complicaciones, el control glucémico es esencial. Se deben reponer todos los déficits vitamínicos objetivados en controles periódicos e intentar deshabituamiento de tóxicos. En pacientes que presentan mutación de canales del sodio se ha visto en algunos estudios que mediante el bloqueo de estos canales con fármacos antiarrítmicos (ej: mexiletina, del grupo Ib) puede mejorar los síntomas de la NFP, pero aún este uso no se encuentra especificado en la ficha técnica del fármaco. Asimismo, en pacientes con mutación en el gen Nav 1.7 algunos estudios han determinado una disminución del dolor en la NFP y mejoría de la calidad del sueño con el uso de lacosamida4.
En cuanto a los síntomas el dolor neuropático se suele tratar con las armas terapéuticas habituales que disponemos para el tratamiento de los dolores neuropáticos, aunque los resultados no son del todo satisfactorios9: se pueden utilizar antidepresivos tricíclicos, aunque hoy en día los inhibidores selectivos de la recaptación de serotonina, como la duloxetina o la venlafaxina, son una opción más segura. Los antiepilépticos, como gabapentina y pregabalina pueden ayudar a disminuir el dolor y los síntomas neuropáticos (disestesias, alodinia, prurito, etc.). El uso de opiáceos (tramadol, oxicodona) puede ser útil en el tratamiento de accesos de dolor agudo, así como tapentadol, un opioide agonista de receptor mu, que se utiliza en polineuropatía diabética, puede utilizarse en NFP8. Es muy importante que al pautar este tipo de tratamientos siempre se intente evitar la dependencia a los opiáceos, ya que se trata de un proceso de larga evolución. La capsaicina también puede ser útil como tratamiento tópico4,6, así como el parche de lidocaína al 5%6 en dolores localizados (no indicado en ficha técnica).
En ocasiones, dada la falta de respuesta a los tratamientos farmacológicos, es preciso recurrir a terapias más agresivas, como bloqueos neurales, estimulación espinal, medicación intratecal o incluso intervenciones neuroquirúrgicas, que están fuera del ámbito de esta revisión.
La evolución de la NFP, una vez diagnosticada, es variable. En ocasiones progresa, pudiendo aparecer afectación de fibras largas mielinizadas, como en el caso de la polineuropatía diabética. También sucede en el caso de NFP idiopáticas que a lo largo de su evolución se manifiesten enfermedades subyacentes potencialmente tratables, que modificarán el pronóstico inicial de la NFP.
En algunos estudios de seguimiento de NFP idiopáticas, incluso en períodos de hasta 14 años, se informa de un 75% de pacientes que permanecen estables o mejoran, mientras que un 25% desarrollan neuropatía de fibras largas.
Dada la complejidad de la entidad es necesario un enfoque multidisciplinar del paciente, atendiendo a la gestión de los posibles factores agravantes del dolor (cambios de temperatura, esfuerzos físicos) y a la posible afectación psicológica, como ocurre en todos los cuadros de dolor crónico.
ConclusionesEn atención primaria nos encontramos con motivos de consulta muy variados en el día a día y que no siempre son explícitos, o los pacientes no pueden describirlos correctamente. Tomarse el tiempo para realizar un correcto interrogatorio y una buena exploración física pueden ayudarnos a sospechar una neuropatía de fibras pequeñas en pacientes afectos de las enfermedades mencionadas en esta revisión. En la actualidad, la mayoría de las exploraciones complementarias que la confirman no están al alcance del médico de familia, por lo que muchas veces se necesita el trabajo en grupo de otros especialistas y agentes de salud.
Esta entidad puede llegar a afectar desfavorablemente la calidad de vida por la presencia de dolor crónico y las disfunciones del sistema nervioso autonómico. Es importante pensar en esta entidad frente a un cuadro de dolor neuropático crónico, con síntomas de afectación del sistema autonómico, y con exploración neurológica y estudios electrofisiológicos estándar prácticamente normales.
Creemos que estar atentos a descubrir esta afección y a detectarla a tiempo puede llegar a proporcionar una mejor calidad de vida para el paciente, al ofrecerle la posibilidad de mejora de sus síntomas.
Conflicto de interesesLas autoras declaran no tener conflicto de intereses.








![[CS1]Algoritmo de los grados de certeza de NFP atendiendo a la clínica y las exploraciones complementarias. Fuente: Gondim et al.7. [CS1]Algoritmo de los grados de certeza de NFP atendiendo a la clínica y las exploraciones complementarias. Fuente: Gondim et al.7.](https://static.elsevier.es/multimedia/11383593/0000004600000004/v2_202006230630/S1138359319304381/v2_202006230630/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
