Estudiar si los parámetros basales de la espirometría forzada pueden influir en la positividad de la prueba de broncodilatación (PBD) y si esto pudiera influir en futuros criterios de positividad.
Material y métodosEstudio descriptivo transversal multicéntrico con emplazamiento en Atención Primaria. Fueron incluidos todos los pacientes derivados por su médico de familia, para la realización de espirometría forzada por tabaquismo, síntomas respiratorios o seguimiento de enfermedades respiratorias, entre los meses de junio de 2015 y febrero de 2017. A todos ellos se les realizó una espirometría forzada con PBD.
ResultadosSe incluyeron 295 pacientes, con una edad media de 53,4±15,5 años, el 62% fueron hombres.
En el 20% de las espirometrías se obtuvo un patrón obstructivo; presentando el 67,5% una obstrucción leve, 18% moderada, 9,6% moderada-grave y un 4,8% muy grave. El 8,8% de las espirometrías obtuvieron PBD positiva; 11,2% fueron positivas únicamente en volumen y el 17,6% fueron positivas únicamente en porcentaje.
Se observó que los pacientes con una PBD positiva en porcentaje presentaban de forma basal menor volumen espiratorio forzado en el primer segundo (1,66 l/sg vs. 2,74 l/sg; p <0,001), y menor capacidad vital forzada (2,85 l vs. 3,73 l; p<0,001). Los pacientes con PBD positiva en volumen presentaban menor volumen espiratorio forzado en el primer segundo (2,59 l/sg vs. 2,62 l/sg; p <0,001), y mayor capacidad vital forzada (3,89 l vs. 3,58 l; p<0,001).
ConclusionesEl volumen espiratorio forzado en el primer segundo y la capacidad vital forzada basales influyen en la positividad de la PBD. Debería valorarse esta circunstancia a la hora de establecer los criterios de positividad de la PBD.
To determine whether the baseline parameters of forced spirometry can influence the positivity of the bronchodilation test (BDT), and whether this could have an influence in future positivity criteria.
Material and methodsA descriptive, cross-sectional study was conducted in a Primary Care setting. It included all patients referred by their family doctor to perform a forced spirometry test due to smoking, respiratory symptoms, or follow-up of respiratory diseases, between the months of June 2015 and February 2017. All of them were subjected to a forced spirometry with a BDT.
ResultsA total of 295 patients were included, with a mean age 53.4±15.5 years, and 62% were male.An obstructive pattern was obtained in 20% of the spirometries, with 67.5% presenting with a mild obstruction, 18% a moderate, 9.6% moderate to severe, and 4.8% very severe. The BDT was positive in 8.8% of the spirometries, with 11.2% only positive in volume, and 17.6% were only positive in percentage.
It was observed that the patients with a BDT positive in percentage had a lower base forced expiry volume in the first second (1.66 L/sec vs. 2.74 L/sec; P<.001), and a lower forced vital capacity (2.85 l vs.3.73 l; P<.001). The patients with a positive BDT in volume had a lower forced expiry volume in the first second (2.59 l/sec vs. 2. 62 l/sec; P<.001), and a higher forced vital capacity (3.89 l vs. 3.58 l; P<.001).
ConclusionsThe baseline forced expiry volume in the first second and forced vital capacity have an influence in the positivity of the BDT. This circumstance should be assessed when establishing the positivity of the BDT.
Datos publicados por la OMS ponen en evidencia la elevada prevalencia de la enfermedad pulmonar obstructiva crónica (EPOC) y del asma a nivel mundial, en datos corroborados a nivel nacional1–4, han presentado, dichos procesos, una elevada morbilidad, limitación funcional y mortalidad. Así mismo, el porcentaje de personas con hábito tabáquico es elevado en nuestro país5.
El estudio diagnóstico y de seguimiento de los pacientes con EPOC o asma y el cribado de personas en riesgo de enfermedad pulmonar (especialmente fumadores) son las principales indicaciones de la espirometría forzada6,7. La prueba broncodilatadora (PBD) evalúa la reversibilidad de la obstrucción bronquial. Es una de las pruebas más sencillas, baratas y útiles de las que se realizan en la práctica clínica habitual en neumología, con utilidad diagnóstica, pronóstica y terapéutica6.
La espirometría forzada es la principal prueba de estudio de la función pulmonar y la base para el diagnóstico y seguimiento de dichos procesos, tratándose del método más reproducible, normalizado y objetivo de medir la limitación del flujo de aire7–10, debiendo ser una herramienta de uso común en atención primaria6,11. Para garantizar su calidad se requiere de unas condiciones mínimas imprescindibles, estando dichas condiciones estandarizadas tanto a nivel instrumental como de la técnica propiamente dicha, y los profesionales encargados de su realización deben de conocerlas6,7,11.
La PBD consiste en repetir la espirometría forzada después de administrar un broncodilatador de forma estandarizada, permitiéndonos objetivar la reversibilidad de la obstrucción; dicho estudio de la reversibilidad bronquial está indicado en toda espirometría diagnóstica y es muy recomendable en las de seguimiento, especialmente para evaluar la respuesta a regímenes terapéuticos en pacientes con reversibilidad conocida6,9,11.
En las recomendaciones vigentes en nuestro entorno, la PBD se considera positiva si el porcentaje del volumen espiratorio forzado en el primer segundo (FEV1) con relación al basal mejora un ≥12% y presenta un incremento ≥ 200ml en este parámetro6,11, pero en la práctica clínica diaria son múltiples los pacientes que solo obtienen uno de los dos criterios. En este sentido hay que mencionar que la prueba presenta una variabilidad conocida en pruebas repetidas12–14, que la expresión del cambio como porcentaje del valor basal normaliza el resultado para el sexo, la edad y el FEV1 inicial15,16 y que existe relación entre la mejoría del FEV1 en porcentaje y un menor valor basal de FEV117; quizás por todo ello algunas recomendaciones han considerado la prueba positiva con el cumplimiento de únicamente uno de los dos valores (porcentaje o volumen) en población general o en grupos específicos de pacientes18–20.
En este contexto, el presente trabajo tiene como objetivo principal estudiar si los parámetros basales de la espirometría forzada pueden influir en la positividad de la PBD y si esto pudiera influir en futuros criterios de positividad.
Material y métodosPara obtener los objetivos descritos se realizó un estudio descriptivo transversal multicéntrico entre los meses junio de 2015 y febrero de 2017.
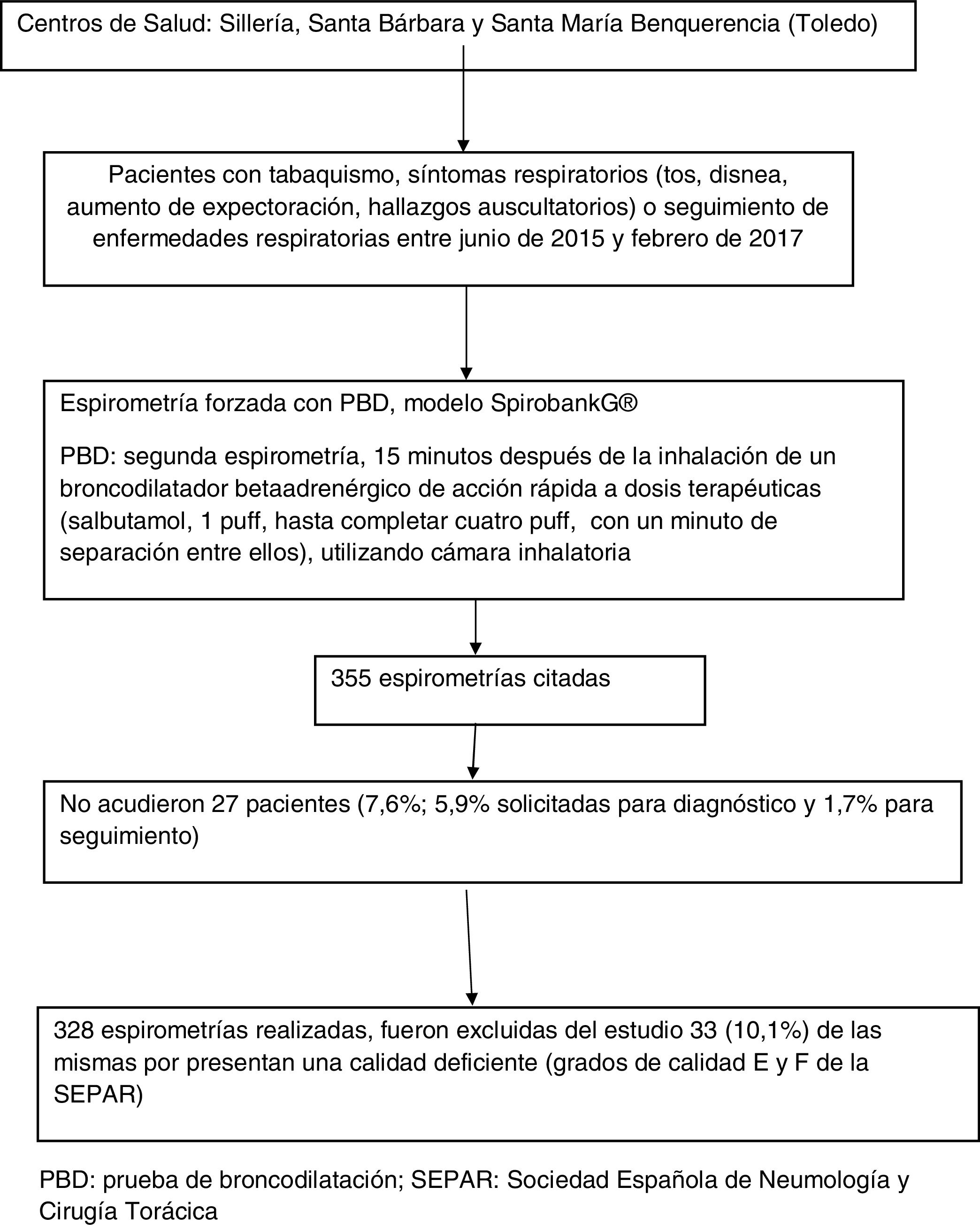
La población diana fueron las personas adscritas a tres centros de salud de la provincia de Toledo (Sillería, Santa Bárbara y Santa María Benquerencia) derivados por su médico de familia en el periodo mencionado, para la realización de espirometría forzada por tabaquismo, síntomas respiratorios (tos, disnea, aumento de expectoración, hallazgos auscultatorios) o seguimiento de enfermedades respiratorias. Antes de realizar la espirometría se descartaron las posibles contraindicaciones de la misma (absolutas y relativas). Se excluyeron del estudio los pacientes que no acudieron a realizarse la prueba y aquellas espirometrías de calidad deficiente, grados de calidad E y F.
La medición principal fue la espirometría forzada con PBD, que se realizó con un modelo SpirobankG®. Previamente a la realización de la prueba, los pacientes recibieron instrucciones por escrito, en las que se mencionaba la pauta de retirada de inhaladores y normas para realizar la prueba. Antes de iniciar la exploración se explicó la prueba a los pacientes pidiendo su colaboración. La prueba se realizó con los pacientes sentados. Para realizar la espirometría basal, todos los pacientes debían realizar tres maniobras aceptables de espirometría forzada. Se pedía al paciente inspirar todo el aire posible, con una pausa de duración mínima, no más de 1 segundo, y realizar, a continuación, una espiración máxima forzada, que se prolongaba de forma constante, hasta que se indicaba al paciente, durante un mínimo de 6 segundos. La prueba se repetía hasta obtener tres curvas válidas y reproducibles. Todo lo anteriormente descrito se realizó siguiendo el procedimiento recomendado por la SEPAR y el Grupo de Trabajo de Enfermedades Respiratorias de semFYC6,11. Se registraron los siguientes parámetros: capacidad vital forzada (CVF), FEV1, relación porcentual entre el FEV1 y CVF (FEV1/CVF), flujo espiratorio máximo entre el 25% y el 75% (FEF 25-75%).
La PBD consistió en la realización de una segunda espirometría, 15 min después de la inhalación de un broncodilatador betaadrenérgico de acción rápida a dosis terapéuticas (salbutamol, un puff, hasta completar cuatro puff, con un minuto de separación entre ellos, utilizando cámara inhalatoria). La técnica fue igual a la utilizada en la espirometría basal. Se consideró la PBD positiva si el FEV1 con relación al basal mejoraba un ≥12% y con un incremento de ≥ 200ml en este parámetro6,11. La prueba PBD se realizó quince min después de la inhalación del broncodilatador.
Para clasificar la calidad de las medidas se utilizó la clasificación de calidad, instalada de forma automática en el espirómetro. Fueron excluidos los pacientes cuya espirometría presentaba criterios de calidad deficiente: una sola maniobra aceptable (sin errores) o ninguna maniobra aceptable (sin errores)21,22, que corresponden con los grados de calidad E y F de la SEPAR respectivamente6.
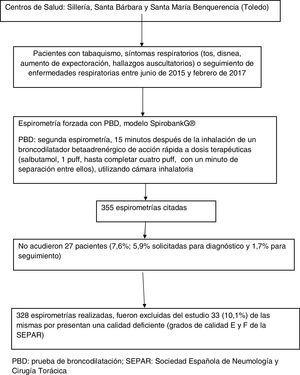
Las espirometrías fueron realizadas por una enfermera y varios médicos de familia, que siguieron un curso de formación teórico-práctica impartido en la Gerencia de Atención Primaria de Toledo. Se incluye un diagrama de flujos de pacientes y espirometrías realizadas (fig. 1).
Otras variables incluidas en este estudio fueron: edad, sexo, variables antropométricas (peso y talla), pulsioximetría (saturación de oxígeno y frecuencia cardiaca), motivo de realización del estudio, antecedente de enfermedad respiratoria, síntomas respiratorios, índice tabáquico, auscultación cardiopulmonar, vacuna antigripal y antineumocócica, y medicación broncodilatadora seguida por los paciente.
El análisis de los datos se realizó a través del paquete estadístico SPSS V 23.0. Para la descripción de resultados se utilizaron medidas de centralización y dispersión para variables cuantitativas, y de distribución de frecuencias para variables cualitativas. Para estudiar la relación entre los parámetros espirométricos y la positividad de la PBD se utilizó la prueba t de Student (muestras independientes). Para determinar el riesgo de tener PBD positiva según niveles de FEV1 o de FVC se ajustaron modelos de regresión logística binaria crudos y con la edad como covariable.
Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes, y han solicitado los permisos correspondientes a los pacientes.
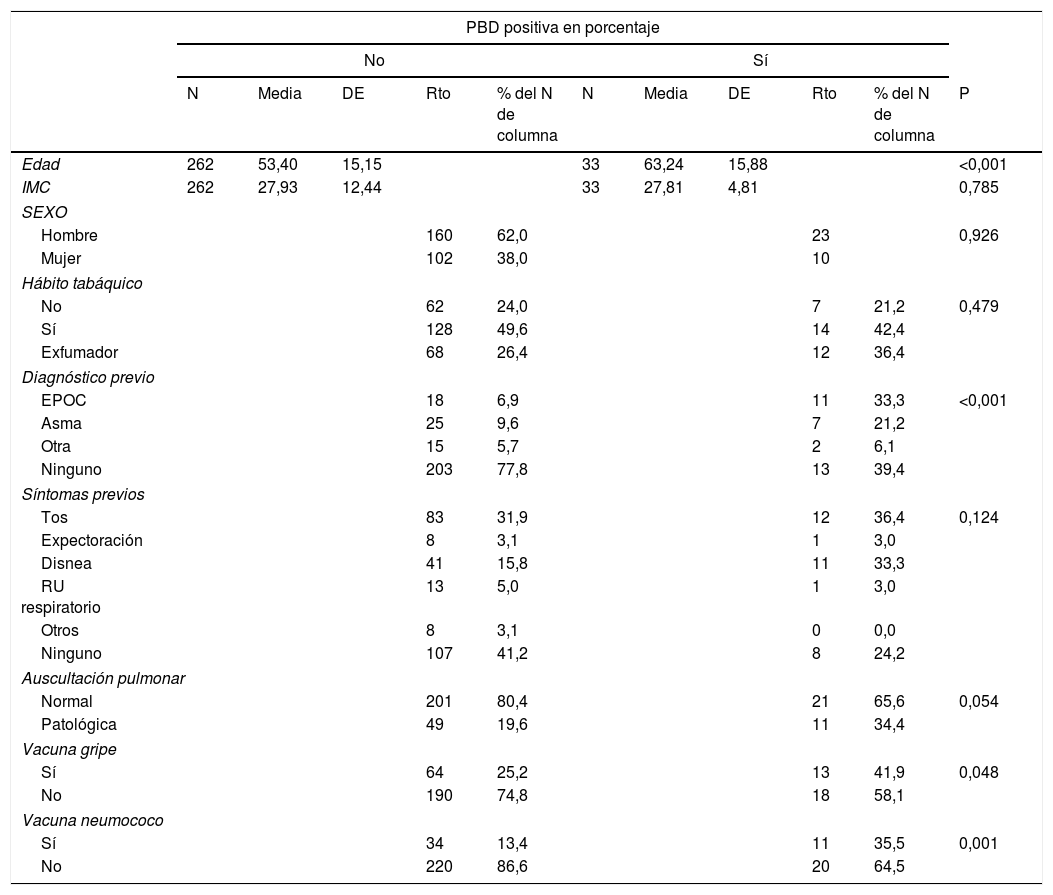
ResultadosFueron citadas un total de 355 espirometrías en el periodo de estudio. No acudieron a su realización 27 pacientes (7,6%; 5,9% solicitadas para diagnóstico y 1,7% para seguimiento). De las 328 espirometrías realizadas, fueron excluidas del estudio 33 (10,1%) de las mismas por presentar una calidad deficiente (grados de calidad E y F de la SEPAR). Los pacientes de las espirometrías finalmente incluidas tenían una edad media de 53,4±15,5 años, siendo el 62,0% varones. Los datos sociodemográficos y variables principales de los pacientes se presentan en la tabla 1.
Características generales de los pacientes que se realizaron una espirometría forzada
| PBD positiva en porcentaje | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| No | Sí | ||||||||||
| N | Media | DE | Rto | % del N de columna | N | Media | DE | Rto | % del N de columna | P | |
| Edad | 262 | 53,40 | 15,15 | 33 | 63,24 | 15,88 | <0,001 | ||||
| IMC | 262 | 27,93 | 12,44 | 33 | 27,81 | 4,81 | 0,785 | ||||
| SEXO | |||||||||||
| Hombre | 160 | 62,0 | 23 | 0,926 | |||||||
| Mujer | 102 | 38,0 | 10 | ||||||||
| Hábito tabáquico | |||||||||||
| No | 62 | 24,0 | 7 | 21,2 | 0,479 | ||||||
| Sí | 128 | 49,6 | 14 | 42,4 | |||||||
| Exfumador | 68 | 26,4 | 12 | 36,4 | |||||||
| Diagnóstico previo | |||||||||||
| EPOC | 18 | 6,9 | 11 | 33,3 | <0,001 | ||||||
| Asma | 25 | 9,6 | 7 | 21,2 | |||||||
| Otra | 15 | 5,7 | 2 | 6,1 | |||||||
| Ninguno | 203 | 77,8 | 13 | 39,4 | |||||||
| Síntomas previos | |||||||||||
| Tos | 83 | 31,9 | 12 | 36,4 | 0,124 | ||||||
| Expectoración | 8 | 3,1 | 1 | 3,0 | |||||||
| Disnea | 41 | 15,8 | 11 | 33,3 | |||||||
| RU respiratorio | 13 | 5,0 | 1 | 3,0 | |||||||
| Otros | 8 | 3,1 | 0 | 0,0 | |||||||
| Ninguno | 107 | 41,2 | 8 | 24,2 | |||||||
| Auscultación pulmonar | |||||||||||
| Normal | 201 | 80,4 | 21 | 65,6 | 0,054 | ||||||
| Patológica | 49 | 19,6 | 11 | 34,4 | |||||||
| Vacuna gripe | |||||||||||
| Sí | 64 | 25,2 | 13 | 41,9 | 0,048 | ||||||
| No | 190 | 74,8 | 18 | 58,1 | |||||||
| Vacuna neumococo | |||||||||||
| Sí | 34 | 13,4 | 11 | 35,5 | 0,001 | ||||||
| No | 220 | 86,6 | 20 | 64,5 | |||||||
DE desviación estándar; N: número válido; P: significación; Rto: recuento.
El 82,3% de las espirometrías se realizaron para diagnóstico, siendo las restantes espirometrías de seguimiento. En el 20% se obtuvo un patrón obstructivo; presentando el 67,5% una obstrucción leve, 18% moderada, 9,6% moderada-grave y un 4,8% muy grave. El 8,8% de las espirometrías obtuvieron PBD positiva; 11,2% fueron positivas únicamente en volumen y el 17,6% fueron positivas únicamente en porcentaje.
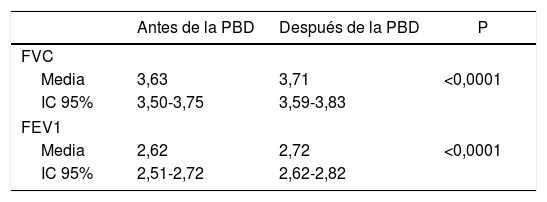
En la tabla 2 se estudia el volumen medio de FVC y FEV1 antes y después de la broncodilatación. Estos volúmenes fueron más altos después de la PBD.
Volumen medio FVC y FEV1 antes y después de la broncodilatación
| Antes de la PBD | Después de la PBD | P | |
|---|---|---|---|
| FVC | |||
| Media | 3,63 | 3,71 | <0,0001 |
| IC 95% | 3,50-3,75 | 3,59-3,83 | |
| FEV1 | |||
| Media | 2,62 | 2,72 | <0,0001 |
| IC 95% | 2,51-2,72 | 2,62-2,82 | |
FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IC: intervalo de confianza; P: significación.
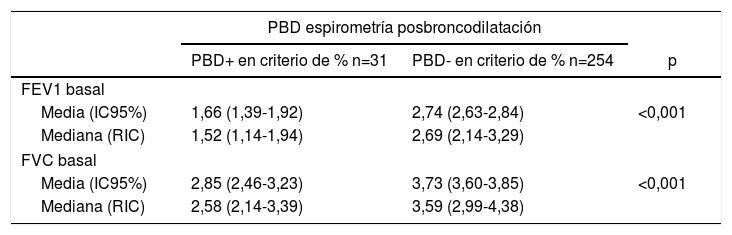
En la tabla 3 se presenta la positividad en porcentaje de la prueba de broncodilatación en la espirometría posbroncodilatación según los valores medios de FEV1 y FVC en la prueba basal. Se observó que los pacientes con una PBD positiva en porcentaje (PBD positiva si el FEV1 con relación al basal mejoraba un ≥12%) presentaban de forma basal menor FEV1 y menor FVC.
Valores medios de FEV1 y FVC basales según resultado de la prueba de broncodilatación en porcentaje (%)
| PBD espirometría posbroncodilatación | |||
|---|---|---|---|
| PBD+ en criterio de % n=31 | PBD- en criterio de % n=254 | p | |
| FEV1 basal | |||
| Media (IC95%) | 1,66 (1,39-1,92) | 2,74 (2,63-2,84) | <0,001 |
| Mediana (RIC) | 1,52 (1,14-1,94) | 2,69 (2,14-3,29) | |
| FVC basal | |||
| Media (IC95%) | 2,85 (2,46-3,23) | 3,73 (3,60-3,85) | <0,001 |
| Mediana (RIC) | 2,58 (2,14-3,39) | 3,59 (2,99-4,38) | |
Se consideró la PBD + en criterio de % si el FEV1 con relación al basal mejoraba ≥12%.
FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IC95%: intervalo de confianza al 95%; PBD: prueba de broncodilatación; RIC: rango intercuartílico (percentil 25-percentil 75).
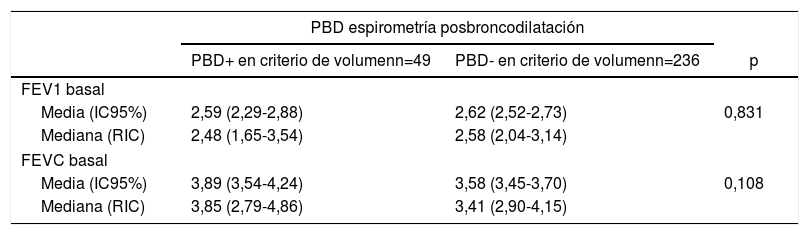
En la tabla 4 observamos la positividad en volumen de la prueba de broncodilatación en la espirometría posbroncodilatación según los valores medios de FEV1 y FVC en la prueba basal. Se observó que los pacientes con PBD positiva en volumen presentaban menor FEV1 y mayor FVC.
Valores medios de FEV1 y FVC basales según resultado de la prueba de broncodilatación en volumen
| PBD espirometría posbroncodilatación | |||
|---|---|---|---|
| PBD+ en criterio de volumenn=49 | PBD- en criterio de volumenn=236 | p | |
| FEV1 basal | |||
| Media (IC95%) | 2,59 (2,29-2,88) | 2,62 (2,52-2,73) | 0,831 |
| Mediana (RIC) | 2,48 (1,65-3,54) | 2,58 (2,04-3,14) | |
| FEVC basal | |||
| Media (IC95%) | 3,89 (3,54-4,24) | 3,58 (3,45-3,70) | 0,108 |
| Mediana (RIC) | 3,85 (2,79-4,86) | 3,41 (2,90-4,15) | |
Se considero la PBD + en criterio de volumen si el FEV1 con relación al basal mejoraba ≥200ml.
FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IC95%: intervalo de confianza al 95%; PBD: prueba de broncodilatación; RIC: rango intercuartílico (percentil 25-percentil 75).
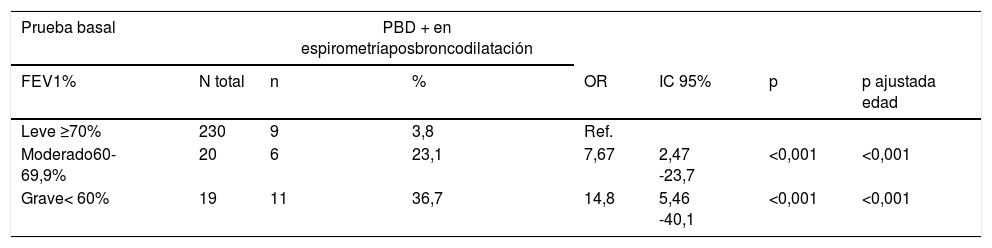
En la tabla 5 se muestra la relación entre la prueba de broncodilatación positiva en la segunda espirometría y FEV1 categorizada en leve, moderada o grave en la prueba basal. Se aprecia cómo la probabilidad de tener la PBD positiva en la segunda espirometría se multiplica por más de 7 en los pacientes que tuvieron FEV1 moderado en % en la prueba basal, y se multiplica por más de 14 en los que tuvieron el FEV1 grave, en relación con los pacientes que tuvieron el FEV1 leve en porcentaje.
Relación entre la prueba de broncodilatación positiva y FEV1 basal estratificado por gravedad
| Prueba basal | PBD + en espirometríaposbroncodilatación | ||||||
|---|---|---|---|---|---|---|---|
| FEV1% | N total | n | % | OR | IC 95% | p | p ajustada edad |
| Leve ≥70% | 230 | 9 | 3,8 | Ref. | |||
| Moderado60-69,9% | 20 | 6 | 23,1 | 7,67 | 2,47 -23,7 | <0,001 | <0,001 |
| Grave< 60% | 19 | 11 | 36,7 | 14,8 | 5,46 -40,1 | <0,001 | <0,001 |
FEV1: volumen espiratorio forzado en el primer segundo; IC: intervalo de confianza 95%; n: número de pacientes con PBD positiva; N total: número total; OR: odds ratio; p: significación estadística; PBD: prueba de broncodilatación.
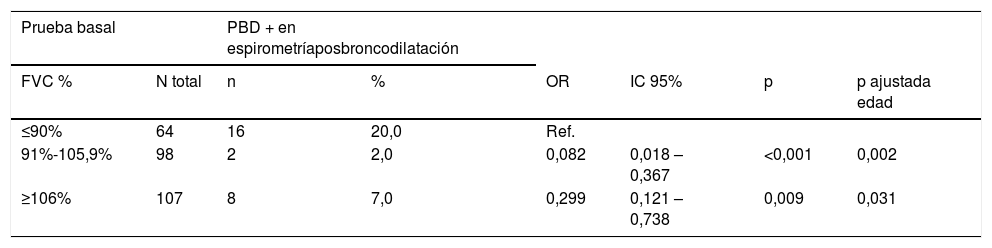
En la tabla 6 se muestra la relación entre la PBD en la segunda espirometría y FVC categorizada según valores de referencia en la prueba basal. Se observa que la probabilidad de tener la PBD positiva en la segunda espirometría se multiplica por 0,08 en los pacientes que tuvieron FVC entre 91-105,9% en la prueba basal, y se multiplica por 0,299 en los que tuvieron el FVC ≥106%, en relación con los pacientes que tuvieron el FVC ≤90%.
Relación entre prueba de broncodilatación positiva y FVC basal estratificado por gravedad
| Prueba basal | PBD + en espirometríaposbroncodilatación | ||||||
|---|---|---|---|---|---|---|---|
| FVC % | N total | n | % | OR | IC 95% | p | p ajustada edad |
| ≤90% | 64 | 16 | 20,0 | Ref. | |||
| 91%-105,9% | 98 | 2 | 2,0 | 0,082 | 0,018 –0,367 | <0,001 | 0,002 |
| ≥106% | 107 | 8 | 7,0 | 0,299 | 0,121 –0,738 | 0,009 | 0,031 |
FVC: capacidad vital forzada; IC: intervalo de confianza 95% para la OR; n: número de pacientes con PBD positiva en la espirometría postbroncodilatación; N total: número total que hicieron la prueba basal; OR: odds ratio de presentar PBD+; PBD: prueba de broncodilatación.
Entre los resultados más importantes de nuestro estudio podemos destacar que los pacientes con una PBD positiva en porcentaje presentaban de forma basal menor FEV1 y menor FVC. De la misma manera se observó que los pacientes con PBD positiva en volumen presentaban menor FEV1 y mayor FVC.
En el estudio de Busse17, se estudió de forma retrospectiva a pacientes con asma grave, parcialmente o mal controlada (ACQ ≥ 1,5), con PBD positiva, dividiéndolos en dos grupos HR ([cambio FEV1 > 20%] y LR [cambio FEV1 entre 12 y 20%]), demostraron que los pacientes del grupo HR tenían menor FEV1 basal, lo que estaría en consonancia con los resultados obtenidos en nuestro estudio.
Otra investigación ha comunicado que una cantidad considerable de pacientes con EPOC muestran algún tipo de respuesta a los broncodilatadores y que cuanto más severa es la obstrucción en la vía aérea mayor la probabilidad de presentar respuesta broncodilatadora solo en el volumen23.
En nuestro estudio se encontró un 20% de pacientes con patrón obstructivo, de los cuales el 32,4% fue moderado, grave o muy grave. Estos resultados son similares a los de la encuesta realizada en población de 40-79 años en EE. UU. por Tilert et al.24, que obtuvieron unos valores entre el 10,2 y 20,9% de patrón obstructivo según los resultados espirométricos obtenidos antes y después de la PBD.
En este estudio la interpretación de la prueba se realizó por los médicos de familia que realizaron la técnica. La calidad de las mismas, considerando el informe del programa instalado en el espirómetro, fue deficiente en el 6,9% de los casos. Los profesionales que realizaron la prueba, una enfermera y dos médicos de familia, hicieron un curso de formación previo, supervisado por la Gerencia de Atención Primaria de Toledo. En un estudio realizado por Llauger et al., los autores encuentran que los médicos de familia interpretan la prueba en el 87,3% de los casos y que en el 68% de los casos no se lleva a cabo ningún tipo de control de calidad de la exploración25. En nuestro caso no se incluyeron en el estudio el 6,9% de las espirometrías, clasificadas con los grados de calidad E y F de la SEPAR.
Una de las posibles limitaciones que tiene la prueba posbroncodilatadora es que, a pesar de tener una alta especificidad tiene una baja sensibilidad, por lo que a medida que vamos aumentando el número de repeticiones de la prueba aumenta la frecuencia con la que esta sale positiva26.
Entre las limitaciones de nuestro estudio podemos señalar que no se utilizó una muestra probabilística, si bien fueron incluidos todos los pacientes derivados por los médicos de familia para realización de espirometría durante el periodo de estudio. Por otra parte, nuestro estudio se basó en la realización de una única espirometría con PBD por paciente, siendo conocido que la repetición de la prueba aumenta su sensibilidad, y algunas PBD negativas pueden ser positivas con la repetición en el tiempo de la prueba. No obstante en el estudio se han seguido las condiciones de práctica clínica habitual y todas las pruebas fueron realizadas por el mismo equipo, enfermera y médicos de familia previamente formados para realizar esta técnica.
Como conclusiones de este estudio podemos señalar que los FEV1 y FVC basales influyen en la positividad de la PBD. Debería valorarse esta circunstancia a la hora de establecer los criterios de positividad de la PBD.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.