El beneficio del ácido acetil-salicílico o de otros antiagregantes en la prevención secundaria está bien establecido; sin embargo, el uso de antiagregación en la prevención primaria sigue siendo un motivo de controversia, por una parte, el beneficio obtenido está muy cercano al daño potencial derivado de su uso (principalmente hemorragias digestivas); por lo que el beneficio neto es menor, dado que su objetivo es evitar la aparición de eventos vasculares en situaciones con un riesgo basal inferior.
El tratamiento antiagregante con aspirina en prevención primaria ha sido evaluado en ensayos clínicos y diversos metaanálisis comparando su eficacia con placebo y los resultados se caracterizan por su heterogeneidad.
Se revisan en este manuscrito los mecanismos de acción de diferentes antiagregantes, las evidencias que existen con aspirina en prevención primaria, las directrices para su uso de diferentes Sociedades Científicas y el coste beneficio de la intervención.
The benefit of acetylsalicylic acid and other antiplatelet drugs in secondary prevention is well established, however it use in primary prevention continues to be controversial. On the one hand, the benefit obtained is very near the potential damage arising from its use (mainly gastrointestinal bleeding), and on the other, the net benefit is less, given that its aim is to prevent the occurrence of vascular events in situations with a lower baseline risk.
Antiplatelet treatment with aspirin in primary prevention has been evaluated in clinical trials and several meta-analyses, comparing its efficacy with a placebo, and with results noted for their heterogeneity.
The mechanisms of action of different antiplatelet drugs, as well as the existing evidence with aspirin in primary prevention, the directions for its use by different Scientific Societies, and the cost/benefit of the intervention are reviewed.
El sustrato morfológico de la enfermedad cardiovascular es la placa aterosclerotica, dicha asociación entre aterosclerosis coronaria e infarto de miocardio fue descrita por primera vez en 19121, la presencia y extensión de las lesiones ateroescleróticas se correlacionan con los factores de riesgo cardiovascular: colesterol, triglicéridos, presión arterial y tabaquismo2.
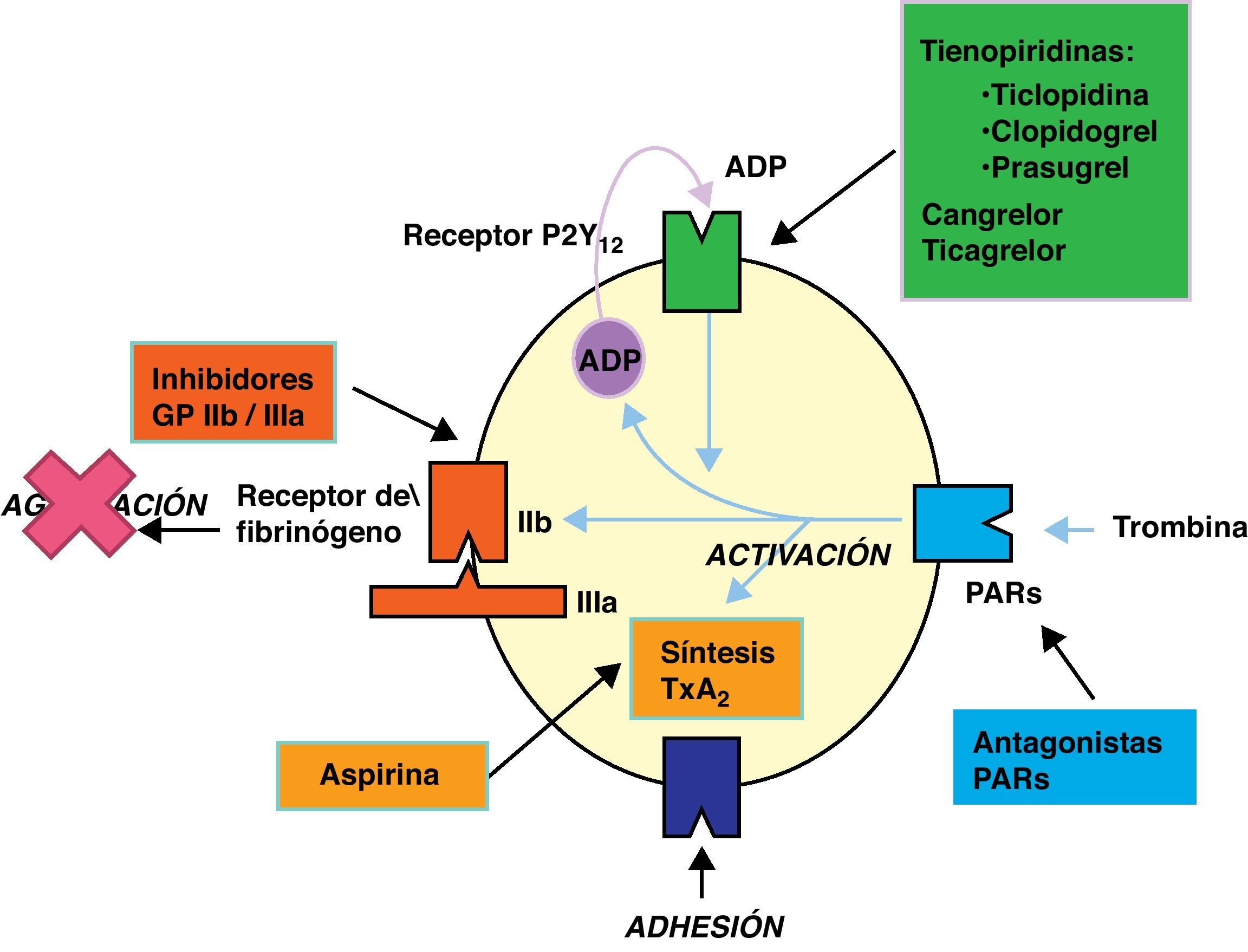
En condiciones fisiológicas3, las células del endotelio vascular tienen propiedades antitrombóticas y fibrinolíticas que previenen la formación de trombos. La exposición a los factores de riesgo cardiovascular produce disfunción del endotelio y provoca una alteración de los mecanismos fisiológicos de protección cardiovascular esta alteración endotelial facilita la acumulación y la oxidación de lipoproteínas de baja densidad (LDL) y origina la infiltración de monocitos circulantes en el espacio subendotelial se diferencian a macrófagos, que captan lípidos transformándose en células espumosas (estría grasa) desencadenando una respuesta inflamatoria y fibroproliferativa crónica que hace progresar las lesiones ateroscleróticas. La rotura de las lesiones ateroscleróticas provoca los procesos de adhesión, activación y agregación de las plaquetas, y la formación del trombo (aterotrombosis).
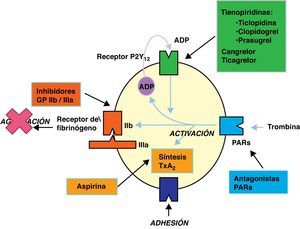
En la adhesión plaquetar4 intervienen el colágeno y fibronectina, presentes en el subendotelio, a los que se adhiere la plaqueta a través de receptores específicos, el complejo GpIb/IX, con la participación del factor von Willebrand y la fibronectina. Tras la adhesión, la plaqueta sufre cambios morfológicos y por acción del colágeno, trombina, epinefrina y adenosina difosfato (ADP) se produce la activación plaquetar, con expresión de nuevos receptores y liberación de mediadores: ADP, serotonina, factor activador plaquetar (PAF) y tromboxano A2 (TXA2) esto provoca el aumento de la agregacion. La activación plaquetar conlleva la expresión de nuevos receptores como son las glucoproteínas de membrana GpIIb/IIIa, que provocan el aumento de la agregación de plaquetas, y por acción del fibrinógeno y la vitronectina, se estabiliza el agregado. El colágeno y epinefrina activan a las fosfolipasas de la membrana plaquetar, la fosfolipasa A2 actúa sobre la fosfatidilcolina liberando ácido araquidónico, el cual es metabolizado por la ciclooxigenasa con formación de derivados prostaglandínicos (PgG2 y H2). La acción de la enzima tromboxano-sintasa sobre la PgH2 induce la generación de TXA2, que tiene acción proagregante y vasoconstrictora. Las células endoteliales de la pared vascular sintetizarán prostaciclina (PgI2) a partir del ácido araquidónico, potente vasodilatador y antiagregante al estimular la adenilciclasa y promover un aumento de AMP cíclico en la plaqueta. Finalmente, la membrana plaquetar va a constituir la superficie sobre la que se producirán diversas reacciones que activan la coagulación.
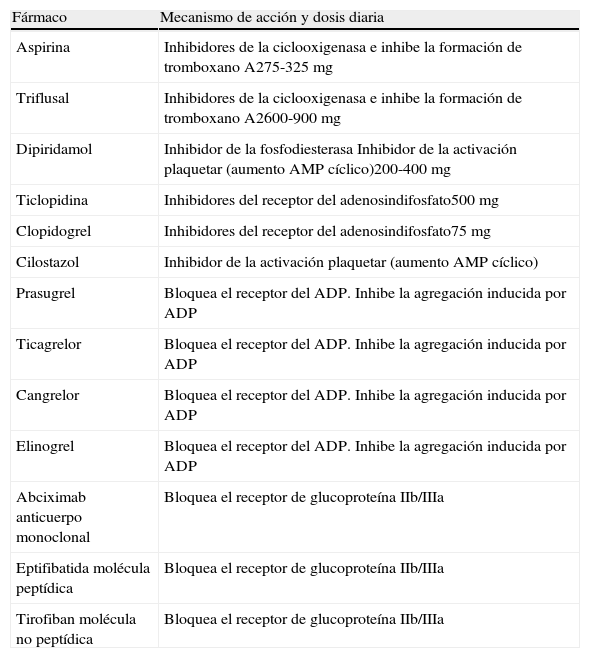
En la tabla 1 y figura 1 se describen los diferentes fármacos antiagregantes, su mecanismo de acción y dosis recomendadas5.
Fármacos antiagregantes y su mecanismo de acción y dosis recomendadas
| Fármaco | Mecanismo de acción y dosis diaria |
| Aspirina | Inhibidores de la ciclooxigenasa e inhibe la formación de tromboxano A275-325mg |
| Triflusal | Inhibidores de la ciclooxigenasa e inhibe la formación de tromboxano A2600-900mg |
| Dipiridamol | Inhibidor de la fosfodiesterasa Inhibidor de la activación plaquetar (aumento AMP cíclico)200-400mg |
| Ticlopidina | Inhibidores del receptor del adenosindifosfato500mg |
| Clopidogrel | Inhibidores del receptor del adenosindifosfato75mg |
| Cilostazol | Inhibidor de la activación plaquetar (aumento AMP cíclico) |
| Prasugrel | Bloquea el receptor del ADP. Inhibe la agregación inducida por ADP |
| Ticagrelor | Bloquea el receptor del ADP. Inhibe la agregación inducida por ADP |
| Cangrelor | Bloquea el receptor del ADP. Inhibe la agregación inducida por ADP |
| Elinogrel | Bloquea el receptor del ADP. Inhibe la agregación inducida por ADP |
| Abciximab anticuerpo monoclonal | Bloquea el receptor de glucoproteína IIb/IIIa |
| Eptifibatida molécula peptídica | Bloquea el receptor de glucoproteína IIb/IIIa |
| Tirofiban molécula no peptídica | Bloquea el receptor de glucoproteína IIb/IIIa |
Se hizo una búsqueda de ensayos clínicos para encontrar las evidencias disponibles del uso de aspirina en prevención primaria. La búsqueda se hizo por población (general y diabéticos), por tratamiento (aspirina) y por tipo de prevención (primaria). La búsqueda se realizó fundamentalmente en Science Citatión index y en Pubmed.
Evidencias en población generalEl tratamiento antiagregante en prevención primaria ha sido evaluado en diferentes ensayos y diversos metaanálisis. En general los ensayo clínicos realizados, han incluido pacientes mayores de 60 años y con algún factor de riesgo cardiovascular (con un porcentaje bajo de diabéticos).
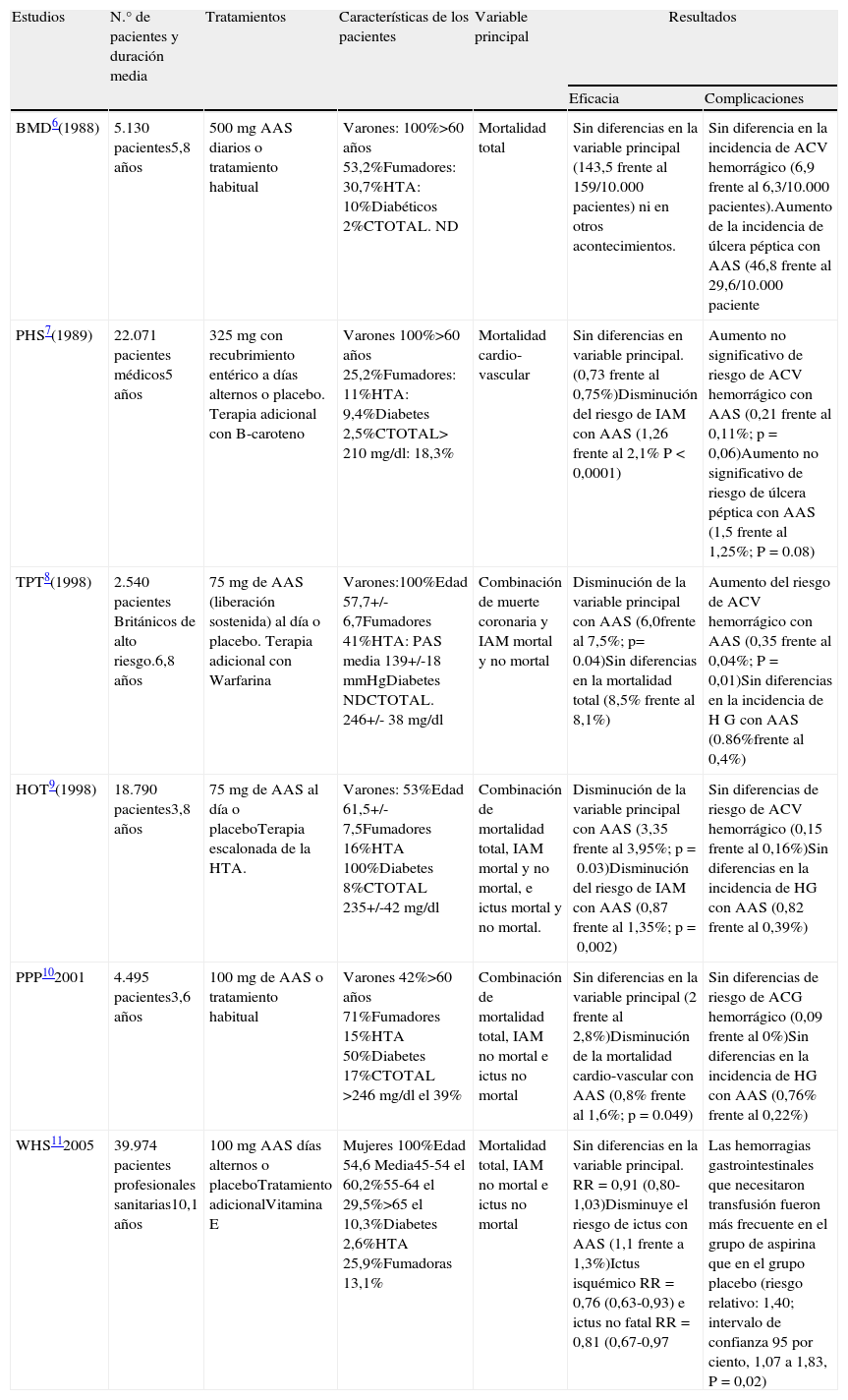
Tres de los estudios sólo incluyeron hombres y otro sólo mujeres. Las dosis de AAS empleadas han sido variables -entre 75 y 325mg diarios en la mayoría de los estudios- y se han comparado con placebo. Las variables principales analizadas son variables combinadas y los resultados obtenidos, tanto en la evaluación de la eficacia como de los aspectos de seguridad han sido heterogéneos (ver tabla 2).
Prevención cardiovascular con aspirina en población general
| Estudios | N.° de pacientes y duración media | Tratamientos | Características de los pacientes | Variable principal | Resultados | |
| Eficacia | Complicaciones | |||||
| BMD6(1988) | 5.130 pacientes5,8 años | 500mg AAS diarios o tratamiento habitual | Varones: 100%>60 años 53,2%Fumadores: 30,7%HTA: 10%Diabéticos 2%CTOTAL. ND | Mortalidad total | Sin diferencias en la variable principal (143,5 frente al 159/10.000 pacientes) ni en otros acontecimientos. | Sin diferencia en la incidencia de ACV hemorrágico (6,9 frente al 6,3/10.000 pacientes).Aumento de la incidencia de úlcera péptica con AAS (46,8 frente al 29,6/10.000 paciente |
| PHS7(1989) | 22.071 pacientes médicos5 años | 325mg con recubrimiento entérico a días alternos o placebo. Terapia adicional con B-caroteno | Varones 100%>60 años 25,2%Fumadores: 11%HTA: 9,4%Diabetes 2,5%CTOTAL> 210mg/dl: 18,3% | Mortalidad cardio-vascular | Sin diferencias en variable principal. (0,73 frente al 0,75%)Disminución del riesgo de IAM con AAS (1,26 frente al 2,1% P<0,0001) | Aumento no significativo de riesgo de ACV hemorrágico con AAS (0,21 frente al 0,11%; p=0,06)Aumento no significativo de riesgo de úlcera péptica con AAS (1,5 frente al 1,25%; P=0.08) |
| TPT8(1998) | 2.540 pacientes Británicos de alto riesgo.6,8 años | 75mg de AAS (liberación sostenida) al día o placebo. Terapia adicional con Warfarina | Varones:100%Edad 57,7+/-6,7Fumadores 41%HTA: PAS media 139+/-18mmHgDiabetes NDCTOTAL. 246+/- 38mg/dl | Combinación de muerte coronaria y IAM mortal y no mortal | Disminución de la variable principal con AAS (6,0frente al 7,5%; p= 0.04)Sin diferencias en la mortalidad total (8,5% frente al 8,1%) | Aumento del riesgo de ACV hemorrágico con AAS (0,35 frente al 0,04%; P=0,01)Sin diferencias en la incidencia de H G con AAS (0.86%frente al 0,4%) |
| HOT9(1998) | 18.790 pacientes3,8 años | 75mg de AAS al día o placeboTerapia escalonada de la HTA. | Varones: 53%Edad 61,5+/-7,5Fumadores 16%HTA 100%Diabetes 8%CTOTAL 235+/-42mg/dl | Combinación de mortalidad total, IAM mortal y no mortal, e ictus mortal y no mortal. | Disminución de la variable principal con AAS (3,35 frente al 3,95%; p=0.03)Disminución del riesgo de IAM con AAS (0,87 frente al 1,35%; p=0,002) | Sin diferencias de riesgo de ACV hemorrágico (0,15 frente al 0,16%)Sin diferencias en la incidencia de HG con AAS (0,82 frente al 0,39%) |
| PPP102001 | 4.495 pacientes3,6 años | 100mg de AAS o tratamiento habitual | Varones 42%>60 años 71%Fumadores 15%HTA 50%Diabetes 17%CTOTAL >246mg/dl el 39% | Combinación de mortalidad total, IAM no mortal e ictus no mortal | Sin diferencias en la variable principal (2 frente al 2,8%)Disminución de la mortalidad cardio-vascular con AAS (0,8% frente al 1,6%; p=0.049) | Sin diferencias de riesgo de ACG hemorrágico (0,09 frente al 0%)Sin diferencias en la incidencia de HG con AAS (0,76% frente al 0,22%) |
| WHS112005 | 39.974 pacientes profesionales sanitarias10,1 años | 100mg AAS días alternos o placeboTratamiento adicionalVitamina E | Mujeres 100%Edad 54,6 Media45-54 el 60,2%55-64 el 29,5%>65 el 10,3%Diabetes 2,6%HTA 25,9%Fumadoras 13,1% | Mortalidad total, IAM no mortal e ictus no mortal | Sin diferencias en la variable principal. RR=0,91 (0,80-1,03)Disminuye el riesgo de ictus con AAS (1,1 frente a 1,3%)Ictus isquémico RR=0,76 (0,63-0,93) e ictus no fatal RR=0,81 (0,67-0,97 | Las hemorragias gastrointestinales que necesitaron transfusión fueron más frecuente en el grupo de aspirina que en el grupo placebo (riesgo relativo: 1,40; intervalo de confianza 95 por ciento, 1,07 a 1,83, P=0,02) |
Modificado de Agusti et al. Prevención primaria de infarto de miocardio (IAM) con AAS. Med. Clínica (Barc) 2004; 122): 593. ACV: accidente accidente vascular cerebral; AAS: ácido ácido Acetil acetil salicílico; BMD: British Male Doctors Trial; CTOTAL: colesterol colesterol total medio; HG: hemorragia gastrointestinal; HOT: hypertension optimal treatment; IAM: infarto infarto agudo de miocardio; NB: no disponible; PAS: presión arterial sistólica; PHS Physians’ Health Study; PPP: Primary Prevention Project; TPT: thrombosis prevention trial; WHS: Women's Health Study.
Fundamentalmente en 3 estudios se ha puesto de manifiesto la eficacia de aspirina en reducción de la mortalidad en prevención primaria: el Primary Prevention Project10, en el que se observó una reducción de la mortalidad cardiovascular, el Physicians’ Health Study7, en el que disminuyó la mortalidad por infarto agudo de miocardio (IAM) y el Estudio HOT con disminución de la variable principal (combinación de mortalidad total, infarto agudo de miocardio mortal y no mortal, e ictus mortal y no mortal) y disminución del IAM.
El último de los estudios publicados, el WHS11, incluyó a 39.876 mujeres de 45 años o más, que recibieron dosis menores de AAS (100mg/48 horas). A pesar de que las pacientes el tratamiento con AAS presentaron un 9% menos de acontecimientos cardiovasculares graves (ictus, IAM o muerte de causa cardiovascular) en comparación con el grupo placebo, estas diferencias no fueron estadísticamente significativas (RR 0,91; IC95%, 0,80-1,03; p=0,13). Únicamente el análisis del subgrupo de mujeres >65 años (10%) se observó una reducción del 26% de acontecimientos cardiovasculares con AAS (RR 0,74; IC95%, 0,59-0,92; p=0,008). A diferencia de los ensayos clínicos previos, no se observó una reducción significativa del riesgo de IAM, pero sí de ictus (0,8 vs. 1,6%; p<0,05).
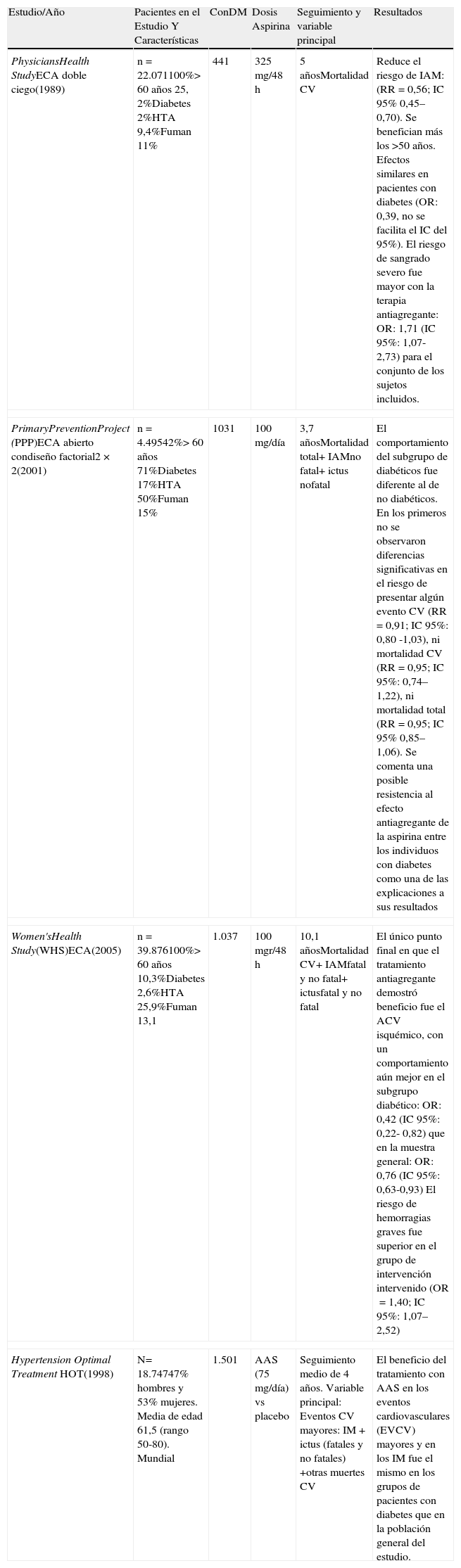
Evidencias en población diabéticaEn la tabla 3 podemos observar los resultados de algunos estudios en los que se valoraba la eficacia de aspirina en los subgrupos de pacientes diabéticos. No aportan datos significativos sobre la eficacia de la antiagregación en prevención primaria de los pacientes diabéticos que se estudiaron en la variable principal. En todo caso sí se observaron algunos beneficios en variables secundarias (ictus isquémico en mujeres, o pacientes mayores de 50 años).
Prevención cardiovascular con aspirina en diabéticos
| Estudio/Año | Pacientes en el Estudio Y Características | ConDM | Dosis Aspirina | Seguimiento y variable principal | Resultados |
| PhysiciansHealth StudyECA doble ciego(1989) | n=22.071100%> 60 años 25, 2%Diabetes 2%HTA 9,4%Fuman 11% | 441 | 325mg/48h | 5 añosMortalidad CV | Reduce el riesgo de IAM: (RR=0,56; IC 95% 0,45–0,70). Se benefician más los >50 años. Efectos similares en pacientes con diabetes (OR: 0,39, no se facilita el IC del 95%). El riesgo de sangrado severo fue mayor con la terapia antiagregante: OR: 1,71 (IC 95%: 1,07- 2,73) para el conjunto de los sujetos incluidos. |
| PrimaryPreventionProject (PPP)ECA abierto condiseño factorial2×2(2001) | n=4.49542%> 60 años 71%Diabetes 17%HTA 50%Fuman 15% | 1031 | 100mg/día | 3,7 añosMortalidad total+ IAMno fatal+ ictus nofatal | El comportamiento del subgrupo de diabéticos fue diferente al de no diabéticos. En los primeros no se observaron diferencias significativas en el riesgo de presentar algún evento CV (RR=0,91; IC 95%: 0,80 -1,03), ni mortalidad CV (RR=0,95; IC 95%: 0,74–1,22), ni mortalidad total (RR=0,95; IC 95% 0,85–1,06). Se comenta una posible resistencia al efecto antiagregante de la aspirina entre los individuos con diabetes como una de las explicaciones a sus resultados |
| Women'sHealth Study(WHS)ECA(2005) | n=39.876100%> 60 años 10,3%Diabetes 2,6%HTA 25,9%Fuman 13,1 | 1.037 | 100 mgr/48h | 10,1 añosMortalidad CV+ IAMfatal y no fatal+ ictusfatal y no fatal | El único punto final en que el tratamiento antiagregante demostró beneficio fue el ACV isquémico, con un comportamiento aún mejor en el subgrupo diabético: OR: 0,42 (IC 95%: 0,22- 0,82) que en la muestra general: OR: 0,76 (IC 95%: 0,63-0,93) El riesgo de hemorragias graves fue superior en el grupo de intervención intervenido (OR=1,40; IC 95%: 1,07–2,52) |
| Hypertension Optimal Treatment HOT(1998) | N= 18.74747% hombres y 53% mujeres. Media de edad 61,5 (rango 50-80). Mundial | 1.501 | AAS (75mg/día) vs placebo | Seguimiento medio de 4 años. Variable principal: Eventos CV mayores: IM+ictus (fatales y no fatales) +otras muertes CV | El beneficio del tratamiento con AAS en los eventos cardiovasculares (EVCV) mayores y en los IM fue el mismo en los grupos de pacientes con diabetes que en la población general del estudio. |
ACV: accidente cerebro-vascular; CV: cardiovascular; DM: diabetes mellitus; ECA: ensayo clínico aleatorio; FRCV: factor de riesgo cardiovascular. Modificado de GEDAPS 2010; IAM: infarto agudo de miocardio; IC: intervalo de confianza; HTA: hipertensión arterial; n: población del estudio; OR: odds ratio; RR: riesgo relativo.
Cuando se analizaron los resultados de estudios publicados que incluyen únicamente pacientes con diabetes, tampoco se han demostrado diferencias significativas en el riesgo de aparición de eventos cardiovasculares (CV) entre los tratados con aspirina y el grupo control. Se publican los resultados del estudio ETDRS12 en el año 1992 y posteriormente en el año 2008 se publican los resultados de los estudios POPADAD13 y JPAD14 exponiendo en la tabla 4 los resultados.
Prevención cardiovascular con aspirina en diabéticos
| Estudio/Año | Pacientes en el estudio y características | DosisAspirina | Seguimiento y variable principal | Resultados |
| ETDRS12(1992) | N=3.711DM1 y DM2. DM avanzada (83%>10 años de evolución), retinopatía, algún FRCV y 49% ECV previa. | 650mg./día(325mg dos veces al día) | 5 añosMortalidad total | No hay diferencia de mortalidad por cualquier causa, ni muerte de origen CV, o en variables como IAM fatal o no fatal. La ASA no alteró la progresión de la retinopatía |
| POPADAD13(2008) | N=1.276Diabéticos >40 años con enfermedad arterial periférica asintomática (ITB< 0,99). | 100mg/día | 8 años1- IAM e ictus fatal+ IAM e ictus no fatal+ amputación encima tobillo2- Muerte CI o ictus | No se observaron diferencias estadísticamentesignificativas en el riesgo de presentar algún eventoCV (HR=0,98; IC 95%: 0,76 -1,26) en el grupo aspirina vs placebo. Tampoco se encontraron diferencias en las variables secundarias analizadas |
| JPAD14(2008) | N=2.539DM2 sin EV conocida. Edad media 65 años, Incluye pacientes con edades entre 30 y 85 años con HTA (58%), cifras elevadas de colesterol (53%) o alguna complicación micro vascular (57%) | 81-100mg/día | 4,37 añosIAM fatal y no fatal+ ictus fatal y no fatal+ enfermedad arterial periféricaLa potencia estadística del estudio era insuficiente debido a una baja incidencia de eventos CV | No hay diferencias en el riesgo de padecer un evento CV entre ambos grupos (HR=0,80; IC 95%: 0,58 -1,10). De las variables secundarias analizadas, únicamente se encontraron diferencias estadísticamente significativas en la combinación mortalidad coronaria y cerebrovascular (HR=0,10; IC 95% 0,01-0,79), que fue menor en el grupo tratado con aspirina, pero analizadas por separado las diferencias no fueron significativas. Analizando los subgrupos se observó que los diabéticos>65 años del grupo intervenido, presentaban menor número de eventos CV con respecto a los más jóvenes (HR=0,68; IC 95%: 0,46-0,99). una reducción significativa (p=0,04) del 32% en la variable principal |
CI: cardiopatía isquémica; CV: cardiovascular; ECA: ensayo clínico aleatorio; DM: diabetes mellitus; ECV: enfermedad cardiovascular; EV: enfermedad vascular. Modificado de GEDAPS 2010; FRCV: factores de riesgo cardiovascular; HR: hazard ratio; IAM: infarto agudo de miocardio; ITB: índice tobillo-brazo; N: población del estudio.
En el estudio ETDRS12 el beneficio encontrado se mueve en el límite de la significación estadística, teniendo en cuenta además, que incluye casi el 50% de los pacientes en prevención secundaria.
El estudio POPADAD13 valora la antiagregación en pacientes con diabetes tipo 1 o 2,>40 años y con enfermedad arterial periférica. No se observaron diferencias significativas entre los grupos tratados (AAS 100mg/día con o sin antioxidante) y los grupos placebo en la variable principal combinada ni en la variable muerte por enfermedad CV o ictus. Tampoco se encontraron diferencias en las variables secundarias analizadas.
Por último el estudio JPAD14 valora la antiagregación en prevención primaria en diabéticos tipo 2. Incluye pacientes con edades entre 30 y 85 anos. No se observaron diferencias en la variable principal combinada (eventos ateroescleróticos) ni en las variables por separado entre el grupo tratado (AAS 81 100mg/día) y el placebo. Solo se observaron diferencias en el subgrupo de pacientes mayores de 65 años y en la variable mortalidad cerebro-vascular y coronaria. Sin embargo, los autores concluyen que la antiagregación no reduce el riesgo de enfermedad CV en los pacientes del estudio.
Evidencias de metaanálisis de prevención primaria con aspirinaTambién se hizo una búsqueda para obtener información de algunos metaanálisis que han valorado el efecto de aspirina frente a placebo en prevención primaria.
Uno de los primeros metaanálisis lo publicaron Hart et al.15 en el año 2000, se incluyeron 5 ensayos clínicos (52.251 sujetos) en los que se utilizaron dosis de 75-650mg/día de AAS. En este metaanálisis no se observaron beneficios de AAS en la prevención de ictus pero sí se observó una reducción del 26% del riesgo de infarto agudo de miocardio (RR: 0,74, p<0,001). Hay que reseñar que el riesgo promedio de ictus en los 5 ensayos fue bajo, un 0,3% anual durante un promedio de 4,6 años. Por otra parte, en este mataánalisis se observó un incremento del riesgo de hemorragias cerebrales (RR: 1,35, p=0,03) pero sin diferencias en la mortalidad. Los autores del mataanálisis concluyen que el análisis del riesgo-beneficio de la AAS es complejo y debe balancearse entre el beneficio en la reducción del infarto de miocardio y el riesgo de episodios hemorrágicos mayores y que las preferencias individuales en este sentido deberían tenerse en cuenta.
Algo más tarde, en el año 2002 el Antithrombotic Trialists Collaboration16 publicó otro metaanálisis de ensayos realizados en pacientes de alto riesgo (la mayoría eran de prevención secundaria) en los que se valoraba la utilidad de alguna terapia antiagregante frente a placebo, alguno de estos ensayos incluyó sujetos en prevención primaria. En el conjunto de los ensayos clínicos en prevención primaria (104 ensayos y 20.000 pacientes) el riesgo de un evento CV de los sujetos del grupo placebo fue de un 10,2% y con la terapia antiagregante se observó una reducción significativa del riesgo del 26%. Hay que hacer referencia a que la terapia antiagregante no fue solo AAS pero esta fue con mucho la más utilizada en un rango de dosis de 75-150mg/día. Los autores de este metaanálisis concluyen que la terapia antiagregante con AAS a dosis de 75-150mg/día debería ser considerada siempre en pacientes de riesgo intermedio-alto (>2% anual).
En otro metaanálisis publicado en el 2006 por Berger et al17 se trataba de valorar si el efecto de AAS en prevención primaria era similar en hombres y mujeres. Se incluyeron 6 ensayos clínicos con 95.456 sujetos y una media de seguimiento de 6,4 años. En las mujeres (51.342) se observó una reducción significativa del 12% riesgo de eventos CV (p=0,003) y una reducción significativa del 17% (p=0,02) del riesgo de ictus, fundamentalmente del ictus isquémico (OR: 0,76, p=0,008) y no se observó beneficio en cuanto a la prevención del IAM ni en la mortalidad CV, por otra parte, en los hombres (44.114) se observó una reducción significativa del 14% del riesgo de eventos CV (p<0,01) y una reducción significativa del 32% del IAM (p<0,001) no observándose beneficios en cuanto a la prevención de ictus ni en la mortalidad CV.
Hay que reseñar que el riesgo medio de eventos CV en el grupo placebo de este metaanálisis fue del 2,65% en mujeres y del 4,82% en los hombres.
Aunque los resultados del metaanáalisis puedan sugerir diferencias en el efecto de la AAS en hombres y mujeres, el pequeño número de IAM observado en las mujeres y de ictus en los hombres sugiere que más estudios son necesarios para concluir que hay diferencias de género en el efecto de AAS.
Por otra parte, en este metaanálisis se observó un aumento del riesgo de sangrado con AAS tanto en hombres (OR: 1,72, p<0,001) como en mujeres (OR: 1,68, p<0,001).
Los autores del metaanálisis concluyen que el beneficio absoluto sería de 3 eventos CV prevenidos en las mujeres y 4 en los hombres por 1.000 sujetos tratados y el riesgo absoluto sería de 3 episodios de sangrados mayores en mujeres y 2,5 episodios en los hombres por 1.000 sujetos tratados. El balance del riesgo-beneficio de la AAS debería ser considerado tanto por los médicos como por los propios pacientes antes de tomar decisiones para usar AAS en prevención primaria de eventos CV en ambos sexos.
Más recientemente, en el año 2009 el Antithrombotic Trialists Collaboration18 publica otro metaanálisis que incluye datos de 6 estudios de prevención primaria que valoraban el efecto de AAS frente a placebo, este metaanálisis tuvo la gran ventaja metodológica de contar con los datos individuales de cada uno de los más de 95.000 sujetos incluidos, lo que permitió a los autores obtener información detallada sobre algunos aspectos que no pudieron ser evaluados en los metaanálisis previos. En prevención primaria con AAS se observó una reducción significativa del 12% del riesgo de eventos CV (p<0,0001) debida fundamentalmente a una reducción del riesgo de IAM fatal y no fatal (0,28 versus 0,34% anual, p<0,0001), no se observaron diferencias en la reducción del riesgo de ictus ni en la mortalidad CV. Por otra parte, se observó un mayor riesgo de hemorragias mayores gastrointestinales o intracraneales (0,10 versus 0,07% anual, p<0,0001).
Hay que hacer referencia a que en este metaanálisis el riesgo de cualquier evento en el grupo placebo fue de un 0,57% anual, con solo un 9% de sujetos participantes que tuvieran un riesgo mayor del 1% anual.
Los autores del metaanálisis concluyen que hoy día no estaría justificado el uso rutinario de AAS en prevención primaria en sujetos con riesgo bajo, pero que los datos del estudio podrían ayudarles a tomar sus propias decisiones.
También tenemos datos de metaanálisis realizados en pacientes diabéticos en prevención primaria19,20.
En el metaanálisis de De Berardis et al.19 se incluyeron datos de 6 ensayos clínicos y 10.117 pacientes con un rango de dosis de AAS de 100-650mg/día y el seguimiento osciló entre 3,6-10,1 años. No se observaron diferencias entre AAS y placebo en cuanto a la prevención de eventos CV ni en la mortalidad CV ni mortalidad total y tampoco hubo diferencias en el riesgo de algún tipo de hemorragia. En este metaanálisis, el riesgo medio de eventos del grupo placebo de un 13,7% y el riesgo de algún tipo de sangrado fue del 2,5%.
Los autores de este metaanálisis concluyen que no hay evidencias que soporten la recomendación del uso rutinario de AAS en prevención primaria en diabéticos y que las decisiones para su uso deben ser individualizadas valorando beneficios y riesgo de sangrados. Si se estima que la incidencia de cualquier evento en sujetos diabéticos oscila entre 10-20 por 1.000 personas/año y se asume según los datos de este estudio una reducción del 10%, 1.000 personas necesitarían ser tratadas durante un año para prevenir uno o 2 eventos cardiovasculares mayores. Por tanto, los beneficios esperados podrían no ser superiores al riesgo de sangrado en pacientes con riesgo bajo o en pacientes con alto riesgo de sangrado (>70 años).
En el metaanálisis de Zhang C et al.20, se incluyeron datos de 7 ensayos clínicos y 11.618 pacientes diabéticos, no se observaron beneficios con AAS ni en la prevención de eventos CV, ni en la mortalidad CV ni mortalidad total y tampoco en la prevención de ictus o IAM. Tampoco hubo un incremento significativo del riesgo de sangrado con AAS. Un análisis de metarregresión sugería que AAS podría reducir el riesgo de IAM en hombres y de ictus en mujeres.
En otro metaanálisis Calvin et al.21 comparaban el efecto de AAS en pacientes diabéticos y no diabéticos. No se encontraron diferencias estadísticamente significativas al comparar el beneficio de la aspirina entre pacientes con DM y sin DM para mortalidad, IAM e ictus isquémico, los riesgos relativos de los pacientes diabéticos con respecto a los no diabéticos fueron 1,12 (95% IC 0,92–1,35), 1,19 (0,82–1,17), y 0,70 (0,25–1,97) respectivamente. Los autores llegaron a la conclusión que posiblemente el beneficio de la aspirina es similar en los diabéticos y en los no diabéticos.
Como conclusión, podríamos decir que la decisión de prescribir aspirina como prevención primaria debería hacerse de manera individualizada y tras una cuidadosa evaluación; se debe basar en el balance entre los beneficios esperados y el riesgo de episodios hemorrágicos graves. Asimismo, el efecto sumatorio de la terapia antiplaquetaria sobre la terapia estándar basada en antihipertensivos y estatinas en la prevención primaria debe seguir siendo estudiado y valorado.
En cuanto a los pacientes diabéticos, el papel de la terapia antiplaquetaria en la reducción del riesgo cardiovascular es una cuestión pendiente y todavía debe ser dilucidada.
Directrices de las diferentes Sociedades Científicas para la prevención primaria con aspirinaAsí como en prevención secundaria hay un consenso generalizado y esta aceptado el uso de aspirina en la prevención de la enfermedad CV, no ocurre lo mismo en el caso de la prevención primaria. Existe una cierta controversia y variabilidad en las directrices de las diferentes Sociedades Científicas en cuanto a que tablas de riesgo utilizar y que umbral de riesgo considerar para decidir a quién tratar e incluso en las dosis de aspirina a utilizar. Llama la atención la variabilidad de las directrices, cuando todas están basadas en los mismos estudios, diferentes ensayos clínicos y metaanálisis ya citados en esta revisión.
Se revisan a continuación las diferentes directrices recientemente publicadas para la población general y específicas para los pacientes diabéticos.
Directrices para la población generalLa Sociedad Europea de Cardiología y otras sociedades para la prevención de la enfermedad CV (2007)22 recomiendan 75mg/día de aspirina en sujetos con riesgo de muerte CV muy alto (SCORE >5%) y presión arterial (PA) controlada.
La Organización Mundial de la Salud (2007)23 sugiere utilizar dosis bajas de aspirina (75mg/día con la PA controlada) en todos los sujetos con un riesgo de sufrir cualquier evento CV superior al 30%.
La Asociación Americana del Corazón (2007)24 recomienda 75-325mg/día de aspirina en mujeres con riesgo coronario >20%. También hacen referencia a la utilización de aspirina en mujeres de riesgo bajo-moderado cuando los beneficios de la intervención sean superiores al riesgo de hemorragias.
La última Task Force Americana (2009)25 recomienda la utilización de 75mg/día de aspirina en hombres (45-59, 60-69 y 70-79 años) si el beneficio es mayor que el riesgo de hemorragias (riesgo de IAM>4, 9 y 12% respectivamente) y en mujeres (55-59, 60-69 y 70-79 años) si el beneficio es mayor que el riesgo de hemorragias (riesgo de ictus>3, 8 y 11% respectivamente). No recomiendan usar aspirina en hombres <45 años y mujeres <55 años.
La Sociedad Europea de Hipertensión (2009)26 recomienda 75-100mg/día de aspirina en hipertensos con insuficiencia renal (creatinina >1,3mg/dl) o con riesgo alto.
Directrices para los pacientes diabéticosEl National Institute for Health and Clinical Excellence británico (NICE 2009)27 recomienda utilizar 75mg/día de aspirina en todos los sujetos >50 años con PA controlada (<145/90mmHg) y en menores de 50 años con algún factor de riesgo CV.
El Ministerio de Sanidad y Consumo28 recomienda tratar con aspirina a todos los diabéticos con un riesgo coronario >10% según REGICOR.
La Asociación Americana de Diabetes (ADA 2010)29 recomienda utilizar 75-162mg/día de aspirina en los diabéticos con riesgo CV alto (>10% a los 10 años) y el documento conjunto de la ADA, de la American Heart Association y de la American College of Cardiology30 hacen la misma consideración en los pacientes de riesgo alto (>10%) y además sugieren que se podría considerar la misma dosis de aspirina en diabéticos con riesgo intermedio (jóvenes con 1 o más factores de riesgo o pacientes mayores sin factores de riesgo pero con un riesgo CV entre 5-10% a los 10 años).
Como normas generales podemos decir que todas las sociedades sugieren valorar los beneficios de la prevención primaria y el riesgo de hemorragias y considerar en pacientes de riesgo la gastroprotección siempre que no haya contraindicación específica para el uso de aspirina.
Aplicación práctica de la antiagregación e impacto económico de la intervenciónEl riesgo de sangrado grave gastrointestinal con AAS, que continúa siendo el fármaco antiagregante de elección por ser el más estudiado y de menor coste, puede oscilar entre el 1,9% con dosis ≤ 100mg/día y el 3,7% con dosis ≥ 200mg/día según datos del estudio CURE31, siendo muy inferior el riesgo de hemorragia intracraneal (1/10.000 tratamientos año)32, por esto, la selección de pacientes candidatos a recibir antiagregación debe ajustarse entre el beneficio en la prevención de enfermedad CV obtenido y el riesgo de hemorragias que puede provocar.
Además, la valoración de riesgo de sangrado no está estandarizada de forma clara y se debe individualizar. Se han relacionado con riesgo de sangrado intestinal factores como edad avanzada, antecedentes de ulcera péptica, síntomas digestivos superiores, infección por Helicobacter pylori, empleo de AINES e hipertensión no controlada. Sin embargo, se ha descrito como la edad no se relaciona con riesgo de sangrado con el uso de dosis bajas de AAS33.
El cálculo del riesgo cardiovascular (RCV) evaluado por morbimortalidad o mortalidad total es fundamental a la hora de la prescripción de antiagregación. El nivel de RCV donde la protección es superior al riesgo de sangrado no está claramente delimitado ni consensuado, pero la mayoría de los autores y documentos de consenso lo sitúan en un RCV de morbimortalidad alto ≥ 20% a 10 años, equivalente a un RCV de mortalidad total (SCORE) ≥ 5%. Por debajo de un 15% de morbimortalidad CV (4% en SCORE) persisten las dudas del beneficio obtenido y no se recomienda de forma generalizada, en estos sujetos habría que tener en cuenta el riesgo de sangrado evaluado de forma individual para cada paciente.
Por otra parte, la correcta prescripción de AAS se debe realizar de forma adecuada informando de los beneficios esperados. El paciente debe conocer explícitamente que está tomando AAS a dosis bajas/reducidas, los efectos secundarios probables y las medicaciones concomitantes que pueden aumentar el riesgo de sangrado, si se realiza correctamente se reduce la probabilidad de iatrogenia inducida.
La asociación de protección gástrica rutinaria en la reducción de riesgo de sangrado gastrointestinal asociado a antiagregación no está claramente indicada, debido la ausencia de ensayos aleatorizados en el momento actual que respondan a esta cuestión, salvo en pacientes de riesgo elevado de sangrado: gastropatía previa, uso concomitante con AINES, anticoagulantes, otros antiagregantes asociados como clopidogrel, corticoides. Tampoco hay evidencias en cuanto a la sustitución de AAS por clopidogrel en pacientes con riesgo de sangrado.
En la prevención de hemorragia intracraneal también se debe valorar el control de la presión arterial PA previamente a la adicción de tratamiento antiagregante.
El coste efectividad de la prevención cardiovascular con AAS depende fundamentalmente del RCV de las poblaciones tratadas incluidas, por lo tanto se relaciona estrechamente con la correcta prescripción de la antiagregación.
En un estudio de excelente diseño, realizado en nuestro medio en 2006, el coste efectividad en prevención primaria de la administración de AAS a dosis bajas en pacientes con un RCV del 15% a 10 años es positivo, produciendo un ahorro económico neto teórico de 797€ (IC95%: 263-1.331), y si se tratase a toda la población española en RCV de forma correcta se produciría un ahorro teórico de 26,5 millones de euros y que empieza el primer año de tratamiento, y una disminución de costes por años de vida ganados y costes por años de vida ajustados por calidad de vida34.
Otro estudio europeo de cohortes reciente que ha incluido 10.000 pacientes con edad superior a 55 años, analiza el coste efectividad de AAS en prevención primaria CV, encontrando que es positivo en varones con un RCV de morbimortalidad a 10 años>10%, y>al 15% para mujeres, en estas, el ahorro de costes se produce más tarde que en varones35.
Dado el bajo coste de AAS en comparación al resto de antiagregantes la comparación es muy positiva para AAS, destacando adicionalmente la escasez de datos en este aspecto del resto de antiagregantes disponibles.
A efectos prácticos, podemos considerar que en población sana sin factores de riesgo cardiovascular no se recomienda la utilización de antiagregación. En población con FRCV y en ausencia de enfermedad CV establecida, se debe calcular siempre el RCV y valorar el riesgo de sangrado, en los pacientes con riesgo de mortalidad cardiovascular total a 10 años igual o superior al 5-6% o de morbimortalidad CV ≥ 15-20%, y que no presenten incremento de riesgo de sangrado se debería considerar y ofrecer a los pacientes la posibilidad de antiagregar con dosis bajas de aspirina.