Las arritmias son, quizá, una de las patologías que más intranquilidad provoca en el médico de atención primaria. Esto es especialmente cierto ante episodios agudos de taquicardia, en las cuales con frecuencia se duda a la hora de decidir qué fármaco utilizar por temor a empeorar el cuadro. Por otro lado, con frecuencia se detectan de forma casual distintos tipos de arritmias asintomáticas en electrocardiogramas rutinarios; las dudas en este caso suelen plantearse respecto a si es necesario tratarlas o no. Saber identificar el tipo de trastorno del ritmo en base al patrón electrocardiográfico es el primer paso indispensable para poder enfrentarnos a estas patologías. En el presente artículo se pretende realizar una revisión de las arritmias más frecuentes, con especial énfasis en su diagnóstico electrocardiográfico, sus causas más frecuentes, su significación pronóstica y su tratamiento.
Arrhythmias are, perhaps, one of the diseases that cause the most concern in the primary care physician. This is especially true when these are acute episodes of tachycardia, in which the physician frequently has doubts about which drug can be used without worsening the clinical picture. On the other hand, different types of asymptomatic arrhythmias are frequently detected on the routine electrocardiograms. In this case, doubt arises regarding whether these should be treated or not. Knowing how to identify the type of rhythm disorder based on the electrocardiographic pattern is the first essential step in order to cope with these conditions. In this article, it has been aimed to make a review on the most frequent arrhythmias, placing special emphasis on their electrocardiographic diagnosis, their most frequent causes, their prognostic significance and treatment.
Las palpitaciones son un motivo de consulta muy frecuente en atención primaria (AP). El primer objetivo del médico de familia es establecer si estas son debidas a una arritmia cardiaca o no y, para ello, es fundamental la documentación electrocardiográfica de un episodio. Una vez detectada, el tratamiento va a variar dependiendo del tipo de arritmia en cuestión, de la intensidad de los síntomas y de la presencia o no de cardiopatía estructural subyacente. Como en cualquier otra enfermedad, el tratamiento debe cubrir dos objetivos: aliviar los síntomas y/o prolongar la supervivencia. Así, si la arritmia es asintomática y los fármacos no mejoran la supervivencia lo más prudente es no tratarla, pues la mayoría de los fármacos antiarrítmicos tienen efectos secundarios, incluido un efecto proarritmogénico, que en ocasiones incluso pueden empeorar el pronóstico del paciente.
Arritmias supraventricularesLlamamos arritmias supraventriculares a aquellas que se originan por encima de la bifurcación del haz de His. Por tanto, en ausencia de trastornos basales de la conducción intraventricular (bloqueos de rama) o conducción aberrante, se caracterizan electrocardiográficamente por ser arritmias de QRS estrecho (<120ms). Las taquiarritmias supraventriculares (TSV) suelen ser repetitivas, ocasionalmente persistentes y pueden, sobre todo en el caso del flutter y la fibrilación auricular (FA), incluso hacerse permanentes. Estas arritmias rara vez ponen en peligro la vida del paciente y los síntomas que originan dependen de la frecuencia cardiaca, de la regularidad o no del ritmo, de la presencia o ausencia de cardiopatía subyacente y de la idiosincrasia del paciente entre otros factores. Así, pueden ser desde asintomáticas hasta provocar síncope, aunque con mayor frecuencia ocasionan síntomas más leves como palpitaciones, disnea o dolor torácico.
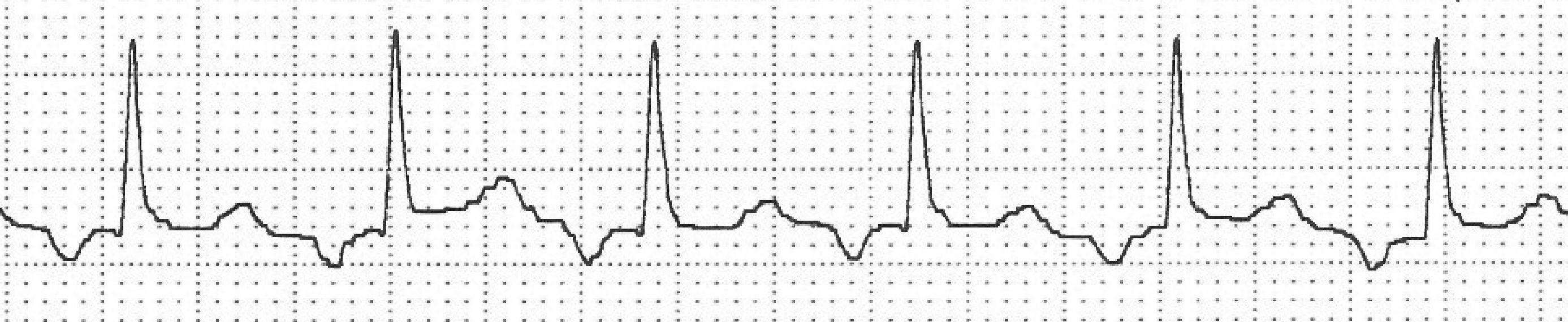
Arrimias auricularesFibrilación auricularLa FA se caracteriza por una activación auricular no coordinada a una frecuencia superior a 350 latidos por minuto (lpm), lo que conlleva el deterioro de su función mecánica. En el ECG (fig. 1), las ondas P son sustituidas por oscilaciones rápidas de la línea de base u ondas fibrilatorias, que varían en amplitud, forma e intervalo1; la respuesta ventricular (QRS) será irregular, y habitualmente rápida en ausencia de fármacos que frenen a un nódulo auriculoventricular (NAV) «sano».
Según el estudio de Framingham, la prevalencia de FA en hombres es del 2,2% y del 1,7% en mujeres. Dicha prevalencia aumenta con la edad, de modo que afecta al 0,2% de los individuos entre 25–34 años, al 3% entre 55–64 años y al 9% de los mayores de 80 años2. De hecho, la FA es la arritmia cardiaca más prevalente en la práctica clínica y la que genera mayor número de consultas a los servicios de urgencias, lo cual obliga a los Médicos de Familia a conocer su fisiopatología y a conseguir un adecuado manejo de la misma3.
La etiología de la FA tiene relación, en general, con factores crónicos de cada paciente que actúan como sustrato (cardiopatía) y con otras causas agudas, pudiendo no volver a recurrir si la causa desaparece (ingesta etílica, electrocución, pericarditis y miocarditis agudas, embolismo pulmonar, hipertiroidismo, etc.)4. Entre el 70–80% de los casos se relaciona con una enfermedad cardiaca. Las cardiopatías asociadas más comunmente son la HTA y la enfermedad coronaria; sin embargo, en los países en vías de desarrollo aún es habitual la asociación de FA con la presencia de enfermedad valvular de origen reumático.
No existe consenso sobre la clasificación de la FA. A continuación se relatan los términos más comúnmente utilizados.
- •
FA de reciente comienzo: primer episodio detectado de FA, ya sea sintomático, no sintomático o autolimitado. El médico debe asumir la incertidumbre sobre la duración real del episodio y de otros posibles episodios anteriores no detectados.
- •
FA recurrente: 2 o más episodios de FA.
- •
FA paroxística: de corta duración, generalmente menos de 2 días; cede de forma espontánea o tras la administración de un fármaco antiarrítmico.
- •
FA persistente: cuando se mantiene durante 7 días o más. Su eliminación se consigue habitualmente con cardioversión eléctrica (CVE).
- •
FA Permanente o crónica: ritmo estable en FA. Cuando falla el intento de pasar a ritmo sinusal o éste no se considera indicado.
- •
La resolución mediante tratamiento farmacológico o CVE directa no altera esta clasificación.
El manejo de los pacientes con FA tiene tres objetivos fundamentales: control de la frecuencia ventricular, prevención de embolias y reversión a ritmo sinusal. Estos objetivos no son excluyentes entre sí.
Para el control de la respuesta ventricular se utilizan fármacos frenadores del NAV como los betabloqueantes, los antagonistas del calcio no dihidropiridínicos (verapamilo y diltiacem) y la digital. En el contexto de la consulta, en pacientes oligosintomáticos con frecuencias no muy rápidas, se recomienda iniciar tratamiento con betabloqueantes a dosis progresivas, pues estos fármacos son muy efectivos y seguros independientemente de la existencia o no de cardiopatía estructural subyacente. En caso de contraindicación a los betabloqueantes se utilizarán verapamilo o diltiacem, siempre que no exista disfunción sistólica significativa del ventrículo izquierdo (VI). Si existe sospecha de disfunción ventricular y contraindicación para betabloqueantes se utilizará digital, que podrá utilizarse también en combinación con los fármacos anteriores si no se consigue un control adecuado con monoterapia.
La cardioversión se realiza habitualmente en urgencias y/o tras evaluación cardiológica, por lo que no se profundizará en este aspecto. Se puede realizar mediante fármacos (los más usados flecainida, propafenona y amiodarona) o con CVE. Destacar que, si la FA es de duración desconocida o de más de 48h de evolución, se ha de anticoagular al paciente durante al menos 3 semanas antes de intentar la cardioversión (salvo que se descarte trombosis intracavitaria con eco transesofágico), y mantenerla al menos 4 semanas posteriormente.
Una vez restaurado el ritmo sinusal, y sobre todo si la arritmia es muy recurrente y/o cursa con síntomas discapacitantes, se ha de mantener tratamiento antiarrítmico para evitar recidivas. En ausencia de cardiopatía estructural los fármacos más usados son la flecainida, la propafenona y el sotalol. La amiodarona se reserva para pacientes refractarios a las anteriores drogas y para aquellos con cardiopatía estructural significativa.
En cuanto a la prevención de fenómenos embólicos a largo plazo, se exponen en las tablas 1 y 2 las recomendaciones de las guías de práctica clínica de la ACC/AHA/ESC1.
Factores de riesgo emboligeno en pacientes con fibrilación auricular
| Factores de riesgo menos validados | Factores de riesgo moderado | Factores de alto riesgo |
| Sexo femenino | Edad ≥75 años | ACV, AIT o embolia previa |
| Edad 65–74 años | HTA | |
| Cardiopatía isquémica | Insuficiencia cardiaca | Estenosis mitral |
| Tirotoxicosis | FEVI ≤35% | Válvula cardiaca protésica |
| Diabetes mellitus |
ACV: accidente cerebrovascular; AIT: accidente isquémico transitorio; FEVI: fracción de eyección del ventrículo izquierdo; HTA: hipertensión arterial.
Tratamiento antitrombótico para pacientes con fibrilación auricular
| Categoría de riesgo | Tratamiento recomendado |
| Sin factores de riesgo | Aspirina, 81–325mg/día |
| Un factor de riesgo moderado | Aspirina, 81–325mg/día o Acenocumarol/Warfarina (INR 2,0–3,0; INR deseado 2,5) |
| Cualquier factor de alto riesgo o más de un factor de riesgo moderado | Acenocumarol/Warfarina (INR 2,0–3,0; INR deseado 2,5)¿ |
El papel del médico de AP y los criterios de derivación son los siguientes:
- 1.
Diagnóstico de la FA, sobre todo de la asintomática.
- 2.
Realizar ECG, y valorar en el mismo la posibilidad de causas subyacentes: infarto agudo de miocardio, hipertrofia ventricular izquierda…
- 3.
Valorar la necesidad de iniciar tratamiento para control de la frecuencia y prevención de episodios embólicos. Monitorizar dicho tratamiento y minimizar el riesgo de toxicidad del mismo.
- 4.
En general, en AP se puede iniciar el tratamiento de las personas con FA permanente o de cualquier tipo en los casos en los que se decida control de la frecuencia y no del ritmo1. Se recomienda remitir a segundo nivel asistencial en los siguientes casos:
- a)
Urgencias: casos con sincopes o muy sintomáticos y que necesitan un control urgente de la frecuencia cardiaca
- b)
Consultas Externas de Cardiología:
- •
Menores de 50 años.
- •
Dificultad para la clasificación.
- •
Tomar la decisión de control de frecuencia o del ritmo.
- •
Sospecha de enfermedad valvular o disfunción sistólica.
- •
Sospecha de síndrome de Wolf-Parkinson-White.
- •
La mayoría de los casos de FA paroxística y persistente para valoración de tratamiento de control del ritmo o cardioversión.
- •
- a)
Es un ritmo auricular rápido, regular y organizado, originado, en su forma típica o común, por un mecanismo macroreentrante en la aurícula derecha cuyo circuito gira en sentido antihorario en torno al anillo tricuspídeo, identificándose una zona de conducción lenta a nivel del istmo cavo-tricuspídeo (ICT). Dicha zona es crítica para el mantenimiento del circuito y, por lo tanto, objetivo de las técnicas de ablación. El patrón ECG típico (fig. 2) muestra complejos auriculares de morfología y polaridad constante, cuyo aspecto recuerda a «dientes de sierra» en derivaciones de cara inferior (II, III y aVF), a una frecuencia entre 250–350lpm (típicamente 300lpm). La frecuencia ventricular dependerá de la conducción auriculoventricular (AV) (150lpm si conducción 2:1, 100lpm si conducción 3:1….). Hay otras formas de flutter atípico, originado por otros mecanismos, que pueden presentar una frecuencia auricular superior y ondas de diferente polaridad en función de la estructura implicada.
Clínicamente puede presentarse de forma paroxística en individuos sanos, asociado a factores desencadenantes (EPOC, tirotoxicosis, pericarditis, insuficiencia respiratoria aguda…) o de forma crónica o permanente generalmente en individuos con cardiopatía de base (HTA, cardiopatía isquémica,). Frecuentemente coexiste con FA.
Respecto al tratamiento, la CVE sincronizada a baja frecuencia (50–100J) es de elección si existe inestabilidad hemodinámica. En caso de buena tolerancia y ausencia de compromiso hemodinámico se podrá controlar la frecuencia ventricular con fármacos frenadores del NAV, iniciar anticoagulación y programar cardioversión (de forma similar a protocolo de FA). No obstante, la recurrencia es frecuente a pesar del uso de antiarrítmicos, siendo el tratamiento de elección la ablación por radiofrecuencia del ICT, que tiene un índice de éxito >90% en el flutter típico. Aunque el riesgo embólico es algo menor que en la FA, se recomienda anticoagulación con la misma pauta que ésta.
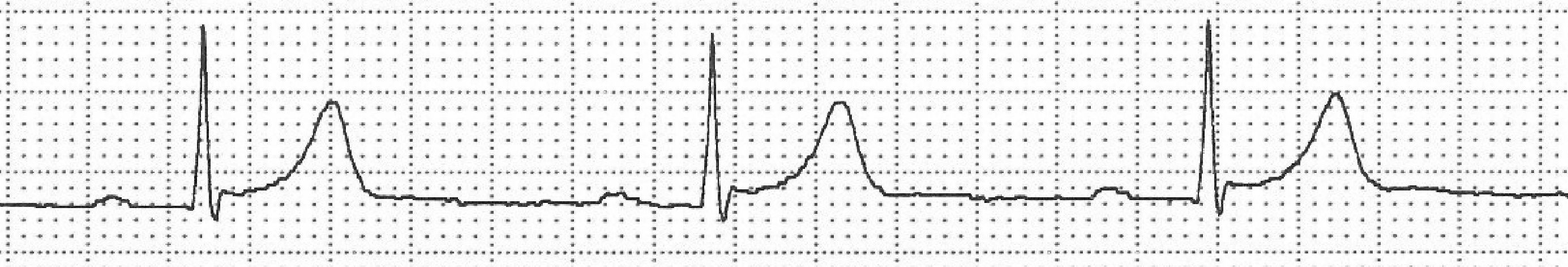
Taquicardia auricular unifocalSe trata de una arritmia poco frecuente, caracterizada por una actividad auricular regular, en general a menos de 250lpm, generada en un foco auricular ectópico único. En el ECG veremos, por tanto, ondas P regulares de morfología idéntica entre si, pero distintas a la sinusal, a una frecuencia entre 100–250lpm; la frecuencia ventricular dependerá de la conducción AV (fig. 3).
Taquicardia auricular uni- o monofocal. Derivación II. Se expone con intención didáctica una taquicardia no muy rápida (111lpm) en la que se observa que cada QRS está precedido de ondas P′ de morfología idéntica entre sí, pero distintas a la sinusal. Habitualmente son más rápidas, de modo que cuando la conducción es 1:1 las ondas P′ suelen quedar enmascaradas en la onda T precedente.
Se asocia con frecuencia a cardiopatía estructural de base, puede ser secundaria a intoxicación digitálica (en este caso el bloqueo AV es muy común) y se agrava en presencia de hipokaliemia. Puede ser paroxística o incesante; las primeras suelen tener un curso benigno, pero las incesantes pueden llevar al desarrollo de taquimiocardiopatía.
El tratamiento agudo de esta taquicardia debe focalizarse en la corrección, si existen, de las causas precipitantes (digital, alteraciones de los electrolitos) y en el control de la FC con betabloqueantes o antagonistas del calcio no dihidropiridínicos. A veces con estos fármacos se consigue la cardioversión, pero lo más frecuente es que se tenga que recurrir para ello a los fármacos Ic o III, o a la CVE (mandatoria si mala tolerancia hemodinámica). El tratamiento de mantenimiento sigue el mismo esquema que el del tratamiento agudo. En casos refractarios a fármacos se recurre a la ablación, que es eficaz en el 86% de los casos, con tasas de recurrencia del 8% en algunas series5.
Taquicardia auricular multifocal o caóticaEs una arritmia irregular caracterizada por la presencia de ondas P de al menos 3 morfologías distintas, a una frecuencia mayor de 100lpm (fig. 4); a veces se confunde, por su irregularidad, con la FA.
Es típica del paciente EPOC descompensado y a veces se asocia a intoxicación digitálica, uso de beta-agonistas o teofilina, y a trastornos electrolíticos como hipokaliemia e hipomagnesemia.
El tratamiento es el de la enfermedad de base, que es la que marca el pronóstico. Es útil, además de la corrección de los trastornos hidroelectrolíticos, la administración de antagonistas del calcio no dihidropiridínicos para el control de la frecuencia cardiaca (los betabloqueantes suelen estar contraindicados por la enfermedad pulmonar de base). No son útiles los antiarrítmicos, la CVE ni la ablación.
Taquicardia sinusal inapropiadaSe caracteriza por un incremento persistente y no paroxístico de la FC en reposo y/o por una aceleración desproporcionada de la FC (sinusal) para un nivel determinado de estrés físico o mental. Su causa es desconocida, si bien se cree que se debe, en parte, a un excesivo automatismo sinusal por alteración de la regulación autonómica (a favor del simpático)6. Se trata de un trastorno más frecuente en profesionales de la salud y mujeres (90%), siendo la edad media de aparición los 38 años. Puede ser desde asintomática hasta invalidante (palpitaciones, dolor torácico, disnea, mareo, presíncopes).
Para su diagnóstico se requiere la exclusión de causas secundarias de taquicardia sinusal (fiebre, anemia, hipertiroidismo…) y la documentación de una FC media durante el día superior a 100lpm, con aceleración excesiva ante mínimo estrés físico/mental, y normalización por la noche (Holter de 24h)7.
El tratamiento debe ser guiado por síntomas, pues el riesgo de desarrollo de taquimiocardiopatía parece bajo8. Como primer escalón se usan los betabloqueantes, pudiendo utilizarse verapamilo o diltiacem si estos están contraindicados. La ivabradina, por su mecanismo de acción, parece muy prometedora. En casos refractarios y muy sintomáticos se puede intentar la modificación o ablación del nodo sinusal con radiofrecuencia9.
Taquicardias por reentrada auriculoventricularEn este apartado se encuadran el 90% de las llamadas «taquicardias paroxísticas supraventriculares» (TPSV)10; el 10% restante corresponde a las taquicardia auriculares unifocales. Se caracterizan por ser taquicardias regulares de QRS estrecho, a unos 150–220lpm, en las que las ondas P suelen ser difíciles de identificar por enmascararse en el interior de la onda T, o incluso del QRS (fig. 5).
Para que se produzca una reentrada AV se necesita que existan dos vías con capacidad de conducción diferente, y un latido adelantado auricular que encuentre solo a una de ellas, habitualmente la de conducción más rápida, en periodo refractario (fig. 6A). De este modo, el impulso baja solo por la vía de conducción más lenta, lo que permite a la vía rápida, antes bloqueada, a recuperar su excitabilidad a tiempo para permitir la conducción de dicho impulso en dirección retrógada (fig. 6B); posteriormente, el frente de onda vuelve a entrar por la vía lenta (fig. 6C), cerrándose así un círculo vicioso.
Estas taquiarritmias tienen típicamente un inicio y final bruscos, y suelen ser autolimitadas. En caso contrario, nuestra actitud ante un episodio agudo dependerá de la tolerancia del paciente a la taquicardia. En caso de inestabilidad hemodinámica (angina, hipotensión severa, insuficiencia cardiaca…) se debe realizar CVE. Si los síntomas son más leves (palpitaciones, ansiedad, disnea leve…), aplicaremos maniobras vagales como paso inicial. Estas maniobras (masaje del seno carotídeo, maniobra de Valsalva, inmersión de la cara en agua helada en niños) aumentan el tono parasimpático y enlentecen momentáneamente la conducción en el nodo AV, lo que permite a menudo terminar la taquicardia, si es que realmente se trata de una reentrada AV; si, por el contrario, estuviésemos ante una taquicardia auricular, ese enlentecimiento momentáneo de la conducción en el nodo AV permitiría desenmascarar las ondas P, antes ocultas en el interior de la T precedente (figs. 7 y 8). Si esto falla se recurre a fármacos iv como la adenosina, los betabloqueantes o los antagonistas del calcio no dihidropiridínicos. La adenosina tiene varias ventajas: acción casi inmediata, vida media muy corta (solo 2–6s) y ausencia de efecto inotrópico negativo; está contraindicada en corazones transplantados y en paciente asmáticos.
En este caso el nodo AV está dividido funcionalmente en 2 vías que forman el circuito de reentrada. En el 90% de los casos la secuencia de la reentrada es como la descrita arriba, es decir, conducción anterógrada por la vía lenta y retrógrada por la vía rápida; así pues, la activación de aurículas y ventrículos es prácticamente sincrónica, por lo que la P queda enmascarada dentro del QRS, o bien se inscribe como una pseudo-r′ en V1 (RP<70ms). En el 10% restante (taquicardia intranodal [TIN] atípica, no común o tipo II) la conducción es a la inversa, por lo que el RP será algo más largo.
Los pacientes con episodios esporádicos y bien tolerados pueden manejarse sin tratamiento médico continuado, utilizando solo maniobras vagales o una dosis puntual de un frenador del NAV (betabloqueante, verapamilo o diltiacem) durante las crisis. Cuando los episodios son más frecuentes se recomienda tratamiento continuado con estos fármacos. Si esto falla, se debe ofrecer al paciente ablación con radiofrecuencia de la vía lenta o, si esta es rechazada, añadir a lo anterior un fármaco Ic o III.
Taquicardias en el síndrome de Wolf-Parkinson-WhiteEl síndrome de Wolf-Parkinson-White (WPW) se caracteriza por la presencia de una vía accesoria (haz de Kent), con capacidad de conducción anterógrada y retrógada, que conecta el miocardio auricular con el ventricular a través del surco AV; se permite así que parte del músculo ventricular se despolarice precozmente (preexcitación). En el ECG basal encontraremos un PR corto (<120ms), pues no existe el retraso fisiológico que el NAV impone a la transmisión del estímulo de aurículas a ventrículos, y un QRS ensanchado por la presencia de un empastamiento inicial (onda delta), que es la expresión electrocardiográfica del miocardio ventricular despolarizado precozmente a través de la vía accesoria (fig. 9). El término «síndrome» de WPW se reserva para pacientes con preexcitación y taquiarritmias.
El tipo más frecuente de taquiarritmia en el paciente con WPW es la reentrada AV. El circuito de reentrada está formado en este caso por el NAV-sistema específico de conducción (Haz de His-ramas) y la vía accesoria. Lo más frecuente es que la taquicardia sea ortodrómica, es decir, conducción anterógrada del impulso a través del NAV y retrógrada por la vía accesoria, lo que origina una taquicardia regular de QRS estrecho (sin onda delta, pues los ventrículos se despolarizan a través del sistema específico de conducción), con onda P algo más alejada del QRS que en la TIN (>70ms) pero con RP
Mucho menos frecuente, pero potencialmente mortal, es la aparición de FA en un paciente con síndrome de WPW. Si la vía accesoria tiene un periodo refractario anterógrado corto, muchos estímulos pueden pasar de aurículas a ventrículos y provocar una respuesta ventricular muy rápida que puede degenerar en fibrilación ventricular.
La incidencia de muerte súbita en pacientes con WPW se ha estimado entre un 0,15–0,45% por paciente-año11,12. El riesgo disminuye con la edad, siendo máximo en niños y excepcional en mayores de 40 años. La demostración de un periodo refractario largo de la vía accesoria, ya sea directamente durante un EEF13, o indirectamente al objetivar pérdida de la preexcitación (desaparición de la onda delta) en el ECG basal (preexcitación intermitente), a frecuencias altas durante una prueba de esfuerzo, o tras la administración de procainamida, se asocia a un riesgo menor.
El tratamiento definitivo para los pacientes con WPW sintomático es la ablación de la vía accesoria con radiofrecuencia; como puente hasta la misma pueden usarse fármacos que previenen la conducción rápida a través de la vía accesoria como flecainida, propafenona, sotalol o amiodarona. En cuanto al tratamiento de los episodios agudos, el tratamiento de las taquicardias por reentrada AV ortodrómicas (QRS estrecho) no difiere del comentado anteriormente (maniobras vagales, adenosina i.v., etc.). En las antidrómicas (QRS ancho), sin embargo, se prefiere el uso de procainamida o flecainida, pues a veces el brazo retrógrado de la reentrada puede ser una segunda vía accesoria, con lo que los frenadotes del NAV serían inefectivos. En caso de FA preexcitada están formalmente contraindicados los frenadotes del NAV, pues favorecen la conducción de estímulos a través de la vía accesoria, siendo de elección la procainamida o la flecainida.
Más controvertido es el manejo de los pacientes con WPW asintomático. Las guías de práctica clínica de la ACC/AHA/ESC de 200314 no especifican ningún protocolo específico de estratificación del riesgo, pues consideran que poseen un valor predictivo positivo demasiado bajo. Así, se recomienda individualizar los casos balanceando el riesgo de muerte súbita con el de complicaciones mayores asociadas a la ablación con catéter (2%). En general, se recomienda considerar ablación en pacientes con profesiones de alto riesgo (bomberos, pilotos, conductores de autobús…) y en jóvenes que quieren realizar deportes de alta competición.
Reentrada AV por vía accesoria ocultaLas vías accesorias ocultas son aquellas que solo permiten conducción retrógrada (de ventrículos a aurículas) a su través. Por tanto, a diferencia de lo que ocurre en el WPW, no pueden ser diagnosticadas en el ECG basal y solo pueden producir reentradas ortodrómicas. El esquema de manejo y tratamiento es similar al de las TIN.
OtrasExtrasístoles auricularesLos extrasístoles o complejos auriculares prematuros son despolarizaciones auriculares adelantadas que provienen de un foco auricular distinto del nodo sinusal. En el ECG se identifican como ondas P adelantadas (aparecen precozmente en el ciclo cardiaco) de morfología distinta a la sinusal normal (la morfología depende de la localización del foco ectópico), y que habitualmente van seguidas de un QRS estrecho (fig. 10) a no ser que exista un trastorno basal de la conducción intraventricular (bloqueo de rama) o conducción aberrante (fig. 11), en cuyo caso el QRS será ancho; en última instancia, si el extrasístole es lo suficientemente precoz como para encontrar al NAV dentro del periodo refractario, el estímulo auricular no será conducido a los ventrículos (extrasístole auricular bloqueado), por lo que en el ECG veremos una P adelantada no seguida de QRS (fig. 12).
Su prevalencia aumenta con la edad y con la presencia de cardiopatía estructural y de otras patologías (EPOC, insuficiencia renal, trastornos neurológicos), aunque también son un hallazgo frecuente en pacientes jóvenes sin cardiopatía (hasta el 73% en Holter-24h1). El estrés, el alcohol, el tabaco, la cafeína y las drogas simpaticomiméticas son potenciales precipitantes.
Lo más frecuente es que sean asintomáticos y no requieren tratamiento. En muchos pacientes, no obstante, originan síntomas como palpitaciones o sensación desagradable de «vuelco». En estos casos debemos inicialmente tranquilizar al paciente, explicándole la naturaleza benigna de los extrasístoles, e instarle a evitar potenciales provocadores como tabaco, alcohol y otros. Si estas medidas no resultan suficientes se pueden utilizar betabloqueantes. Solo excepcionalmente se usaran antiarrítmicos, especialmente en aquellos casos en que los extrasístoles desencadenan otras arritmias supraventriculares.
Arritmia sinusalPuede ser respiratoria o no respiratoria. La primera consiste en un aumento de la FC con la inspiración y un descenso con la espiración; es fisiológica y habitual en niños y personas jóvenes (fig. 13). La no respiratoria es propia de los ancianos, aunque también se observa en la intoxicación digitálica y en pacientes con elevación de la presión intracraneal. En ausencia de síntomas, que es lo habitual, (fig. 14) no requiere tratamiento; si da lugar a pausas significativas sintomáticas, el tratamiento es el implante de un marcapasos.
Arritmias ventricularesLas arritmias ventriculares se originan por debajo de la bifurcación del haz de His, generalmente en el músculo ventricular; así pues, salvo por raras excepciones, son arritmias con QRS ancho (>120ms).
Extrasistoles ventricularesLos extrasístoles o complejos ventriculares prematuros son latidos adelantados (aparecen antes de lo que correspondería a una onda P) que provienen de un foco ectópico localizado en alguno de los ventrículos. Electrocardiográficamente se reconocen por la aparición precoz de un QRS ancho, no precedido de onda P (la despolarización de las aurículas ocurre después de la de los ventrículos, quedando habitualmente la P retrógrada-enmascarada en el interior del QRS) y con ST y onda T anormal, habitualmente de polaridad opuesta a la del QRS; habitualmentese siguen de una pausa compensadora completa (la distancia que separa a los dos latidos que contienen el extrasístole es igual al doble de la distancia que separa a dos latidos sinusales normales). Se habla de bigeminismo cuando alternan un latido normal y un extrasístole, y trigeminismo cuando alternan 2 latidos normales y un extrasístole.
Los extrasístoles ventriculares son muy frecuentes en la población sana, aumentando su prevalencia con la edad, el sexo masculino, la raza negra y la presencia de diversas cardiopatías (dilatada, hipertrófica, isquémica, valvular). También se asocian al uso de estimulantes (café, te, alcohol, tabaco, cocaína…), determinados fármacos (digital, teofilina, antipsicóticos, antidepresivos triciclitos, antiarrítmicos…) y a alteraciones hidroelectrolíticas (hipo/hiperkaliemia, hipomagnesemia).
Lo más frecuente es que sean asintomáticos, pero a veces producen sensación de paro repentino o «vuelco» del corazón y, con frecuencia, y debido al latido postextrasistólico hipercontráctil, palpitaciones en el tórax o en el cuello e incluso ligero mareo fugaz.
Las dos claves a considerar a la hora de manejar pacientes con extrasístoles ventriculares son la presencia o ausencia de cardiopatía subyacente y la presencia o ausencia de síntomas.
En pacientes sin cardiopatía estructural la presencia de extrasístoles tiene escaso significado pronóstico (algún estudio ha demostrado un ligero aumento del riesgo de arritmias graves si son muy frecuentes, multiformes o en pequeñas rachas15,16), por lo que solo se trata, una vez descartados factores provocadores (uso de estimulantes, fármacos, alteraciones electrolíticas), a los pacientes sintomáticos. En primer lugar se ha de tranquilizar al paciente acerca de la benignidad del trastorno y, en caso necesario, iniciar tratamiento con dosis bajas de betabloqueantes (usar la mínima dosis eficaz para minimizar efectos secundarios); en pacientes seleccionados puede ser útil el uso de ansiolíticos. Si esto falla ha de derivarse al paciente al cardiólogo, que valorará el uso de verapamil o, en casos muy seleccionados, de antiarrítmicos. De forma excepcional, si son muy frecuentes y sintomáticas, monomórficas, y refractarias a tratamiento médico, se puede considerar la ablación.
En lo que se refiere a pacientes con cardiopatía estructural, en general el valor pronóstico de estas arritmias es muy escaso en las miocardiopatías dilatadas no isquémicas y en la hipertrofia del VI, mientras que se asocian a un peor pronóstico en los pacientes que han sufrido un infarto previo, sobre todo si son frecuentes (>10/h) o repetitivas; sin embargo, la supresión de los extrasístoles con fármacos del grupo I en estos últimos se asocia a un aumento de la mortalidad17, mientras que la amiodarona ha demostrado un descenso de la muerte arrítmica, pero no de la mortalidad total18. Por otro lado, el tratamiento estándar de todas estas patologías en general mejora la supervivencia y reduce la incidencia de extrasístoles (pej reducción de hipertrofia con tratamiento antihipertensivo o tratamiento con betabloqueantes e IECA en pacientes con miocardiopatía dilatada o isquémica). Así pues, y en conclusión, solo se trata la extrasistolia ventricular a los pacientes sintomáticos a pesar de un tratamiento adecuado de la enfermedad de base, siendo la amiodarona, tras los betabloqueantes, el fármaco más seguro para ello.
Taquicardia ventricular no sostenidaSe define la taquicardia ventricular no sostenida (TVNS) por la presencia de 3 o más extrasístoles ventriculares consecutivos a una frecuencia >100lpm (algunos autores exigen 5 o más latidos a una frecuencia >120lpm), con una duración de menos de 30s (fig. 15). Su prevalencia es menor que la de los extrasístoles, pero su epidemiología y clínica es similar. Es raro que estas arritmias provoquen síntomas importantes como presíncope o síncope, debiendo sospecharse la coexistencia de arritmias sostenidas cuando estos están presentes.
Los pacientes con TVNS deben ser evaluados al menos con ecocardiograma y un test de detección de isquemia para descartar cardiopatía estructural subyacente con significación pronóstica; descartada esta, su manejo, en general, es similar al de los extrasístoles. La excepción a esta regla de excelente pronóstico en pacientes sin cardiopatía estructural la constituyen las variedades polimórficas (que pueden estar asociadas al síndrome de QT largo [congénito o adquirido], o a una rara forma familiar denominada «catecolaminérgica»), que tienen riesgo aumentado de muerte súbita y requieren un manejo específico por especialistas.
En pacientes con antecedentes de infarto, la significación pronóstica de estas arritmias es escasa si aparecen en las primeras 48h, estando en este caso relacionadas con fenómenos de isquemia o reperfusión. Las que ocurren de forma más tardía se relacionan con la formación del tejido cicatricial y se asocian con un riesgo aumentado de muerte súbita, sobre todo si la FEVI residual es19,20. En los pacientes con FEVI >40%, en general, solo se añade al tratamiento de base con betabloqueantes e IECA la amiodarona en caso de síntomas.
En los pacientes con miocardiopatía dilatada idiopática los principales determinantes pronósticos son la FEVI y la situación funcional NYHA, sin que la presencia de TVNS añada valor pronóstico de forma independiente. El manejo es similar al de los pacientes isquémicos con FEVI >40%.
Por último, la presencia de TVNS es uno de los principales factores de riesgo de muerte súbita en pacientes con miocardiopatía hipertrófica, junto con otros como los antecedentes personales y/o familiares de muerte súbita o un espesor parietal ≥30mm entre otros21. Estos pacientes han de ser tratados con betabloqueantes. La amiodarona puede ofrecer una mejoría sintomática, aunque no está claro que prevenga de forma eficaz la muerte súbita22. La decisión de implantar un desfibrilador automático implantable profiláctico debe individualizarse, aconsejándose cuando concurren varios factores de riesgo.
Taquicardia ventricular sostenidaLa definición es similar a la de la TVNS, pero con duración mayor de 30s. El manejo a largo plazo de los pacientes con episodios de taquicardia ventricular sostenida (TVS) es complejo y en general se reserva para especialistas, por lo que nos limitaremos al diagnóstico y manejo agudo de las mismas.
Ante una taquicardia de QRS ancho las posibilidades diagnósticas son tres: taquicardia ventricular, taquicardia supraventricular en paciente con bloqueo de rama (ya sea previamente existente o funcional [conducción aberrante]) o taquicardia supraventricular con conducción anterógrada por una vía accesoria. Si la taquicardia es mal tolerada el tratamiento agudo será la CVE inmediata en todo caso. Si es bien tolerada, el tratamiento dependerá de si la taquicardia es supraventricular, en cuyo caso el manejo será como el de las de QRS estrecho, o ventricular, siendo los tratamientos de elección en este último caso la procainamida y/o el sotalol i.v. o bien la amiodarona si existe disfunción sistólica del VI14; también la lidocaína es eficaz en el contexto del infarto agudo de miocardio. No obstante, en caso de duda siempre trataremos una taquicardia de QRS ancho como si fuese ventricular, pues el tratamiento de estas es también eficaz en las supraventriculares, mientras que los efectos de los fármacos usados en las supraventriculares (pej. verapamil i.v.) pueden ser deletéreos en pacientes con TVS. Siendo prácticos, en el contexto de la AP, quizá el tratamiento más seguro de este tipo de taquicardias sea la amiodarona i.v. pues es eficaz y segura en prácticamente todos los escenarios posibles.
Teniendo claro lo anteriormente dicho, ¿cómo hacemos el diagnóstico diferencial en las taquicardias de QRS ancho? En primer lugar, si la taquicardia es irregular lo más probable es que se trate de una FA, o bien de una taquicardia o flutter auricular con conducción AV variable en paciente con bloqueo de rama o con conducción anterógrada por vía accesoria. Si es regular, nos apoyaremos inicialmente en datos de la anamnesis. Así, si el paciente tiene antecedentes de un infarto de miocardio, el diagnóstico de TVS es prácticamente seguro, mientras que si tiene antecedentes de síndrome de WPW, la posibilidad de TSV con conducción anterógrada por la vía accesoria ha de tenerse en cuenta. Si el paciente tiene un bloqueo de rama previamente conocido, un patrón de bloqueo en taquicardia idéntico al que presenta en ritmo sinusal es muy sugestivo de TSV, mientras que si el patrón es diferente, los más probable es que se trate de una TVS. A continuación se expone un algoritmo basado en los criterios de Brugada para el diagnóstico de las taquicardias ventriculares (si no se cumple un punto, se pasa al siguiente):
- 1)
Ausencia de complejos RS en todas las precordiales (fig. 17).
- 2)
Si existen complejos RS, intervalo R-S (desde inicio de R hasta punto más negativo de la S) >100ms en precordiales.
- 3)
Disociación AV con frecuencia ventricular mayor que la auricular, latidos de fusión y/o latidos de captura.
- 4)
Criterios morfológicos clásicos (fig. 16).
Llamamos bradicardia a cualquier ritmo cardiaco con una frecuencia inferior a 60 lpm. Se deben a alteraciones en la formación y/o en la conducción de los impulsos que pueden ser funcionales (hipertonía vagal), medicamentosas o secundarias a trastornos degenerativos, inflamatorios, isquémicos, infiltrativos o fibróticos.
Los síntomas de una bradicardia dependen del grado en el que el gasto cardiaco se vea comprometido, pudiendo ir desde el mareo o astenia leve hasta el síncope.
Como regla general, las bradicardias sintomáticas persistentes no debidas a una causa reversible se tratan con el implante de un marcapasos definitivo. Cuando la causa es reversible, se recurre al marcapasos temporal o provisional hasta la resolución de la misma. Como puente hasta la implantación del marcapasos temporal o definitivo son útiles, según los casos, la atropina, el isoproterenol o la adrenalina i.v.
Paros sinusalesSe trata en este caso de un trastorno en la formación del estímulo en el nódulo sinusal, que origina una pausa de asistolia (fig. 18) que puede ser interrumpida, bien por el propio ritmo sinusal, que recupera su actividad una vez terminado el paro, o bien por un latido de escape de un foco distinto al sinusal (auricular, de la unión o ventricular).
En muchas ocasiones coexisten en un mismo paciente, habitualmente de edad avanzada, bradicardia sinusal importante con paros sinusales y alteraciones de la conducción sinoauricular (ver siguiente apartado); se trata del denominado síndrome del seno enfermo o enfermedad del nódulo sinusal, causa muy frecuente de indicación de marcapasos. También es frecuente que estos pacientes alternen dichos ritmo lentos con taquiarritmias auriculares como la FA, un trastorno conocido como síndrome bradicardia-taquicardia.
Bloqueos sinoauriculares y auriculoventricularesEn los bloqueos sinoauriculares (BSA) existe un trastorno en la conducción del estímulo creado en el nódulo sinusal hacia el músculo auricular circundante, mientras que en los bloqueos aurículoventriculares (BAV) dicho trastorno de conducción se produce entre las aurículas y los ventrículos.
Existen tres grados de bloqueo:
- •
En el bloqueo de primer grado existe una prolongación anormal del tiempo de conducción a través del área de bloqueo, pero con transmisión de todos los impulsos. Dado que la activación del nodo sinusal no se puede observar en el ECG de superficie, el BSA de primer grado no es diagnosticable con el mismo. En el caso del BAV de primer grado, observaremos en el ECG una prolongación del intervalo PR por encima de 200ms, pero todas las ondas P irán seguidas de un complejo QRS (hay transmisión de todos los impulsos) (fig. 19).
- •
En el bloqueo de segundo grado hay ya un trastorno en la transmisión del impulso (al menos un impulso es bloqueado). Existen 2 tipos:
- ○
Tipo I o con fenómeno de Wenckebach: en este caso hay un retraso progresivo de la conducción hasta que uno o más impulsos no se transmiten. Habitualmente, el retraso de la conducción antes del fallo en la transmisión del impulso es cada vez menor, lo que hace que la cámara distal al área de bloqueo se acelere antes de dicho fallo. En el BSA veremos en el ECG un acortamiento progresivo del intervalo P-P hasta que una onda P falla, lo que origina una pausa de asistolia hasta que se reinicia el proceso (fig. 20). En el BAV veremos un alargamiento progresivo del intervalo PR hasta que una P no irá seguida de QRS (fig. 21); este tipo de bloqueo suele ser de localización suprahisiana, habitualmente en el NAV, por que suele tener un comportamiento benigno (salvo en ancianos), no siendo raro encontrarlo en pacientes vagotónicos como atletas bien entrenados.
- ○
Tipo II o sin fenómeno de Wenckebach: a diferencia del anterior, no se produce un retraso progresivo de la conducción antes del fallo en la transmisión del impulso. En el BSA se observará que la pausa de asistolia no irá precedida de un acortamiento del intervalo P-P y, además, que la duración de dicha pausa, a diferencia de lo que ocurre en el paro sinusal, será un múltiplo exacto del intervalo P-P normal (fig. 22). El BAV de segundo grado tipo II (o de Mobitz) se caracteriza electrocardiográficamente porque el PR será constante (no se alargará progresivamente) antes de que aparezca la onda P no seguida de QRS (fig. 23); a diferencia del tipo I, este bloqueo suele ser de localización infrahisiana, por lo que no suele responder a la atropina, y evoluciona con mayor frecuencia a BAV completo.
- ○
Llamamos BAV 2:1 cuando se bloquea una de cada dos ondas P; en este no es posible saber con seguridad si se trata de un BAV tipo Wenckebach o Mobitz, ya que para diagnosticar el primero necesitamos que dos ondas P consecutivas sean conducidas para ver si se alarga o no el PR (fig. 24).
- ○
- •
En el bloqueo de tercer grado o completo ningún impulso es conducido a través del área de bloqueo. El BSA de tercer grado no es diagnosticable con el ECG de superficie ya que, dado que ningún estímulo creado en el nodo sinusal llega a las aurículas, veremos solo un ritmo de escape de algún marcapasos subsidiario. En el BAV completo ningún estímulo auricular es conducido a los ventrículos, por lo que estos últimos crean su propio ritmo independiente; se produce así una disociación aurículo-ventricular, en la que veremos ondas P regulares a un ritmo determinado y complejos QRS, también regulares, pero a un ritmo inferior e independiente del de las aurículas (fig. 25). Dependiendo del foco donde se origine el escape ventricular, los QRS podrán ser estrechos (haz de His) o anchos (músculo ventricular).