La enfermedad pulmonar obstructiva crónica (EPOC) es una patología infradiagnosticada, con una elevada morbimortalidad. El diagnóstico y el seguimiento se realizan en gran parte en atención primaria (AP). El objetivo de nuestro estudio es clasificar los pacientes EPOC de acuerdo con GOLD 2019 y GesEPOC 2017. Como objetivos secundarios, analizar el tipo de riesgo, describir y comparar el tratamiento pautado con el recomendado por las guías.
Material y métodosEstudio observacional transversal multicéntrico realizado en siete equipos de AP. Se incluyeron 637 pacientes EPOC entre 35 y 85años.
ResultadosLa edad media fue de 70,3años, el 84,6% tenían comorbilidades y el 43,5% eran fumadores activos. El FEV1 post-broncodilatador medio fue del 61,92% (DE: 17,42). Predominaron los pacientes con mMRC=1 (43,8%), 57,8% CAT<10. Índice BODEx leve (75,7%). GoldA fue mayoritario (47,7%). El fenotipo más frecuente fue el no agudizador (61,1%). El 25% fueron ACO. El 56,2% eran pacientes de bajo riesgo. El 20,6% no tenían prescrito ningún tratamiento, LABA +LAMA +CI (19,6%), LAMA +LABA (16,5%) y LAMA (16,3%). Si comparamos los tratamientos que tienen pautados los pacientes con lo que recomienda la GOLD, obtenemos que el 61% coinciden con una concordancia moderada, mientras que si los comparamos con la GesEPOC, el 53,8% coinciden con concordancia débil. El 73,4% de los tratamientos coinciden entre ambos documentos (concordancia moderada).
ConclusionesLos pacientes EPOC atendidos en AP son de bajo riesgo, leves y no agudizadores. Si comparamos los tratamientos que tienen pautados los pacientes con lo que recomiendan la GOLD y la GesEPOC, encontramos una concordancia moderada y débil, respectivamente.
Chronic obstructive pulmonary disease (COPD) is an underdiagnosed pathology with a high morbidity and mortality. Diagnosis and follow-up are mostly carried out in primary care (PC). The objective of our study is to classify COPD patients according to GOLD 2019 and GesEPOC 2017 guidelines. As secondary objectives, to analyze the type of risk and to describe and compare the prescribed treatment with that recommended by the guidelines.
Material and methodsMulticenter cross-sectional observational study in seven Health Care centers. 637 COPD patients between 35 and 85years old were included.
ResultsThe mean age was 70.3years old, 84.6% had comorbidities and 43.5% were active smokers. The mean post-bronchodilator FEV1 was 61.92% (SD: 17.42). Most are patients with mMRC=1 (43.8%), 57.8% CAT<10. Mild BODEx index (75.7%). GoldA was the majority (47.7%). The most frequent phenotype was non-exacerbator (61.1%). 25% were ACOs. 56.2% were low-risk patients. 20.6% had not been prescribed any treatment, LABA +LAMA +CI (19.6%), LAMA +LABA (16.5%) and LAMA (16.3%). If we compare the treatments that the patients have prescribed, with the one is recommended by GOLD, we obtain that 61% coincide with moderate concordance, while if we compare with GesEPOC, 53.8% coincide with weak concordance. 73.4% of the treatments coincide between both documents (moderate agreement).
ConclusionsCOPD patients treated in PC are low risk, mild and non-exacerbators. If we compare the treatments that the patients have prescribed, with what is recommended by GOLD and GesEPOC, we find a moderate and weak concordance, respectively.
La enfermedad pulmonar obstructiva crónica (EPOC) es una patología infradiagnosticada, con una elevada morbimortalidad1. En el estudio EPISCANII, la prevalencia de EPOC en la población mayor de 40años es del 12,4%2. El diagnóstico y el seguimiento de gran parte de estos pacientes se realiza en atención primaria (AP). Un estudio transversal de una cohorte de 895.155 pacientes con EPOC demostró que el 82,3% realizaban seguimiento por su médico de familia3.
En nuestro país disponemos de varias guías-documentos de práctica clínica de EPOC, y entre ellas destacamos el documento GOLD1 y el GesEPOC4. Un estudio concluye que uno de cada tres pacientes EPOC no disponía de espirometría, así como sobreprescripción de corticoides inhalados en pacientes con bajo riesgo5. Existen pocos estudios realizados en el ámbito de la AP6 en esta línea de investigación, por lo que el objetivo principal de este estudio fue clasificar a los pacientes diagnosticados de EPOC de acuerdo con GOLD 2019 y GesEPOC2017. Como objetivos secundarios, analizamos el tipo de riesgo, la gravedad clínica y la comparación del tratamiento pautado para el paciente con el recomendado por las guías y el grado de concordancia entre ambas.
Material y métodosSe trata de un estudio observacional transversal multicéntrico realizado en siete equipos de AP de la ciudad de Barcelona y de los municipios de Badalona y de Sant Adrià del Besòs. Se seleccionaron pacientes entre 35 y 85años diagnosticados de EPOC según el programa informático eCAP, con código diagnóstico J44.9 del CIM10 y con espirometría con FEV1/FVC post-broncodilatación <0,7. Los criterios de exclusión fueron: diagnóstico único de asma, fibrosis pulmonar o enfermedad terminal (con pronóstico de vida inferior a 6meses), patología cardíaca descompensada en los tres meses previos, pacientes institucionalizados o aquellos en que no fuera posible el contacto telefónico o que no aceptaran el consentimiento informado.
Se realizó un muestreo consecutivo de pacientes de cada equipo que cumplían criterios de selección. Una muestra de 439 individuos fue suficiente para estimar, con una confianza del 95% y una precisión de ±5 unidades porcentuales, un porcentaje poblacional que se previó que fuera alrededor del 50%. El porcentaje de reposiciones necesario se previó que fuera del 20% (se tuvo en cuenta una estimación de 5.000 pacientes diagnosticados de EPOC en la población estudiada).
Se elaboró una hoja de recogida de datos para el registro de las siguientes variables: edad, sexo, valores espirométricos, escala modificada de disnea por el Medical Research Council (mMRC), cuestionario CAT, clasificación del paciente EPOC según GOLD (A, B, C y D) y según GesEPOC2017 (no exacerbador, exacerbador con bronquitis crónica, exacerbador enfisematoso y ACO), índice BODEx, eosinofilia en sangre periférica, tratamiento crónico para la EPOC en la receta electrónica, tratamiento recomendado según guía GOLD 2019 y guía GesEPOC 2017, exacerbaciones durante el último año y comorbilidades asociadas. Los datos fueron recogidos a través del sistema informático eCAP. En caso de no disponer de toda la información en la historia clínica informatizada, se realizó contacto telefónico o presencial para completarla.
Se pidió consentimiento verbal informado por vía telefónica o presencial a todos los pacientes. Los datos fueron procesados en una base de datos anonimizada y la recogida de estos se realizó por los profesionales asistenciales de los equipos de referencia. Se aseguró la confidencialidad y el anonimato de los datos.
Respecto al análisis de datos, se han calculado estadísticos descriptivos para todas las variables consideradas, media (desviación típica) para las variables continuas con distribución normal, mediana (rango intercuartílico) en caso de distribución de no normal, y número (porcentaje) para las variables categóricas.
Las diferencias entre grupos se han analizado con el test de chi-cuadrado para datos categóricos, el test de Student para datos continuos y las correspondientes pruebas no paramétricas (U de Mann-Whitney) según el caso. Se ha utilizado el índice kappa para analizar la concordancia entre el tratamiento pautado y el recomendado por las guías GesEPOC y GOLD. Mediante este estadístico se valora la fracción de concordancia observada no debida al azar7.
El trabajo fue aprobado por el comité de ética de la Fundación Jordi Gol el 24 de octubre de 2018 con el código P18/186.
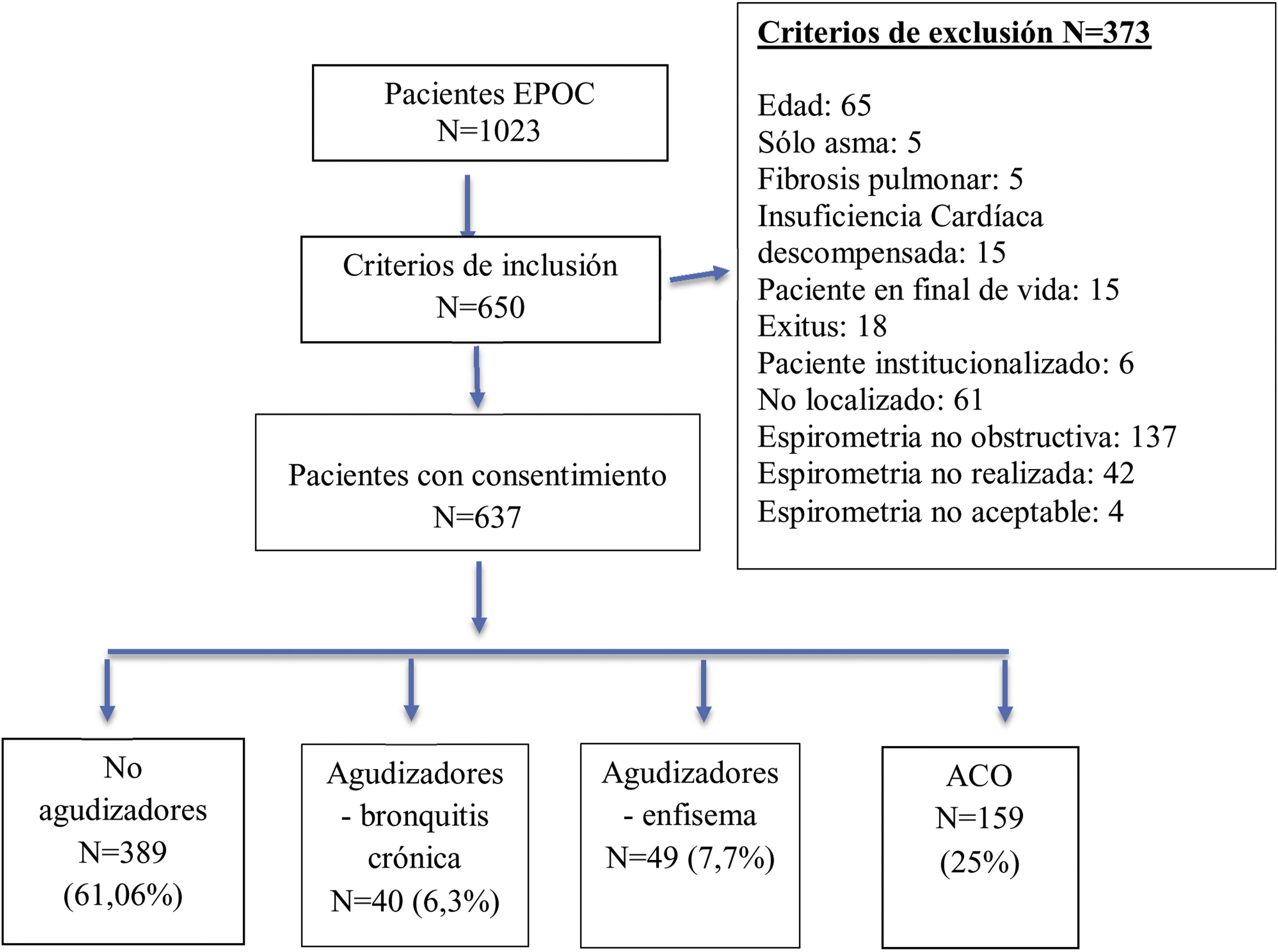
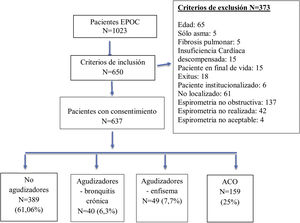
ResultadosDe un total de 1.023 historias clínicas registradas de EPOC en nuestras consultas de AP, 637 fueron validados para el análisis. El proceso de muestreo se describe con un diagrama de flujo STROBE en la figura 1.
Las características de la población a estudio se reflejan en la tabla 1. El 77,2% de los pacientes fueron hombres. El 43,5% de pacientes eran fumadores activos. El 84,6% presentaron alguna comorbilidad, siendo la más frecuente la hipertensión arterial (58,2%), seguida de la dislipemia (52%). El FEV1 post-broncodilatador medio fue del 61,92% (DE: 17,42). En la escala de disnea mMRC predominó el grado1 en el 43,8%. El 57,8% de los pacientes tenía un CAT <10. El 75,7% presentaron un índice BODEX leve. El 47,7% fueron GOLDA, y el fenotipo más frecuente fue el no agudizador (61,1%). El 17,6% presentan eosinofilia ≥300cél/μl.
Características de la población a estudio y clasificación según GOLD 2019 y GesEPOC 2017
| n (%) | IC 95% | |
|---|---|---|
| Edad (años) | 70,3 (DE 9,2) | (69,58-71,01) |
| Sexo | ||
| Varón | 492 (77,2) | (74,02-81,1) |
| Mujer | 145 (22,8) | (17,3-23,2) |
| Hábito tabáquico | ||
| Fumador | 277 (43,5) | (39,6-47,3) |
| No fumador | 45 (7,1) | (5,07-9,06) |
| Exfumador | 304 (47,7) | (43,8-51,6) |
| Desconocido | 11 (1,7) | (0,71-2,7) |
| Media de FEV1 | 61,92 (DE 17,42) | (60,6-63,3) |
| Escala mMRC | ||
| Grado 0 | 152 (25) | (21,5-28,3) |
| Grado 1 | 279 (43,8) | (39,9-47,6) |
| Grado 2 | 110 (17,3) | (14,3-20,2) |
| Grado 3 | 71 (11,1) | (8,7-13,6) |
| Grado 4 | 18 (2,8) | (1,5-4,1) |
| CAT | ||
| <10 | 368 (57,8) | (53-60) |
| ≥ 10 | 269 (42,2) | (38-46) |
| BODEX | ||
| Leve | 482 (75,7) | (72,3-79) |
| Moderado | 102 (16) | (13,2-18,8) |
| Grave | 42 (6,6) | (4,6-8,5) |
| Muy grave | 11 (1,7%) | (0,7-2,7) |
| Comorbilidades | 539 (84,6) | (81,8-87,4) |
| Hipertensión arterial | 371 (58,2) | (54-62) |
| Dislipemia | 331 (52) | (48-56) |
| Diabetes mellitus | 184 (28,9) | (25-32) |
| Insuficiencia cardíaca | 59 (9,3) | (7-12) |
| Asma | 51 (8) | (6-10) |
| SAHS | 61 (9,6) | (7-12) |
| Ansiedad | 101 (15,9) | (13-19) |
| Depresión | 60 (9,4) | (7-12) |
| Enfermedad renal crónica (FG <30) | 20 (3,1) | (2-5) |
| Antecedente de neumonía | 9 (1,4) | (0-2) |
| Hepatopatía crónica | 47 (7,4) | (5-9) |
| Obesidad | 127 (20) | (17-23) |
| Clasificación GOLD 2019 | ||
| A | 304 (47,7%) | (43,8-51,6) |
| B | 197 (30,9%) | (27,3-34,5) |
| C | 38 (6%) | (4,1-7,8) |
| D | 98 (15,4%) | (12,5-18,1) |
| Clasificación GesEPOC 2017 | ||
| No agudizador | 389 (61,06%) | (57,2-64,8) |
| Agudizador-bronquitis crónica | 40 (6,3%) | (4,3-8,1) |
| Agudizador-enfisema | 49 (7,7%) | (5,6-9,7) |
| ACO | 159 (25%):127 no agudizadores, 32 agudizadores | (21,5-28,3) |
| Eosinofilia | ||
| <150 cél/μl | 338 (53,1%) | (49,1-56,9) |
| 150-299 cél/μl | 187 (29,4%) | 27,6-34,8) |
| ≥ 300 cél/μl | 112 (17,6%) | (15,4-19,9) |
Del total de 637 pacientes, 121 (19%) fueron agudizadores según GesEPOC: 40 bronquitis crónica, 49 enfisema y 32 asma-EPOC (ACO).
En la tabla 2 se muestra la clasificación de los pacientes por fenotipos y grados de riesgo de acuerdo con GesEPOC. El 56,2% fueron de riesgo bajo y en este, el fenotipo más frecuente es el no agudizador (76%). El 70,6% de los pacientes con riesgo alto cumplían un único criterio.
Clasificación por fenotipos y grados de riesgo. Criterios utilizados para definir el tipo de riesgo según GesEPOC 2017
| Fenotipon (%, IC 95%) | Riesgo bajo n=358 (56,2%) | Riesgo alto n=279 (43,8%) | |
|---|---|---|---|
| Fenotipo no agudizador | 272 (76%; 71,5-80) | 117 (41,9%; 37,2-44,6) | 1 criterio n=197 (70,6%):• A: 70 (25,1%)• B: 65 (23,3%)• C: 62 (22,2%)2 criterios n=58 (20,8%)• A+B: 24 (8,6%)• B+C: 15 (5,4%)• A+C: 19 (6,8%)3 criterios n=24 (8,6%) |
| Fenotipo agudizador bronquitis | 0 | 40 (14,3%; 11,5-18,1) | |
| Fenotipo agudizador enfisema | 0 | 49 (17,6%; 14,3-20,8) | |
| Fenotipo ACO | 86 (24%; 19,9-28,2) | 73 (26,2%; 24,8-29) | |
A: FEV1 postBD <50%; B: mMRC >2 o 2 con tratamiento; C: ≥2 exacerbaciones moderadas o 1 ingreso.
Fenotipo ACO: Alrededor del 25% son ACO (tablas 2 y 3), de los cuales el 54,1% pertenecen a riesgo bajo. Del total de ACO, el 54,7% presentaban CAT <10. Respecto al BODEx, el 74,8% son leves. En la tabla 3 se reflejan los criterios por los cuales los pacientes fueron clasificados como fenotipo mixto, destacando en el 70,4% la eosinofilia.
Descripción de los pacientes EPOC fenotipo asma-EPOC (ACO)
| n (%) | IC 95% | |
|---|---|---|
| Edad (media años, DE) | ||
| Género (n, %) | 69,3 (9,13) | (67,8-70,7) |
| Hombre | 32 (20,1) | (16-24) |
| Mujer | 127 (79,9) | (74-86) |
| Hábito tabáquico (n, %) | ||
| Fumador | 9 (5,7) | (2-9,2) |
| Desconocido | 74 (46,5) | (38,7-54,3) |
| No fumador | 75 (47,2) | (39,3-55) |
| Exfumador | 1 (0,6) | (0,6-1,8) |
| FEV1(media, DE) | 61,6 (18) | (58,8-64,5) |
| Eosinofilia (media, DE) | 347,19 (218,3) | (313-381) |
| Cuestionario CAT | ||
| <10 | 87 (54,7) | (47-62) |
| ≥ 10 | 72 (45,3) | (37-53) |
| BODEx | ||
| Leve | 119 (74,8) | (68-81) |
| Moderado | 27 (17) | (11,1-22,8) |
| Grave | 10 (6,3) | (2,4-10,1) |
| Muy grave | 3 (1,9) | (0,2-4) |
| Pacientes que cumplen cada criterio solo o en combinación | ||
| Eosinofilia ≥ 300 | 112(70,4) | (67,2-72,1) |
| Asma | 42 (26,4) | (23,4-28,6) |
| PBD de 15% y 400 cc | 25 (15,7) | (14-16,2) |
| Pacientes que cumplen >1 criterio | ||
| Asma +eosinofilia +PBD | 0 | |
| Asma +eosinofilia | 10 (6,3) | (4,8-9,1) |
| Asma +PBD | 2 (1,3) | (0,8-2,6) |
| Eosinofilia +PBD | 8 (5) | (3,3-6,9) |
| Pacientes que cumplen solo un criterio | ||
| Asma | 30(18,9) | (15,8-21,3) |
| Eosinofilia | 94 (59,1) | (55,2-62,3) |
| PBD | 15 (9,4) | (7,1-11,6) |
Eosinofilia: ≥ 300 cél/μl; PBD: prueba broncodilatadora del 15% y 400cc.
Los grupos de fármacos prescritos, solos o en combinación, fueron: LAMA 54,6%, LABA 53,6%, corticoides inhalados (CI) 35%, SABA 14%, SAMA 15,7%, teofilina 0,30%, mucolítico 0,20%, roflumilast y macrólidos 0,60%, respectivamente. El 20,6% de los pacientes no tenían prescrito ningún tratamiento, habiendo diferencias significativas entre los diferentes estadios de la clasificación GOLD, los diferentes fenotipos según GesEPOC y entre los diferentes tipos de riesgo (tablas 4 y 5).
Tratamiento basal de los pacientes clasificados por GOLD
| Totaln=637 | GOLD An=304 (47,7%) | GOLD Bn=197 (30,9%) | GOLD Cn=38 (6%) | GOLD Dn=98 (15,4) | p | |
|---|---|---|---|---|---|---|
| Patrones de tratamiento, n (%, IC 95%) | ||||||
| Sin tratamiento | 131 (20,6%;17,4-23,7) | 95 (31,3%; 26-36,5) | 27 (13,7%; 11,3-17,7) | 5 (13,2%; 1,9-24,4) | 4 (4,1%; 0,1-8,1) | <0,001 |
| SABA | 3 (0,5; 0,06-1) | 2 (0,7%; 0,2-1,6) | 1 (0,5%; 0,5-1,5) | 0 | 0 | NS |
| SAMA | 36 (5,7%; 3,8-7,4) | 16 (5,3%; 2,7-7,7) | 16 (8,1%; 4,2-11,9) | 3 (7,9%; 1,11-16,8) | 1 (1%; 1-3) | NS |
| SABA +SAMA | 5 (0,8%; 0,1-1,5) | 1 (0,3; 0,3-0,9) | 2 (1%; 0,4-2,4) | 0 | 2 (2%; 0,8-4,8) | NS |
| LABA | 31 (4,9%; 3,1-6,5) | 15 (4,9%; 2,5-7,3) | 9 (4,6%; 1,6-7,5) | 4 (10,5%; 0,3-20,7) | 3 (3,1%; 0,4-6,5) | NS |
| LAMA | 104 (16,3%; 13,4-19,2) | 58 (19,1%; 4,6-23,5) | 29 (14,7%; 9,7-19,7) | 4 (10,5%; 0,3-20,7) | 13 (13,3%; 6,4-20,1) | NS |
| LABA +LAMA | 105 (16,5%; 13,6-19,4) | 35 (11,5%; 7,9-15,1) | 35 (17,8%; 12,3-23,1) | 6 (15,8%; 3,6-27,9) | 29 (29,6%; 20,4-38,7) | <0,001 |
| CI | 10 (1,6%; 0,6-2,5) | 4 (1,3%; 0,03-2,6) | 4 (2%; 0,04-4) | 1 (2,6%; 2,7-7,9) | 1 (1%; 1-3) | NS |
| LAMA +CI | 14 (2,2%; 1,06-3,3) | 9 (3%; 1,05-4,8) | 4 (2%; 0,04-4) | 0 | 1 (1%; 1-3) | NS |
| LABA +CI | 75 (11,8%; 9,2-14,3) | 38 (12,5%; 8,7-16,2) | 22 (11,2%; 6,7-15,6) | 4 (10,5%; 0,3-20,7) | 11 (11,2%; 4,8-17,6) | NS |
| LABA +LAMA +CI | 125 (19,6%; 16,5-22,7) | 31 (10,2%; 6,7-13,6) | 49 (24,9%; 18,7-31) | 11 (28,9% 13,8-44) | 34 (34,7%; 25-44,2) | <0,001 |
| SABA +CI | 0 | 0 | 0 | 0 | 0 | |
| SAMA +CI | 0 | 0 | 0 | 0 | 0 | |
| SABA +SAMA +CI | 0 | 0 | 0 | 0 | 0 | |
CI: corticoides inhalados; LABA: β-2 adrenérgico de larga duración; LAMA: antimuscarínico de larga duración; SABA: β-2 adrenérgico de corta duración; SAMA: antimuscarínico de corta duración.
Tratamiento basal de los pacientes clasificados por GesEPOC según fenotipo
| TOTALN=637 | Agudizador bronquitisN=40 | Agudizador enfisemaN=49 | ACON=159 | No agudizador N=389 | p | |
|---|---|---|---|---|---|---|
| Tratamiento, n (%, IC 95%) | ||||||
| Sin tratamiento | 131 (20,6%; 17,4-23,7) | 1 (2,5%; 2,6-7,6) | 3 (6,1%; 0,8-13,1) | 23 (14,5%; 8,9-20) | 104 (26,7%; 22,3-31,2) | <0,001 |
| SABA | 89 (14%; 11,3-16,7) | 8 (20%; 7-33) | 10 (20,4%; 8,7-32,1) | 29 (18,2%; 12,2-24,3) | 42 (10,8%; 7,7-13,9) | 0,04 |
| SAMA | 100 (15,7%; 12,9-18,5) | 9 (22,5%; 9-36) | 11 (22,4%; 10,3-34,6) | 22 (13,8%; 8,4-19,3) | 58 (14,9%; 11,4-18,5) | NS |
| LABA | 335 (52,6%; 48,7-56,5) | 27 (67,5%; 52-82) | 39 (79,6%; 67,9-91,3) | 94 (59,1%; 51,4-66,8) | 175 (45%; 40-50) | 0,000 |
| LAMA | 348 (54,6%; 51-58,5) | 29 (72,5%; 58-87) | 38 (77,6%; 65,4-89,7) | 86 (54,1%; 46,3-61,9) | 195 (50,1%; 45,1-55) | 0,000 |
| CI | 223 (35%; 31,3-38,7) | 15 (37,5%; 21,8-53,2) | 22 (44,9%; 30,5-59,3) | 78 (49,1%; 41,2-56,9) | 108 (27,8%; 23,3-32,2) | 0,000 |
| Teofilina | 2 (0,3%; 0,1-0,7) | 0 | 1 (2%; 2,1-6,1) | 1 (0,6%; 0,6-1,9) | 0 | NS |
| Mucolítico | 1 (0,2%; 0,2-0,5) | 0 | 1 (2%; 2,1-6,1) | 0 | 0 | 0,017 |
| Roflumilast | 4 (0,6%; 0-1,2) | 1 (2,5; 2,6-7,6) | 2 (4,1%; 1,7-9,8) | 1 (0,6%; 0,6-1,9) | 0 | 0,007 |
| Macrólido | 4 (0,6%; 0-1,2) | 1 (2,5%; 2,6-7,6) | 1 (2%; 2,1-6,1) | 2 (1,3%; 0,5-3) | 0 | NS |
| Patrones de tratamiento, n (%, IC 95%) | ||||||
| Sin tratamiento | 131 (20,6%; 17,4-23,7) | 1 (2,5%; 2,6-7,6) | 3 (6,1%; 0,8-13) | 23 (14,5%; 8,9-19,9) | 104 (26,7%; 22,3-31,1) | 0,000 |
| SABA | 3 (0,5; 0,06-1) | 0 | 0 | 2 (1,3%; 0,5-3) | 1 (0,3%; 0,2-0,7) | NS |
| SAMA | 36 (5,7%; 3,8-7,4) | 3 (7,5%; 1,03-16) | 1 (2%; 2-6) | 8 (5%; 1,6-8,5) | 24 (6,2%; 3,7-8,5) | NS |
| SABA +SAMA | 5 (0,8%; 0,1-1,5) | 0 | 2 (4,1%; 1,6-9,8) | 1 (0,6%; 0,6-1,8) | 2 (0,5%; 0,2-1,2) | NS |
| LABA | 31 (4,9%; 3,1-6,5) | 2 (5%; 2-12) | 3 (6,1%; 0,8-13) | 8 (5%; 1,6-8,4) | 18 (4,6%; 2,5-6,7) | NS |
| LAMA | 104 (16,3%; 13,4-19,2) | 7 (17,5%; 5,1-29,8) | 5 (10,2%; 1,4-18 | 20 (12,6%; 7,3-17,8) | 72 (18,5%; 14,6-22,4) | 0,07 |
| LABA +LAMA | 105 (16,5%; 13,6-19,4) | 12 (30%; 15,1-44,8) | 14 (28,6%; 15,4-41,6) | 19 (11,9%; 6,8-17) | 60 (15,4%; 11,8-19,03) | 0,009 |
| CI | 10 (1,6%; 0,6-2,5) | 1 (2,5%; 2,5-7,5) | 0 | 4 (2,5%; 0,06-4,9) | 5 (1,3%; 0,1-2,4) | NS |
| LAMA +CI | 14 (2,2%; 1,06-3,3) | 1 (2,5%; 2,5-7,5) | 0 | 7 (4,4%; 1,1-7,6) | 6 (1,5%; 0,3-2,7) | NS |
| LABA +CI | 75 (11,8%; 9,2-14,3) | 4 (10%; 0,3-19,7) | 3 (6,1%; 0,8-13) | 27 (17%; 1,2-7,6) | 41 (10,5%; 7,4-13,6) | NS |
| LABA +LAMA +CI | 125 (19,6%; 16,5-22,7) | 9 (22,5%; 8,9-36) | 19 (38,8%; 24,6-52,9) | 40 (25,2%; 18,3-31,8) | 57 (14,7; 11,1-18,2)) | 0,000 |
| SABA +CI | 0 | 0 | 0 | 0 | 0 | |
| SAMA +CI | 0 | 0 | 0 | 0 | 0 | |
| SABA +SAMA +CI | 0 | 0 | 0 | 0 | 0 | |
CI: corticoides inhalados; LABA: β-2 adrenérgico de larga duración; LAMA: antimuscarínico de larga duración; SABA: β-2 adrenérgico de corta duración; SAMA: antimuscarínico de corta duración.
El patrón de tratamiento más frecuentemente prescrito fue LABA +LAMA +CI (19,6%), seguido de LAMA +LABA (16,5%) y LAMA (16,3%). LABA +CI se observó en el 11,8% de casos. Los broncodilatadores de acción corta más frecuentemente prescritos en monoterapia fueron los del grupo SAMA (5,7%) frente a SABA (0,5%) (tabla 4).
En cuanto al tratamiento en los grupos clasificados por GOLD (tabla 4), el fármaco más frecuentemente indicado fue LAMA en todos los grupos. Tanto en GOLDA como en GOLDB el porcentaje de pacientes con corticoides inhalados fue del 27% y del 40,1%, respectivamente. Del total de pacientes que no recibían ningún tratamiento, la mayoría se situaban en el grupo GOLDA.
Con relación al tratamiento basal de los pacientes clasificados por GesEPOC según fenotipo (tabla 5), destaca que el 50,9% de los pacientes ACO (sin tener en cuenta el riesgo) no llevan CI, y de estos, el 25,2% están tratados con triple terapia, mientras que el 14,5% no llevan ningún tipo de tratamiento. Aunque existen diferencias significativas en el tratamiento con CI entre fenotipos a favor de agudizadores y ACO, el 28% de pacientes no agudizadores llevan CI.
Con relación a los pacientes sin tratamiento, tanto en el grupo de bajo riesgo como en el de alto riesgo, el fenotipo más frecuente es el no agudizador.
Al comparar tipos de riesgo, destaca que en el riesgo alto el 5% no llevan tratamiento, frente al 32,7% en el riesgo bajo (p<0,001). También resalta que en el riesgo alto el 23,7% tienen pautado LABA +LAMA, frente el 10,9% en el bajo riesgo (p<0,001). En el caso de la triple terapia, el 35,1% de los pacientes con riesgo alto lo tienen pautado, mientras que es del 7,5% en el caso de riesgo bajo (p<0,001).
Si comparamos los tratamientos que tienen pautados los pacientes con lo que recomienda la GOLD, obtenemos que el 61% coinciden con una concordancia moderada (k=0,47), mientras que si comparamos con GesEPOC, el 53,8% coinciden (débil concordancia, con k=0,366). El 73,4% de los tratamientos coinciden entre ambos documentos (concordancia moderada, con k=0,580).
DiscusiónLos resultados de este estudio muestran que no siempre se cumplen las recomendaciones de las guías. Un total de 373 pacientes fueron motivo de exclusión, ya que 42 (4,1%) no tenían espirometría registrada en la historia clínica, 137 (13%) tenían espirometría no obstructiva y en 2 pacientes la espirometría no era aceptable por morfología. Es decir, detectamos 181 pacientes (17,6%) que no eran EPOC realmente. La proporción de hombres con diagnóstico de EPOC fue similar a la observada en la literatura previa8-10. Consideramos elevado el porcentaje de pacientes que continuaban fumando, lo que evidencia un fracaso en la primera línea de tratamiento. Un estudio español encontró una prevalencia de fumadores del 22%10,11, mientras que en el estudio IBERPOC el 15% lo eran12. Desconocemos si los pacientes que nunca habían fumado presentaban antecedentes de tabaquismo pasivo o exposición a humos; cabe señalar que la población estudiada reside en una región urbana. El estudio de Rotterdam muestra un porcentaje superior de pacientes sin antecedentes de exposición al tabaco (16,3%)13. La proporción de comorbilidades fue parecida a la observada en otros trabajos10,14, destacando también la hipertensión arterial15. En relación con la clasificación por GOLD, más de las tres cuartas partes de los pacientes se clasificaron como GOLDA yB. Un estudio realizado en AP muestra una prevalencia de GOLDA muy aproximada a la del nuestro6. Solo el 21,4% se clasificaron como GOLDC oD. Otros trabajos realizados en el ámbito hospitalario muestran una prevalencia de GOLDC yD mayor, lo que evidencia las diferencias entre los perfiles de pacientes atendidos en cada nivel asistencial10. Se observó un alto porcentaje de pacientes con corticoides inhalados tanto en GOLDA como en GOLDB, sin quedar clara su indicación.
El número total de pacientes agudizadores que hemos observado difiere del de otros trabajos, que encuentran un 46%16, pero estos datos son de consultas externas hospitalarias de neumología. Otros trabajos realizados en AP encuentran un 27,6%, pero estos están analizados sobre base de datos17 y no en revisión detallada de historias clínicas, como en nuestro estudio.
Destaca la mayor prevalencia de pacientes de riesgo bajo, nuevamente diferente a estudios de ámbito hospitalario, en el que el 79,8% tenían riesgo alto16. Más de la mitad de los pacientes se clasificaron como fenotipo no agudizador, coincidiendo con otros estudios9,16,18. Al igual que en el estudio FENEPOC19, encontramos una alta prevalencia del fenotipo ACO, siendo mayor que en otra literatura consultada18,20 Observamos como criterio diagnóstico más frecuente la eosinofilia en sangre periférica21, y esto nos pudo permitir tener este alto porcentaje de pacientes. El 15% de ACO se clasificaron solo por la prueba BD positiva, y este valor ha sido retirado en la última guía GesEPOC por el bajo valor diagnóstico.
Respecto a los pacientes que no tenían prescrito ningún tratamiento, el 79% eran no agudizadores y tenían una puntuación en la escala de CAT inferior a 10. Un estudio con 41.502 pacientes EPOC observó un valor parecido de pacientes sin tratamiento del 21,2%, y de estos, más de la mitad se clasificaban como GOLDA oB17. Cabe recordar que estas guías prácticamente no contemplan la opción de no tratar farmacológicamente, y podría ser una alternativa en algunos casos de muy poca sintomatología en estadios iniciales. A pesar de esto, el médico de familia debe profundizar en la anamnesis, ya que los pacientes respiratorios tienden a minimizar sus síntomas y a adaptarse a sus limitaciones, ocultando así su clínica. Hay que recordar que en el momento del diagnóstico el 50% de pacientes con EPOC pueden tener un grado de obstrucción moderada (GoldII)1 y la actividad física puede estar reducida con disnea ≥mMRC122.
En los pacientes con tratamiento farmacológico activo destaca el mayor uso de LAMA en monoterapia respecto a LABA, tal como se indica en las guías1,4. Otros estudios aportan datos contrarios17. La combinación LABA +CI, que es de elección en el tratamiento del fenotipo mixto, únicamente se observó en el 11,8% de casos. Estos valores pueden verse influidos por la falta de recomendación de la guía GesEPOC en fenotipar pacientes de bajo riesgo (más de la mitad de estos pacientes fueron clasificados de bajo riesgo en nuestro estudio); nosotros recomendamos hacerlo para beneficiar al paciente de un tratamiento más individualizado. El patrón de tratamiento más frecuentemente prescrito fue LABA +LAMA +CI (19,6%), a pesar de que la mayoría de los pacientes fueron clasificados como de bajo riesgo y no agudizadores. Un estudio observacional con base de datos de pacientes atendidos en AP en Cataluña reveló que un total de 34.018 personas con diagnóstico de EPOC iniciaron la triple terapia durante el periodo de observación, siendo el 70% de estos pacientes GOLDA oB17. Asimismo, estudios realizados en el Reino Unido, Suecia y Latinoamérica muestran como patrón de tratamiento más frecuente la triple terapia23-25. Este valor nos parece excesivo, y pensamos que puede estar influido por factores externos a la evidencia y al poco seguimiento de las guías. El 35% de los pacientes tenían prescrita corticoterapia inhalada de forma aislada o en combinación, dato aceptable e inferior a la bibliografía consultada16,17,26. En nuestro estudio, el porcentaje de corticoides inhalados solos o en combinación, en los grupos GOLD A y B, fue del 27% y del 40%, respectivamente. El estudio multicéntrico realizado en Latinoamérica muestra unos valores aproximados del 55% en GOLDA y del 56% en GOLDB25. Otro estudio en España, con 2.669 pacientes atendidos en el ámbito hospitalario, muestra un porcentaje de uso de corticoides del 37,3% y del 51,8% para GOLDA yB, respectivamente27. Estos valores de CI son inadecuados en estos estadios y se deberían reservar para estadiosC yD en pacientes agudizadores. Por eso deberíamos realizar un uso más racional de los CI, tal y como indican las guías y los documentos de consenso.
En primer lugar y de acuerdo con la literatura consultada, este es el primer estudio observacional multicéntrico realizado en el ámbito de la AP en España que clasifica a los pacientes con diagnóstico de EPOC y compara los tratamientos prescritos por los médicos de familia con los recomendados por las guías GOLD2019 y GesEPOC2017. Un hallazgo positivo de este estudio es la mayor precisión diagnóstica observada, habiendo únicamente un 16% de pacientes excluidos que no cumplían criterios diagnósticos por espirometría o que no se habían sometido a esta prueba. Este porcentaje no es despreciable y se debe mejorar, pero difiere significativamente del encontrado en la bibliografía consultada. Un estudio transversal multicéntrico en AP en Canadá observó un diagnóstico correcto únicamente en el 56% de 116 pacientes26. Estudios similares en España encontraron un 21,3% de pacientes diagnosticados sin cumplir el criterio espirométrico7.
En segundo lugar, este estudio pone de manifiesto la alta prevalencia de pacientes de bajo riesgo atendidos en las consultas de AP. Pese a que este trabajo no está exento de sesgos, pensamos que las características observadas pueden aproximarse mejor al perfil de población asignada a nuestros centros. Destaca la alta proporción de fenotipo mixto, probablemente relacionada en parte con la laxitud que representa el criterio diagnóstico de eosinofilia periférica mayor o igual a 300cél/μl. En nuestro trabajo, el 59% de los pacientes con fenotipo mixto cumplían únicamente el criterio de eosinofilia en sangre periférica. Solo el 16,7% cumplían el criterio espirométrico, y ningún caso cumplía los tres criterios diagnósticos.
Nuestro estudio presenta algunas limitaciones. En primer lugar, al tratarse de un estudio observacional transversal, no podemos establecer relaciones de causalidad con los datos observados. Dado que la mayoría de información fue recogida a través de la historia clínica informatizada y a pesar de la supervisión periódica de la base de datos, es posible que haya una limitación intrínseca a toda auditoría clínica. Por otro lado, no se realizó un muestreo aleatorio y el número de participantes en cada centro fue desigual. No obstante, a pesar de estas limitaciones, creemos que la muestra es representativa del paciente EPOC en AP.
ConclusionesEste estudio en AP muestra una alta proporción de pacientes EPOC de bajo riesgo y no exacerbadores. GOLDA predomina si utilizamos dicha clasificación, y el fenotipo no exacerbador es el más frecuente en la clasificación GesEPOC. Se observó una alta proporción de fenotipo mixto asma-EPOC. También un bajo porcentaje de pacientes con corticoides inhalados, comparado con otros estudios. Creemos que debemos mejorar la concordancia de nuestros tratamientos con las guías terapéuticas establecidas.
FinanciaciónNo existió ningún tipo de financiación.
Conflicto de interesesXavier Flor Escriche declara haber recibido en los cinco últimos años honorarios por su participación en reuniones, congresos, charlas científicas o trabajos de investigación organizados por las siguientes industrias farmacéuticas: AstraZeneca, Boehringer-Ingelheim, Chiesi, Laboratorios Dr. Esteve, GlaxoSmithKline, MSD, Novartis, Pfizer, Teva, Takeda, Mundipharma, Unión y Orión. Silvia Álvarez Álvarez declara haber recibido en los cinco últimos años honorarios por su participación en reuniones, congresos, charlas científicas o trabajos de investigación organizados por las siguientes industrias farmacéuticas: AstraZeneca, Boehringer-Ingelheim, Chiesi, GlaxoSmithKline, MSD, Novartis, Teva, Mundipharma y Orión. El resto de autores no tienen conflicto de intereses.
CAP Chafarinas, Barcelona: Xavier Flor-Escriche, Ana Sanz Bas, Valeria Zamora Putin, Paolo Alessandro Cabeza Martínez, Laia Bes Roig, Abraham Maté San Miguel, Elias Galán Monroy, Cristina González Moreno, Clara Martínez Perez.
CAP Sant Roc, Badalona: Sílvia Álvarez Álvarez, Núria Curós Bernet, Eva Muñoz Mata, Judit Llussà Arboix, Cristina Domènech Tura, Lucía Arias Alonso, Antía Fraga Fraga, Gemma Quiñones Pérez, Júlia Moser Ganduxer, German Portela Rosado, Clara Flamarich Gol, Mar Aguilar Giralt, Ester Cano Costa, Víctor Espinosa Buendía, Sandra Maneus Quintela, Lucas Gómez Chereguini, Ana Maura Prat, Roger Barba Padrós, Francisco Antonio Blazquez Cerrillo, María Claustre Palacios Moliner, Alba García Zaera.
CAP Gorg. Badalona: Ana Altaba Barceló, Francisco Javier Merlo Grau, Emma Gil Cardona.
CAP Dr. Barraquer, Sant Adrià del Besòs: Marta Morera García.
CAP Casernes, Barcelona: Carolina Carrillo Aparicio.
CAP Via Barcino, Barcelona: Joan Juvanteny Gorgals, Mireia González Rodríguez.
CAP Horta 7F, Barcelona: Judit Méndez Gómez.
Técnica de salud de la Unidad Docente de Medicina Familiar y Comunitaria de Barcelona: María Isabel Fernández San Martín.
Fundació IDIAP Jordi Gol, Barcelona: Mónica Monteagudo Zaragoza.