Una de las principales características de una buena combinación farmacológica es la sinergia. Existe en el mercado, desde hace relativamente poco tiempo, una nueva combinación analgésica de ibuprofeno, un antiinflamatorio no esteroideo (AINE) muy usado en la práctica médica diaria por su buen cociente de eficacia y seguridad, y codeína, un opiáceo menor muy utilizado como segundo escalón analgésico en combinación. Hemos realizado una revisión en MEDLINE de los principales estudios publicados en la literatura médica en cuanto a eficacia y seguridad de ambos principios activos por separado, para finalizar con una aproximación tanto de la experiencia clínica mostrada en estudios con combinaciones analgésicas en general, como en las hipótesis de un posible sinergismo entre AINE y opiáceos.
One of the principal characteristics of a good pharmacological combination is drug synergism. A new analgesic combination of ibuprofen, a non-steroidal anti-inflammatory drug, used frequently in clinical practice due to good quotient of efficacy and safety, and codeine, a minor opiate used very much as second analgesic step in combination, has recently come on the market. We have conducted a review in MEDLINE of the principal studies published in the medical literature as regards the efficacy and safety of both drugs separately and finally, a review of the clinical experience showed in studies with analgesic combinations in general and on the hypothesis of a possible drug synergism between NSAIDs and Opiates.
En el tratamiento del dolor, usar una combinación de analgésicos con mecanismos de acción diferentes ofrece varias ventajas con relación a utilizar solamente un principio activo de forma aislada. Por un lado, el hecho de combatir el dolor a través de caminos diferentes es una estrategia de optimización en la eficacia terapéutica, y por otro, en el caso de un posible sinergismo, obtendríamos la misma eficacia con dosis menores de ambos principios activos, con lo que se minimizaría la aparición de efectos adversos, optimizando así la seguridad.
El beneficio de la combinación analgésica ha sido probado en numerosos ensayos clínicos y son muchas las sociedades y asociaciones que los recomiendan en sus guías clínicas de consenso1. En la práctica clínica habitual, la combinación de analgésicos es un hecho bien conocido y extendido, sobre todo en el ámbito de los cuidados post-operatorios y en el dolor crónico2.
La elección de una determinada combinación analgésica no es caprichosa. Lo adecuado sería unir moléculas que presenten mecanismos de acción efectivos pero diferentes y, además, que no compitan entre ellos metabólicamente. Lo ideal sería que, además de esto, tuvieran sinergia farmacológica, es decir, que el efecto resultante supere a la simple suma del efecto de los 2 fármacos por separado.
En el presente artículo se revisa la combinación de ibuprofeno (un antiinflamatorio no esteroideo [AINE] muy utilizado por su notable cociente eficacia/seguridad) y codeína (un opiáceo menor, que junto con tramadol, lidera el segundo escalón analgésico del conocido protocolo de la OMS).
Mecanismo de acción del ibuprofenoEl ibuprofeno es un fármaco antiinflamatorio no esteroideo, derivado del ácido propiónico, cuyo principal mecanismo antipirético, analgésico y antiinflamatorio radica en el bloqueo de la síntesis de prostaglandinas a través de la inhibición de las isoformas de la enzima ciclooxigenasa 1 y 2 (COX-1 y COX-2). El ibuprofeno se une de forma reversible a la COX-1, a diferencia de la aspirina que se une de forma irreversible. La COX-1 y la COX-2 tienen el mismo peso molecular y son muy similares en su estructura. Sin embargo, el sitio activo de la COX-1 es más pequeño que el de la COX-2. Esto implica que casi todos los AINE inhibidores de la COX-1 lo serán también de la COX-2. Por el contrario, muchos inhibidores de la COX-2 tendrán escaso poder bloqueante sobre la COX-13.
La inhibición de las COX no explica del todo el efecto antiinflamatorio de los AINE, ya que al inhibir dichas enzimas se evita cierto grado de vasodilatación y quimiotaxis, pero no todos los procesos que ocurren durante la inflamación. Además, existen prostaglandinas con cierta actividad antiinflamatoria. Por tanto, para explicar el fenómeno antiinflamatorio de los AINE debemos tener en cuenta que actúan otros mecanismos implicados además de la inhibición de las COX. Por ejemplo, algunos AINE inhiben la expresión o la actividad de algunas moléculas de adhesión que participan en el fenómeno inflamatorio. Otros AINE, sobre todo los salicilatos, producen una inhibición de ciertos factores de transcripción que activan una serie de mediadores inflamatorios, como puede ser la interleucina 1 (IL-1) o el factor de necrosis tumoral alfa (TNF-α). Otra parte significativa del efecto antiinflamatorio de los salicilatos se debe a la inducción de la liberación de adenosina, que posee propiedades antiinflamatorias.
El mecanismo de acción analgésico de los AINE probablemente sea también consecuencia directa de la inhibición de la síntesis de prostaglandinas3. Inicialmente fue propuesto un mecanismo de acción exclusivamente periférico, inhibiendo la formación de prostaglandinas en el tejido periférico inflamado. Sin embargo, desde hace bastantes años (Hanzlick, 1926) se barajaba la posibilidad de un mecanismo central analgésico. La expresión en el cerebro y medula espinal de las isoformas COX-1 y COX-2ha permitido dar mayor fiabilidad a dicha hipótesis4,5. Más recientemente se ha sugerido un mecanismo central en la médula espinal no solamente relacionado con el bloqueo de la síntesis de prostaglandinas a nivel central, sino también con posibles mecanismos adicionales de neuromodulación no relacionados con la inhibición de la ciclooxigenasa6,7.
En cuanto al mecanismo de acción antipirético, los AINE suprimen la elevación de prostaglandinas en el hipotálamo. Se sabe que en los procesos febriles se liberan una serie de citocinas. Estas citocinas incrementan la síntesis de prostaglandina E2 (PGE2) en el área hipotalámica y otras zonas del sistema nervioso central (SNC). La PGE2 aumenta el AMP cíclico (AMPc), estimulando al hipotálamo para elevar la temperatura corporal. Por lo tanto, al disminuir la producción de prostaglandinas por parte de los AINE, disminuye la fiebre.
Mecanismo de acción de la codeínaLa codeína es uno de los alcaloides que se encuentra en el opio. Su estructura original es la metilmorfina. Su efecto analgésico se basa en la capacidad del individuo para metabolizar la codeína (desmetilación) y convertirla en morfina. Como promedio, esto solamente ocurre en el 10% de la codeína ingerida. Por eso, la potencia analgésica de la codeína es unas diez veces menor que la de la morfina3. Además, al ser este proceso de desmetilación saturable, la codeína es considerada un opiáceo menor, con un techo analgésico demostrado en curvas de dosis/eficacia alrededor de los 60mg por vía parenteral, lo que quiere decir que a partir de dicha dosis no se conseguía aumentar el efecto analgésico aunque aumentáramos la dosis8. Es por ello que la codeína es considerada un fármaco con un perfil beneficio/riesgo positivo para el tratamiento de los dolores de intensidad suave-moderada con una menor probabilidad de efectos adversos si lo comparamos con los opiáceos mayores (morfina, fentanilo, etc.).
Aunque desde hacía muchos años ya existía la hipótesis de que el mecanismo de acción analgésico de los opiáceos se debía a una unión agonista sobre unos receptores, no fue hasta finales de los ochenta cuando se pudieron caracterizar9. Estos receptores opioides (μ, δ y κ) no solamente se encuentran a nivel central, ya que algunos autores han demostrado la presencia de los mismos en las terminaciones periféricas de las neuronas sensoriales10.
Aunque los estudios de unión de receptores permitieron postular la existencia de varios subtipos de receptores opioides, los datos obtenidos a partir de la clonación de los diferentes receptores no han permitido confirmar la existencia de los mencionados subtipos. La explicación podría ser por diferencias de acoplamiento una vez producido el ARN mensajero (ARNm).
Los receptores opioides pertenecen a la familia de receptores con 7 segmentos transmembrana, acoplados a proteínas G. Las neuronas opioides liberan péptidos endógenos que se unen a receptores neuronales de localización presináptica y bloquean la transmisión del estímulo nervioso. La unión del opioide al receptor provoca, mediante la proteína G que actúa como segundo mensajero, la inhibición de la adenilciclasa encargada de transformar el ATP en AMP cíclico (AMPc), disminuyendo así las concentraciones de AMPc intracelular. Además, los receptores opioides se relacionan con la apertura de canales de potasio y cierre de canales de calcio. Al abrirse los canales de potasio, se producirá una hiperpolarización de membrana, que provocará una reducción tanto en la descarga de potenciales de acción, como en la duración de los mismos y, en definitiva, una disminución de la capacidad del terminal presináptico para la liberación de neurotransmisores (como, por ejemplo, la sustancia P)11.
Eficacia y seguridad del ibuprofenoEl ibuprofeno, como todos los AINE, es antipirético, analgésico y antiinflamatorio (con excepción del paracetamol, que no es antiinflamatorio). La reacción adversa más común de los AINE (exceptuando el paracetamol) es la gastropatía por afectación de la mucosa gastrointestinal3. Ibuprofeno es uno de los AINE que posee un menor riesgo de gastropatía y nefropatía. Algunos estudios han citado un ligero incremento del riesgo cardiovascular con ibuprofeno aunque más bajo comparado con los coxibs o diclofenaco12. Además, el inicio del efecto analgésico parece ser más lento para los inhibidores de la COX-213.
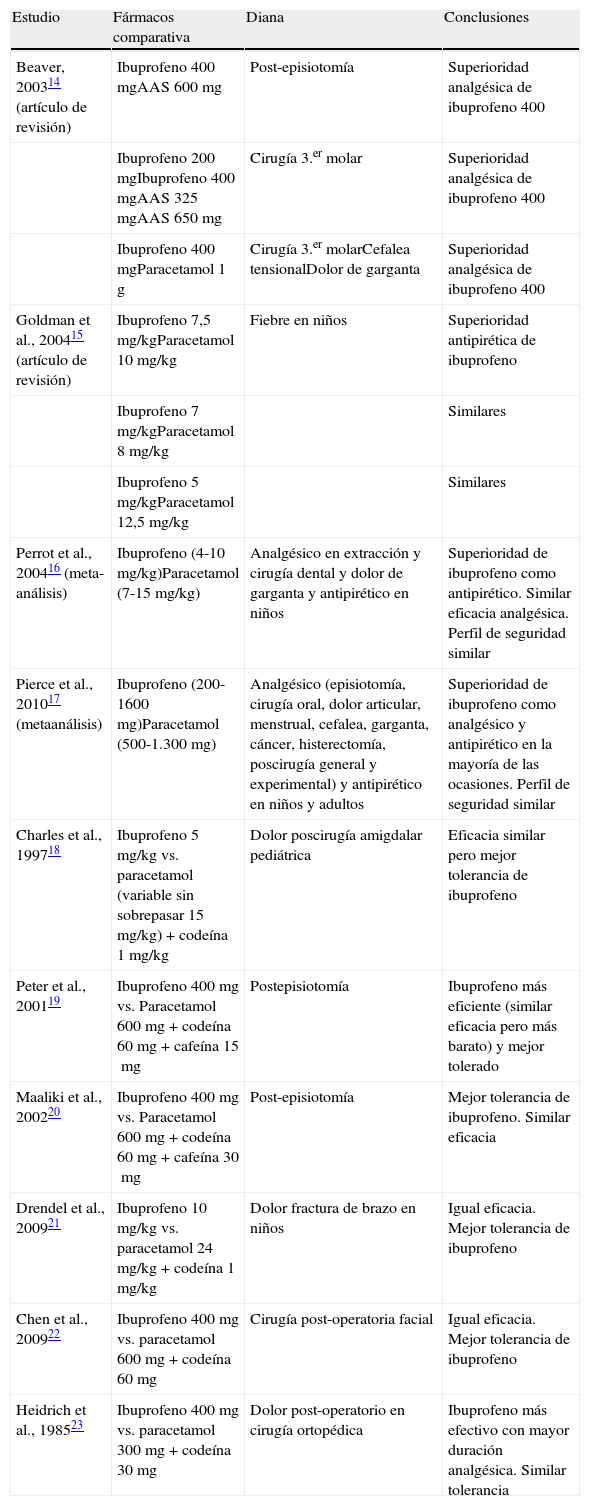
La eficacia analgésica de ibuprofeno ha sido estudiada en numerosos trabajos (tabla 1). Existen estudios que afirman que ibuprofeno es superior como analgésico que la aspirina en cirugía del tercer molar y post-episiotomía14. Otros trabajos confirman que el ibuprofeno es ligeramente más eficaz que el paracetamol en el tratamiento de la fiebre en niños15. Un meta-análisis reafirma lo anterior exponiendo que el ibuprofeno en niños es igual de eficaz que el paracetamol como analgésico pero más efectivo como antipirético16. Otro meta-análisis concluye que en la población adulta y en niños, el ibuprofeno parece ser ligeramente más eficaz en su efecto antipirético y analgésico comparado con paracetamol17.
Estudios de eficacia y tolerabilidad de ibuprofeno
| Estudio | Fármacos comparativa | Diana | Conclusiones |
| Beaver, 200314 (artículo de revisión) | Ibuprofeno 400mgAAS 600mg | Post-episiotomía | Superioridad analgésica de ibuprofeno 400 |
| Ibuprofeno 200mgIbuprofeno 400mgAAS 325mgAAS 650mg | Cirugía 3.er molar | Superioridad analgésica de ibuprofeno 400 | |
| Ibuprofeno 400mgParacetamol 1g | Cirugía 3.er molarCefalea tensionalDolor de garganta | Superioridad analgésica de ibuprofeno 400 | |
| Goldman et al., 200415 (artículo de revisión) | Ibuprofeno 7,5mg/kgParacetamol 10mg/kg | Fiebre en niños | Superioridad antipirética de ibuprofeno |
| Ibuprofeno 7mg/kgParacetamol 8mg/kg | Similares | ||
| Ibuprofeno 5mg/kgParacetamol 12,5mg/kg | Similares | ||
| Perrot et al., 200416 (meta-análisis) | Ibuprofeno (4-10mg/kg)Paracetamol (7-15mg/kg) | Analgésico en extracción y cirugía dental y dolor de garganta y antipirético en niños | Superioridad de ibuprofeno como antipirético. Similar eficacia analgésica. Perfil de seguridad similar |
| Pierce et al., 201017 (metaanálisis) | Ibuprofeno (200-1600mg)Paracetamol (500-1.300mg) | Analgésico (episiotomía, cirugía oral, dolor articular, menstrual, cefalea, garganta, cáncer, histerectomía, poscirugía general y experimental) y antipirético en niños y adultos | Superioridad de ibuprofeno como analgésico y antipirético en la mayoría de las ocasiones. Perfil de seguridad similar |
| Charles et al., 199718 | Ibuprofeno 5mg/kg vs. paracetamol (variable sin sobrepasar 15mg/kg)+codeína 1mg/kg | Dolor poscirugía amigdalar pediátrica | Eficacia similar pero mejor tolerancia de ibuprofeno |
| Peter et al., 200119 | Ibuprofeno 400mg vs. Paracetamol 600 mg+codeína 60 mg+cafeína 15mg | Postepisiotomía | Ibuprofeno más eficiente (similar eficacia pero más barato) y mejor tolerado |
| Maaliki et al., 200220 | Ibuprofeno 400mg vs. Paracetamol 600 mg+codeína 60 mg+cafeína 30mg | Post-episiotomía | Mejor tolerancia de ibuprofeno. Similar eficacia |
| Drendel et al., 200921 | Ibuprofeno 10mg/kg vs. paracetamol 24mg/kg+codeína 1mg/kg | Dolor fractura de brazo en niños | Igual eficacia. Mejor tolerancia de ibuprofeno |
| Chen et al., 200922 | Ibuprofeno 400mg vs. paracetamol 600 mg+codeína 60mg | Cirugía post-operatoria facial | Igual eficacia. Mejor tolerancia de ibuprofeno |
| Heidrich et al., 198523 | Ibuprofeno 400mg vs. paracetamol 300 mg+codeína 30mg | Dolor post-operatorio en cirugía ortopédica | Ibuprofeno más efectivo con mayor duración analgésica. Similar tolerancia |
El análisis de la eficacia de ibuprofeno ha ido más allá con estudios que lo comparan no solo con paracetamol sino con la asociación paracetamol codeína. En niños operados de amígdalas se observó una eficacia analgésica similar entre la combinación de paracetamol y codeína y el ibuprofeno pero mejor tolerancia de éste por menor incidencia estadísticamente significativa de náuseas18. En estudios para el control del dolor post-episiotomía se prefirió ibuprofeno a la combinación paracetamol-codeína-cafeína por ser más eficiente19 y tener menor aparición de efectos adversos19,20. En otro estudio en niños con fractura de brazo se observó que el ibuprofeno era, al menos, igual de efectivo que la combinación paracetamol-codeína y producía menor aparición de efectos adversos21. Se obtuvieron los mismos resultados en otro estudio para tratar el dolor post-operatorio en cirugía estética facial22. En otras ocasiones, la ventaja del ibuprofeno sobre la combinación paracetamol-codeína no se basó en una menor incidencia de efectos adversos, sino en una mayor duración de la acción analgésica para controlar el dolor en el post-operatorio de pacientes que recibieron cirugía ortopédica23.
Eficacia y seguridad de la codeínaLa codeína posee un claro efecto analgésico debido a su condición de profármaco que se transforma en morfina a través de un proceso de desmetilación hepática. Debido a que este proceso es saturable, posee un techo analgésico y, por consiguiente, es considerado por ello un opiáceo menor. Por lo tanto, la codeína, junto con tramadol (otro opiáceo menor que ha demostrado similar eficacia y tolerancia), son el referente opiáceo a asociar a los AINE en el segundo escalón de la escalera analgésica de la OMS24.
Es interesante observar que en estudios clínicos que comparan AINE+codeína con AINE solo, codeína sola y placebo, el tratamiento que está más cerca del placebo y que, por lo tanto, es más difícil de demostrar eficacia con respecto a él, es la codeína sola25.
Aparte de su efecto analgésico, la codeína posee un efecto antitusígeno, como la mayoría de opioides. De hecho, probablemente la codeína sea el fármaco antitusígeno más utilizado. Dicho efecto antitusígeno se alcanza con dosis subanalgésicas (la dosis antitusígena en adultos es de 10-20mg)3.
Entre sus efectos adversos más importantes se encuentra la sedación y los trastornos gastrointestinales (náuseas, estreñimiento). Debe usarse con precaución en la población anciana (por mayor sensibilidad a la sedación con mayor riesgo de depresión respiratoria y por la retención urinaria), en los asmáticos y pacientes con enfermedad pulmonar obstructiva crónica (EPOC), así como en la insuficiencia respiratoria, insuficiencia cardiaca, renal, hepática o hipotiroidismo. En dosis elevadas en la embarazada puede producir una prolongación del parto y en el neonato un síndrome de abstinencia3.
Sus efectos adversos se ven aumentados por el consumo de alcohol y otros depresores centrales, así como por el uso de anticolinérgicos (que aumentan el estreñimiento y la retención urinaria)3.
Por otro lado, el consumo de inductores o de inhibidores enzimáticos puede modificar la eficacia analgésica de la codeína, sobre todo en relación con la isoforma del citocromo P450 CYP2D6. Así, para un metabolizador lento del CYP2D6 (y el 7% de los caucásicos lo son) la codeína puede resultar ineficaz26 y para los metabolizadores ultrarrápidos del CYP2D6, producir un aumento de sus efectos adversos27.
Experiencia clínica con combinaciones analgésicasPara que la elección de una determinada combinación farmacológica analgésica sea adecuada hay que tener en cuenta los siguientes requisitos: por un lado, unir moléculas con mecanismos de acción analgésicos efectivos y diferentes, y por otro, que estos principios activos no compitan metabólicamente2. Con esta premisa, existen estudios que han evaluado la farmacocinética de la combinación ibuprofeno-codeína en diferentes dosis para llegar a la conclusión de que no existe interacción farmacocinética alguna entre estos 2 compuestos28,29. Además, se sugiere que la similar vida media observada entre la codeína y el ibuprofeno podría ser una ventaja para la combinación analgésica de ambos principios activos29.
Antes de evaluar el sinergismo entre ibuprofeno y codeína, se pensó en demostrar el efecto aditivo de la codeína en el paracetamol. Existen estudios que demuestran que, aunque con diferencias pequeñas pero estadísticamente significativas, la eficacia del paracetamol más la codeína supera a la del paracetamol solo, aunque con el inconveniente de que los efectos adversos eran significativamente mayores con la combinación cuando se utilizaba a dosis múltiple, pues en la primera dosis la tolerancia era similar30.
Existen estudios clínicos de otras combinaciones analgésicas de opiáceos parecidos a la codeína con ibuprofeno. Es el caso de la hidrocodona. En un estudio se compararon 15mg de hidrocodona+400mg de ibuprofeno con los componentes por separado y con placebo en mujeres con moderado o grave dolor post-operatorio de cirugía abdominal o ginecológica. La combinación fue significativamente superior al placebo y a los componentes por separado. Se habló en todo momento de efecto aditivo pero no de sinergia31. Sin embargo, la sinergia entre ibuprofeno e hidrocodona fue medida y observada más tarde en modelos experimentales de nocicepción en ratones32.
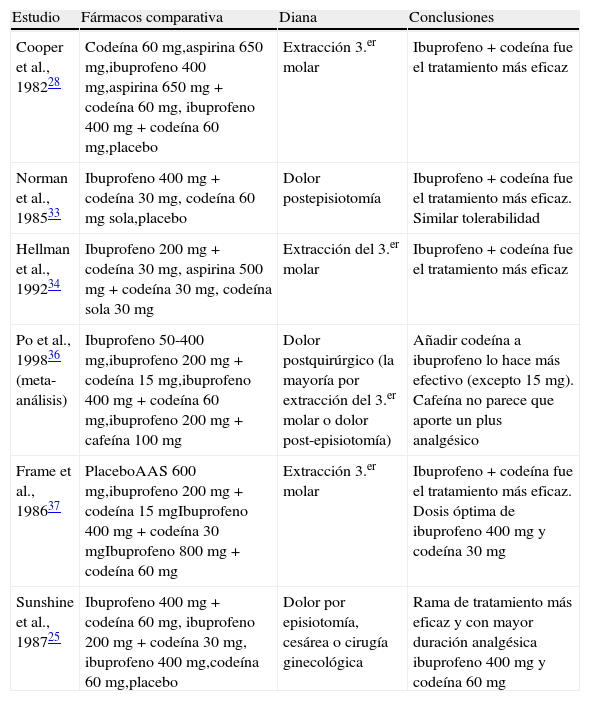
Los estudios clínicos con la combinación ibuprofeno y codeína comienzan a principios de los años ochenta (tabla 2). Se evaluó la eficacia analgésica en sujetos que habían tenido una extracción del tercer molar con distintos tratamientos: codeína 60mg, aspirina 650mg, ibuprofeno 400mg, aspirina 650mg+codeína 60mg, ibuprofeno 400mg+codeína 60mg o placebo. La combinación de ibuprofeno y codeína fue el tratamiento más eficaz (aunque no estadísticamente significativo con respecto al ibuprofeno solo), incluso ibuprofeno solo fue superior a la aspirina sola y alcanzó una eficacia analgésica incluso mayor a la combinación de aspirina y codeína28.
Estudios clínicos con la combinación ibuprofeno-codeína
| Estudio | Fármacos comparativa | Diana | Conclusiones |
| Cooper et al., 198228 | Codeína 60mg,aspirina 650mg,ibuprofeno 400mg,aspirina 650 mg+codeína 60mg, ibuprofeno 400 mg+codeína 60mg,placebo | Extracción 3.er molar | Ibuprofeno+codeína fue el tratamiento más eficaz |
| Norman et al., 198533 | Ibuprofeno 400 mg+codeína 30mg, codeína 60mg sola,placebo | Dolor postepisiotomía | Ibuprofeno+codeína fue el tratamiento más eficaz. Similar tolerabilidad |
| Hellman et al., 199234 | Ibuprofeno 200 mg+codeína 30mg, aspirina 500mg+codeína 30mg, codeína sola 30mg | Extracción del 3.er molar | Ibuprofeno+codeína fue el tratamiento más eficaz |
| Po et al., 199836 (meta-análisis) | Ibuprofeno 50-400mg,ibuprofeno 200 mg+codeína 15mg,ibuprofeno 400 mg+codeína 60mg,ibuprofeno 200 mg+cafeína 100mg | Dolor postquirúrgico (la mayoría por extracción del 3.er molar o dolor post-episiotomía) | Añadir codeína a ibuprofeno lo hace más efectivo (excepto 15mg). Cafeína no parece que aporte un plus analgésico |
| Frame et al., 198637 | PlaceboAAS 600mg,ibuprofeno 200 mg+codeína 15mgIbuprofeno 400 mg+codeína 30mgIbuprofeno 800 mg+codeína 60mg | Extracción 3.er molar | Ibuprofeno+codeína fue el tratamiento más eficaz. Dosis óptima de ibuprofeno 400mg y codeína 30mg |
| Sunshine et al., 198725 | Ibuprofeno 400 mg+codeína 60mg, ibuprofeno 200 mg+codeína 30mg, ibuprofeno 400mg,codeína 60mg,placebo | Dolor por episiotomía, cesárea o cirugía ginecológica | Rama de tratamiento más eficaz y con mayor duración analgésica ibuprofeno 400mg y codeína 60mg |
Otro estudio comparó la eficacia analgésica después de una episiotomía de la combinación ibuprofeno-codeína, codeína sola y placebo, resultando más eficaz la combinación33. Otro estudio posterior dio a la combinación ibuprofeno 200mg-codeína 30mg como la más eficaz en comparación con aspirina 500mg-codeína 30mg y codeína sola de 30mg en pacientes que tuvieron una extracción del tercer molar34.
En otro estudio se demostró que la combinación ibuprofeno-codeína producía una analgesia mayor estadísticamente significativa que la combinación paracetamol-codeína-cafeína, aunque las dosis de codeína eran distintas según los grupos (25,6mg de codeína en la combinación con 400mg de ibuprofeno versus 16mg de codeína en la combinación con 1g de paracetamol y 60mg de cafeína). La incidencia de efectos adversos fue similar en ambos grupos (en torno al 20%)35.
Un meta-análisis de finales de los años noventa evaluó la eficacia analgésica de ibuprofeno solo y en combinación con codeína o cafeína en el dolor posquirúrgico (la mayoría de ellos por extracción del tercer molar o dolor post-episiotomía). Los resultados indicaron que la combinación ibuprofeno-codeína aportaba un mayor efecto analgésico que el ibuprofeno solo pero solamente a partir de unas determinadas dosis de codeína. Es decir, la codeína en dosis bajas (15mg) no aportaba un plus analgésico (probablemente porque la codeína a estas dosis posee un efecto más antitusígeno que analgésico). Los resultados con cafeína son inciertos y probablemente no mejore la eficacia analgésica de ibuprofeno solo36.
Otro tema relacionado con la optimización de la combinación analgésica son las dosis. Para ello se han realizado estudios para clarificar cual dosis sería la óptima para la combinación ibuprofeno-codeína. Con este respecto, a mediados de los años ochenta, un estudio doble ciego controlado con placebo comparó 3 dosis de combinaciones entre ibuprofeno y codeína y otro brazo de tratamiento con aspirina. Los pacientes diana fueron aquellos a los que se le había extraído el tercer molar. La combinación ibuprofeno-codeína superó en eficacia a la aspirina y el placebo y la dosis más óptima en términos de minimización de aparición de efectos adversos fue ibuprofeno 400mg/codeína 30mg37.
Un año más tarde, un estudio comparó la eficacia analgésica de dosis única de los siguientes tratamientos para mujeres que habían sufrido una episiotomía, cesárea o cirugía ginecológica: Una combinación ibuprofeno 400mg+codeína 60mg, ibuprofeno 200mg+30mg de codeína, ibuprofeno 400mg solo, codeína 60mg sola o placebo. El resultado fue que la dosis más eficaz correspondió a la combinación ibuprofeno 400mg+codeína 60mg. Además, se observó que la adición de codeína confería mayor duración analgésica al ibuprofeno25.
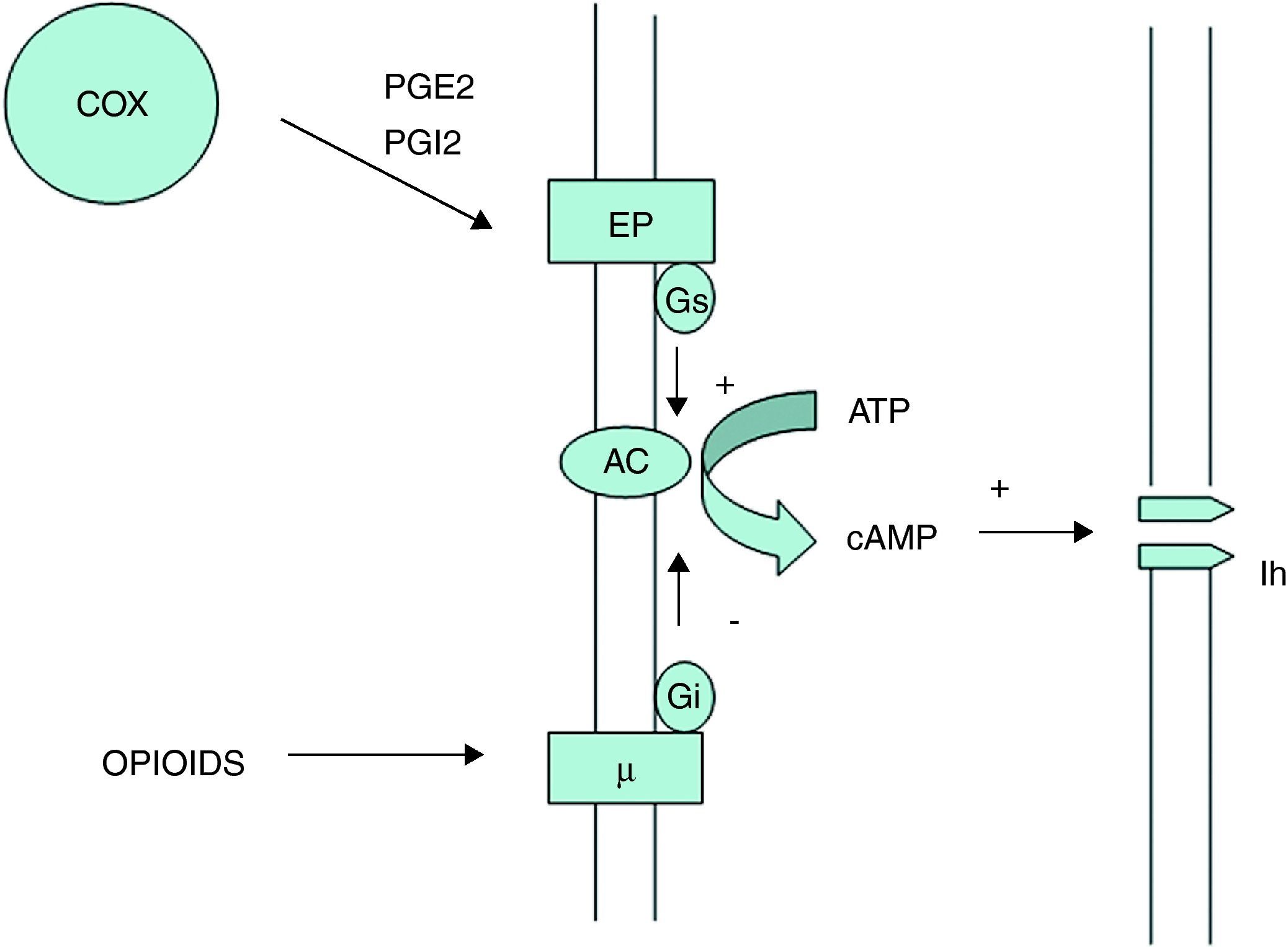
Hipótesis de sinergismo ibuprofeno-codeínaParece ser que los mecanismos moleculares que pueden explicar el sinergismo entre opioides y antiinflamatorios no esteroideos (AINE) son varios. Un primer mecanismo a nivel periférico ha sido demostrado experimentalmente en neuronas del trigémino y del ganglio nodoso (fig. 1). En estas neuronas aferentes, las prostaglandinas formadas por la vía de la ciclooxigenasa (particularmente PGE2 y PGI2) actúan sobre sus receptores prostanoides para estimular la vía de la adenilciclasa a través de proteínas G estimuladoras. La adenilciclasa cataliza la conversión del ATP en AMP cíclico (AMPc). Este AMPc formado se encarga de modular las corrientes catiónicas activadas por hiperpolarización (Ih), aumentando la excitabilidad y la frecuencia del potencial de acción del nervio. Por lo tanto, los AINE, al inhibir la producción de prostaglandinas, estarían inhibiendo de forma indirecta la activación de la adenilciclasa para formar AMPc y por tanto disminuyendo la excitabilidad del nervio sensitivo. Por otro lado, los opioides actúan sobre los receptores μ que funcionalmente antagonizan la vía de la adenilciclasa a través de proteínas G inhibitorias, disminuyendo su actividad y producción de AMPc, por lo que también disminuirían la excitabilidad de las neuronas aferentes.
Mecanismo de sinergia periférico entre AINE y opiáceos. AC: adenilciclasa; COX: ciclooxigenasa; EP: receptor prostanoide. Gi: proteína G inhibidora; Gs: proteína G estimuladora; Lh: corrientes catiónicas activadas por hiperpolarización. Las prostaglandinas formadas por la vía de la ciclooxigenasa (particularmente PGE2 y PGI2) actúan sobre sus receptores prostanoides para estimular la vía de la adenilciclasa a través de proteínas G estimuladoras. La adenilciclasa cataliza la conversión del ATP en AMP cíclico (AMPc). Este AMPc formado se encarga de modular las corrientes catiónicas activadas por hiperpolarización (Ih), aumentando la excitabilidad y la frecuencia del potencial de acción del nervio. Por lo tanto, los AINE, al inhibir la producción de prostaglandinas estarían inhibiendo de forma indirecta la activación de la adenilciclasa para formar AMPc y por lo tanto disminuyendo la excitabilidad del nervio sensitivo. Por otro lado, los opioides actúan sobre los receptores μ que funcionalmente antagonizan la vía de la adenilciclasa a través de proteínas G inhibitorias, disminuyendo su actividad y producción de AMPc, por lo que también disminuirían la excitabilidad de las neuronas aferentes.
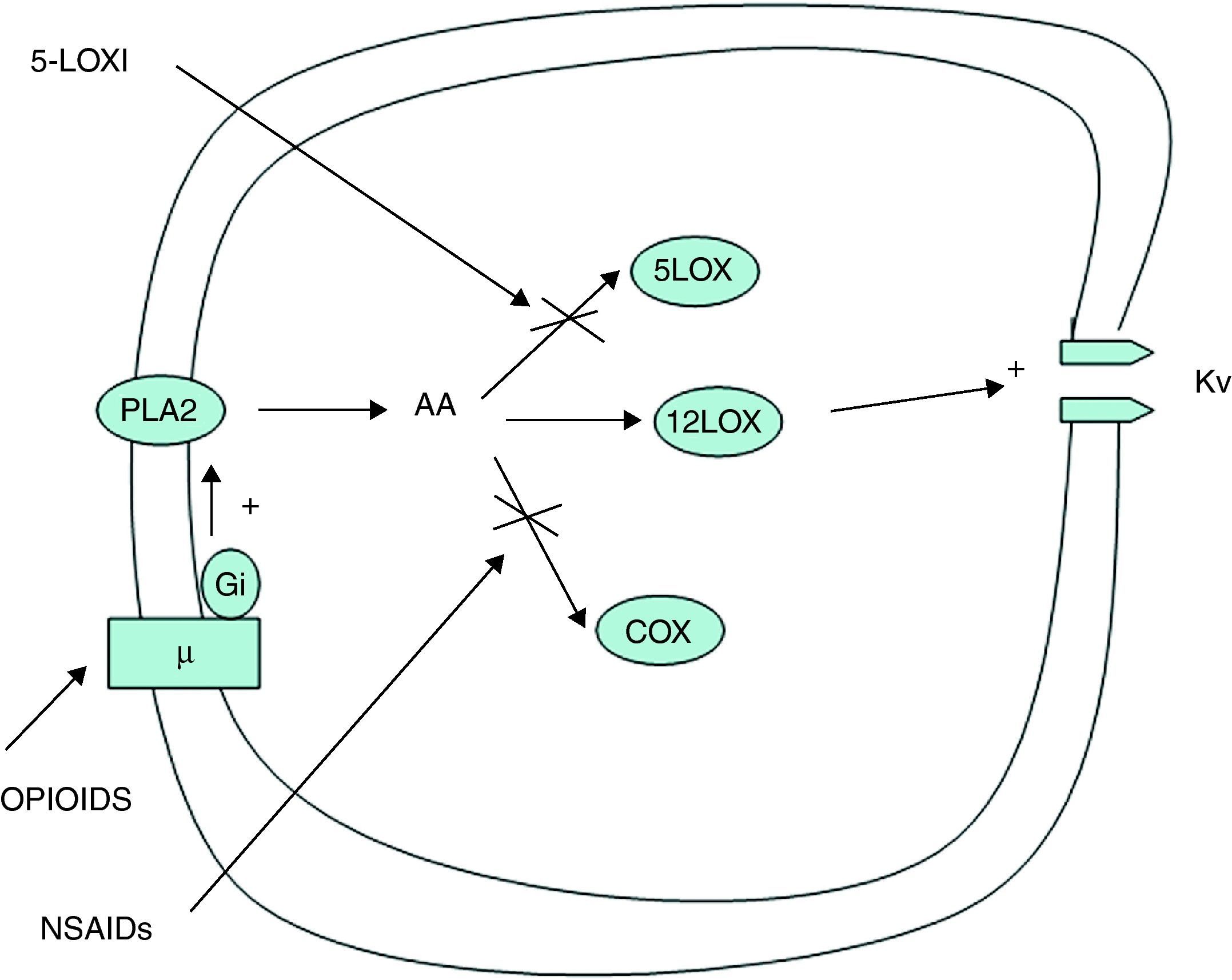
Un segundo mecanismo de sinergia podría explicarse a nivel central (fig. 2). Una región clave en la acción analgésica farmacológica en el sistema nervioso central es la llamada sustancia gris periacueductal mesencefálica (PAG). Esta región es rica en receptores opioides y posee una moderada densidad de receptores prostanoides. Esto sugiere que los AINE pueden producir analgesia y sinergia con opioides también por un mecanismo central. En principio se podría asumir y explicar este hecho en base a un mecanismo dependiente de prostaglandinas similar al mecanismo periférico descrito anteriormente. Sin embargo, se ha podido comprobar que la naloxona, antagonista opioide, es capaz de atenuar la analgesia producida por los AINE a nivel de la PAG, sugiriendo que estos producen analgesia en parte por un mecanismo endógeno opioide independiente de las prostaglandinas.
Mecanismo de sinergia central entre AINE y opiáceos.
AA: ácido araquidónico; COX: ciclooxigenasa; Gi: proteína G inhibidora; 5LOX: 5-lipooxigenasa; 12LOX: 12-lipooxigenasa; 5-LOXI: inhibidores de la 5-lipooxigenasa; NSAID: antiinflamatorios no esteroideos; PLA2: fosfolipasa A2; Kv: canales de potasio dependientes del voltaje. Los opioides a nivel de la sustancia gris periacueductal mesencefálica (PAG) estimulan a la enzima fosfolipasa A2. Esto da lugar a un aumento en la formación de 12-lipooxigenasa, 5-lipooxigenasa y ciclooxigenasa a través del ácido araquidónico. Los metabolitos de la 12-lipooxigenasa potencian la actividad dependiente del voltaje de los canales de potasio (Kv) que inhiben la respuesta neurotransmisora gabaérgica. Los AINE y los inhibidores de la 5-lipooxigenasa bloquean las vías alternativas de la fosfolipasa A2, por lo que a partir del ácido araquidónico se formaría más 12-lipooxigenasa, lo que potenciaría el efecto inhibidor del neurotransmisor GABA a través de la mayor activación de la conductancia de los canales de potasio Kv, favoreciendo, por lo tanto, la eficacia de los opioides.
Se ha propuesto que el efecto analgésico de los opioides en la PAG está relacionado con la supresión de la influencia inhibitoria del neurotransmisor GABA (ácido gamma-aminobutírico)38. El mecanismo responsable de esta acción supresora de los receptores μ opioides sobre la respuesta gabaérgica de las células nerviosas se relaciona con la inhibición de los canales de calcio y la apertura de la conductancia del potasio presináptico, ambos dependientes del voltaje. Todas estas acciones están mediadas de forma completa y directa por proteínas G inhibitorias y son independientes de la adenilciclasa. Los opioides a nivel de la PAG estimulan a la enzima fosfolipasa A2. Esto da lugar a un aumento en la formación de 12-lipooxigenasa, 5-lipooxigenasa y ciclooxigenasa a través del ácido araquidónico. Los metabolitos de la 12-lipooxigenasa potencian la actividad dependiente del voltaje de los canales de potasio (Kv) que inhiben la respuesta neurotransmisora gabaérgica. Los AINE y los inhibidores de la 5-lipooxigenasa bloquean las vías alternativas de la fosfolipasa A2, por lo que a partir del ácido araquidónico se formaría más 12-lipooxigenasa, lo que potenciaría el efecto inhibidor del neurotransmisor GABA a través de la mayor activación de la conductancia de los canales de potasio Kv, favoreciendo, por tanto, la eficacia de los opioides.
Este mecanismo es el que podría también explicar el sinergismo de los AINE sobre los opioides a nivel central, independientemente de la formación de prostaglandinas. Además, puede ser una hipótesis explicativa de la capacidad de la naloxona para disminuir la acción analgésica central de los AINE.
No todos los AINE poseen la misma capacidad analgésica central. Aunque tanto la ciclooxigenasa-1 (COX-1) como la ciclooxigenasa-2 (COX-2) están expresadas en el cerebro, parece ser que la COX-1 tiene una mayor importancia en el rol analgésico de los AINE a nivel central, y por lo tanto, en el sinergismo con los opioides.
Todavía no se sabe la veracidad de este mecanismo de inhibición presináptica mediado por la 12-lipooxigenasa en humanos ya que solamente se ha experimentado en neuronas de invertebrados. Lo que sí se cree es que dicho mecanismo no es exclusivo de la PAG, sino que en otras regiones del SNC donde los AINE producen analgesia el mecanismo debe ser similar, por ejemplo, en la espina dorsal de la médula espinal, ya que se ha demostrado que en esta zona la naloxona ha revertido los efectos analgésicos de los AINE. Aunque, en parte, en esta región también puede explicarse la analgesia por la vía dependiente de la síntesis de prostaglandinas. Es más, la densidad de receptores prostanoides es más alta en esta zona que en la región PAG.
Una vez expuestas estas hipótesis de mecanismos de acción, sería interesante en el futuro examinar la analgesia y el sinergismo que podrían realizar los inhibidores de la 5-lipooxigenasa (5-LOXI)39,40.
ConclusionesLa combinación ibuprofeno-codeína aporta 2 mecanismos diferentes (antiinflamatorio no esteroideo y opioide) habiéndose demostrado que no interaccionan entre ellos. Esto es una ventaja con respecto a combinaciones analgésicas como paracetamol-codeína ya que esta última no presenta propiedades antiinflamatorias. Por otro lado, ibuprofeno es de los mejores AINE en cuanto a cociente de eficacia y seguridad y la codeína posee una mejor tolerancia que los opiáceos mayores. Además, se han señalado diversas hipótesis de sinergismo farmacológico entre estas 2 sustancias: una de ellas, a través de un mecanismo del sistema nervioso periférico, relacionado con la inhibición de las prostaglandinas vía adenilciclasa para la formación de AMP cíclico. Otra hipótesis, del SNC, independiente del bloqueo de la síntesis de prostaglandinas y de la vía de la adenilciclasa, activando a la fosfolipasa A2 e inhibiendo el impulso nervioso a través de la conductancia de canales de potasio mediados por metabolitos de la 12-lipooxigenasa.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecimientos a Laboratorios Abbott.