INTRODUCCIÓN
El incremento anual de la incidencia de pacientes que precisan diálisis se estima en un 4-9% en los países occidentales1,2. Los pobres resultados y el alto coste de estas terapias obligan a considerar la prevención o retraso de pérdida de la función renal como una prioridad médica3.
El control de la tensión arterial (TA) y de la proteinuria en niveles lo más cercanos a la normalidad son los dos elementos determinantes del tratamiento de pacientes con insuficiencia renal crónica (IRC). El estudio The Modification of Diet in Renal Disease4,5 demostró que alcanzar cifras de TA inferiores a 130/85 mmHg retrasaba el deterioro de la función renal en pacientes con IRC. Recientemente las guías de tratamiento de la hipertensión arterial recomiendan como objetivo terapéutico en pacientes con IRC una TA de 130/80 mmHg, e incluso menor si la proteinuria es mayor de 1 g diario6-8. La intervención sobre el sistema renina-angiotensina (SRA) con los inhibidores de la enzima conversora de angiotensina (IECA) y los bloqueadores del receptor de la angiotensina (ARA) retrasan la progresión de la enfermedad renal en pacientes con IRC. La reducción de la proteinuria se considera clave como factor de renoproteccion9,10, y tanto IECA como ARA contribuyen a lograr este objetivo11-13. Sin embargo, el seguimiento de estas recomendaciones en la practica clínica diaria es todavía hoy día bajo. En la tercera edición de la National Health and Nutrition Examination Survey14, sólo el 11% de los pacientes con IRC tenía una TA menor de 130/85 mmHg y la proporción de pacientes que recibía un inhibidor del SRA era inferior al 50%. En España un estudio reciente demuestra que sólo un 17% de los pacientes con IRC tienen una TA menor de 130/80 mmHg y que el 75% recibe un fármaco inhibidor del SRA15.
FISIOPATOLOGÍA
Una vez que el filtrado glomerular (FG) cae por debajo de la mitad de su valor normal, se produce una pérdida progresiva de la función renal, independientemente de que la causa original esté presente o no. Este deterioro se caracteriza por proteinuria, hipertensión arterial (HTA) y una disminución progresiva del FG16. La pérdida de nefronas adquirida (nefropatía diabética, hipertensiva, arterioesclerótica) contribuye a la hipertensión y a la lesión glomerular progresiva del adulto17-19. Como respuesta, las nefronas restantes experimentan una serie de adaptaciones estructurales y funcionales que aumentan el FG de cada una de ellas. El más evidente de estos cambios maladaptativos son los cambios hemodinámicos dentro del glomérulo (hipertensión capilar glomerular), que conducen en última instancia a la esclerosis glomerular y muerte de la nefrona. La hipertensión capilar glomerular es mantenida por la presión arterial sistémica y la vasoconstricción de las arteriolas eferentes del glomérulo, efectos dependientes del efecto del sistema renina-angiotensina. Además del papel central de la angiotensina II en los cambios de la hemodinámica glomerular asociada a la pérdida de la nefrona, la angiotensina II tiene otros efectos no hemodinámicos (activación del factor-β de crecimiento, proliferación de células mesangiales y activación e infiltración de macrófagos) que son también importantes en la progresión de la insuficiencia renal. Dado este papel central de la angiotensina II en la progresión de la enfermedad renal, el tratamiento dirigido a la nefroprotección debe basarse en el bloqueo del sistema renina-angiotensina (SRA). Es importante reseñar que este bloqueo debe ser contemplado como complementario al tratamiento específico de la patología renal original (esteroides, inmunosupresores), que puede también ser requerido.
LOS IECA COMO AGENTES NEFROPROTECTORES
Nefropatía diabética
El papel nefroprotector de los inhibidores de la enzima de conversión de la angiotensina (IECA) fue demostrado inicialmente en animales. Posteriormente pequeños estudios pusieron de manifiesto el beneficio del tratamiento antihipertensivo, especialmente con IECA, en la progresión de la nefropatía diabética20. Aunque estos estudios demostraron cierto beneficio, su pequeño tamaño limitó su utilidad. Por el contrario, el Captopril Collaborative Study, publicado en 1993, demostró claramente la eficacia de un IECA (captopril) como nefroprotector, más allá de su efecto antihipertensivo, en diabéticos tipo 1 con nefropatía21. En este estudio, 409 pacientes diabéticos tipo 1 con nefropatía (proteinuria ≥ 0,5 g/día y creatinina sérica ≤ 2,5 mg/dl) fueron aleatorizados a recibir captopril o placebo (más terapia convencional en ambos grupos) durante una media de 3 años. El objetivo principal del estudio (doblar el nivel basal de la creatinina sérica) se redujo en un 48% en los pacientes tratados con captopril y el objetivo combinado (muerte, trasplante renal o necesidad de diálisis) se redujo en un 50%. En pacientes con diabetes tipo 1 y microalbuminuria, un metaanálisis de 12 estudios (698 pacientes) demostró que los IECA se asociaron a una reducción significativa ([odds ratio] OR de 0,38) en el riesgo de progresión a proteinuria franca y a un incremento en la probabilidad de normalización de la proteinuria (OR de 3,07)22. Sin embargo, comparados con otros tratamientos antihipertensivos, los IECA no demostraron efectos nefroprotectores consistentes en diabéticos tipo 2. Mientras que tres estudios demostraron una reducción de la proteinuria junto con la estabilización de la función renal23-25, otros estudios no encontraron tal asociación26-28. Los estudios United Kingdom Prospective Diabetes Study (UKPDS) y el Appropriate Blood Pressure Control in Diabetes (ABCD) tampoco pudieron demostrar ningún efecto beneficioso de los IECA en la reducción de la proteinuria o la estabilización de la función renal29,30. Sin embargo, varios estudios encontraron efectos beneficiosos de los IECA en la reducción de microalbuminuria o del riesgo de la progresión a macroalbuminuria26,31-35. En el más reciente de estos estudios, el Microalbuminuria, Cardiovascular, and Renal Outcomes-Heart Outcomes Prevention Evaluation (MICRO-HOPE), 3.577 pacientes diabéticos de más de 55 años, con antecedentes cardiovasculares o factores de riesgo cardiovascular y microalbuminuria fueron aleatorizados a tratamiento con ramipril o placebo (más tratamiento convencional en ambos grupos). El tratamiento con IECA redujo la progresión a proteinuria franca en un 24% (p = 0,027)31. Además, ramipril redujo significativamente el riesgo del objetivo primario combinado compuesto por infarto de miocardio, accidente cerebrovascular (ACVA) o muerte cardiovascular31. Al menos dos estudios36,37 investigaron el papel de los IECA en la prevención primaria de la microalbuminuria en pacientes con diabetes tipo 2. En el primer estudio, el tratamiento con el IECA ramipril en pacientes diabéticos tipo 2 normotensos y sin albuminuria se asoció a una reducción del 12,5% (contra placebo) en el riesgo de desarrollar microalbuminuria36. En el ensayo Bergamo Nephrologic Diabetes Complications Trial (BENEDICT)37, 1.204 pacientes con diabetes tipo 2, hipertensos y sin albuminuria, fueron tratados con trandolapril más verapamil, trandolapril, verapamil o placebo al menos durante 3 años. El objetivo principal del estudio que fue la microalbuminuria persistente fue retrasado en 2,6 y 2,1 veces entre los pacientes tratados con trandolapril más verapamil y los del grupo tratado sólo con trandolapril. El efecto del verapamil no fue diferente al del placebo37. En conclusión, basándonos en esta evidencia parece razonable recomendar el uso de IECA en todo paciente con diabetes tipo 1 con micro o macroalbuminuria. Los datos respecto al tratamiento con IECA en pacientes normoalbuminúricos son concluyentes. También sería razonable recomendar la terapia con IECA en pacientes con diabetes tipo 2 con microalbuminuria, y quizás para aquellos con normoalbuminuria. Los datos con respecto a pacientes con nefropatía franca no son concluyentes. Sin embargo, en vista de la asociación entre diabetes tipo 2 y enfermedades cardiovasculares, es justificable considerar el tratamiento con IECA en estos pacientes para reducir el riesgo cardiovascular.
Nefropatía no diabética
Varios estudios han valorado el papel de los IECA en la progresión de formas no-diabéticas de enfermedad renal. El Angiotensin-ConvertingEnzyme Inhibition in Progressive Renal Insufficiency (AIPRI)38 asignó aleatoriamente a 583 pacientes con insuficiencia renal crónica (IRC) en tratamiento con benazepril o placebo (más terapia convencional en ambos grupos), durante 3 años. Aunque el estudio encontró una reducción del 53% en el objetivo renal principal con benazepril, cifras previas de tensión arterial (TA) menores en este grupo imposibilitaron atribuir estos efectos beneficiosos a un efecto nefroprotector único del IECA. El estudio The Ramipril Efficacy in Nephropathy (REIN)39, aleatorizó 352 pacientes con IRC no-diabética a ramipril o placebo (más terapia convencional en ambos grupos), alcanzando un control similar de la TA en ambos grupos. Los pacientes con una proteinuria basal superior a 3 g al día que fueron tratados con ramipril presentaron un menor deterioro del FG comparados con los tratados con placebo (0,53 frente a 0,88 ml/minuto), lo que condujo a la suspensión del tratamiento con placebo. En la fase de extensión del estudio, los pacientes tratados inicialmente con placebo fueron tratados con ramipril, comprobándose una reducción significativa del deterioro del FG. Los pacientes del grupo ramipril continuaron con el tratamiento observando una mejoría adicional en la reducción de la caída del FG, alcanzando niveles similares a los asociados al envejecimiento normal40. Una pequeña parte de los pacientes que continuaron terapia con ramipril experimentaron un aumento en el FG41. En los pacientes del estudio REIN con proteinuria entre 1-3 g/día, seguidos durante una media de 31 meses, el tratamiento con IECA se asoció a una reducción significativa del riesgo de progresión a IR terminal42. El estudio Angiotensin-converting enzyme Inhibition in Progressive Renal Disease (AIPRD), un meta-análisis de 11 estudios que implicaban a 1.860 pacientes con IRC no-diabética y proteinuria, demostró una asociación inversa entre el tratamiento con IECA y el riesgo de progresión de la IR (OR de 0,69 y 0,70 para IR terminal o para el objetivo combinado de doblar la creatinina basal o de IR terminal, respectivamente)43. El estudio African American Study of Kidney disease and hipertensión (AASK) en afroamericanos hipertensos alcanzó la misma conclusión: ramipril era más nefroprotector que amlodipino o metoprolol44.
Antagonistas de los receptores de la angiotensina II como nefroprotectores
Los antagonistas de los receptores de la angiotensina II (ARA II) bloquean el receptor tipo 1 de la angiotensina II y tienen un perfil más benigno en cuanto a sus efectos secundarios. Dos grandes ensayos prospectivos y aleatorizados han demostrado que la interrupción del SRA con ARA II retrasa la progresión de la IRC en pacientes diabéticos tipo 2 con nefropatia45,46. El ensayo Irbesartan Diabetic Nephropathy Trial (IDNT) evaluó el efecto de irbesartán frente a la terapia convencional (placebo) o amlodipino en 1.715 pacientes hipertensos y diabéticos tipo 2 con nefropatía35. El objetivo principal compuesto era el tiempo transcurrido hasta alcanzar un primer acontecimiento (doblar la creatinina sérica basal, insuficiencia renal terminal o muerte). El tiempo medio de seguimiento fue de 2,6 años. El riesgo relativo de alcanzar el objetivo principal para los pacientes tratados con irbesartán fue de un 20% (p = 0,02) y de un 23% (p = 0,006) menor que el riesgo en los grupos de placebo y amlodipino respectivamente. El riesgo relativo de doblar la creatinina sérica basal en los pacientes tratados con irbesartán fue del 29% (p = 0,009) y del 39% (p < 0,001) menor que el riesgo en los grupos de placebo y amlodipino respectivamente. El riesgo relativo de insuficiencia renal terminal en los pacientes tratados con irbesartán fue un 17% menor que el riesgo de los que recibieron placebo y un 24% más bajo que los que recibieron amlodipino, pero las diferencias no alcanzaron significación estadística. En el estudio Reduction of End Points in NIDDM with the Angiotensin II Antagonist Losartan (RENAAL) se comparó el efecto de un ARA II (losartán) con el de placebo en 1.513 pacientes hipertensos y diabéticos 2 con nefropatía46. El objetivo principal de este estudio era similar al del IDNT, pero el tiempo medio de seguimiento fue más largo (3,4 años). La dosis de losartán fue de 100 mg/día en el 71% de los pacientes. El tratamiento con losartán redujo el riesgo relativo del objetivo principal en un 16% (p = 0,024). El riesgo de doblar la creatinina sérica basal, de insuficiencia renal terminal, y del objetivo combinado de insuficiencia renal terminal o muerte se redujeron un 25% (p = 0,002), 28% (p = 0,006) y 20% (p = 0,010) respectivamente. Dos ensayos más recientes, el Irbesartan in Patients with Type 2 diabetes and Microalbuminuria (IRMA2) y el Microalbuminuria Reduction with Valsartan (MARVAL) evaluaron el papel de los ARA II en la progresión de la proteinuria en pacientes diabéticos tipo 2 con microalbuminuria47,48. En el IRMA247, 590 pacientes hipertensos y diabéticos tipo 2 con microalbuminuria y una creatinina sérica basal ≤ 1,5 mg/dl en hombres y ≤ 1,1 mg/dl en mujeres fueron aleatorizados a recibir irbesartán (150 o 300 mg/día) o placebo durante 2 años. Treinta pacientes del grupo placebo desarrollaron nefropatía franca, frente a 10 en el grupo de irbesartán 300 mg/día (p < 0,001) y 19 en el grupo de irbesartán 150 mg/día (p = no significativo [ns]). En el último seguimiento, el 34% de los pacientes tratados con irbesartán 300 mg/día (p = 0,006 contra placebo), el 24% de los tratados con irbesartán 150 mg/día, y el 21% del grupo placebo habían alcanzado normoalbuminuria. En el estudio MARVAL38, 332 pacientes diabéticos tipo 2 con microalbuminuria fueron aleatorizados a recibir tratamiento con valsartán o amlodipino durante semanas. Valsartán redujo el índice de excreción de albúmina más que amlodipino (p < 0,001), y un mayor número de pacientes del grupo valsartán alcanzaron la normoalbuminuria (29,9% frente 14,5%). Aunque está pendiente la publicación de estudios clínicos que evalúen el papel de los ARA II en retardar la progresión de la IRC en pacientes con diabetes tipo 1 y pacientes no-diabéticos, los datos preliminares sugieren que los ARA II sean probablemente tan eficaces como los IECA. Finalmente, el estudio Diabetics Exposed to Telmisartan And Enalapril (DETAIL) comparó los efectos de un IECA (enalapril) y de un ARA II (telmisartán) en 250 pacientes con diabetes tipo 2 con micro o macroalbuminuria (índice urinario de excreción de albúmina 1-999 μg/minuto) e HTA ligera o moderada. El objetivo principal del estudio fue el cambio del FG en el momento de iniciar el tratamiento y al final del seguimiento (5 años). En él, el telmisartán no fue inferior a enalapril49.
Tratamiento combinado con IECA y ARA II
Varios estudios han mostrado un efecto añadido en la nefroprotección al combinar el tratamiento con IECA y ARA II, tales como TA50-52, prevención de la microalbuminuria50 y proteinuria51-54. El estudio COOPERATE55 demostró un efecto nefroprotector mayor del tratamiento combinado de IECA/ARA II que cualquiera de ellos por separado. En este estudio, 263 pacientes con IRC no-diabética fueron asignados aleatoriamente a losartán (89 pacientes), a trandolapril (86 pacientes), o a una combinación de losartán y de trandolapril (88 pacientes) durante 3 años. El objetivo compuesto principal era tiempo a doblar la creatinina sérica basal o insuficiencia renal terminal. Este objetivo fue alcanzado por 10 pacientes (11%) pertenecientes al grupo de terapia combinada, y 20 pacientes (23%) en cada uno de los grupos de tratamiento no combinado (p = 0,018 y p = 0,016 para la terapia combinada contra trandolapril o losartán respectivamente). De acuerdo con éstos resultados, parece que la progresión de la insuficiencia renal se puede reducir en mayor medida con la combinación de IECA y de ARA II. Sin embargo, se necesitan más ensayos clínicos antes de recomendar un uso sistemático de la terapia combinada en todos los pacientes con insuficiencia renal. Hasta entonces, el tratamiento combinado de IECA/ARA II se debe recomendar solamente en los pacientes en los que no se alcanzan los objetivos terapéuticos con la dosis máxima en monoterapia.
CONCLUSIÓN
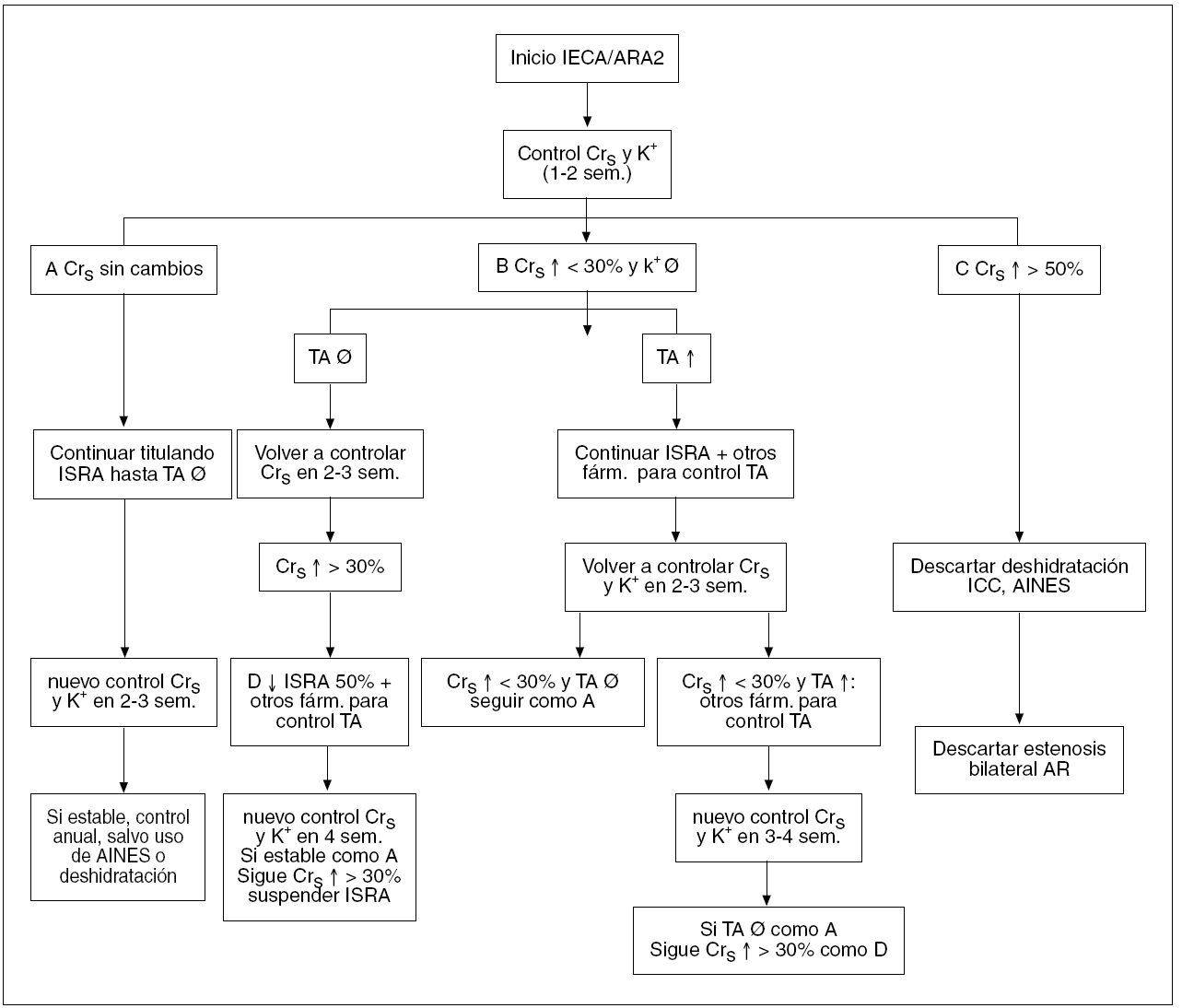
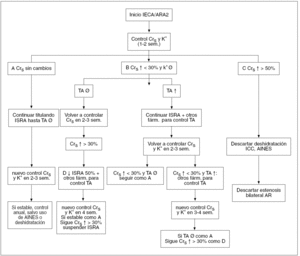
El bloqueo del SAR con IECA y ARA II ha revolucionado el tratamiento de pacientes con insuficiencia renal. Aunque el bloqueo del SRA puede retardar la progresión de la IRC, a menudo no es suficiente para prevenir su progresión. Para alcanzar una nefroprotección más eficaz, se requiere una estrategia definida y dirigida a diversos aspectos de la fisiopatología de la progresión de la insuficiencia renal. Además, una vez iniciado el tratamiento, se requiere una supervisión frecuente para asegurar el logro de los objetivos marcados (TA, proteinuria, índice de la caída del FG) y prevenir efectos secundarios como hiperpotasemia o incremento continuo de la creatinina sérica (fig. 1)56.
Figura 1. Esquema de seguimiento de pacientes tratados con inhibidores de la enzima de conversión de la angiotensina (IECA) o antagonistas de los receptores de la angiotensina II (ARA II), en función de la creatinina sérica, niveles séricos de potasio y tensión arterial. AINE: antiinflamatorios no esteroideos; AR: arterias renales; Crs: creatinina sérica; farm: fármacos; : incremento; ¬: descenso; ICC: insuficiencia cardíaca; ISRA: inhibidores del sistema renina angiotensina (IECA o ARA 2); K+: niveles séricos de potasio; sem: semanas; TA: tensión arterial.
Por otra parte, todavía hoy día muchos pacientes no se benefician de terapias de nefroprotección actualmente disponibles y que se han demostrado eficaces. Es papel del médico identificar y tratar a un mayor número de pacientes que pueden beneficiarse del tratamiento con bloqueadores del SRA, retrasando el deterioro de la función renal y disminuyendo el número de pacientes que precisarán tratamiento de sustitución de la función renal (diálisis y trasplante renal).
Correspondencia: C. López García.
Centro de Salud Juan de Austria.
Av. Juan de Austria, 39.
28805 Alcalá de Henares. Madrid.
Recibido el 29-01-2007; aceptado para su publicación el 18-09-2007.