INTRODUCCIÓN
En España, entre un 10 y un 15% de las personas de más de 15 años presentan enfermedades reumáticas, entre las cuales destaca por su mayor incidencia la artrosis. Esta patología es la mayor causa de dolor y de disfunción en pacientes por encima de los 65 años1 y tiene un importante impacto socioeconómico fuera y dentro de España. La prevalencia de la artrosis asintomática en la población española se estima en un 43%, con una diferencia notable entre sexos, con un porcentaje del 29,4% en hombres y del 52,3% en mujeres, y la de la artrosis sintomática en un 10,2%, subiendo hasta casi un 35% en los grupos de edad mayores de 65 años2.
La artrosis es una artropatía degenerativa, inflamatoria y crónica, en la que influyen factores genéticos, hormonales y ambientales y que, a su vez, es expresión de un grupo heterogéneo de patologías de etiología multifactorial, con manifestaciones biológicas, morfológicas y clínicas similares3. Afecta a los tejidos articulares, incluyendo el cartílago, el hueso subcondral y la membrana sinovial, donde se producen la mayoría de los cambios durante el curso de la enfermedad. La discapacidad atribuible a la artrosis de rodilla es equivalente a la causada por las enfermedades cardíacas, y mayor que la provocada por cualquier otra patología en ancianos.
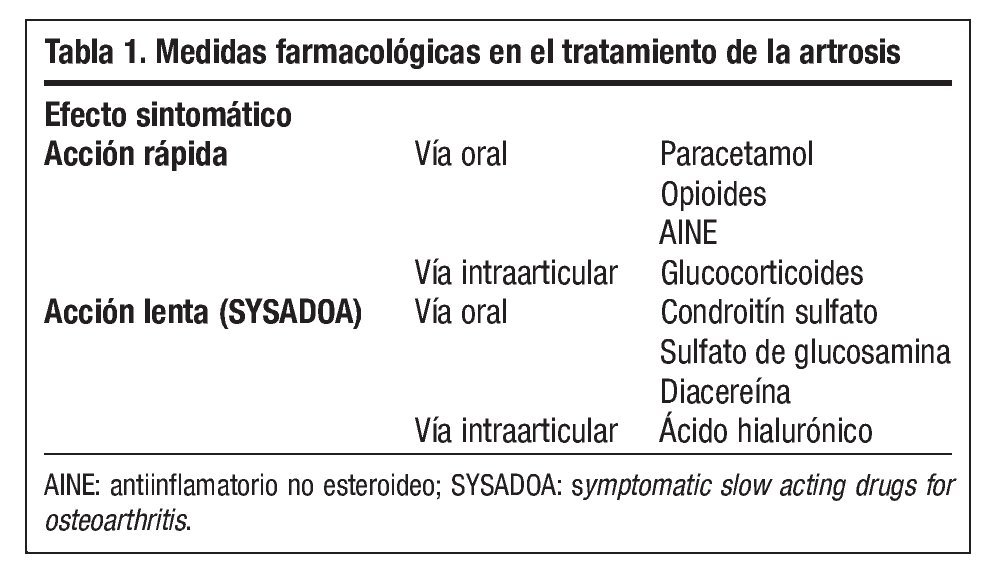
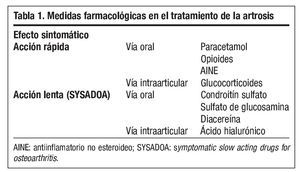
La terapéutica de la artrosis es un proceso complejo que se encuentra en continua revisión. Los objetivos del manejo integral de esta enfermedad incluyen medidas no medicamentosas, correctamente empleadas, y tratamiento farmacológico. Este último es el campo terapéutico donde existen más interrogantes, y actualmente se focaliza en la disminución del dolor y en la mejoría de la capacidad funcional (tabla 1).
Los fármacos de acción sintomática rápida (analgésicos y/o antiinflamatorios) se usan habitualmente para mejorar los síntomas dolorosos de forma rápida y potente, pero presentan una serie de problemas de seguridad (gastrointestinales, cardiovasculares, hepáticos y renales) y pueden presentar problemas de interacciones con otros medicamentos. De este modo, a veces deben asociarse con gastroprotectores.
Los fármacos de acción sintomática lenta (SYSADOA [Symptomatic Slow Acting Drugs for OsteoArthritis]), a pesar de presentar un inicio del efecto lento, poseen como ventajas adicionales una eficacia global parecida a la de los antiinflamatorios no esteroideos (AINE) y un efecto que se prolonga durante más tiempo, incluso durante algunos meses después de la supresión del tratamiento (efecto carry over o remanente). Además, se trata de productos que forman parte de la matriz del cartílago, son seguros y tienen una baja relación coste/efectividad4. Las sustancias que se comportan como SYSADOA incluyen la diacereína, el condroitín sulfato (CS) y el sulfato de glucosamina (SG) por vía oral, y el ácido hialurónico (AH) por vía intraarticular, aunque los tres últimos destacan por su mayor experiencia clínica y su elevado perfil de seguridad.
Estos compuestos también han recibido recientemente especial atención como posibles fármacos modificadores de la enfermedad artrósica, y se les ha denominado, genéricamente, agentes condroprotectores4. Varios ensayos clínicos realizados con CS5-9, SG10,11, AH12-15 y diacereína16 han puesto en evidencia su posible actuación como fármacos S/DMOAD (Structure/ Disease-Modifying anti-OA drug)4, atribuyéndoles la capacidad de prevenir, retrasar, estabilizar, reparar y/o revertir las lesiones de hueso y cartílago4, aunque se trata de datos preliminares que deberán confirmarse en un futuro con nuevos ensayos clínicos destinados a comprobar dicho efecto modificador de la enfermedad.
METODOLOGÍA
Se ha realizado una búsqueda bibliográfica a través del MEDLINE (1966-2007), incluyendo las palabras clave: artrosis, tratamientos farmacológicos, SYSADOA, condroitín sulfato, sulfato de glucosamina, ácido hialurónico y diacereina. Como principales criterios de selección se han incluido ensayos clínicos controlados con placebo y randomizados, estudios comparativos, revisiones sistemáticas y/o bibliográficas en adultos con artrosis primaria que cumplieran los criterios diagnósticos establecidos por la Academia Americana de Reumatología (ACR). El principal criterio de exclusión fue la presencia de artrosis secundaria.
CONDROITÍN SULFATO
El CS forma parte del grupo de los glicosaminoglicanos (GAG), que son importantes constituyentes estructurales de la matriz extracelular del cartílago. El CS está presente principalmente en la matriz extracelular de los condrocitos, y es más abundante en los tejidos con una gran matriz extracelular (tejidos conectivos, cartílago, piel, vasos sanguíneos, ligamentos y tendones).
Las propiedades de resistencia al peso que el cartílago articular posee se deben, esencialmente, a la integridad y a la estructura de la matriz. El colágeno fibrilar y los proteoglicanos no fibrilares contribuyen a mantener las propiedades físicas del tejido. Esencialmente, los GAG del cartílago constituyen estos agregados de alto peso molecular (proteoglicanos) cuya forma principal se llama agrecano.
En las enfermedades articulares degenerativas, tales como la artrosis, se produce un deterioro y una pérdida del cartílago articular. Una fase clave en el proceso degenerativo es la pérdida de proteoglicano del cartílago (rico en CS) y la exposición de su red de colágeno a un mal funcionamiento mecánico. La degradación de proteoglicanos tiene lugar en la matriz como consecuencia de una elevada actividad de las metaloproteinasas (colagenasas, gelatinasas y estromelisinas). Se ha observado que la actividad de la colagenasa y la estromelisina está significativamente aumentada en la artrosis humana. Estas enzimas son secretadas y sintetizadas por los sinoviocitos, pero también por los condrocitos bajo el efecto "catabolito" de la interleucina-1 (IL-1). La IL-1 también induce la síntesis y secreción de la prostaglandina E2 (PGE2) por parte de los condrocitos. La PGE2 podría inhibir la síntesis de ADN y la proliferación de condrocitos in vivo17.
Puede concluirse que la deficiencia de inhibidores específicos para controlar la actividad de las metaloproteinasas neutras podría conducir a una reducción de los proteoglicanos en la matriz.
Mecanismos de acción
La justificación para utilizar CS para el tratamiento de la artrosis se basa en datos experimentales obtenidos en modelos in vitro e in vivo (animales y pacientes artrósicos), los cuales han demostrado que los GAG sulfatados exógenos poseen un efecto sobre el metabolismo de los condrocitos, influyendo favorablemente en la restauración del cartílago o previniendo una mayor degradación de la matriz durante el curso de la enfermedad.
Los resultados de diversos estudios realizados in vitro y en animales sugieren que la acción terapéutica de CS se debe, al menos, a los siguientes mecanismos de acción: actividad antiinflamatoria a nivel de los componentes celulares de la inflamación (factor de necrosis tumoral alfa [TNF-α], IL-1β, ciclooxigenasa 2 [COX-2], prostaglandina E2[PGE2], factor nuclear kappa B [NFκB]18), estimulación de la síntesis de proteoglicanos y ácido hialurónico endógeno, reducción de la actividad catabólica de los condrocitos (inhibiendo algunas enzimas proteolíticas tales como colagenasa, elastasa, proteoglicanasa, fosfolipasa A2, NAG, MMP-3, MMP-9, MMP-13, MMP-14, catepsina B y agrecanasa 1 y 2), reducción de la apoptosis, óxido nítrico19 y radicales libres, y efecto protector de los componentes celulares del cartílago20,21 (fig. 1). A nivel del hueso subcondral, se ha observado recientemente que el CS ejerce un efecto positivo sobre el desequilibrio óseo producido en el hueso subcondral artrósico, regulando la expresión y producción de OPG (factor que interviene en la remodelación del hueso subcondral)21.
Figura 1. Efecto farmacológico del condroitín sulfato en el sistema osteoarticular. AINE: antiinflamatorio no esteroideo; AH: ácido hialurónico; IL: interleucina; ON: óxido nítrico; S/DMOAD: structure disease modifying osteoarthritis drugs; TNF: factor de necrosis tumoral.
Efecto clínico
Los ensayos clínicos en pacientes artrósicos demuestran que el tratamiento con CS produce una disminución o desaparición de los síntomas de la enfermedad artrósica, como son el dolor y la impotencia funcional, mejorando el movimiento de las articulaciones afectadas, con un efecto que perdura durante 2 o 3 meses5-9,22-24. Los resultados de estos ensayos clínicos demuestran, además, que CS es capaz de disminuir la ingesta de medicación de rescate, presentando resultados muy positivos en cuanto a la valoración global del paciente y el investigador.
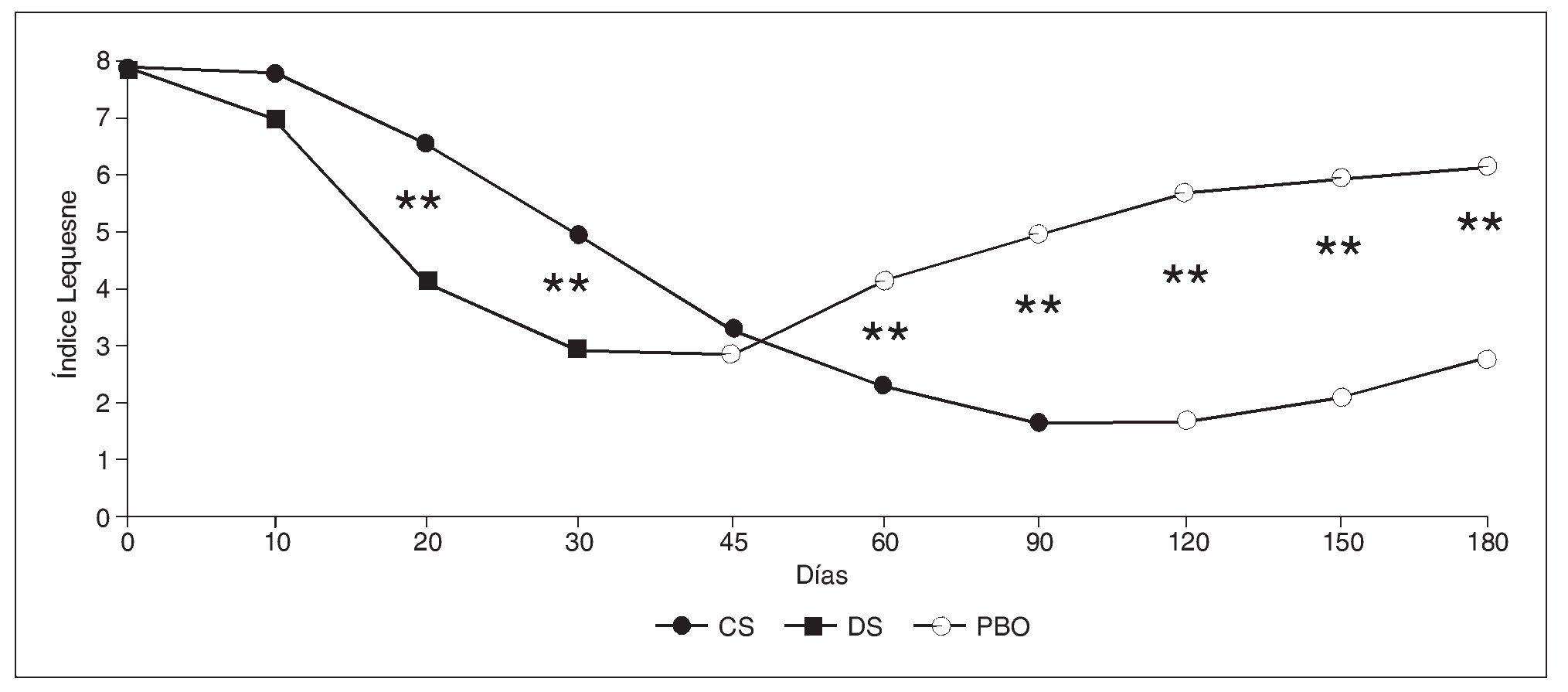
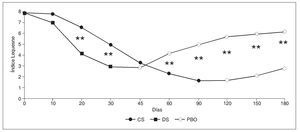
Dado que se trata de un SYSADOA, el inicio de acción de CS es algo lento, entre 2-3 semanas, aunque eventualmente alcanza la misma eficacia que los AINE y además presenta un efecto remanente por el cual su eficacia se mantiene hasta 2-3 meses después de la supresión del tratamiento22 (fig. 2).
Figura 2. Valores medios del índice Lequesne durante el ensayo clínico llevado a cabo por Morreale et al. CS: condroitín sulfato; DS: diclofenaco; PBO: placebo. **p < 0,01.
En un ensayo clínico25 reciente llevado a cabo por el National Institutes of Health de EE. UU. con un total de 1.583 pacientes con artrosis de rodilla se encontró que CS consiguió una mejora global del 65,4%, aunque no alcanzó la significación estadística frente al placebo, dada la elevada tasa de respuesta de este grupo (60,1%), muy superior a la esperada (35%), y al hecho de que la mayoría de los pacientes presentó inicialmente dolor leve y, por lo tanto, poca capacidad de discernir una mejora del dolor según los propios autores. No obstante, un análisis exploratorio en el subgrupo de pacientes con dolor moderado a grave sugiere que la administración conjunta de CS + glucosamina disminuye significativamente el dolor respecto al placebo (79,2 frente a 54,3%, p = 0,002) en pacientes afectos de artrosis de rodilla; esta respuesta fue un 10% superior a la del control positivo. En este mismo ensayo clínico se observó una disminución significativa de la hinchazón, acompañada o no de derrame articular (sinovitis), en el grupo tratado con CS comparado con placebo (p = 0,01).
Clegg et al, basándose en el mismo estudio, también evaluaron si el CS podría tener un efecto diferencial sobre los síntomas de la artrosis en cuanto al grado radiográfico de Kellgren & Lawrence (KL) de los pacientes. Los resultados sugieren que el CS podría mejorar el dolor de la artrosis de rodilla en pacientes en fases iniciales de la patología, en concreto con grado 2 de KL26.
Un metaanálisis27 que recogió los datos de siete ensayos clínicos con CS confirmó que CS fue significativamente superior a placebo en cuanto a los parámetros de dolor y capacidad funcional, mostrando, al menos, una mejora del 50% en comparación con la medicación control.
Sin embargo, un reciente metaanálisis publicado por Reichenbach et al en 200728 ha puesto en duda la validez terapéutica de CS en el tratamiento de la artrosis. Pese a dichas conclusiones, se ha observado un cierto sesgo en los resultados del estudio que influye en las conclusiones presentadas. En el análisis de los datos, únicamente se incluyeron 3 estudios de los 20 revisados para realizar la evaluación, y además los autores no tuvieron en cuenta la heterogeneidad de éstos. De hecho, la variable principal de 2 de estos 3 ensayos era la evaluación del efecto modificador de la enfermedad de CS y no del efecto sintomático. El efecto sintomático debe ser evaluado durante un período de tiempo corto (3-6 meses), mientras que para determinar si un fármaco posee un efecto modificador de la enfermedad se necesita un largo período de tiempo (2-3 años). Este hecho evidencia la debilidad en el tratamiento estadístico de los datos del metaanálisis y, por lo tanto, la limitación de dicha revisión.
Paralelamente a los resultados que demuestran la eficacia sintomática del CS, también se ha evidenciado en 5 ensayos clínicos5-9, mediante técnicas radiográficas, la posibilidad de que CS pueda prevenir las lesiones articulares erosivas o retrasar la progresión de la lesión articular. Los resultados citados sugieren que el CS además de mejorar efectivamente la sintomatología de la artrosis de rodilla y dedos, posee propiedades modificadoras de la estructura que, aunque no reparan el daño provocado, sí son capaces de retrasar y mitigar la progresión de la enfermedad.
Condroitín sulfato como tratamiento de base de la artrosis en Atención Primaria
El CS es una sustancia natural bien conocida que, según las evidencias presentadas, puede recomendarse como un tratamiento de acción sintomática lenta, eficaz y segura para la artrosis utilizado en la manera recomendada. El hecho de que el CS se encuentre comercializado en varios países desde hace varios años y de que se hayan tratado varios millones de pacientes en todo el mundo sin detectarse efectos adversos graves, confirma su gran perfil de seguridad.
Hasta ahora, el CS está comercializado y se utiliza en distintos países europeos: en Suiza desde 1982, en Italia desde 1990, en Francia desde 1993, en Austria desde 1994, en Portugal desde 2000, en España desde 2002, así como en varios países de la Europa del Este. Durante estos años, los estudios de farmacovigilancia jamás han revelado ningún efecto tóxico importante en el hombre como resultado de la utilización de este compuesto.
Las últimas recomendaciones de la Liga Europea Reumatológica (EULAR) para el tratamiento de la artrosis de rodilla hacen referencia a su elevado perfil de seguridad. En una escala del 0 al 100, se le atribuye un nivel de toxicidad de 6, por lo que constituye uno de los fármacos más seguros, junto al SG, para el tratamiento de la artrosis29.
En dichas recomendaciones también se constata el nivel de eficacia y seguridad de CS, al que se incluye dentro de la categoría 1A de mayor evidencia científica, con un grado de recomendación A, también el más elevado. A su vez, el reciente documento de consenso de la Sociedad Española de Reumatología sobre el tratamiento farmacológico de la artrosis de rodilla recoge el mismo grado de recomendación para CS30. Este mismo año, las guías publicadas de la Sociedad Internacional de Investigación en Artrosis (OARSI) recomiendan CS y también SG como el segundo tratamiento más efectivo para el manejo de la artrosis moderada31. El CS, así como los otros SYSADOA y el paracetamol, también ha sido clasificado por la Sociedad de Reumatología de Atención Primaria del Reino Unido como primera línea de tratamiento del dolor de rodilla32.
La excelente seguridad demostrada en toda la investigación clínica realizada con CS es de especial interés en un tratamiento crónico (tratamiento continuado y/o en ciclos) como es el de la enfermedad artrósica. Asimismo, también cabe destacar que el CS no es metabolizado por enzimas del citocromo P450, ello es de gran trascendencia ya que implica que CS no puede presentar interacciones con otros medicamentos a nivel metabólico. Este aspecto es de especial relevancia para pacientes de la tercera edad polimedicados.
Además, el CS presenta la ventaja de ser un fármaco mucho más seguro que la terapéutica clásica utilizada, pues no presenta efectos adversos a nivel gastrointestinal, hepático, renal o cardiovascular como la mayoría de los AINE, por lo que puede administrarse de forma crónica tal y como esta patología requiere, actuando como tratamiento de base. Además, su utilización puede suponer una reducción del consumo de analgésicos y AINE o gastroprotectores27,30. Por otra parte, las características de su efecto remanente hacen también posible que puedan pautarse ciclos con y sin tratamiento, de manera intermitente, para favorecer una mayor comodidad y calidad de vida del paciente. Por todo lo anterior podemos afirmar que el CS hoy por hoy puede considerarse uno de los tratamientos de base de dicha patología, actuando como una herramienta terapéutica eficaz en Atención Primaria.
SULFATO DE GLUCOSAMINA
El SG es un principio activo de origen biológico presente en el organismo humano y sintetizado a partir de la quitina que se extrae de las conchas y/o caparazones de los crustáceos. La glucosamina es un amino-monosacárido natural y es el sustrato para la biosíntesis de los proteoglicanos del cartílago.
Se ha demostrado la actividad del SG sobre la síntesis de proteoglicanos en los cartílagos articulares33. Asimismo, posee una actividad antiinflamatoria ciclooxigenasa independiente; de ahí la buena tolerancia gastrointestinal y general de la glucosamina.
Además, ha demostrado inhibir algunas enzimas destructoras del cartílago tales como colagenasa, agrecanasa, fosfolipasa A2 y enzimas lisosomales y la formación de otras sustancias que dañan los tejidos, como radicales superóxido de los macrófagos.
Estas acciones pueden explicarse por una actividad estabilizadora de la membrana, posiblemente conectada con las citadas propiedades metabólicas del producto.
Los efectos sobre la síntesis de óxido nítrico (ON), favorecedor de la degradación del cartílago, no están totalmente claros: existen grupos que han encontrado que disminuye la síntesis de ON34 y otros no han encontrado efecto alguno19.
Todo ello explica su actividad beneficiosa a nivel clínico en los procesos de artrosis y, en particular, sobre los síntomas de la enfermedad10,11,33,35-37.
Dado que se trata de un SYSADOA, el inicio de acción del SG es lento, entre 2 o 3 semanas, aunque eventualmente alcanza la misma eficacia que los AINE y además presenta un efecto remanente por el cual su eficacia se mantiene hasta 2 meses después de la supresión del tratamiento.
Como se ha comentado anteriormente, en un reciente ensayo clínico publicado por Clegg et al25, se ha demostrado que la combinación de CS más glucosamina en pacientes afectos de artrosis de rodilla, con dolor moderado o intenso, consigue una mejoría estadísticamente significativa del dolor inicial en comparación con el grupo placebo.
ÁCIDO HIALURÓNICO
El AH pertenece a la familia de los GAG y se encuentra en diversos tejidos extracelulares, incluyendo el líquido sinovial, la matriz extracelular de la piel y el cartílago.
En las articulaciones, el AH es producido por los condrocitos y los sinoviocitos. El AH constituye el eje central de varios agregados de proteoglicanos necesarios para la integridad funcional del cartílago. Es uno de los componentes principales de la matriz extracelular del cartílago y las capas superficiales de la membrana sinovial y está presente en elevadas concentraciones en el líquido sinovial.
En los pacientes artrósicos, el AH del líquido sinovial se despolimeriza, dando como resultado una disminución del peso molecular y la viscoelasticidad, aumentando la susceptibilidad del cartílago a la lesión. El AH proporciona viscoelasticidad al líquido sinovial, fundamental para sus propiedades de lubricante y amortiguador, y esencial para la correcta estructura de los proteoglicanos en el cartílago articular.
La administración intraarticular de AH mejora la movilidad de las articulaciones con superficie del cartílago degenerativa y alteraciones en el líquido sinovial. Existen varios AH que pueden o no tener los mismos efectos clínicos debido a su distinta procedencia, distinta concentración, distinta posología y sobre todo distintos pesos moleculares38.
El AH de 500-730 kDa ha demostrado que su eficacia terapéutica se debe a la combinación de sus propiedades tanto mecánicas (mejorando las propiedades viscoelásticas del líquido sinovial y actuando como una viscosuplementación), como farmacológicas, de ahí su aprobación como medicamento frente al resto de AH que están disponibles como implante.
Por otra parte, estudios in vitro e in vivo indican que el AH con peso molecular de 500-730 kDa puede ejercer un efecto sobre la inflamación por actuar sobre determinados radicales libres del oxígeno, por inhibir la proliferación, migración y fagocitosis leucocitaria y por inhibir la PGE2 y el ON. El AH a este peso molecular también reduce la apoptosis en el cartílago artrósico y contrarresta algunos de los efectos de la IL-1. Asimismo, la inyección intraarticular de AH estimula la síntesis de AH endógeno, y TIMP-138-40.
En ensayos clínicos controlados, los ciclos de terapia con 5 inyecciones de AH de peso molecular 500-730 kDa han demostrado mejorar significativamente los síntomas de la artrosis, como son el dolor y la impotencia funcional, durante al menos 6 meses después de la finalización del tratamiento. En algunos casos la mejoría se ha evidenciado hasta 12 meses e incluso más41,42 (efecto remanente). Un reciente metaanálisis de 24 ensayos clínicos publicados confirma la eficacia y seguridad de este AH en el tratamiento de la artrosis de rodilla, así como en otras articulaciones, presentando además evidencias de una posible acción modificadora del curso de la enfermedad artrósica43.
DIACEREÍNA
La diacereína es una molécula de síntesis química, con un mecanismo de acción distinto al que tienen los AINE clásicos o los corticoides, ya que actúa inhibiendo directamente la IL-1β e interviniendo, por lo tanto, en la cascada inflamatoria iniciada por esta citocina44,45.
Se trata de un fármaco SYSADOA, con un inicio de acción lento, incluso superior al de los otros tres fármacos comentados, entre 4 y 6 semanas.
Su eficacia clínica ha sido estudiada en varios estudios que han demostrado un efecto moderado en la mejoría de los síntomas de la artrosis, especialmente en cuanto al dolor, aunque en términos de capacidad funcional no ha resultado ser tan eficaz. Su capacidad como potencial modificador de la estructura en la enfermedad artrósica ha sido evaluada en dos ensayos clínicos en pacientes con artrosis de cadera y de rodilla, encontrándose un efecto positivo en la progresión de la artrosis sólo en el primer caso46-48.
El principal problema de este fármaco utilizado en tratamientos prolongados es la elevada frecuencia en la aparición de efectos adversos gastrointestinales16 (diarrea), de un 30 a un 40%, que no favorecen su administración continuada.
CONCLUSIONES
A partir de esta revisión de los fármacos de acción sintomática lenta para la artrosis, se puede confirmar que estos medicamentos (condroitín sulfato, sulfato de glucosamina, ácido hialurónico) son eficaces en el tratamiento sintomático de dicha patología y son fármacos altamente seguros. Este último punto es clave en el tratamiento crónico de la artrosis, ya que se trata de una patología frecuente en la tercera edad, población que además suele estar polimedicada.
Existen, además, evidencias de que estas moléculas pueden actuar como modificadoras de la patología, llegando a retrasar el curso de la enfermedad artrósica. Cabe destacar, sin embargo, que estos datos se tendrán que confirmar en ensayos clínicos que se encuentran en curso. Todo ello permite pensar que en los próximos años se podrá iniciar el estudio de la combinación de estas nuevas moléculas y su especialización en la articulación.
El siguiente paso en el manejo de la artrosis es personalizar el tratamiento de dicha patología. Con este objetivo, estudios sobre farmacogenómica y marcadores bioquímicos permitirán identificar grupos de pacientes con el mismo perfil genético e igual respuesta terapéutica. De este modo, la confirmación de la existencia de subgrupos de pacientes con una misma respuesta terapéutica abre la puerta a la terapia individualizada, pudiéndose identificar previamente a los pacientes y tratarlos con la mejor terapia en función de su perfil genético. Sólo hasta el momento se han identificado, al menos, diez biomarcadores relacionados con el padecimiento de esta patología en diferentes articulaciones. Estas nuevas líneas de investigación que ayudarían a mejorar la calidad de vida de los pacientes y disminuirían los costes del sistema sanitario nos permiten pensar que estamos ante una nueva era terapéutica en la artrosis.
Correspondencia: S. Giménez Basallote.
Avda. Juan Sebastián Elcano, 88, 5.o B. 29017 Málaga. España.
Correo electrónico:sgimenez@semergen.es
Recibido el 12-11-07; aceptado para su publicación el 13-03-08.