El «corazón del atleta» consiste en una serie de cambios estructurales cardiacos y del sistema neuroautonómico, en una respuesta adaptativa al ejercicio intenso y sostenido. Así, se suelen observar aumentos en el grosor de la pared ventricular, en las dimensiones del ventrículo izquierdo (VI), un predominio vagal y ciertos patrones ECG, como la bradicardia sinusal, el bloqueo auriculoventricular de primer grado o la hipertrofia aislada de VI1,2 (tabla 1). Sin embargo, en algunos atletas, y en especial en los deportistas de raza negra (DRN), se observa un intenso remodelado cardiaco, con unas manifestaciones electrocardiográficas y estructurales que plantean en ocasiones una difícil diferenciación respecto a la miocardiopatía hipertrófica (MCH)1,3.
Hallazgos normales y hallazgos anormales en el electrocardiograma de un deportista
| Hallazgos normales en el ECG de un deportista | Hallazgos anormales, indicativos de miocardiopatía |
|---|---|
| Bradicardia sinusal Arritmia sinusal Extrasistolia auricular Ritmo de escape de la unión AV BAV de primer grado BAV de segundo grado Mobitz 1 (Wenckebach) Bloqueo incompleto de rama derecha Criterios aislados de hipertrofia de VI, sin coexistencia de alguno de los siguientes: Crecimiento de AI Desviación del eje a la izquierda Depresión del segmento ST OTN Ondas Q patológicas Repolarización precoz (supradesnivelación del segmento ST con elevación del punto J, ondas J) En deportistas de raza negra: supradesnivelación convexa del segmento ST combinada con OTN de V1 a V4 | OTN (>1mm de profundidad, excluidas en iii, aVR y V1) Inversión del segmento ST (>0,5mm) Ondas Q patológicas (>3mm o>40mseg) Aumento de tamaño de la AI Desviación izquierda del eje (entre −30 y −90°) Bloqueo de rama completo (especialmente si QRS≥140mseg) Hipertrofia de VD Extrasistolia ventricular frecuente (≥2 extrasístoles ventriculares en 10seg de trazado) Arritmias ventriculares (bigeminismo, trigeminismo, taquicardia ventricular no sostenida) |
AI: aurícula izquierda; AV: auriculo ventricular; BAV: bloqueo auriculoventricular; OTN: onda T negativa; VD: ventrículo derecho; VI: ventrículo izquierdo.
Fuente: Modificada de Drezner et al.11.
La MCH es una enfermedad genética del sarcómero, con una herencia autosómica dominante y una penetrancia relacionada con la edad. Se caracteriza por una hipertrofia miocárdica, una desorganización miofibrilar, un grado variable de disfunción diastólica y un riesgo importante de muerte súbita en cualquier momento de su evolución, a menudo relacionada con arritmias ventriculares inducidas por el ejercicio1. En el ECG suelen observarse voltajes muy aumentados, ondas Q prominentes y ondas T negativas (OTN) profundas2. Si bien la ecocardiografía es la técnica diagnóstica de elección, la resonancia magnética ha demostrado un mayor rendimiento en la identificación de hipertrofias segmentarias localizadas en la pared anterolateral o en el ápex1.
Hay autores que hablan de «zonas grises», en referencia al problema diagnóstico que se plantea cuando las manifestaciones del corazón del atleta semejan una cardiopatía1,4. La duda puede surgir ante un ECG con profundas alteraciones o ante un grosor anómalo del septo, pues pueden representar tanto unos cambios adaptativos extremos como una MCH subyacente con baja expresividad1. En este escenario de solapamiento de entidades, la presencia de OTN en las derivaciones precordiales izquierdas despierta un interés creciente4,5.
Es evidente la necesidad de un diagnóstico correcto. Mientras que la identificación de una MCH y el cese del deporte pueden reducir el riesgo de muerte súbita, no identificar una MCH puede incrementar dicho riesgo de forma notable1. Por otro lado, un diagnóstico erróneo de MCH puede tener, para un deportista profesional, profundas consecuencias personales, económicas y sociales.
Este dilema diagnóstico no solo ocurre en el ámbito de la medicina deportiva, sino que se plantea con una frecuencia cada vez mayor en Atención Primaria6, y señala la conveniencia de conocer adecuadamente ambas entidades en el primer nivel de atención.
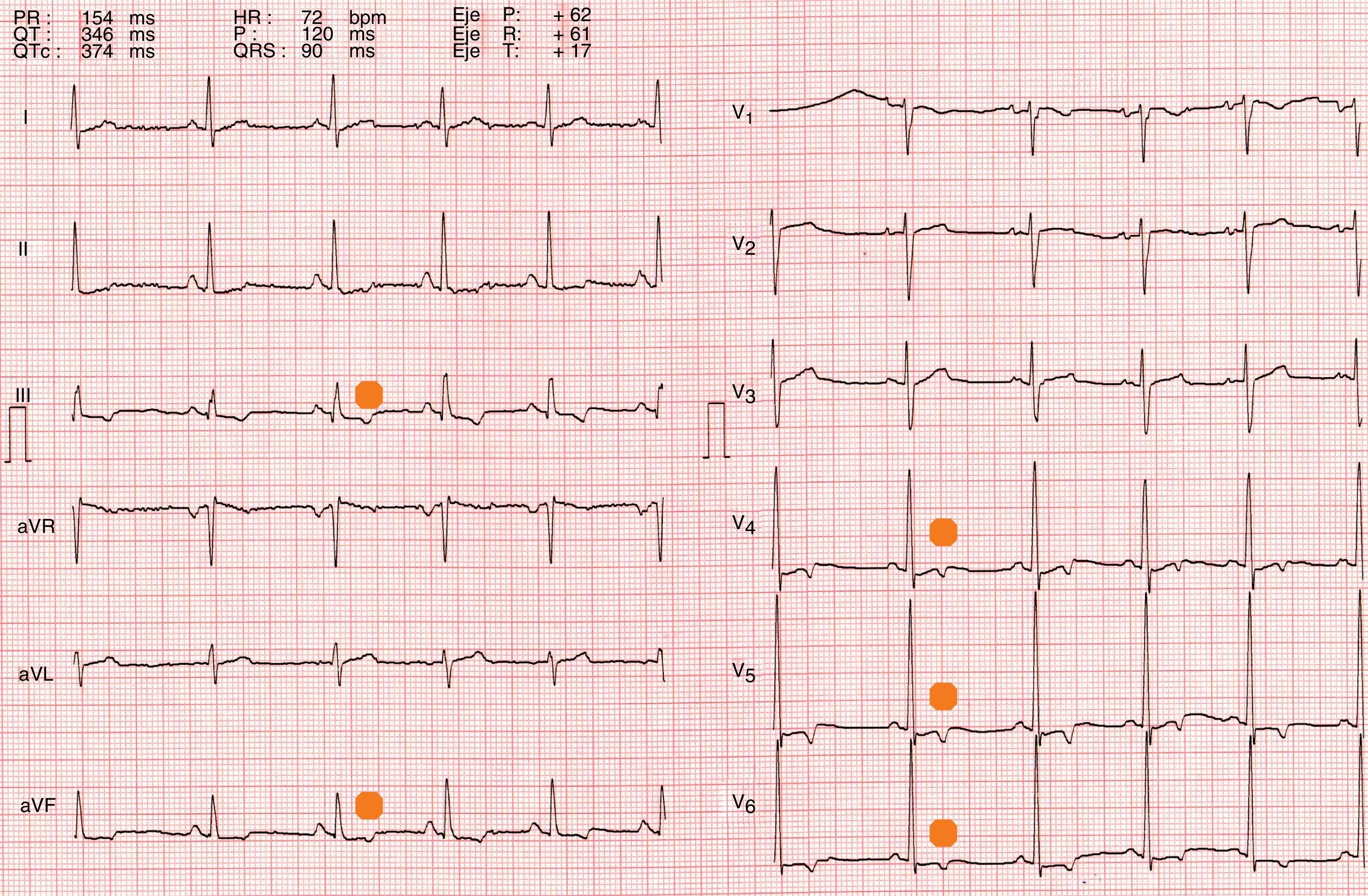
Presentamos el caso de un varón afroamericano, de 25 años de edad, nacido en California (EE. UU.), jugador de baloncesto profesional. Sin antecedentes personales o familiares de interés. No refería ningún síntoma cardiovascular. Presentaba una constitución mesoendomorfa, una baja capacidad aeróbica (VO2 máxima=4,2l/min=36,2ml/kg/min), una auscultación cardiopulmonar sin alteraciones y un test de tolerancia al esfuerzo con respuestas tensionales normales. El ECG mostró la presencia de OTN de 2mm en las derivaciones iii, aVF y V4-V6 (fig. 1). En el ecocardiograma, los valores se encontraron dentro de la normalidad, con un grosor del septo de 10 mm (normal hasta 13 mm en deportistas) y de 11 mm en la pared posterior del VI (normal ≤12 mm1,4), un diámetro telediastólico de VI de 49 mm (sugerente de MCH si < 45 mm1,4) y telesistólico de 28 mm, con una FEVI de 65%. Los tamaños auriculares y de ventrículo derecho, así como el patrón doppler-diastólico, fueron, asimismo, normales. Se descartaron manifestaciones estructurales indicativas de MCH, y de acuerdo con el protocolo vigente, el deportista obtuvo la autorización médica para el deporte competitivo.
La magnitud de los cambios adaptativos del corazón del atleta guarda relación con el género masculino, el tamaño corporal, el tipo de deporte (es mayor en el remo, el ciclismo, el esquí de fondo, el baloncesto y el fútbol), factores genéticos y, de forma importante, con la raza negra4. En este aspecto, Basavarajaiah et al.3 analizaron 300 DRN asintomáticos y 300 controles, deportistas de raza blanca (DRB), y observaron que los primeros presentaban una masa de VI y un grosor parietal de VI un 13 y un 12% superiores, respectivamente, que los segundos, pareados por edad, tamaño corporal y niveles de tensión arterial. Además, una mayor proporción de DRN tenían un grosor parietal de VI>12mm, incluyendo un 3% con un valor≥15mm.
La respuesta adaptativa en los DRN se acompaña, asimismo, de una mayor frecuencia de patrones ECG anómalos. Magalski et al.7 analizaron una cohorte de 1.959 jugadores de fútbol americano y observaron una mayor prevalencia de ECG alterados en los DRN en comparación con los DRB (30 y 13%, respectivamente). Además, en los DRN se detectaron con mayor frecuencia los patrones eléctricos más alterados, incluyendo ondas R/S con voltajes≥35mm, OTN>2mm y ondas Q≥4mm.
Tradicionalmente se ha considerado que estos ECG profundamente alterados son manifestaciones extremas del corazón del atleta, falsos positivos asociados a una variante racial1. Sin embargo, la mayor incidencia de muerte súbita en los DRN apunta a que algunos ECG anómalos pueden expresar en realidad una MCH no diagnosticada previamente1. De hecho, en la MCH las alteraciones eléctricas pueden preceder a los cambios hipertróficos o representar una forma incompleta de la enfermedad2.
La localización de las OTN tiene relevancia clínica (tabla 1). Su aparición en la cara inferior no representa un fenotipo de riesgo, y en V1-V4 parecen formar parte –en especial cuando se asocian a una elevación convexa del ST– del espectro de cambios del remodelado cardiaco propio de los DRN2,4.
Por el contrario, la presencia de OTN en V5-V6 obliga a descartar una miocardiopatía subyacente, pues hay evidencias de que pueda tratarse de la manifestación inicial de una miocardiopatía, anterior a la aparición de alteraciones cardiacas estructurales o funcionales5. En este sentido, se dispone de resultados prospectivos sobre atletas con OTN en derivaciones precordiales izquierdas. Pelliccia et al.8 evaluaron a 81 deportistas con OTN en derivaciones laterales, pareados con 229 controles con ECG normales. Tras un seguimiento de 12 años, 3 atletas con OTN desarrollaron clínica de MCH, frente a ninguno en el grupo control. Por su parte, Papadakis et al.9, tras un seguimiento de 69 meses sobre 1.819 DRB y 904 DRN, reportaron que un DRN sobrevivió a una parada cardiaca y otro DRN y un DRB fueron diagnosticados de MCH; los 3 presentaban OTN en la cara inferior y lateral. Un resultado discordante es el observado por Sheikh et al.10, en cuyo estudio, que incluyó 329 DRN de 14-18 años, tras un seguimiento de 8,3 años no detectaron ningún caso de MCH. En opinión de los autores, una explicación del resultado negativo podía ser el retraso en la expresión fenotípica debido a la penetrancia relacionada con la edad que tiene la MCH.
En nuestro caso (deportista asintomático con OTN en precordiales izquierdas y ecocardiograma normal), las recomendaciones vigentes incluyen comunicar la aparición de síntomas, no restringir el deporte competitivo, una evaluación cardiológica anual y ofrecer la realización de un test genético5. Sin embargo, estos test tienen una utilidad limitada, dado que no evalúan todas las regiones genéticas, la tecnología no detecta todas las mutaciones posibles y, además, algunos fenotipos se pueden desarrollar sin una base genética determinada2,4,5. Se ha estimado que en un paciente con MCH confirmada, la tasa de falsos negativos de los test genéticos se sitúa entre el 40-70%4.
En conclusión, en este deportista no se ha podido descartar fehacientemente una MCH. Y tampoco podría descartarse con el resultado negativo de un test genético. Es inquietante aceptar las limitaciones de las técnicas diagnósticas disponibles ante una enfermedad que puede debutar en forma de muerte súbita.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.