No cabe duda de que la genética está adquiriendo una relevancia creciente en la sociedad y en la medicina1,2. Por tanto, es lógico que el médico práctico se pregunte cómo puede ayudarle el genetista. La visión por parte del genetista es, además, de necesidad mutua, ya que éste también necesita del médico práctico. De hecho, la mayoría de signos indicativos de una posible alteración genética se identifican por primera vez formando parte de una exploración clínica de rutina3. Por tanto, es importante que el médico reconozca las posibles alteraciones con base hereditaria. Además, debe contar con información relativa a los centros donde es posible remitir a los pacientes para su estudio genético o, en los casos de baja complejidad, de los laboratorios donde enviar las muestras para su análisis genético. Una vez identificada una alteración genética en un miembro de una familia, el médico práctico posee un papel clave en la identificación y seguimiento de los demás miembros con riesgo.
Después de una introducción acerca de cómo la genética nos afecta a todos, este artículo pretende aportar una descripción de las actuaciones básicas que el médico puede realizar en su práctica diaria para identificar posibles candidatos al análisis genético y, a continuación, realizar un seguimiento integral hasta su diagnóstico, pronóstico y, si es posible, tratamiento4 y prevención.
La genética nos afecta a todos: causas y factores de riesgo genético
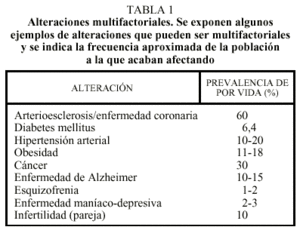
Una concepción errónea bastante extendida es que las mutaciones génicas sólo afectan a un 2-3% de los recién nacidos. Este 2-3% se refiere a los casos relativamente graves de alteraciones monogénicas (debidas a las alteraciones de un solo gen), dominantes o recesivas, o de alteraciones citogenéticas1. Pero se estima que todos nosotros (el 100% de la población) somos portadores de alteraciones recesivas graves en aproximadamente unos 7 genes distintos. Cada uno de nosotros heredamos dos copias (denominadas alelos) de cada gen, una del padre y otra de la madre. Afortunadamente, no estamos enfermos porque la otra copia que todos nosotros tenemos de cada uno de estos 7 genes es normal. Por tanto, aunque no estemos enfermos, todos tenemos un potencial de transmisión de algunas enfermedades a la descendencia.
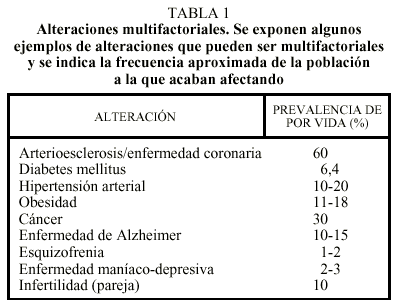
Aparte de las alteraciones moleculares monogénicas o citogenéticas, existen enfermedades muy frecuentes en la vida adulta que también tienen una base genética (tabla 1). En su conjunto, estas enfermedades acaban afectando prácticamente a la totalidad de la población. Las alteraciones génicas asociadas a estas enfermedades comunes se comportan como factores de riesgo genético, no como causas de enfermedad. Este matiz es extraordinariamente importante en la práctica médica diaria. Por ejemplo, para enfermedades dominantes se puede decir que una mutación en un gen es causa de enfermedad si la mayoría (60-100%) de individuos que tienen la mutación acaban (o acabarían) desarrollando la enfermedad en ausencia de tratamiento preventivo. En contraste, se considera que una mutación o un cambio en un gen se comporta como factor de riesgo si, siendo el riesgo superior en el portador, sólo el 1-40% de individuos que tienen la mutación acaban desarrollando la enfermedad. Los mismos conceptos serían aplicables a enfermedades recesivas, donde el genotipo que se comportaría como causa o como factor de riesgo correspondería a la mutación en estado homocigoto.
Alternativamente se puede utilizar el término de «penetrancia» de un genotipo (combinación de alelos en un locus concreto) para referirse al porcentaje de individuos que, poseyendo este genotipo, expresan la enfermedad. Así, es posible decir que las mutaciones con alta penetrancia (p. ej., 90-100%) son causa de enfermedad, mientras que las mutaciones con baja penetrancia (p. ej., 1-10%), que además suelen ser muy prevalentes en la población, sólo se comportan como factores de riesgo.
Como ejemplo de mutación que es causa de enfermedad cabe mencionar la mutación C282Y del gen HFE responsable de la hemocromatosis hereditaria5,6. La hemocromatosis es la enfermedad recesiva más frecuente de todas y es debida a un exceso de absorción de hierro en el intestino. El exceso de hierro en el organismo se acumula en el hígado, páncreas y en otros órganos o tejidos ocasionando daño celular. Con los años, y dependiendo del órgano que haya resultado más afectado, puede aparecer cirrosis hepática, diabetes mellitus, condrocalcinosis o hipogonadismo, entre otras alteraciones. Una de cada 17 personas en España es portadora de la mutación C282Y del gen HFE7, y una de cada 700 es homocigota C282Y y se encuentra potencialmente afectada. La penetrancia del genotipo C282Y/C282Y en los varones de 50-60 años es relativamente elevada (cerca de un 80%), mientras que la penetrancia del mismo genotipo en las mujeres es inferior (cerca de un 20%).
Como ejemplo de factor de riesgo genético cabe mencionar la presencia del alelo E4 del gen de la apolipoproteína E (APOE), que se comporta como factor de riesgo para el desarrollo de la enfermedad de Alzheimer8. Las personas con un genotipo 4/3 o con un genotipo 4/4 poseen un riesgo incrementado (15-45% aproximadamente) de desarrollar la enfermedad de Alzheimer, en comparación con las personas con el genotipo normal (3/3), que poseen un riesgo aproximado del 5-10%. La presencia del factor de riesgo no permite predecir si una persona concreta desarrollará o no la enfermedad, pero puede ser muy predictivo en un grupo de personas.
Muchas de estas enfermedades comunes de la vida adulta suelen describirse como enfermedades genéticas multifactoriales (tabla 1). Multifactorial quiere decir que en su patogenia participan múltiples factores, tanto genéticos como ambientales. Así, podemos generalizar la aparición de cualquier enfermedad con la siguiente ecuación:
fenotipo = genotipo + ambiente
El fenotipo es cómo somos o, en el caso de enfermedad, los síntomas o signos presentes. La ecuación indica que la aparición de la enfermedad (el fenotipo) depende de lo que heredamos (el genotipo), más la influencia o interacción con el ambiente, entendido el ambiente en un sentido amplio (alimentación, entorno físico, entorno social, fármacos, etc.). Esta ecuación es válida para todas las enfermedades humanas.
En las enfermedades monogénicas, en donde la mutación es causa de enfermedad, el ambiente tiene un papel muy poco importante o nulo. Es decir, que la enfermedad aparece independientemente del estilo de vida. En contraste, en las enfermedades multifactoriales (tabla 1), lo heredado se comporta sólo como factor de riesgo, y hacen falta factores ambientales (muchas veces desconocidos) para que la enfermedad aparezca. En el otro extremo encontraríamos las enfermedades causadas por agentes exógenos, como las infecciones o las intoxicaciones, donde el genotipo tendría un papel poco importante.
¿Cómo puede el médico contribuir a incorporar la genética a su práctica diaria?
El proceso de consejo genético incluye una serie de actividades9: a) establecer o confirmar el diagnóstico; b) determinar el tipo de herencia, para lo que es esencial realizar un completo árbol familiar o pedigrí; c) calcular el riesgo de repetición o recurrencia; d) detectar posibles portadores (individuos que tienen el gen en heterocigosis y que están sanos en el momento de ser explorados); e) comunicar al consultante o a su familia la probabilidad de recurrencia; f) proporcionar información sobre las opciones de tratamiento; g) proporcionar información sobre las opciones reproductivas o de prevención, y h) en los casos que sea necesario, proporcionar apoyo psicológico a los individuos. Este proceso suele ser el fruto de una colaboración multidisciplinaria. El médico práctico, como primer eslabón en la visita del paciente, posee un papel muy importante en la identificación de los posibles casos relacionados con la herencia a través de diversas acciones básicas.
Interrogar acerca de los antecedentes familiares y construir un árbol genealógico
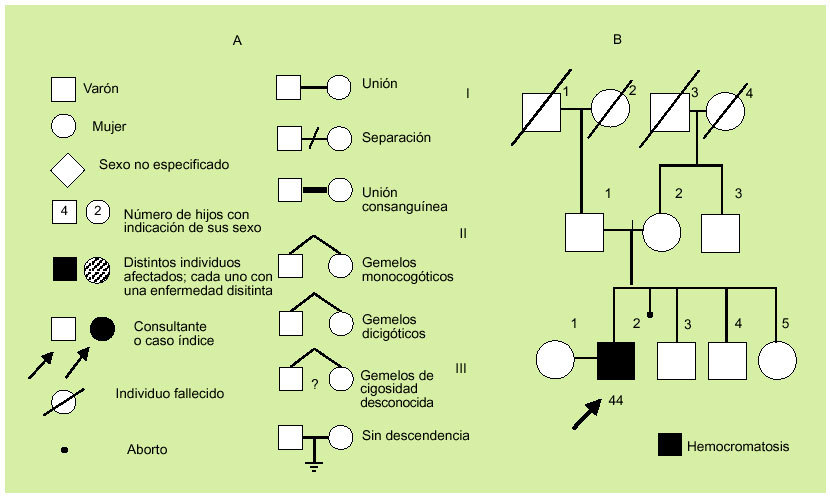
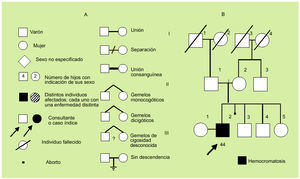
La evaluación de la historia clínica y la elaboración del árbol genealógico (fig. 1) son muy importantes, dado que permiten conocer antecedentes familiares, gestacionales y personales. En concreto, interesa conocer datos familiares de varias generaciones que permitan detectar anomalías similares a las del propositus. También es importante conocer la edad de comienzo de la enfermedad en los distintos miembros, la edad de los padres, la existencia de posible consanguinidad y la posible existencia de abortos. Una cuidadosa información de la gestación puede permitir detectar enfermedades maternas o agentes teratógenos (infecciones, alcohol, hidantoínas, anticoagulantes, hormonas, drogas, radiaciones) responsables de alteraciones que pueden ser parecidas y confundirse con las asociadas a diversas enfermedades hereditarias.
Fig. 1. Símbolos comúnmente utilizados en la construcción de un árbol genealógico (A) y ejemplo de árbol genealógico (B).
Ante la sospecha de antecedentes familiares positivos, será de interés solicitar informes clínicos y/o material iconográfico (fotografías) de los familiares implicados para tratar de relacionarlos con el cuadro del propositus. Es importante recordar que las enfermedades de causa genética pueden presentarse con distinta expresividad clínica (gravedad variable), la cual, en ocasiones, puede ser tan baja que se confunda con la normalidad. Por este motivo, es de interés una correcta exploración de los familiares cuando se sospeche un mecanismo
genético aunque la historia familiar aparezca como negativa.
Búsqueda de información sobre enfermedades con base génica
Una vez se ha detectado una alteración que puede presentar una base genética es necesario alcanzar un diagnóstico clínico lo más detallado posible y determinar si el gen mutante es conocido. Para ello suele resultar conveniente ampliar la información relativa a la enfermedad sospechada. Una consecuencia de la rapidez actual con la que se producen los avances en biomedicina y del gran número de enfermedades hereditarias existentes es que resulta difícil mantenerse al día. Por tanto, es crucial conocer cuáles son las alternativas disponibles para buscar información actualizada. De forma práctica, cualquier clínico puede buscar información acerca de cualquier enfermedad con base hereditaria a través de Internet en OMIM (On Line Mendelian Inheritance in Man). La dirección web correspondiente se expone en la tabla 2. Se trata de una base de datos, actualizada semanalmente, en la que es posible realizar una búsqueda por palabras clave. El resultado aporta una revisión, incluyendo las referencias originales, y una sinopsis clínica de cada enfermedad. Sin duda, existen también otras alternativas en la búsqueda de la información relativa a una enfermedad concreta, como la consulta de la base de datos Medline (tabla 2) o la consulta de los textos especializados10. Como texto elemental y breve, pero muy profesional y que aporta información general del proceso de consejo genético, cabe recomendar el libro Practical Genetic Counsel-ling9, del que se publican ediciones actualizadas periódicamente.
Establecer contacto con los centros de genética próximos y remitir muestras para análisis
En el ámbito práctico se plantea qué es lo que se requiere para diagnosticar una enfermedad molecular tras su sospecha o diagnóstico clínico, y tras averiguar que el gen mutante ya ha sido descubierto. Normalmente cada laboratorio de genética se especializa sólo en algunas enfermedades hereditarias. Por tanto, en esta fase resulta esencial determinar a qué laboratorio podemos remitir las muestras para su análisis. En este sentido, resulta útil la consulta a través de Internet de las bases de datos EDDNAL (European DNA Laboratories) y de la Sociedad Española de Genética Humana (tabla 2). Ambas proporcionan las direcciones de contacto, o incluso de correo electrónico de los distintos centros. Así, es posible pedir información de costes y requerimientos para el envío de muestras. Además, el contacto directo con los profesionales ofrece una oportunidad de aclarar las posibles dudas que pudiesen existir acerca de las indicaciones, interpretación y condiciones del análisis que se plantea realizar.
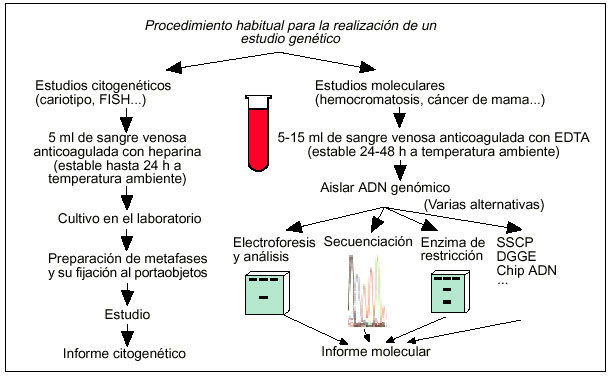
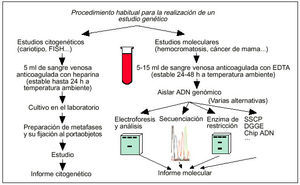
El siguiente paso en el proceso de análisis genético suele consistir en la obtención de una muestra de sangre venosa anticoagulada en EDTA para los estudios moleculares o en heparina en los estudios citogenéticos (fig. 2). Esta muestra debe enviarse entonces a temperatura ambiente al laboratorio de análisis genéticos a través de un mensajero. Una vez las muestras de sangre son recibidas en el laboratorio de análisis genético, suele procederse a la extracción del ADN y a la amplificación del gen de interés mediante PCR en los estudios moleculares, o a la obtención de un cariotipo en los estudios citogenéticos (fig. 2). Tras el estudio molecular o citogenético, el laboratorio de análisis envía el informe correspondiente al médico que lo solicitó.
Fig. 2. Principales alternativas de análisis genético ante la sospecha de una enfermedad hereditaria.
¿Cómo puede ayudar el análisis genético al médico práctico?
Enfermedades multifactoriales
De nuevo resulta importante diferenciar los factores de riesgo genético presentes en las enfermedades multifactoriales de las mutaciones que son causa de enfermedad. La utilidad práctica de la detección de factores de riesgo genético en las enfermedades multifactoriales (tabla 1) es todavía bastante limitada en la actualidad. Teóricamente, la posibilidad de conocer los factores de riesgo genético en los individuos de una población puede permitir un seguimiento más detallado o frecuente de aquellos con mayor riesgo y establecer estrategias de prevención.
En la práctica, los factores de riesgo genético presentes en muchas de las enfermedades comunes multifactoriales de la vida adulta, como puede ser la hipertensión o el riesgo coronario (tabla 1), están todavía en un proceso de investigación. En el caso de factores de riesgo claramente establecidos, por ejemplo, la presencia del alelo 4 del gen APOE en un paciente con síntomas de enfermedad de Alzheimer, éstos permiten al neurólogo incrementar ligeramente la especificidad diagnóstica. Pero incluso en este caso, no está justificado en la actualidad el análisis del genotipo APOE en los familiares del paciente al no existir estrategias efectivas de prevención para esta enfermedad.
Aun así, está claro que para que este campo avance el genetista y el médico práctico se necesitan mutuamente. El médico práctico, como primer eslabón con el paciente, aporta la identificación de los individuos candidatos de estudio y una caracterización clínica detallada. El genetista aporta las herramientas de análisis genético en el proceso de identificación de nuevos factores de riesgo. En el futuro, una vez se hayan identificado los factores de riesgo genético de la mayoría de enfermedades comunes multifactoriales y se dispongan de estrategias efectivas de prevención, se prevén cambios importantes en la forma de ejercer la medicina. Por ejemplo, es previsible que el análisis genético sea un paso previo a cualquier estrategia de prevención o de tratamiento.
Enfermedades monogénicas
Es precisamente en las enfermedades monogénicas de defecto conocido donde el análisis genético es con claridad de ayuda inmediata al médico práctico. Tras la sospecha clínica de una enfermedad hereditaria, la identificación de la mutación responsable a) aporta un diagnóstico etiológico; b) puede hacer innecesaria la realización de pruebas adicionales, muchas veces costosas o invasivas; c) aporta en muchos casos un pronóstico; d) puede indicar un tratamiento más adecuado, y e) facilita la identificación de familiares con riesgo permitiendo iniciar estrategias de prevención.
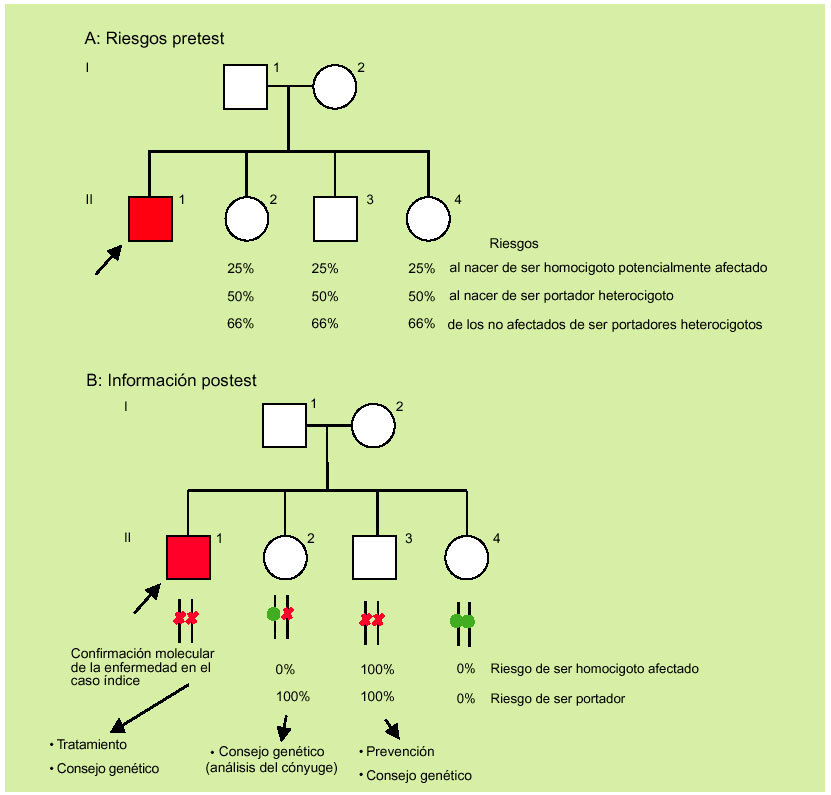
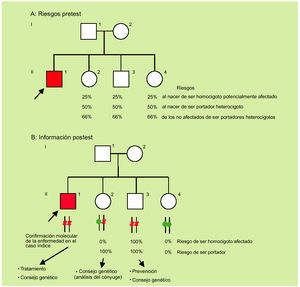
Ante un diagnóstico clínico, y gracias a los estudios moleculares, actualmente ya es posible abandonar la estrategia de informar acerca de riesgos para pasar a hablar en términos de certeza con una elevada fiabilidad (fig. 3).
Fig. 3. De los riesgos pretest (A) a la información postest (B).
Del riesgo pretest a la información molecular
Con el fin de ilustrar el «valor añadido» del análisis molecular cabe considerar la información disponible antes y después de la genotipificación de los distintos miembros de una familia con un paciente con sospecha clínica de hemocromatosis (fig. 3). Antes del análisis molecular sólo es posible establecer las probabilidades pretest para los distintos miembros (fig. 3a). Si se contase sólo con esta información debería de hacerse un seguimiento (analíticas) de por vida a los individuos a riesgo (fig. 3b; miembros II2, II3 y II4), con el fin de iniciar un tratamiento tan pronto existieran indicios de posible afectación. Después de la genotipificación a) queda confirmada molecularmente la sospecha de hemocromatosis en el caso índice; b) queda claro que existe (en este caso concreto) un solo individuo adicional potencialmente afectado al que se le tiene que realizar una prevención (fig. 2b; individuo II3); c) existe un único individuo portador heterocigoto (II-2), y d) existe un único individuo no portador con genotipo normal (II-4).
De forma similar, la detección de las personas propensas al cáncer de mama o al cáncer de colon, tras la detección de antecedentes familiares y la identificación de la mutación responsable, puede permitir establecer estrategias de prevención en los individuos a riesgo. Esta prevención puede llevarse a cabo, por ejemplo, indicando la realización de mamografías en el caso del cáncer de mama, o de colonoscopias más frecuentes en el caso del cáncer de colon, a los individuos portadores de la alteración genética.
Pero incluso en el caso de enfermedades para las que no existe tratamiento preventivo, la información molecular también resulta mucho más útil que sólo los riesgos pretest, ya que permite escoger entre diversas opciones reproductivas y de prevención. Esta situación ocurre en algunas enfermedades neurodegenerativas como, por ejemplo, la enfermedad de Huntington, en donde el análisis molecular suelen solicitarlo los familiares del propositus que desean saber si padecerán o no en un futuro una determinada enfermedad11. El conocimiento por parte del solicitante de que padecerá la enfermedad puede ayudar a tomar decisiones futuras.
En el caso de enfermedades incapacitantes o letales a edad precoz y para las que no existe tratamiento puede recurrirse al diagnóstico prenatal. Merece comentario
el diagnóstico preimplantatorio, que posibilita el estudio de gametos y/o embriones y la subsiguiente selección de los normales para su implantación. Su finalidad es evitar el aborto en aquellas parejas con alto riesgo genético. No obstante, tiene como inconvenientes la necesidad de fecundación in vitro y la necesidad de confirmación del resultado mediante el diagnóstico prenatal.
Formación continuada en genética
Cada vez más los profesionales perciben la necesidad de actualizar sus conocimientos en genética. Precisamente, una de las funciones del genetista puede ser la de contribuir a la formación continuada del médico práctico. En este sentido, cada año se organizan diversos cursos de formación continuada en genética en los principales centros hospitalarios. La lectura periódica de revistas y de artículos acerca de las aplicaciones actuales de la genética también es un buen sistema para mantenerse al día. Por último, pero no menos importante, es la capacidad de autoaprendizaje a través de la realición de consultas a las bases de datos (tabla 2) y a través de la comunicación con los distintos profesionales.
En resumen, los avances actuales de la genética están permitiendo alcanzar un diagnóstico etiológico en muchas enfermedad con base génica. Es de todos conocido que con un diagnóstico etiológico es posible aportar un pronóstico y orientar hacia un tratamiento más específico. Además, los resultados del análisis genético son también útiles permitiendo la identificación de familiares a riesgo y el inicio de estrategias de prevención.