La broncoscopia o examen directo del árbol traqueobronquial con un tubo flexible (fibrobroncoscopia) o rígido (broncoscopia rígida) representa uno de los avances más significativos en el diagnóstico de las enfermedades respiratorias y actualmente constituye la técnica de elección en la valoración de muchas de ellas, localizadas o difusas. Desde 1897, en que el alemán J.G. Killian desarrolló el primer broncoscopio rígido o el japonés S. Ikeda en 1967 realizó la primera fibrobroncoscopia o broncoscopia flexible, su continua evolución, ampliación o perfeccionamiento ha llegado a constituir una subespecialidad en los centros de referencia. Su uso adecuado es de gran utilidad para el diagnóstico y, en ocasiones, el tratamiento de diversas enfermedades que afectan al aparato respiratorio; permite obtener muestras de las secreciones bronquiales, de la mucosa bronquial o el parénquima pulmonar, e incluso de las adenopatías mediastínicas o lesiones más periféricas para su estudio microbiológico, citohistológico, bioquímico, inmunológico, de su contenido inorgánico o estudios de biología molecular.
Instrumental, técnica y preparación del paciente
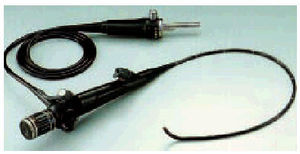
La fibrobroncoscopia se realiza a través de un tubo flexible de una longitud de alrededor de 50-60 cm y de un diámetro de aproximadamente 5 mm, por donde se extiende la fibra óptica y, a través de la conexión a una fuente de luz (fig. 1), conseguimos un campo de visión excelente y la posibilidad de explorar los bronquios segmentarios o subsegmentarios hasta que el avance del instrumento queda limitado por el diámetro del tubo utilizado (de tercer a sexto orden bronquial). Actualmente, también disponemos de instrumentos ultrafinos (calibre externo del tubo de 1,8 mm) que pueden facilitar el acceso o visión hasta la octava o doceava generación bronquial y de cámaras en miniatura insertadas en el extremo distal del instrumento, que han permitido la reproducción de las imágenes en un monitor y su grabación a través del videobroncoscopio, facilitando la mejora o manipulación de estas imágenes, su almacenamiento para posteriores comparaciones y la docencia.
Fig. 1. Fibrobroncoscopio o broncoscopio flexible.
En la parte proximal del instrumento se encuentra una óptica regulable o la conexión al monitor y una palanca posterior que permite la movilización de la punta distal del instrumento para acceder a las localizaciones más superiores o posteriores (angulación anteroposterior de 130-180°). Desde la parte más proximal a la distal se extiende una canal de alrededor de 2 mm, que comunica el exterior con las distintas zonas a las que accedemos y permite la instilación de la anestesia o suero, la aspiración del contenido endobronquial o la introducción de los dispositivos (pinzas o catéteres) para la realización de las distintas técnicas.
Es una exploración bien tolerada que no requiere un ingreso hospitalario en la mayoría de los pacientes y se realiza con lidocaína como anestésico local. Es imprescindible que el paciente esté en ayunas un mínimo de 6 h y sea informado de las características principales de su realización, administrando 0,5 mg de atropina intramuscular o subcutánea antes de la exploración para evitar posibles reacciones vasovagales o la excesiva producción de secreciones, y sedantes o ansiolíticos de forma electiva que, aunque habitualmente no son imprescindibles, pueden de ser de gran ayuda en determinados pacientes o facilitar su tolerancia, llegando a ser recomendados como rutinarios por determinados autores.
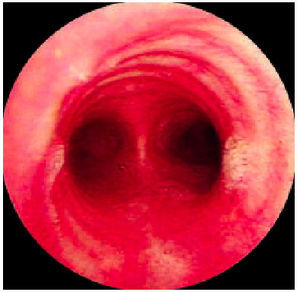
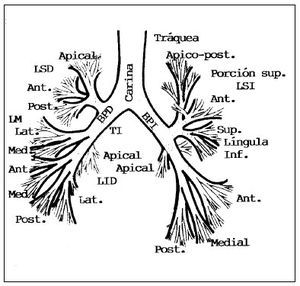
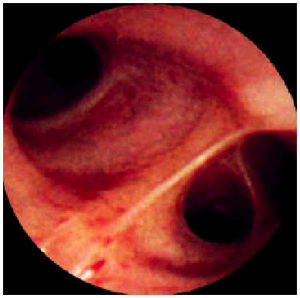
Esta técnica se realiza con el paciente en una posición cómoda (decúbito o sedestación) (fig. 2). El extremo distal del tubo se introduce habitualmente por vía nasal, aunque también puede introducirse por la boca (con una protección para evitar que sea mordido), una traqueostomía o un tubo orotraqueal de intubación. La vía de introducción nasobucal permite la valoración de la laringe y especialmente de la morfología o movilización de las cuerdas vocales. Con posterioridad se accede a la tráquea, la carina y los bronquios principales (fig. 3); asimismo, se examinan de forma sistemática, cuidadosa e independiente ambos árboles bronquiales, con valoración de la morfología, configuración, coloración o vascularización de los distintos lóbulos y segmentos (fig. 4), se toman muestras cuando es anormal o se aspira su contenido para analizarlo (fig. 5).
Fig. 2. Fibrobroncoscopia. Realización de la exploración.
Fig. 3. Fibrobroncoscopia. Visión normal de la tráquea y distalmente de la carina con la entrada de ambos bronquios principales.
Fig. 4. Esquema de la distribución del árbol traqueobronquial normal.
Fig. 5. Fibrobroncoscopia. Visión normal de los bronquios segmentarios del lóbulo inferior derecho.
Esta exploración tiene casi siempre una duración inferior a los 30 min según la colaboración del paciente o las técnicas a realizar, y es aconsejable mantener al paciente en ayunas n mínimo de 2 h para evitar problemas de aspiración tras finalizarla.
Técnicas broncoscópicas
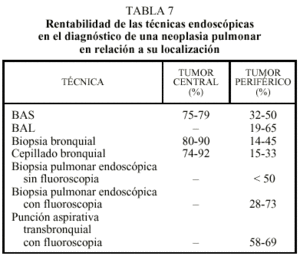
Los métodos o técnicas utilizados para la obtención de muestras durante la broncoscopia quedan reflejados en la tabla 1.
Broncoaspirado (BAS)
Es la muestra que se obtiene de la aspiración del contenido endobronquial tras sobrepasar las cuerdas vocales para evitar la presencia de material orofaríngeo contaminante. Está constituido de secreciones junto con el suero o la anestesia instilados durante la exploración, que puede ser más selectivo de alguna zona específica. Su análisis citológico es importante para la confirmación o el diagnóstico de una neoplasia pulmonar, aunque es necesario excluir la presencia de una neoplasia orofaríngea o esofágica que pueda contaminar la muestra. El análisis microbiológico no suele revestir gran interés para el aislamiento de bacterias en el diagnóstico de una neumonía o una infección respiratoria, por la posibilidad de su contaminación por la flora que coloniza la orofaringe. Su análisis cuantitativo, su realización en los pacientes con traqueostomía o intubación orotraqueal y la posibilidad de aislar gérmenes no saprófitos de la vía aérea superior, como la Legionella spp., Pneumocystis carinii o Mycobacteruim tuberculosis, siguen siendo de interés y recomiendan su utilización cuando se sospechan.
Lavado broncoalveolar (BAL)
El BAL es una técnica endoscópica que permite acceder al estudio del contenido soluble profundo del parénquima pulmonar y es reflejo de la celularidad o contenido del espacio alveolar, y probablemente intersticial. Esta técnica puede proporcionarnos el diagnóstico, el pronóstico, el tratamiento o el material de investigación de numerosas enfermedades pulmonares locales o difusas.
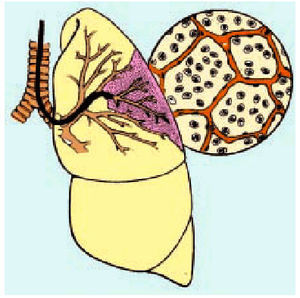
Para su realización es necesario el enclavamiento bronquial de la punta del broncoscopio en la zona a analizar y la instilación de tres alícuotas de suero fisiológico estéril (20-50 ml cada una, con un total de 100-150 ml), de forma independiente e intentando en cada caso aspirar para recuperar el máximo de líquido instilado (fig. 6). La recuperación de la primera alícuota suele ser reflejo del contenido bronquial y las dos últimas son las que procesaremos como contenido alveolointersticial. La cantidad de líquido es variable y depende de la experiencia del broncoscopista, de la colaboración del paciente, de la enfermedad analizada y del segmento pulmonar estudiado, siendo necesario obtener más del 40% del líquido instilado para considerarlo significativo. El material obtenido después de su realización puede analizarse desde el punto de vista citológico, microbiológico, bioquímico y del contenido no orgánico.
Fig. 6. Esquema de la realización y de la zona analizada en el lavado broncoalveolar.
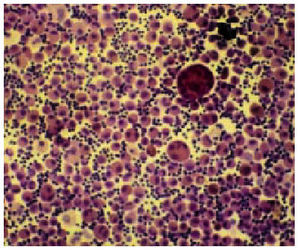
En los pacientes sanos, el líquido recuperado suele ser espumoso y blanquecino-transparente, mientras que en los fumadores es marrón-negruzco, en los pacientes con una neumonía lipoidea con gotas de grasa flotantes, de aspecto lechoso en la proteinosis alveolar o sanguinolento en la hemorragia alveolar (fig. 7). El análisis microbiológico es definitivo para el aislamiento de patógenos no saprófitos y especialmente útil para el diagnóstico de infecciones oportunistas en los pacientes inmunodeprimidos. El riesgo de contaminación por el contenido del canal tras el paso por la orofaringe aconseja que, para el estudio bacteriano o de flora saprófita, tengamos en cuenta la presencia de menos del 1% de células epiteliales, más del 2% de microorganismos intracelulares y un cultivo cuantitativo por encima del 104 UFC/ml. No obstante, su análisis citológico es actualmente uno de los más utilizados y es considerado como el de mayor relevancia en las enfermedades pulmonares difusas, por su valor diagnóstico y pronóstico (tabla 2).
Fig. 7. Lavado broncoalveolar hemático en un paciente con una hemorragia alveolar.
La tinción de Papanicolau o Giemsa permite la identificación del contenido celular, aunque pueden aplicarse otras técnicas como la citometría de flujo, enzimoinmunoanálisis o anticuerpos monoclonales, que ayudan a identificar las subpoblaciones linfocitarias y la posibilidad de un linfoma. El BAL ha sido utilizado para el estudio de masas o nódulos pulmonares periféricos en busca de células neoplásicas, aunque con una rentabilidad limitada que aumenta hasta el 70-80% de los pacientes con un linfoma, carcinoma bronquioloalveolar o linfangitis carcinomatosa. La microscopia electrónica puede facilitar el diagnóstico de la histiocitosis X, la tinción de PAS de la proteinosis alveolar, la tinción de Sudán de la neumonía lipoidea, la tinción de plata-metanamina para la infección por P. carinii y la tinción de Pearls confirma la presencia de macrófagos cargados de hemosiderina o hemosiderófagos en la hemorragia alveolar.
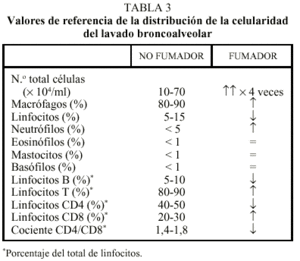
Aunque no existe un acuerdo unánime en la bibliografía sobre los valores normales de la celularidad del BAL, la tabla 3 refleja los más utilizados y su distribución en sujetos normales. En la enfermedad intersticial difusa, el recuento diferencial de las células más habituales ayuda a orientar el diagnóstico (tabla 4), aunque también la presencia de células no habituales puede ser significativa (tabla 5). La presencia de linfocitos maduros en ausencia de neutrófilos aumenta la probabilidad de una sarcoidosis, una alveolitis alérgica extrínseca o una reacción a fármacos (fig. 8), con la particularidad de un incremento del porcentaje del tipo CD8 en las dos últimas. Su presencia, junto a una elevación discreta de los neutrófilos, puede ser indicativa de una fase inicial de entidades, como la alveolitis alérgica extrínseca y la tuberculosis, o sugiere la posibilidad de una sarcoidosis evolucionada. La presencia exclusiva de neutrófilos obliga a excluir que sea secundaria al tabaquismo o a una infección como primeras opciones, entre las que las bronquiectasias suelen presentar los porcentajes más elevados. La exclusión de las entidades anteriores aconseja descartar la presencia de una fibrosis pulmonar idiopática o de una fibrosis asociada a una colagenosis, principalmente la artritis reumatoide o la esclerodermia sistémica. En la fibrosis pulmonar idiopática, la presencia de linfocitosis sugiere una mejor respuesta al tratamiento con corticoides, que disminuye cuando aumentan los neutrófilos y es más desfavorable cuando aumentan los eosinófilos.
Fig. 8. Lavado broncoalveolar (microscopia óptica). Presencia de numerosos macrófagos y aisladas células gigantes multinucleadas en un paciente con una celularidad de predominio linfocitario.
Las muestras obtenidas pueden ser analizadas para determinar el contenido de material inorgánico. Aunque su existencia es sólo signo de exposición y no es patognomónica de enfermedad, puede observarse la presencia de cuerpos de asbesto o ferruginosos (fig. 9), de partículas birrefringentes con la luz polarizada o detectarse con la aplicación de técnicas microanalíticas como la espectroscopia, la microscopia electrónica de barrido o la de energía dispersiva (EDXA).
Fig. 9. Lavado broncoalveolar. Cuerpo de asbesto.
Existe una variante del BAL convencional llamada protegido que ha sido utilizada para evitar su contaminación orofaríngea y para facilitar el estudio microbiológico. Para realizarla se utiliza un catéter especial con una tapón reabsorbible que se introduce en la zona a estudio, más allá de la punta del broncoscopio, y que abarca una zona superior al catéter protegido, donde se instilan cantidades inferiores de suero (60 ml) que posteriormente se procesan para su cultivo cuantitativo, considerándolo positivo cuando se observan microorganismos intracelulares o más de 104 UFC/ml.
Cepillado no protegido
A través del canal de aspiración pueden utilizarse cepillos metálicos especialmente diseñados para frotar o cepillar con suavidad las lesiones a estudio y obtener muestras citológicas superficiales de las células descamadas, que pueden ser visualizadas en el microscopio tras su extensión y fijación (fig. 10). Su rentabilidad aumenta en las lesiones visibles más centrales, especialmente las neoplasias, aunque también ha sido utilizado para estudios microbiológicos o en las lesiones más periféricas cuando son dirigidos con un aparato de fluoroscopia. Esta técnica suele realizarse después de las biopsias por provocar un mayor sangrado que dificultaría las anteriores, que son más rentables.
Fig. 10. Fibrobroncoscopia. Esquema de cepillo endobronquial no protegido.
Cepillado protegido
La utilización convencional de un cepillo o catéter por el canal del broncoscopio posibilita su contaminación por las secreciones aspiradas de la vía aérea superior. Para evitar este problema se idearon los catéteres telescopados de doble luz con oclusión distal o cepillos protegidos, en los que el catéter es doble y telescopado (fig. 11), evitando la contaminación del cepillo interno que se extiende más allá de la punta del broncoscopio en la zona a analizar. Es una técnica sencilla, rápida y bien tolerada que no prolonga en exceso la exploración y que, tomando medidas estériles de manipulación, puede orientarnos sobre la etiología de un infección. La muestra se procesa para su cultivo cuantitativo, considerándolo positivo o como posible etiología de la infección cuando supera las 103 UFC/ml o se observan microorganismos intracelulares. No está indicado cuando la búsqueda está dirigida a microorganismos no sapró fitos, como Legionella spp., Pneumocystis carinii o el Mycobacteryum tuberculosis, en los que un BAS o un BAL suelen ser suficientes.
Fig. 11. Esquema del funcionamiento del catéter protegido o telescopado.
Biopsia bronquial
Consiste en la utilización de pinzas de biopsia para la toma de muestras de 1-3 mm de tamaño de la mucosa bronquial o de lesiones visibles durante la exploración (fig. 12). Es la técnica de elección para el diagnóstico de una neoplasia pulmonar central (confirma el diagnóstico en más del 90% de los casos) y también se ha demostrado útil en otras enfermedades, como la sarcoidosis o la linfangitis carcinomatosa.
Fig. 12. Fibrobroncoscopia. Biopsia bronquial de espolón engrosado y muy vascularizado sospechoso de neoplasia.
Biopsia pulmonar endoscópica
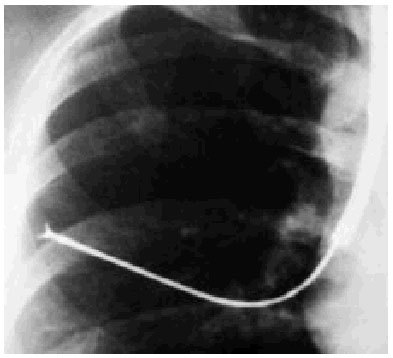
La biopsia pulmonar endoscópica, también llamada biopsia transbronquial, es la técnica que permite la obtención de pequeños fragmentos de parénquima pulmonar, más allá del árbol bronquial y evitando inicialmente una cirugía torácica más invasiva (fig. 13). La toma de muestras de pequeño tamaño y su procedencia de zonas muy concretas limita su rentabilidad, considerándola especialmente útil o indicada cuando se sospecha una enfermedad pulmonar difusa como la tuberculosis miliar, una infección por Pneumocystis carinii si el BAL no es definitivo, o en enfermedades como la sarcoidosis, linfangitis carcinomatosa, carcinoma bronquioloalveolar, proteinosis alveolar, neumonía eosinófila crónica o la BONO (bronquiolitis obliterante con neumonía organizada). Aunque menos útil, también ha permitido un diagnóstico orientativo de enfermedades como la histiocitosis X, amiloidosis, alveolitis alérgica extrínseca o la granulomatosis de Wegener. Lamentablemente, no es útil para el diagnóstico o la clasificación de las neumonías intersticiales, la fibrosis pulmonar idiopática o las fibrosis pulmonares asociadas a las colagenosis, donde en general sólo ayuda a descartar algunas de las entidades descritas inicialmente.
Fig. 13. Radiografía de tórax. Pinza de biopsia en la periferia para la realización de una biopsia pulmonar endoscópica.
La toma de 8-10 muestras de parénquima pulmonar por esta técnica puede permitir el diagnóstico de hasta el 25% de las enfermedades pulmonares intersticiales difusas, orientarlo en el 25% y, en el resto, sólo facilitar la exclusión de algunas de ellas. No obstante, es muy importante confirmar su indicación, ya que es una de las técnicas que puede asociarse a un mayor número de complicaciones, como el neumotórax (10% de los casos) o la hemorragia pulmonar, que desaconseja su realización en los pacientes con hipertensión pulmonar o de forma ambulatoria.
Punción aspirativa transbronquial
En estos últimos años ha sido posible la utilización de agujas de aspiración citológica (20-22 G) o histológica (18-19 G) unidas a un catéter e introducidas a través del canal del broncoscopio para posteriormente atravesar la pared bronquial. Esta técnica ha sido utilizada para la punción de adenopatías hiliares o mediastínicas a través de la tráquea o los bronquios principales, una vez localizadas previamente con la TC torácica, el diagnóstico de lesiones extrínsecas o submucosas en las que las biopsias convencionales son inespecíficas, la punción de masas mediastínicas, la punción de tumores con alto riesgo de sangrado con las biopsias bronquiales, en tumores necróticos donde interesa la toma de muestras de mayor profundidad e incluso para el drenaje de quistes o abscesos pulmonares y del mediastino. La utilización conjunta con la fluoroscopia también ha permitido la punción de lesiones más periféricas.
Indicaciones
Las indicaciones de la broncoscopia han ido ampliándose con el tiempo, manteniendo la mayoría de las iniciales, y pueden clasificarse en tres grupos: diagnósticas, terapéuticas o para el control de la eficacia de determinados tratamientos (tabla 6).
Diagnósticas
Las indicaciones diagnósticas son las más numerosas y entre ellas destacan, por su especial importancia, el estudio de una neoplasia pulmonar, de la hemoptisis, el estudio microbiológico en enfermos inmunodeprimidos o no, el estudio de la enfermedad pulmonar intersticial y la valoración de infiltrados pulmonares o imágenes radiológicas no específicas.
En las neoplasias pulmonares es la técnica de elección, tanto para el diagnóstico como para completar su estadificación, y con unas rentabilidades que varían con relación a la localización de las lesiones (tabla 7). La presencia de lesiones proximales o centrales aumenta mucho su rentabilidad, aunque tampoco es despreciable en las lesiones más periféricas. Esta exploración proporciona signos de inoperabilidad cuando se confirma una parálisis de las cuerdas vocales, una infiltración de la carina, la tráquea o en los bronquios principales a menos de 2 cm de carina y la presencia de múltiples lesiones. Actualmente, uno de los aspectos más interesantes y novedosos con relación a las neoplasias es su aplicación en el diagnóstico precoz. Gracias a la utilización de marcadores fotosensibilizantes, como las hematoporfirinas inyectadas por vía intravenosa o utilizando la especial fluorescencia (sistema LIFE o de autofluorescencia) que emiten las displasias o neoplasias pulmonares con relación a la mucosa normal, se han iniciado múltiples estudios que confirman la posibilidad de detectar, seguir o eliminar zonas de riesgo de malignidad que en la exploración convencional, la radiografía o la TC y el estudio del esputo podrían pasar desapercibidas.
Aunque la radiografía sea normal, la presencia de hemoptisis en un paciente con factores de riesgo para una neoplasia o en fumadores de más de 45 años es una de las principales indicaciones de la broncoscopia. En la hemoptisis, una broncoscopia en el momento del sangrado puede facilitar el diagnóstico etiológico, localizar el sangrado y/o controlarlo endoscópicamente (fig. 14). La hemostasia endoscópica se suele conseguir con el enclavamiento y la aspiración continua colapsando la zona del sangrado, instilando suero frío o diluciones de adrenalina, utilizando catéteres balón de taponamiento y con resinas.
En los enfermos con infecciones pulmonares, y especialmente en los inmunodeprimidos, es muy útil para el estudio microbiológico y la toma selectiva de muestras para su cultivo. En los pacientes con sospecha de tuberculosis sólo estará indicada cuando el análisis de esputo es repetidamente negativo, y en los pacientes con una neumonía, la mayoría de autores coinciden en que estaría indicada cuando no existe una buena respuesta al tratamiento antibiótico, sigue una mala evolución o es grave y se sospecha una infección no habitual u otra etiología no infecciosa. Sin embargo, sería distinto en los pacientes inmunodeprimidos por la falta de especificidad de las manifestaciones clínicas o radiológicas y la amplia variedad de etiologías que complican la mayoría de decisiones diagnósticas, en las que la realización precoz de la broncoscopia podría facilitarlas gracias al estudio citológico o microbiológico que proporciona la realización de técnicas como el BAL. Así, P. carinii puede ser aislado en el 80-90% de los casos cuando realizamos el BAL o casi en el 100% cuando también realizamos la biopsia pulmonar endoscópica en los enfermos infectados con sida o en otras entidades similares.
En la enfermedad pulmonar intersticial, la realización del BAS, el BAL, las biopsias bronquiales y las pulmonares endoscópicas son de gran ayuda para diagnosticar u orientar el diagnóstico de muchas de sus etiologías. Es una técnica especialmente rentable en el diagnóstico de la sarcoidosis, confirmando la presencia de granulomas no necrosantes en el 37-90% de las biopsias bronquiales o el 80-90% de las pulmonares endoscópicas (el 60% cuando la radiografía es normal) y por la presencia de una linfocitosis marcada con predominio de CD4, que en algunos grupos, y especialmente cuando el cociente CD4/CD8 es superior a 3,5, ha sido considerado suficiente para su diagnóstico una vez excluidas otras causas de linfocitosis. Aunque en la fibrosis pulmonar idiopática suele ser insuficiente para un diagnóstico definitivo, en la alveolitis alérgica extrínseca es característica la presencia de una linfocitosis marcada con predominio de CD8 en el BAL y de biopsias pulmonares endoscópicas inespecíficas, con algunos granulomas incipientes que, en un contexto clínico y unas precipitinas positivas, es suficiente para el diagnóstico. En los pacientes con una histiocitosis X, la presencia en el BAL de histiocitos o células de Langerhans superior al 3% con cuerpos de Birbek, o una inmunohistoquímica que demuestre un incremento de la positividad de CD1 o de la proteína S100, suelen ser suficientes para el diagnóstico.
Terapéuticas
Independientemente de las indicaciones más tradicionales, como el control de la hemoptisis, la intubación electiva, la extracción de cuerpos extraños y la aspiración de secreciones o tapones mucosos endobronquiales, uno de sus aspectos en mayor expansión y evolución es la posibilidad de la resección o desobstrucción de las estenosis traqueobronquiales benignas o malignas, junto a la colocación de prótesis.
En la actualidad, la presencia de una lesión traqueobronquial obstructiva parcial o importante puede ser corregida de forma endoscópica sin necesidad de recurrir a una cirugía más invasiva. En la tabla 8 se exponen las principales técnicas utilizadas como terapia endobronquial con la intención de repermeabilizar la tráquea o los bronquios principales a través de la dilatación de la luz o la resección de la obstrucción utilizando en la mayoría de los casos el broncoscopio rígido. La resección con láser utiliza una luz amplificada por emisión de radiación sobre el tejido anormal con un sistema de dióxido de carbono, argón o YAG neodimio (fig. 15). Esta técnica es muy eficaz, alcanzando resultados inmediatos muy favorables, aunque no debe utilizarse cuando el pronóstico del paciente es muy malo a corto plazo, si existe riesgo de crear una fístula, la obstrucción es extrínseca o las posibilidades de viabilidad distal de la obstrucción son bajas (obstrucción superior a 4-6 semanas o en lesiones muy extensas). En el electrocauterio se utiliza la electricidad de forma similar a un bisturí para producir calor y destruir el tejido patológico por vaporización, mientras que en la crioterapia se aplica frío sobre las lesiones en varias sesiones para conseguir su destrucción (deshidratación, desvascularización, formación de cristales y alteraciones metabólicas). Con la braquiterapia se utiliza la irradiación endobronquial a dosis variables a través de sondas especiales para destruir los tejidos tumorales, y en la terapia fotodinámica (Photodynamic therapy [PDT]) se aprovecha la fluorescencia emitida por los tejidos neoplásicos superficiales endobronquialmente marcados después de la administración de hematoporfirinas intravenosas para aplicar una luz a una determinada longitud de onda, que activa la fotosensibilidad-fototoxicidad de estos tejidos y provoca su destrucción selectiva.
Fig. 14. Fibrobroncoscopia. Oclusión sangrante e irregular de un segmento pulmonar por una neoplasia.
Fig. 15. Broncoscopia. Resección por láser de tumoración endobronquial.
Una vez desobstruida la vía aérea, puede asegurarse su permeabilidad con la utilización de prótesis endobronquiales. Existen prótesis metálicas, siliconadas o mixtas de distintos tamaños y formas para introducirlas en las vías aéreas de mayor calibre y con la posibilidad de su retirada o recambio posterior. Las principales complicaciones relacionadas con su utilización recaen en la posibilidad de su malposición, rotura o migración, de la reacción local, dificultad de expectoración, infección, hemoptisis, la perforación de la vía aérea o la posibilidad de que la sobrepase una progresión de la tumoración.
En otro tipo de lesiones puede ser suficiente su dilatación con sondas balón o tubos rígidos de distinto calibre y, en el caso de la presencia de una fístula, puede ocluirse utilizando una prótesis o de forma transitoria con resinas y gomas de oclusión, a la espera de una resolución espontánea o quirúrgica, dependiendo de su etiología.
Valoración de distintos tratamientos
Esta exploración ha sido utilizada para valorar la respuesta o evolución de las neoplasias pulmonares después de realizar un tratamiento con quimioterapia o radioterapia, aunque en la actualidad, y siempre que no existan dudas o discrepancias, puede realizarse con la TC. No obstante, todavía sigue siendo útil y está indicada en el control de los pacientes que han sido intervenidos por una neoplasia pulmonar para descartar complicaciones y su recidiva local o cicatrizal, que es una de las más frecuentes.
En el trasplante pulmonar es la técnica de elección para la confirmación de un rechazo o de una infección oportunista y su indicación forma parte de la rutina de seguimiento de estos pacientes. Además, en los enfermos que han sido sometidos a una instrumentación invasiva o prolongada de las vías aéreas superiores, como traqueostomía o la intubación orotraqueal, esta exploración facilita el diagnóstico o exclusión de lesiones en las cuerdas vocales o la tráquea, como los granulomas, una reacción inflamatoria y estenosis organizadas.
Indicaciones urgentes
En la tabla 6 se reflejan las indicaciones más urgentes de la broncoscopia y en las que sería aconsejable su realización inmediata o en un plazo máximo de 24-48 h por el riesgo vital que supone para el paciente, sobre todo en aquellos que están más comprometidos desde el punto de vista respiratorio o se encuentran en las unidades de enfermos más críticos.
Complicaciones
Las complicaciones durante la broncoscopia son poco frecuentes y de escasa importancia. Es una exploración con una tolerancia excelente y se asocia a una mortalidad del 0,01-0,0001% de los pacientes, afectando especialmente a los más graves y con mayor deterioro respiratorio. En la tabla 9 se exponen las principales complicaciones relacionadas con la broncoscopia. Los pacientes sometidos a la biopsia pulmonar endoscópica son los más susceptibles de sufrir complicaciones, como el neumotórax (10% de los casos) o la hemoptisis, y esto obliga a restringir su realización a los pacientes con una clara indicación. El broncoespasmo suele ocurrir en los pacientes con asma o hiperreactividad bronquial y puede ser evitado o controlado con la administración previa de broncodilatadores. La hipoxemia es un fenómeno habitual durante la exploración, aunque suele ser más pronunciada y de riesgo en los pacientes con una insuficiencia respiratoria o a los que se realizarán más técnicas invasivas, y puede evitarse con la administración de oxigenoterapia suplementaria a altas dosis. Las arritmias cardíacas suelen ocurrir en los pacientes con cardiopatías de base o mayor compromiso respiratorio, y estamos obligados a monitorizar a estos pacientes durante la exploración para su detección o tratamiento precoz. La hemorragia es poco frecuente si no existen trastornos de la coagulación, y suele estar en relación con técnicas como las biopsias, consiguiendo en casi todos los casos un control espontáneo o con medidas de hemostasia endoscópica similares a las realizadas durante la hemoptisis.
Contraindicaciones
En la práctica diaria existen pocas contraindicaciones para la realización de la broncoscopia, que quedan reflejadas en la tabla 10. La falta de tolerancia o colaboración del paciente puede solucionarse con la utilización de anestesia general o sedación consciente. No obstante, las contraindicaciones más importantes y de mayor riesgo son las relacionadas con los trastornos de la coagulación, el compromiso respiratorio o insuficiencia respiratoria, la hemorragia cerebral reciente o la presencia de cardiopatías, sobre todo cuando existen arritmias no controladas o cardiopatía isquémica activa. Para esta última es aconsejable un tiempo de espera de hasta un mes tras el control de la isquemia y, si es posible, de la disponibilidad de una prueba de esfuerzo que lo confirme.
Nuevas aplicaciones
Ecografía broncoscópica
La disponibilidad de un minitransductor con sondas de ultrasonidos que a través del canal del broncoscopio puede enclavarse en forma de balón hinchable en la tráquea o los bronquios principales evitando el aire pulmonar ha permitido visualizar el mediastino y la zona de 360° que envuelve a las estructuras donde se fija. Este tipo de estudios permiten localizar y delimitar la pared bronquial, tumoraciones pulmonares o mediastínicas no visibles endoscópicamente, estructuras vasculares o adenopáticas, zonas necróticas y servir de guía para la realización de biopsias o punciones transbronquiales. Esta técnica ya ha sido utilizada con buenos resultados en el estudio de la neoplasia pulmonar, tanto para su diagnóstico como para mejorar su estadificación, facilitando el estudio más detallado de las adenopatías mediastínicas o en la mejor delimitación de las tumoraciones más proximales.
Broncoscopia virtual
La rápida evolución tecnológica de la tomografía computarizada helicoidal o espiral y la posibilidad de realizar múltiples cortes en poco tiempo en distintas localizaciones para posteriormente reconstruirlos ha permitido obtener imágenes internas de la vía aérea de una forma menos invasiva, similares a la fibrobroncoscopia en la llamada broncoscopia virtual. No obstante, es una técnica en desarrollo y ha sido considerada de utilidad en el estudio-estadificación de las neoplasias pulmonares, la valoración de masas mediastínicas-pulmonares y del árbol traqueobronquial. Sus inconvenientes principales son la presencia de artefactos o numerosas variantes anatómicas, su elevado coste, la dificultad de valoración de las vías aéreas de menor calibre o de una definición clara de los límites de las lesiones y la necesidad de una broncoscopia convencional, a la que hasta el momento no ha conseguido sustituir cuando el resultado es dudoso o se necesita una confirmación definitiva.
Bibliografía general
Ahmad M, Dweik RA. Future of flexible bronchoscopy. Clin Chest Med 1999;20:1-17.
Baughman RP, Drent M. Role of bronchoalveolar lavage in interstitial lung diseases. Clin Chest Med 2001;22:331-42.
Becker HD. Bronchoscopy: year 2001 and beyond. Clin Chest Med 2001;22:225-40.
Castella J, Ancochea J, Llorente L, Puzo C, Sanchís J, Sueiro A, et al. Lavado broncoalveolar. Arch Bronconeumol 1997;33:515-26.
Castella J, Ausina V, Puzo C, Quintana E, Rodríguez G, Rello U, et al. Lavado broncoalveolar protegido: nuevo método endoscópico en el diagnóstico de las neumonías bacterianas. Med Clin (Barc) 1991;96:721-6.
Castella J, Hernández S, Puzo C, Padilla I, García E, de la Heras P, et al. Punción bronquial aspirativa en las neoplasias localizadas en bronquios centrales. Arch Bronconeumol 1990;27:68-70.
Castella J, Puzo C. Broncología. Barcelona: Salvat, 1982.
Disdier C, Sánchez de Cos J, Masa JF. Rentabilidad de la broncoscopia flexible en el diagnóstico y estadificación del carcinoma broncogénico. Neumosur 1997;9:228-35.
Disdier C, Varela G, Sánchez de Cos J, Bengoechea O, Jiménez M, Garín J, et al. Utilidad de la punción transbronquial y la mediastinoescopia en la estadificación ganglionar mediastínica del carcinoma broncogénico no microcítico. Estudio preliminar. Arch Bronconeumol 1998;34:237-44.
Fernández J. Indicaciones de la broncoscopia. Medicine 1997;7:1669-70.
Fulkerson WJ. Fiberoptic bronchoscopy. N Eng J Med 1984;311:511-5.
García E, Puzo C, Castella J. Complicaciones de la fibrobroncoscopia. Arch Bronconeumol 1993;29:153-7.
Haponik EF, Aquino S, Vining DJ. Virtual bronchoscopy. Clin Chest Med 1999;20:201-17.
Liebler JM, Markin CJ. Fiberoptic bronchoscopy for diagnosis and treatment. Clin Chest Med 2000;16:83-100.
Moreno E, Pérez A. Evolución histórica en el centenario de la broncoscopia: pasado, presente y futuro. Arch Bronconeumol 1998;34:300-6.
Prakash UBS. Bronchoscopy. New York: Raven Press, 1994.
Rafanan AL, Mehta AC. Stenting of the tracheobronchial tree. Clin Chest Med 2000;38:395-407.
Ramser ER, Beamis JF. Laser bronchoscopy. Clin Chest Med 1995;16:415-26.
Reynolds HY. Bronchoalveolar lavage. Am Rev Respir Dis 1987;135:250-63.
Sheski FD, Mathur PN. Cryotherapy, electrocautery and brachytherapy. Clin Chest Med 1999;20:123-38.
Wang KP. Transbronchial needle aspiration. How I do it. J Bronchology 1994;1:63-8.