de estudios existentes.
Desde los primeros años de la pandemia por el VIH hemos asistido a una reducción progresiva en la incidencia y mortalidad de infecciones oportunistas, resultado de un mejor reconocimiento y tratamiento de las mismas y el uso de terapias antirretrovirales combinadas. El claro beneficio obtenido con el uso del tratamiento antirretroviral de gran actividad (TARGA) en los últimos años, se asocia con la recuperación inmune obtenida en un porcentaje elevado de pacientes, incluso en las fases más avanzadas de la enfermedad, suficiente al menos para mantener dichas infecciones bajo control1,2.
La primera evidencia de recuperación inmune fue clínica, y se basó en estudios observacionales, demostrando la recuperación de procesos infecciosos crónicos asociados a inmunodepresión grave en pacientes que iniciaban TARGA3,4. Estudios posteriores demostraron que el uso de TARGA con control virológico mantenido se asociaba a una recuperacion linfocitaria, a expensas de células de memoria en las fases más tempranas y de células naive posteriormente, con recuperación de la respuesta específica frente a los distintos patógenos oportunistas5,6. Como resultado de estos datos, hemos asistidos a un número creciente de estudios encaminados a demostrar la seguridad de la retirada de profilaxis frente a infecciones oportunistas en pacientes con TARGA que presentan un buen control virológico y una recuperación inmune adecuada.
El presente capítulo intenta ofrecer una visión general de las infecciones oportunistas más frecuentes en nuestro medio que se pueden beneficiar de una retirada de profilaxis, basado en estudios que soporten dichas recomendaciones. La información presentada se basa fundamentalmente en las recomendaciones hechas por el Servicio de Salud pública de los EE.UU. y de la Sociedad Americana de Enfermedades Infecciosas (IDSA), el Grupo Español de Estudio del Sida (GESIDA) de la Sociedad Española de Enfermedades Infecciosas (SEIMC), y las recomendaciones presentadas por Kovacs y Masur recientemente7-9. Otros estudios relevantes publicados en los últimos años serán, asimismo, revisados.
Neumonia por Pneumocystis carinii
Indicación de profilaxis
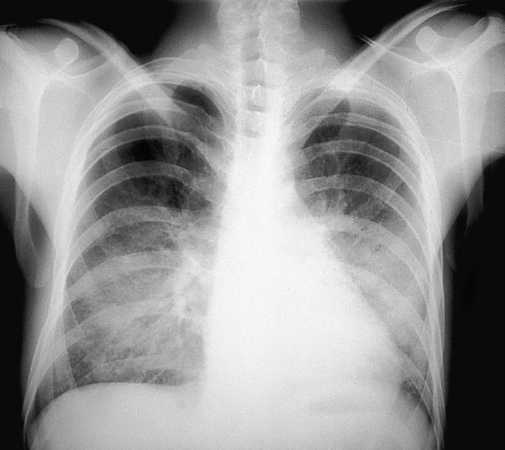
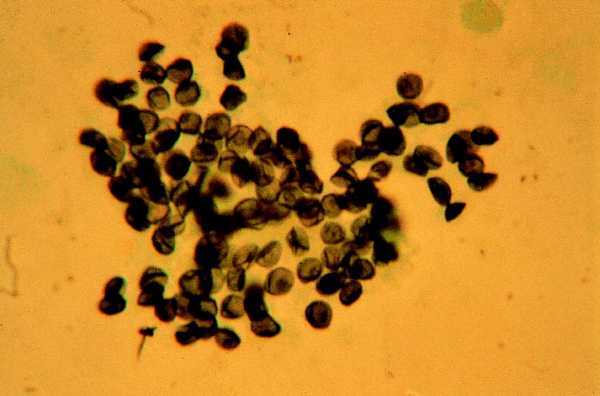
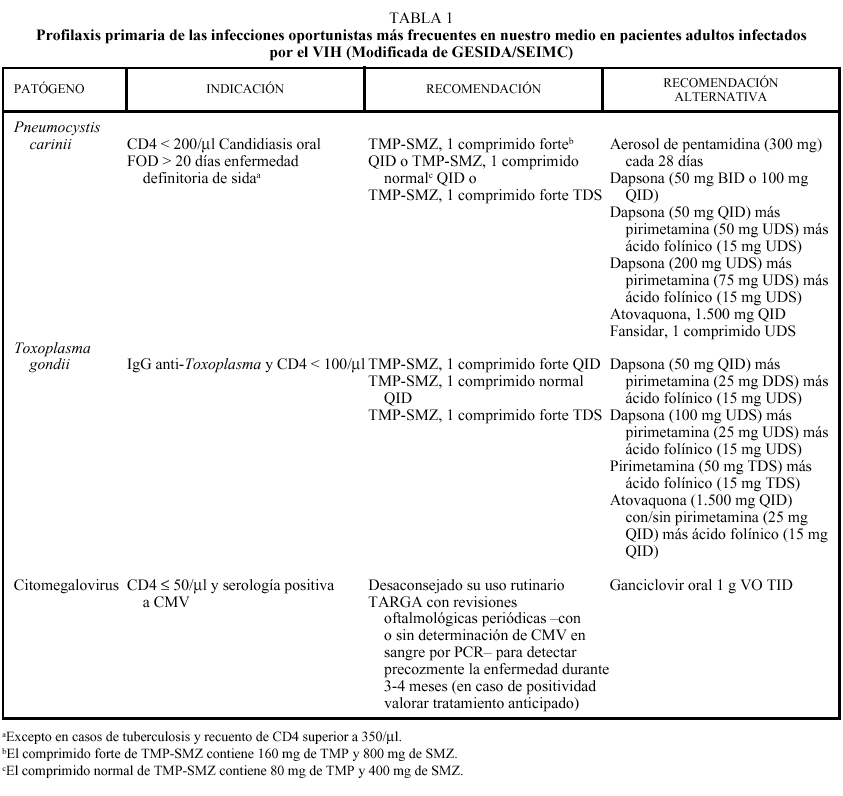
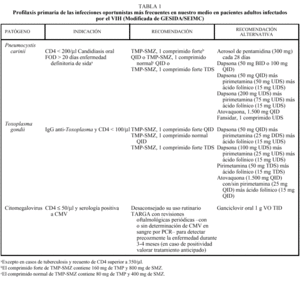
Se indicará profilaxis primaria frente a PCP en todo paciente con recuento de linfocitos CD4 menor de 200/µl, historia de candidiasis oral o episodio definitorio de sida asociado. Dicha recomendación deberá considerarse también en pacientes con recuentos de linfocitos CD4 superiores a 200/µl pero con porcentajes inferiores al 14% criterio definitorio de sida o cargas virales elevadas factor de riesgo independiente para el desarrollo de infecciones oportunistas7-9. Los pacientes que han presentado una PCP (figs. 1 y 2) deberán mantener una profilaxis secundaria para prevenir recidivas. En las tablas 1 y 2 se resumen las pautas recomendadas siendo el trimetoprim-sulfametoxazol (TMP-SMX) el fármaco de elección.
Fig. 1. Radiografía de tórax de un pacientes con sida con una neumonía por P. carinii que muestra el típico patrón intersticial bilateral.
Fig. 2. Tinción de plata metenamina del lavado broncoalveolar del caso anterior con numerosos quistes de P. carinii.
Estudios sobre la retirada de la profilaxis
En el primer estudio prospectivo, abierto, aleatorizado y multicéntrico presentado, y realizado por el grupo GESIDA sobre un total de 474 pacientes, la retirada de la profilaxis primaria frente a PCP demostró ser segura. Ninguno de los 240 pacientes que suspendieron la profilaxis, ni del restante grupo control que la mantuvo, presentó recidivas tras un seguimiento de 19 meses. Los pacientes incluidos en el estudio recibían TARGA y habían presentado una recuperación de CD4 superior a 200/µl con cargas virales inferiores a 5.000 copias/ml el 80% con menos de 500 copias durante un mínimo de 3 meses. Otros 113 pacientes en profilaxis secundaria frente a PCP y con los mismos criterios de inclusión fueron aleatorizados a retirar o mantener profilaxis frente a PCP. Ninguno de los 60 pacientes que suprimieron la profilaxis ni del resto del grupo que la mantuvieron presentó recidiva de PCP10. Resultados similares han sido demostrados en otros estudios no aleatorizados. Datos obtenidos del estudio EuroSIDA sobre un total de 378 pacientes, 319 de ellos en profilaxis primaria y 59 con profilaxis secundaria, con recuentos de linfocitos CD4 superior a 200/µl y una carga viral media de 500 copias/ml demostraron que la retirada de profilaxis no se acompañaba de recidivas en el grupo en el que se suspendió la profilaxis ni en el grupo control11. Finalmente, en un metaanálisis europeo llevado a cabo por Ledergerber et al que implicaba a 17.500 pacientes de 8 cohortes prospectivas (246 con historia previa de PCP), que cumplían los requisitos de control virológico y recuperación inmune en pacientes con TARGA, tampoco se registraron casos de PCP tras un seguimiento de 5 a 13 meses (236 personas/año)12.
Criterios de retirada de la profilaxis
Tanto la profilaxis primaria como secundaria podrá retirarse en aquellos pacientes, que recibiendo TARGA durante al menos 6 meses, presenten una recuperación de linfocitos CD4 superior a 200/µl con la carga viral controlada (indetectable o menor de 5.000 copias durante un mínimo de 3-6 meses)7-9 (tabla 3). En aquellos pacientes en los que aparezcan nuevos episodios de sida o disminución de linfocitos CD4 inferior a 200/µl, se reinstaurará la profilaxis antibiótica.
Toxoplasmosis encefálica
Indicación de profilaxis
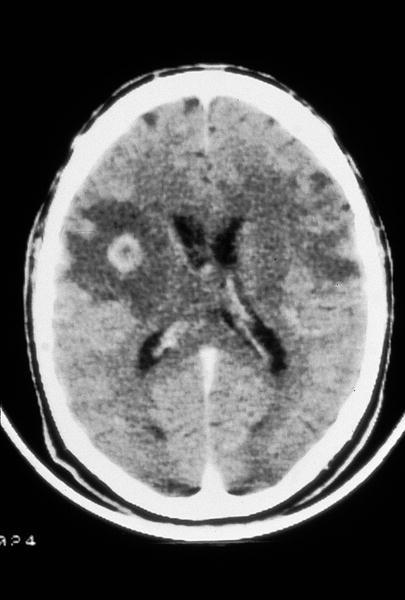
Se recomienda el inicio de profilaxis primaria en todo paciente con una cifra de linfocitos CD4 menor de 100/µl y serología positiva para T. gondii, siendo el TMP-SMX el tratamiento de elección al ofrecer también protección frente a PCP7-9. En aquellos pacientes que han tenido una toxoplasmosis encefálica (fig. 3) o de otra localización deberán mantener profilaxis secundaria siendo de elección la combinación pirimetamina-sulfadiacina junto con ácido folínico al dar protección añadida frente a la PCP7-9. En las tablas 1 y 2 se consideran otras opciones terapéuticas.
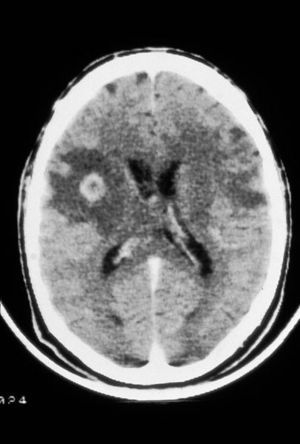
Fig. 3. TC craneal carácterística de un paciente con sida y una toxoplasmosis encefálica que presenta numerosas lesiones hipodensas; algunas de ellas captan contraste de forma anular.
Estudios sobre la retirada de la profilaxis
Datos obtenidos de la cohorte suiza, sobre un grupo de 240 pacientes que recibían profilaxis primaria frente a Toxoplasma gondii y con recuperación de los linfocitos CD4 superior a 200/µl tras terapia TARGA, demostraron que la retirada de la profilaxis en estos pacientes era segura. Los pacientes fueron seguidos durante una media de 26 meses, 199 de los cuales suspendieron la profilaxis frente a toxoplasma, no presentando ninguno de ellos recidiva13.
En el estudio multicéntrico y aleatorizado llevado a cabo por el grupo GESIDA sobre 438 pacientes con una serología para toxoplasma positiva 54 de ellos con antecedentes de toxoplasmosis encefálica no aparecieron nuevos casos ni en el grupo que mantuvo profilaxis ni en el grupo en el que se retiró. En este estudio, 225 pacientes con recuperación de linfocitos CD4 con valores superiores a 200/µl y cargas virales inferiores a 5.000 copias/ml suspendieron la profilaxis frente a toxoplasma, 27 de ellos recibían profilaxis secundaria. Tras un seguimiento de 21 meses en el grupo en el que se suspendió la profilaxis primaria, y de 12 meses en el grupo control que se retiró la profilaxis, no apareció ningún nuevo caso o recidiva14.
Criterios de retirada de la profilaxis
Los pacientes en terapia combinada (TARGA) con aumento de linfocitos CD4 superior a 200/µl durante más de 3-6 meses (tabla 3), una carga viral controlada, y una estabilidad clínica serán candidatos a la retirada de la profilaxis primaria, existiendo datos a favor de su seguridad en la retirada de la profilaxis secundaria si cumplen estos mismos criterios. En aquellos pacientes en los que se plantee la retirada, deberá realizarse un control estrecho debiendo reiniciarse la profilaxis frente a toxoplasma en aquellas situaciones en las que las cifras de CD4 disminuyan a menos de 200/µl8.
Infección por citomegalovirus
Indicación de profilaxis
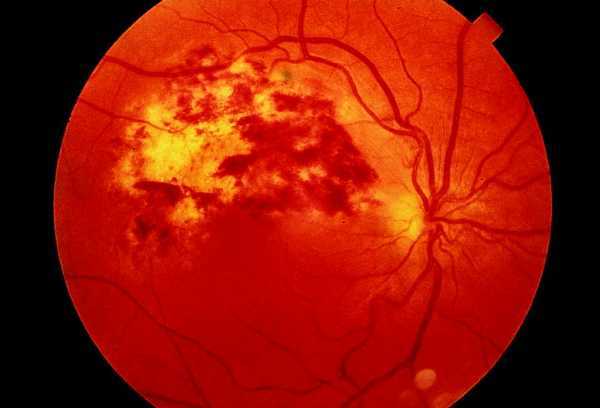
En la actualidad, no se recomienda realizar profilaxis primaria de manera rutinaria frente a citomegalovirus (CMV) dada la ausencia de estudios que demuestren una mayor supervivencia en los pacientes tratados15. Factores como el riesgo de toxicidad, la aparición de resistencias asociadas a un uso generalizado de ganciclovir, el número elevado de pastillas que implica y el coste del mismo irían también en contra de su uso sistemático. No obstante, podría valorarse la posibilidad de instaurar profilaxis temporal durante los primeros meses de tratamiento en aquellos pacientes con recuento de linfocitos CD4 inferior a 50/µl y detección viral Ag pp65 o PCR-CMV en plasma hasta obtener valores mantenidos de linfocitos CD4 superiores a 100-150/µl. Datos presentados por Casado et al sobre una cohorte de 172 pacientes con menos de 100 linfocitos CD4, demostró una recidiva por CMV en el 38% de los pacientes con PCR-CMV positivas frente al 2% de los pacientes con PCR-CMV negativa, siendo el riesgo mayor en los primeros 3-6 meses 16. Los controles oftalmológicos serán obligados para detectar la eventual aparición de retinitis por CMV (fig. 4) en sus fases más tempranas.
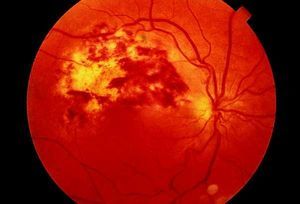
Fig. 4. Paciente infectado por el VIH con una retinitis por citomegalovirus.
En relación con la profilaxis secundaria, en pacientes tratados por retinitis por CMV y con buena respuesta, se mantendrá el tratamiento supresor con ganciclovir, foscarnet o cidofovir (tabla 2). A falta de estudios comparativos entre ellos, la elección del fármaco a utilizar se basará más en su patrón de toxicidad.
Estudios sobre la retirada de la profilaxis
Diversos estudios, aunque con muestras pequeñas, han demostrado la seguridad de la retirada de la profilaxis secundaria frente a CMV. Datos presentados por Tural et al sobre una muestra de 7 pacientes que suspendieron la profilaxis secundaria frente a CMV, tras una recuperación de linfocitos CD4 en cifras superiores a 150/µl3, demostró que no se asociaba a recidiva tras una mediana de seguimiento de 9 meses17. Datos similares fueron obtenidos por Whitcup et al en una muestra de 14 pacientes con una recuperación inmune y un seguimiento medio de 16 meses18. Recientemente, se han presentado datos con seguimientos más prolongados, durante una mediana de 48 semanas, en 35 pacientes con terapia TARGA y sin recibir profilaxis, sin presentar tampoco recidivas19. Finalmente, algunos autores (Casado et al) han demostrado que el riesgo de recidiva de retinitis por CMV puede asociarse más con un recuento de CD4 inferior a 50/µl3 que con la carga viral20.
Criterios de retirada de la profilaxis
Se valorará la retirada de la profilaxis frente a CMV en pacientes con un control virológico y una recuperación de cifras de linfocitos CD4 superiores a 100-150/µl durante un mínimo de 3-6 meses5-9 (tabla 3). Deberán tenerse en cuenta además otros factores como la ausencia de actividad viral, localización anatómica de las lesiones, presencia o ausencia de lesiones en ojo conco mitante y ausencia o no de antigenemia CMV. Una disminución de los valores de CD4 inferior a 50 se asocia a una mayor incidencia de recidivas, por lo que en estos pacientes deberá reinstaurarse la profilaxis frente a CMV. En los pacientes con reactivación de retinitis y/o vitritis durante los primeros meses de TARGA, con recuperación inmune, deberá replantearse la necesidad de reiniciar la profilaxis frente a CMV.
Infección diseminada por Mycobacterium avium-complex
Indicación de profilaxis
Dada la baja incidencia de MAC en nuestro medio, incluso previo a la era del TARGA, no se considera indicada la instauración de profilaxis primaria8.
Estudios sobre la retirada de la profilaxis
En nuestro medio y dada la baja incidencia de infección por MAC, no está indicado realizar profilaxis primaria. No obstante, diversos estudios han demostrado la seguridad de la retirada de dicha profilaxis en pacientes con TARGA y recuperación inmune21,22. En relación con la retirada de la profilaxis secundaria en pacientes con historia de enfermedad por MAC, diversos estudios sugieren que puede ser segura tras la recuperación inmune mantenida durante un mínimo de 6 meses. Entre otros estudios, los datos presentados por Martínez et al con una muestra de 5 pacientes, así como los de Soriano et al con una muestra de 7 pacientes, sugieren que la retirada de la profilaxis secundaria puede ser segura en pacientes con control virológico y una recuperación de valores de CD4 superior a 100/µl durante más de 6 meses. En ambos estudios, la retirada de profilaxis secundaria no dio lugar a recidivas tras un seguimiento de 12 y 18 meses respectivamente 23,24.
Criterios de retirada de la profilaxis
Estudios realizados en grupos reducidos de pacientes con TARGA y recuperación inmune sugieren que la supresión de profilaxis secundaria en pacientes con control virológico y una recuperación de cifras de CD4 superior a 100/µl durante más de 6 meses podría ser segura por lo que podría considerarse8 (tabla 3). Una reducción de CD4 inferior a 100/µl aconsejaría reiniciar profilaxis frente a MAC.
Criptococosis diseminada
Indicación de profilaxis
En nuestro entorno no se recomienda el inicio de profilaxis primaria frente al criptococo, dada su baja incidencia en nuestro medio y el riesgo de aparición de resistencias tras el uso extendido y prolongado de fluconazol como profilaxis. Los pacientes con meningitis por criptococo deberán recibir tratamiento de inducción con anfotericina B se debe valorar la asociación con flucitosina continuando posteriormente tratamiento supresor con fluconazol durante un tiempo indefinido5-9 (tablas 2 y 3).
Estudios sobre la retirada de la profilaxis
Estudios presentados por Alberg et al, sobre 6 pacientes que suspendieron el tratamiento supresor con fluconazol, tras haber presentado un cuadro de criptococosis diseminada, demostraron que su retirada en pacientes con cultivos negativos para criptococo y un buen control inmunológico y virológico no se acompañaban de recidiva tras un seguimiento de 8-9 meses25. Datos similares sobre una muestra de 6 pacientes fueron presentados por Martínez et al. En este estudio, además, a pesar de cultivos seriados negativos, se objetivaron títulos positivos de Ag criptocócico fluctuantes (de 1:8 a 1:256) que no se relacionaron con el tiempo de retirada de profilaxis ni con la clínica de meningitits26. Estos estudios reflejan que una terapia efectiva permitiría una recuperación inmune frente a criptococo, como ocurre frente a otros patógenos como PCP y CMV ya comentados.
Criterios de retirada de la profilaxis
En el momento actual no existen criterios para recomendar una retirada de profilaxis, dada la falta de estudios con un número suficiente de pacientes que apoyen la seguridad de dicha retirada.
Leishmaniasis
A pesar de que la leishmaniasis visceral es una de las parasitosis más frecuentes en nuestro medio en los pacientes con el VIH existen muy pocos datos que permitan hacer ninguna recomendación respecto a la retirada de profilaxis secundarias, no estando indicada la instauración de profilaxis primaria8.