La introducción de los inhibidores de la proteasa del VIH-1 (IP) como parte de pautas antirretrovirales potentes ha traído consigo una disminución sin precedentes en la morbilidad y en la mortalidad asociadas a la infección por el VIH-1. Sin embargo, las pautas intensivas con IP no han sido capaces de erradicar la infección por el VIH-1 y las pautas de mantenimiento de menor potencia que la pauta intensiva inicial no pueden mantener la supresión de la replicación del VIH-1. Estos datos sugieren que, al menos por ahora, el tratamiento antirretroviral intensivo deberá mantenerse durante un largo período de tiempo o quizás de por vida para conseguir una supresión sostenida de la replicación viral.
El tratamiento prolongado con pautas antirretrovirales intensivas que incluyen IP se ha asociado a alteraciones metabólicas y a alteraciones en la distribución de la grasa corporal, que se denominan en conjunto como síndrome de lipodistrofia. Aunque la mayoría de estudios asocian la aparición de lipodistrofia al tratamiento con IP, otros estudios lo asocian a fármacos antirretrovirales distintos de los IP o a la evolución crónica de la propia infección por el VIH-1. Sea cual sea la etiopatogenia del síndrome de lipodistrofia, este problema no había sido descrito antes de la introducción de los IP ni en la historia natural de la infección por el VIH-1 ni como efecto adverso del tratamiento antirretroviral.
Efectos metabólicos del tratamiento con inhibidores de la proteasa
A corto plazo, el tratamiento con IP se acompaña de un aumento del peso corporal y una mejoría del estado nutricional de los pacientes infectados por el VIH-1. A más largo plazo, se ha asociado con efectos metabólicos negativos como intolerancia a la glucosa o diabetes mellitus, hipertrigliceridemia e hipercolesterolemia, y lipodistrofia.
Existen motivos para considerar que los efectos metabólicos asociados al tratamiento con IP pueden tener una patogenia común. Varios estudios han evidencia do una asociación entre diferentes alteraciones metabólicas en pacientes tratados con IP: resistencia a la insulina e hiperlipemia, resistencia a la insulina y lipodistrofia, hiperlipemia y lipodistrofia, y resistencia a la insulina, hiperlipemia y lipodistrofia. Además, según nuestra experiencia clínica, el desarrollo de lipodistrofia se precede de forma casi invariable por hipertrigliceridemia y resistencia a la insulina. Por ello, parece razonable considerar que todas estas alteraciones metabólicas tienen una patogenia común.
Hiperlipemia
La hipertrigliceridemia (pero no la diabetes mellitus ni la lipodistrofia) fue identificada como una complicación de la infección por el VIH-1 antes de la disponibilidad de los IP. La hipertrigliceridemia de los pacientes con sida, conocida previamente a la introducción de los IP, se asoció al aumento de determinadas citocinas como interferón-*, interleucina 6 y factor de necrosis tumoral (TNF), que son indicativas de progresión de la propia enfermedad por el VIH-1. La única alteración metabólica asociada a los IP que fue comunicada antes de su comercialización fue la hipertrigliceridemia en pacientes tratados con ritonavir. Posteriormente, varios autores han comunicado hipertrigliceridemia en asociación con los demás IP comercializados. Antes de la utilización de los IP, los pacientes con infección por el VIH-1 solían tener hipocolesterolemia. Sin embargo, con los IP se ha descrito más frecuentemente hipercolesterolemia. La prevalencia de hiperlipemia en pacientes infectados por el VIH-1 y tratados con IP al cabo de un año es relativamente elevada (> 50%).
Diabetes mellitus
La Administración sobre Alimentos y Fármacos (FDA) de los Estados Unidos informó por vez primera sobre la posibilidad de diabetes mellitus en relación con el uso de IP en junio de 1997, al describir 83 casos de inicio diabético o de empeoramiento de la diabetes preexistente. La diabetes asociada al tratamiento con IP es la tipo 2, aunque las necesidades terapéuticas de pacientes con diabetes tipo 1 pueden incrementarse después de iniciar tratamiento con IP. La prevalencia de hiperglu cemia sintomática en los pacientes infectados por el VIH-1 tratados con IP al cabo de un año es baja (< 1%), aunque se ha comunicado la existencia de hiperglucemia asintomática en al menos un 10% de pacientes en tratamiento crónico con IP.
Lipodistrofia
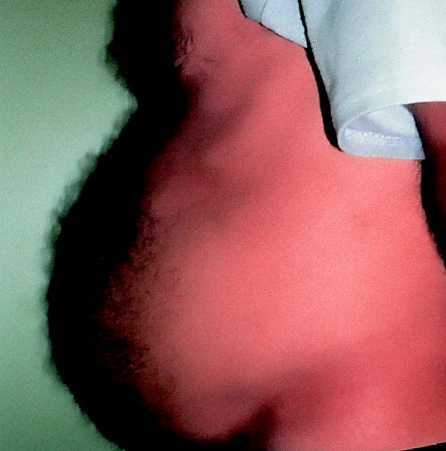
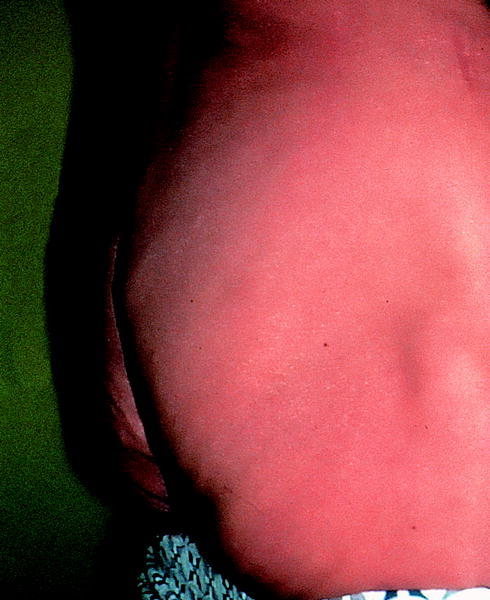
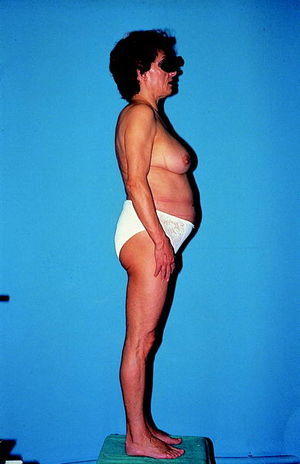
La lipodistrofia se ha identificado como efecto secundario del tratamiento con IP con posterioridad a la hiperlipemia y a la hiperglucemia. Esto puede tener su explicación en que las manifestaciones clínicas de la lipodistrofia aparecieron de forma lenta e inesperada. En el verano de 1997, aproximadamente un año después de la introducción de los IP en los Estados Unidos, algunas direcciones de Internet como www.pinkpage.com y www.thebody.com describieron informes anecdóticos de un proceso consistente en un aumento del perímetro abdominal (fig. 1) que los pacientes designaron «crixbelly» (en castellano ha recibido la traducción de «crixipanza»). Este efecto se asoció inicialmente a indinavir, aunque más tarde se observó en pacientes tratados con cualquiera de los IP existentes.
Fig. 1. Varón con una importante acumulación de grasa abdominal.
No existe una definición consensuada de lipodistrofia que permita estandarizar y comparar los estudios sobre este tema. Esto es debido en parte a que las manifestaciones clínicas que se han comunicado sobre lipodistrofia no son homogéneas. Sin embargo, dichas manifestaciones pueden ser agrupadas en 2 categorías generales: las que tienen un predominio de obesidad central y las que tienen un predominio de pérdida de grasa periférica. Un reciente estudio transversal de pacientes tratados con IP describe que las alteraciones metabólicas asociadas a lipodistrofia son similares en tipo y en prevalencia, independientemente de que predomine la obesidad central o la pérdida de grasa periférica.
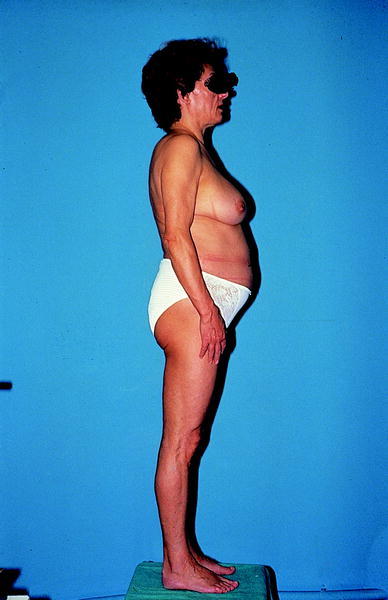
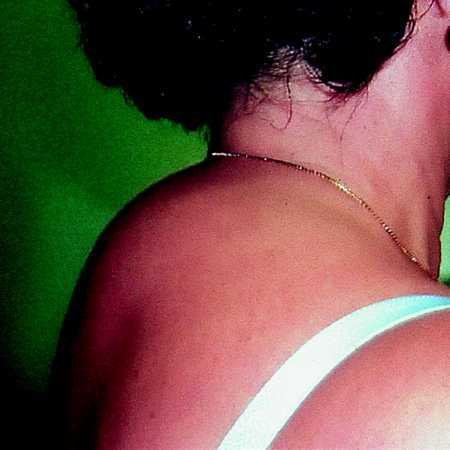
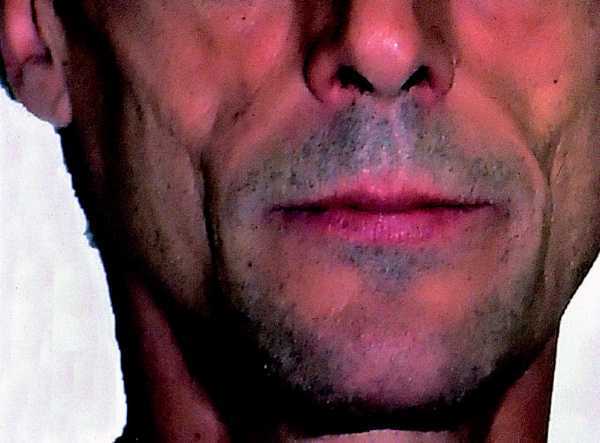
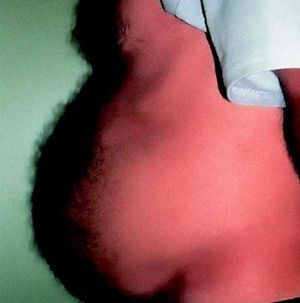
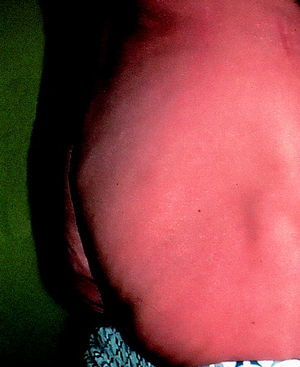
Varios autores han descrito pacientes que desarrollaron obesidad central en forma de aumento de la grasa visceral, hipertrofia mamaria o acumulación de grasa cervical o interescapular («joroba de búfalo») (figs. 1-3). Los pacientes tratados con IP con obesidad central tenían, además, una disminución de grasa abdominal subcutánea en comparación con los controles sin lipodistrofia. Por otra parte, la mayoría de los pacientes con obesidad central experimentaron un aumento del peso corporal desde el comienzo del tratamiento con IP.
Fig. 2. Mujer que presenta acumulación de grasa central (hipertrofia mamaria y obesidad abdominal) y pérdida de grasa periférica (delgadez de brazos y piernas).
Fig. 3. Mujer que ha desarrollado una acumulación de grasa en la región interescapular («joroba de búfalo»).
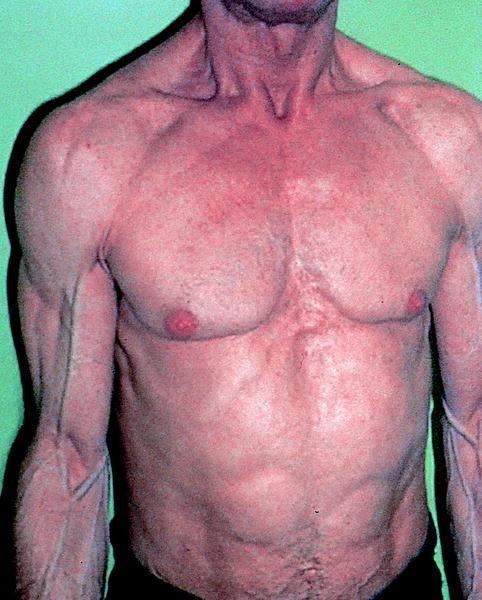
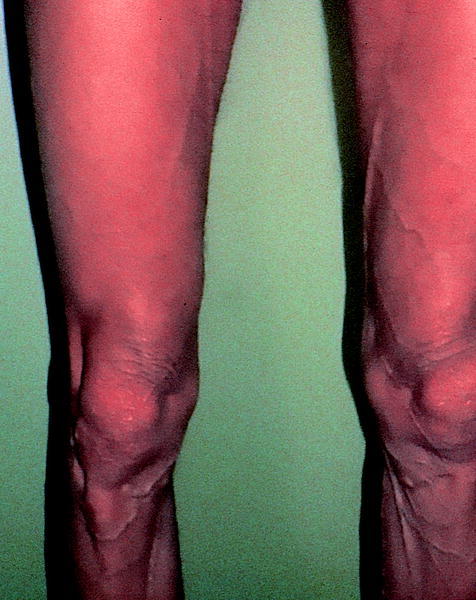
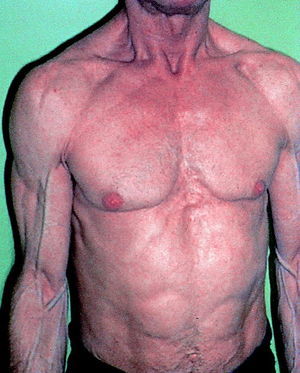
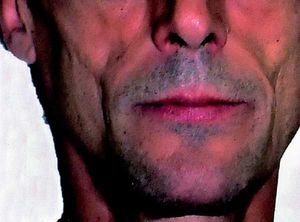
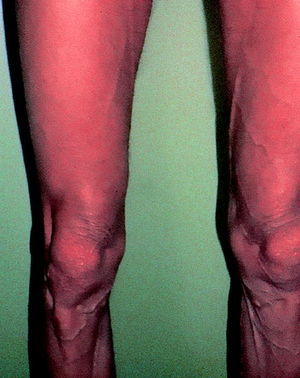
Otros autores han descrito pacientes con un predominio de pérdida de grasa periférica (figs. 4-7). En uno de estos informes, los pacientes con lipodistrofia tuvieron una relativa pérdida de peso frente a los controles sin lipodistrofia.
Fig. 4. Varón con pérdida de grasa subcutánea que le confiere un aspecto atlético.
Fig. 5. Varón con una característica pérdida de la grasa de la bolsa de Bichat (mejillas).
Fig. 6. Varón con atrofia de las nalgas.
Fig. 7. Mujer con delgadez de las piernas.
Al revisar la bibliografía, es posible comprobar que la aparición clínica de determinados cambios en la dis tribución de la grasa corporal puede depender de la duración del tratamiento con IP. Los efectos bene ficiosos del tratamiento con IP en cuanto al peso y al estado nutricional se han comunicado al cabo de muy poco tiempo (3-6 meses). La aparición de lipodistrofia se ha descrito en pacientes que, generalmente, llevaban más de 6 meses de tratamiento con IP. Los cambios en la distribución de la grasa corporal parece que se desarrollan antes en aquellos con un predominio de obesidad central (mediana de tiempo, 6 meses) que en aquellos con un predominio de pérdida de la grasa periférica (mediana de tiempo, 12 meses).
Resulta difícil determinar la prevalencia de lipodistrofia porque el diagnóstico de esta entidad se ha basado en definiciones clínicas subjetivas. Las estimaciones de prevalencia varían mucho dependiendo de la definición de lipodistrofia, el diseño del estudio, el área geográfica y el tiempo transcurrido desde el inicio del tratamiento con IP. De este modo, la tasas de prevalencia de lipodistrofia que se han comunicado oscilan entre el 2 y el 84% después de 3-18 meses de tratamiento con IP.
Patogenia del síndrome de lipodistrofia
La patogenia del síndrome de lipodistrofia es desconocida. Sin embargo, se sospecha que tiene que ver con la introducción de los IP en el tratamiento antirretroviral. Antes de la introducción de los IP, los parámetros metabólicos descritos en pacientes VIH-1 clínicamente estables (triglicéridos plasmáticos normales o elevados, colesterol plasmático disminuido y aumento de la sensibilidad a la insulina) eran diferentes de los observados en asociación con los IP (hipertrigliceridemia, hiper colesterolemia y disminución de la sensibilidad a la insulina). Algunos autores han especulado sobre los posibles mecanismos patogénicos del síndrome de lipodistrofia. Estas hipótesis, aunque son diferentes en los detalles, coinciden en que los IP no son específicos de la proteasa del VIH-1 y pueden inhibir alguna(s) proteína(s) humana(s) implicada(s) en el metabolismo de lípidos y carbohidratos.
Carr et al comprobaron que la región catalítica de la proteasa del VIH-1 comparte aproximadamente un 60% de homología con las regiones de dos proteínas que regulan el metabolismo lipídico: la proteína asociada con el receptor de lipoproteínas de baja densidad, y la proteína ligadora de ácido retinoico tipo 1. Estos autores han hipotetizado que los IP inhiben la proteína ligadora de ácido retinoico tipo 1 modificada y la síntesis de ácido 9-cis-retinoico mediada por el citocromo P450-3A. El ácido 9-cis-retinoico es un activador del receptor retinoico X y del receptor proliferador del peroxisoma activado tipo gamma (PPAR-*), que es un receptor del adipocito que regula su diferenciación y apoptosis. La unión del IP a la proteína asociada con el receptor de lipoproteínas de baja densidad alteraría la captación hepática de quilomicrones y el aclaramiento de triglicéridos por el complejo endotelial formado por la proteína asociada con el receptor de lipoproteínas de baja densidad y la lipoproteinlipasa. La hipertrigliceridemia resultante sería responsable de la distribución anormal de grasa y de la resistencia a la insulina. Algunas cuestiones que no quedan completamente explicadas con esta hipótesis son que la homología en la estructura primaria de las proteínas no implica necesariamente que exista una homología en la estructura terciaria, y que la pérdida de la grasa periférica como primer acontecimiento según esta hipótesis no concuerda con las observaciones clínicas que indican un aumento de peso y/o una obesidad central como primera manifestación clínica de lipodistrofia. Dos recientes trabajos que utilizan cultivos de adipocitos murinos han referido resultados discordantes sobre el efecto de los IP en el tejido adiposo in vitro. Uno de ellos indica que inhiben la adipogénesis, coincidiendo con la hipótesis de Carr et al, mientras el otro señala una estimulación de la adipogénesis. Es posible que el efecto de los IP sobre los adipocitos murinos no sea igual que sobre los adipocitos humanos o que el efecto in vitro sea diferente del efecto in vivo.
La insulina puede ser un sustrato de la proteasa del VIH-1. Por tanto, nosostros hemos especulado que si un sustrato (insulina) es compartido por varias enzimas (enzimas degradadoras de la insulina y la proteasa del VIH-1), es posible que los inhibidores de una de las enzimas (la proteasa del VIH-1) puedan también inhibir a alguna de las otras enzimas (enzimas degradadores de la insulina). Este efecto implicaría una hiperinsulinemia primaria debida a una reducción del catabolismo de la insulina, que se realiza principalmente en el hígado. Inicialmente, la hiperinsulinemia aumentaría los efectos fisiológicos de la insulina produciendo un incremento neto de la grasa corporal con una acumulación predominantemente intraabdominal debida a la gran densidad de 11-ß-deshidrogenasa en las células de la grasa visceral. La insulina induce la actividad de esta enzima y podría causar un síndrome seudoCushing al aumentar localmente los valores de cortisol. Posteriormente, existiría un predominio de la resistencia a la insulina que induciría un aumento de la lipólisis predominantemente subcutánea y una hipersecreción compensatoria de insulina que podría dar lugar al inicio de una diabetes mellitus tipo 2 en individuos predispuestos. Estudios recientes confirman que la resistencia a la insulina aparece al cabo de poco tiempo (< 6 meses) en la mayoría de pacientes tratados con IP. En una revisión reciente sobre los individuos no obesos con resistencia a la insulina («individuos metabólicamente obesos de peso normal») se cuestiona si la obesidad central puede ser la consecuencia de la resistencia a la insulina o un acontecimiento concomitante, más que su causa.
Stricker y Goldberg también han hipotetizado que los IP interaccionan con un grupo de proteínas aspárticas humanas denominadas catepsinas, que son responsables de la degradación del glucagón, la insulina, los factores de crecimiento semejantes a la insulina y las proteínas ligadoras de estas sustancias. Estos autores establecieron la hipótesis de que el aumento en las concentraciones de estas sustancias produciría una acumulación de grasa e hiperglucemia. Sin embargo, no dan una explicación precisa sobre cómo su hipótesis puede justificar la producción de las alteraciones metabólicas que se observan en los pacientes tratados con IP.
Tratamiento de la lipodistrofia
Los valores plasmáticos de los lípidos y la sensibilidad a la insulina pueden servir para predecir el desarrollo de lipodistrofia y por ello deberían incorporarse a las determinaciones analíticas rutinarias a realizar periódicamente en los pacientes tratados con IP. La hiperlipemia y la resistencia a la insulina son factores de riesgo cardiovascular bien reconocidos en la población general, y también han sido implicados de forma anecdótica como factores de riesgo de coronariopatía prematura en pacientes tratados con IP, aunque algunos estudios poblacionales no corroboran ese riesgo después de más de un año de tratamiento con IP. Por eso, se debería investigar estrategias para prevenir o reducir la hiperlipemia y la resitencia a la insulina antes de que se desarrolle la lipodistrofia.
La dieta y el ejercicio físico pueden contribuir a mejorar la obesidad central y a reducir los valores plasmáticos elevados de los lípidos, por lo que deberían ser aconsejados siempre de entrada ante un paciente que presenta síndrome de lipodistrofia. El hábito de fumar es un factor de riesgo prevenible que debe desaconsejarse firmemente en los pacientes con manifestaciones del síndrome de lipodistrofia.
En general, consideramos que los efectos beneficiosos del tratamiento con IP compensan los posibles efectos metabólicos negativos que puedan aparecer. Sin embargo, si un paciente tratado con IP de forma eficaz desarrolla manifestaciones compatibles con el síndrome de lipodistrofia, la decisión de continuar o no con el IP dependerá de la gravedad de las alteraciones metabólicas, el nivel de supresión de la replicación del VIH-1, la historia previa de su tratamiento antirretroviral y las preferencias del paciente para modificar un tratamiento intensivo estándar con IP por un tratamiento intensivo sin IP. Las pautas antirretrovirales triples en las que el inhibidor de la proteasa (pautas estándares) queda sustituido por un no nucleósido o un tercer nucleósido tienen una potencia antirretroviral similar a medio plazo (6-12 meses) en los pacientes no tratados previamente.
La retirada de los IP ha demostrado efectos controvertidos a muy corto plazo (< 3 meses). En un estudio no hubo modificaciones, mientras que en otro estudio se observó una mejoría parcial en la redistribución de grasa. La sustitución de otros IP por nelfinavir ha producido al cabo de 3 meses una mejoría parcial en las alte raciones metabólicas y en la lipodistrofia evidente en algunos estudios, pero no en otros. Ya que todos los IP actualmente comercializados pueden producir las manifestaciones del síndrome de lipodistrofia, no parece razonable justificar el cambio de un IP por otro con la única finalidad de tratar este problema. La sustitución de IP por nevirapina en pacientes con intensa repercusión psicológica a causa de la lipodistrofia demostró ser útil para mantener la supresión de la replicación viral, mientras que las alteraciones metabólicas y la lipodistrofia revertieron parcialmente al cabo de 6 meses. Otro estudio, aleatorizado y controlado, en el que los IP se sustituyeron por nevirapina también demostró un efecto beneficioso al cabo de 3 meses sobre la hiperlipemia, aunque no sobre otros aspectos del síndrome de lipodistrofia. La sustitución de IP por efavirenz demostró al cabo de 6 meses un efecto beneficioso sobre la resistencia a la insulina y sobre la lipodistrofia, pero por motivos que se desconocen hubo un aumento de los valores plasmáticos de trigliceridos y de colesterol total, que despiertan dudas sobre la idoneidad de esta actuación para tratar el síndrome de lipodistrofia hasta que no se disponga de más información a este respecto. También existen otros estudios en los que los IP han sido sustituidos por abacavir, con resultados similares a los estudios de los no nucleósidos. La actitud terapéutica pasiva de retirar los IP puede que no sea útil para revertir por completo las alteraciones del síndrome de lipodistrofia y no representa una alternativa práctica para aquellos pacientes que precisen los IP para mantener la supresión virológica.
Las estatinas, o inhibidores de la hidroxi-metil-glutaril coenzima A reductasa, y el gemfibrozil han demostrado ser útiles para mejorar las alteraciones lipídicas, aunque se desconoce el efecto que estos fármacos pudieran tener como modificadores de la historia natural de la
lipodistrofia. Por otro lado, casi todas las estatinas se metabolizan a través del citocromo P450 y el uso concomitante con IP podría incrementar su toxicidad potencial, que es predominantemente muscular. Se dispone de información sobre el uso de agentes sensibilizadores de la insulina como troglitazona o metformina para tratar el síndrome de lipodistrofia, aunque en un número reducido de pacientes y a corto plazo (3 meses). La metformina mejoró la hipertrigliceridemia y la resistencia a la insulina, y disminuyó la obesidad central y el peso; se desconoce su efecto sobre la lipodistrofia con predominio de pérdida de grasa periférica. La troglitazona mejoró la resistencia a la insulina, pero no la hiperlipemia ni la lipodistrofia. La troglitazona no está comercializada en España. Por otro lado, la potencial toxicidad de estos fármacos (hepatotoxicidad grave en el caso de la troglitazona, y acidosis metabólica en el caso de la metformina) aconsejan ser prudentes antes de disponer de estudios controlados a más largo plazo que demuestren una utilidad claramente superior a su riesgo potencial. Algunos autores han abogado por el uso de preparados hormonales análogos de testosterona o de hormona del crecimiento. Los preparados hormonales análogos de testosterona pueden incrementar la masa magra y de esta forma contribuir a la mejoría estética debida a la pérdida de grasa periférica. Sin embargo, incrementan la resistencia a la insulina y tienen un perfil de efectos secundarios amplio cuando se usan de forma crónica. La hormona del crecimiento mejoró la obesidad central en un reducido número de pacientes, pero no modificó la pérdida de grasa periférica y empeoró la hipertrigliceridemia.
Se ha relizado una extirpación quirúrgica de las acumulaciones de grasa que son accesibles como la joroba de búfalo o la hipertrofia mamaria, pero no en el caso de la obesidad abdominal, ya que la acumulación de grasa es intraabdominal. La extirpación de la joroba de búfalo en algunos pacientes no se ha seguido de recidiva inmediata, aunque su beneficio a largo plazo es desconocido.
Por último, pero no menos importante, la lipodistrofia es una modificación no deseada de la fisonomía que puede tener graves repercusiones psicológicas para los pacientes que la sufren. La calidad de vida y la adhesión al tratamiento antirretroviral pueden verse seriamente comprometidos ante la aparición de lipodistrofia. Independientemente del tratamiento que se considere más adecuado para tratar el síndrome de lipodistrofia, se debería contemplar en todo paciente la posibilidad de ofrecer un apoyo psicológico adecuado.
Conclusiones
Aunque no existe una relación causa-efecto definitiva, muchos datos observacionales asocian el tratamiento antirretroviral intensivo con IP con un aumento del riesgo para desarrollar el síndrome de lipodistrofia. Se sospecha que los IP pueden contribuir a originar este síndrome al inhibir alguna de las proteínas humanas implicadas en el metabolismo de los hidratos de carbono y de los lípidos, aunque la patogenia aún es desconocida. Sin embargo, deben desempeñar un papel otros factores ya que no todo paciente desarrolla las mismas alteraciones metabólicas ni los mismos cambios corporales después de un período similar de tratamiento con IP y, por otra parte, algunos pacientes no tratados con
IP también pueden verse afectados. Se precisan con urgencia estudios que permitan conocer la prevalencia de este síndrome así como los factores de riesgo para desarrollarlo. La hiperlipemia y la resistencia a la insulina suelen preceder al desarrollo de lipodistrofia y estar presentes una vez que las manifestaciones de lipodistrofia son evidentes. El manejo rutinario de los pacientes infectados por el VIH-1 con tratamiento antirretroviral intensivo probablemente requerirá incorporar estudios metabólicos y de la composición corporal en un futuro próximo. Las actitudes terapéuticas tanto pasivas (sustitución de los IP por otros fármacos antirretrovirales) como activas (dieta, ejercicio, fármacos hipolipemiantes, fármacos sensibilizadores de la insulina, u otros) deben ser investigados de forma urgente para mejorar la repercusión psicológica causada por la lipodistrofia y para prevenir posibles riesgos cardiovasculares en el futuro.
Bibliografía recomendada
Carr A, Samaras K, Burton S, Law M, Freund J, Chisholm DJ, Cooper DA. A syndrome of peripheral lipodystrophy, hyperlipidaemia and insulin resistance in patients receiving HIV protease inhibitors. AIDS 1998; 12: F51-F58.
Carr A, Samaras K, Chisholm DJ, Cooper DA. Pathogenesis of HIV-1-protease inhibitor-associated peripheral lipodystrophy, hyperlipidaemia, and insulin resistance. Lancet 1998; 352: 1881-1883.
Dube MP, Johnson DL, Currier JS, Leedom JM. Protease inhibitor-associated hyperglycaemia. Lancet 1997; 350: 713-714.
Hengel RL, Watts NB, Lennox JL. Benign symmetric lipomatosis associated with protease inhibitors. Lancet 1997; 350: 1596.
Henry K, Melroe H, Huebsch J, Hermundson J, Levine C, Swensen L et al. Severe premature coronary artery disease with protease inhibitors. Lancet 1998; 351: 1328.
Henry K, Melroe H, Huebesch J, Hermundson J, Simpson J. Atorvastatin and gemfibrozil for protease-inhibitor-related lipid abnormalities. Lancet 1998; 352: 1031-1032.
Herry I, Bernard L, de Truchis P, Peronne C. Hypertrophy of the breasts in a patient treated with indinavir. Clin Infect Dis 1997; 25: 937-938.
Kotler DP, Rosenbaum K, Wang J, Pierson RN. Studies of body composition and fat distribution in HIV-infected and control subjects. J Acquir Immune Defic Synd Hum Retrovirol 1999; 20: 228-237.
Lo JC, Mulligan K, Tai VW, Algren H, Schambelan. «Buffalo hump» in men with HIV-1 infection. Lancet 1998; 351: 867-870.
Magde S, Kinloch-de-Loes S, Mercey D, Johnson MA, Weller IVD. Lipodystrophy in patients naive to HIV protease inhibitors. AIDS 1999; 13: 735-737.
Martínez E, Casamitjana R, Conget I, Gatell JM. Protease inhibitor-associated hyperinsulinaemia. AIDS 1998; 12: 2077-2079.
Martínez E, Gatell J. Metabolic abnormalities and use of HIV-1 protease inhibitors. Lancet 1998; 352: 821-822.
Martínez E, Conget I, Lozano L, Casamitjana R, Gatell J. Reversion of lipodystrophy after switching from HIV-1 protease inhibitors to nevirapine. AIDS 1999; 13: 805-810.
Miller KD, Jones E, Yanovski JA, Shankar R, Feuerstein Y, Fallon J. Visceral abdominal-fat accumulation associated with use of indinavir. Lancet 1998; 351: 871-875.
Miller KK, Daly PA, Sentochnik D, Doweiko J, Samore M, Basgoz NO et al. Pseudo-Cushing´s syndrome in human immunode ficiency virus-infected patients. Clin Infect Dis 1998; 27: 68-72.
Roth VR, Kravcik S, Angel JB. Development of cervical fat pads following therapy with human immunodeficiency virus type 1 protease inhibitors. Clin Infect Dis 1998; 27: 65-67.
Saint-Marc T, Poizot-Martin I, Partisani M, Fabre J, Touraine JL. A syndrome of lipodystrophy in patients receiving a stable nucleoside-analogue therapy [resumen 653]. 6th Conference on Retroviruses and Opportunistic Infections. Chicago, 1999.
Saint-Marc T, Touraine JL. Effects of metformin on insulin resistance and central adiposity in patients receiving effective protease inhibitor therapy [resumen 672]. 6th Conference on Retroviruses and Opportunistic Infections. Chicago, 1999.
Sellmeyer DE, Grunfeld C. Endocrine and metabolic disturbances in human immunodeficiency virus infection and the acquired immune deficiency syndrome. Endocr Rev 1996; 17: 518-532.
Stricker RB, Goldberg B. Weight gain associated with protease inhibitor therapy in HIV-infected patients. Res Virol 1998; 149: 123-126.
Stricker RB, Goldberg B. Fat accumulation and HIV-1 protease inhibitors. Lancet 1998; 352: 1392.
Torres R, Unger K. The effect of recombinant human growth hormone on protease-inhibitor-associated fat maldistribution [resumen 675]. 6th Conference on Retroviruses and Opportunistic Infections. Chicago, 1999.
Viraben R, Aquilina C. Indinavir-associated lipodystrophy. AIDS 1998; 12: F37-F39.
Walli R, Herfort O, Michl GM, Demant T, Jäger H, Dieterle C et al. Treatment with protease inhibitors associated with peripheral insulin resistance and impaired oral glucose tolerance in HIV-1-infected patients. AIDS 1998; 12: F167-F173.
Walli RK, Michl GM, Bogner JR, Goebel FD. Effects of the PPAR-activator troglitazone on protease-inhibitor associated peripheral insulin resistance [resumen 673]. 6th Conference on Retroviruses and Opportunistic Infections. Chicago, 1999.