Actualmente podemos afirmar, sin temor a equivocarnos, que la mamografía sigue siendo la técnica diagnóstica de elección para luchar de forma efectiva contra el cáncer de mama1. Los ultrasonidos ocupan un importantísimo papel complementario. Otras técnicas diagnósticas, como la termografía, la diafanoscopia y la xeromamografía, prácticamente ya no se usan; la resonancia magnética (RM), la radiología digital, la gammagrafía y la tomografía por emisión de positrones (PET) se encuentran en fase experimental, si bien el uso de la RM es cada vez más frecuente. Por último, hemos de mencionar también el uso de sistemas informáticos para mejorar el diagnóstico por imagen computer-aided detection (CAD).
Moskowitz, en 1984, adivinando el desarrollo de las nuevas tecnologías afirmo que no debemos considerar una técnica como eficaz hasta que demuestre que altera el curso o el tratamiento del paciente. Debemos, pues, evitar pruebas que, aunque añadan información o la embellezcan, no faciliten la salud de la paciente.
Mamografía
La esperanza en alterar el curso del cáncer de mama depende de la capacidad de la mamografía de detectar cánceres ocultos y probablemente curables. Para que ésto sea posible la mamografía ha de tener gran sensibilidad y ser efectuada a intervalos adecuados. La sensibilidad de la mamografía dependerá en términos generales de las posibilidades técnicas del sistema mamográfico, de las dificultades anatómicas de la mama y de un experto profesional que la interprete2.
La mamografía es la técnica de imagen que nos permite reproducir en un plano bidimensional un órgano que en realidad tiene tres dimensiones, por lo cual las imágenes obtenidas constan de la superposición de múltiples planos. Como cualquier otro procedimiento radiográfico, se basa en la impresión de una película radiográfica por los rayos X después de atravesar la mama y tras haber sufrido una absorción parcial de la radiación por los distintos componentes del tejido mamario.
El riesgo potencial de la radiación no debe ser ignorado, pero esta teórica posibilidad debe ser analizada junto con la reducción de la mortalidad por cáncer de mama que se demuestra en estudios aleatorios y controlados de cribado y la falta de éxito en reducir la mortalidad por dicha enfermedad sin usar las campañas de detección precoz por medio de la mamografía. Con los conocimientos actuales, es posible afirmar que el número de cánceres preclínicos curables detectados por mamografía es mayor que el número de posibles carcinomas que pueden provocarse según las teorías más pesimistas, por ello la relación riesgo/beneficio se inclina claramente por el beneficio en mujeres sintomáticas y asintomáticas3.
Valoración mamográfica de las lesiones
La meta de los programas de cribado es conseguir detectar el mayor número de cánceres en estadios tempranos y reducir al máximo las biopsias innecesarias. Para ello, no basta con realizar un gran número de mamografía de calidad a unos precios razonables; es necesaria una cuidadosa evaluación de cada exploración por un radiólogo experimentado para extraer el máximo provecho de la prueba efectuada. Es labor del radiólogo analizar la mamografía y, provenga o no de mujeres asintomáticas, se debe buscar meticulosamente la presencia de una serie de «pistas» que permitan descubrir el cáncer de mama en sus primeros estadios. Estas ayudas4-6 son la existencia de: masas, calcificaciones focales o segmentarias, distorsión de la arquitectura, asimetría en el parémquima y la vasculatura, aumentos de la densidad, alteración de la piel y el pezón y por último, anomalías en los ganglios linfáticos axilares.
Estos hallazgos habrá que valorarlos junto con datos y antecedentes clínicos y, siempre que sea conveniente y posible, se realizará un estudio comparativo con las mamografías previas de la paciente.
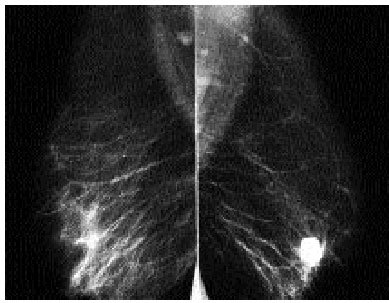
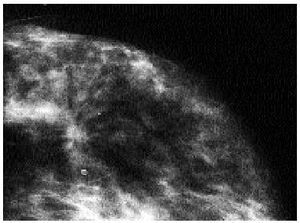
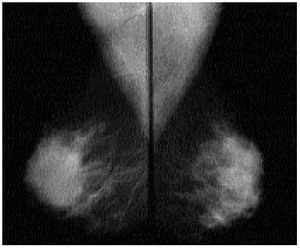
El diagnóstico de cáncer de mama sería muy sencillo si éste tuviera siempre las mismas características; evidentemente esto no es así, y aunque muchos carcinomas presentan características fuertemente sugestivas de malignidad, la mayor parte de las ocasiones no es posible asegurar, a partir de los hallazgos mamográficos, la malignidad o benignidad de una lesión (fig. 1). En la revisión de Sickles7, de 300 cánceres en lesiones no palpables el 61% de los tumores se descubrió a partir de los llamados signos indirectos, y sólo el 23% de las calcificaciones y el 16% de las masas cumplían con las características típicas de malignidad.
Fig. 1. Mamografía bilateral. En la zona retroareolar de la mama derecha se observa un nódulo densamente calcificado en relación con fibroadenoma calcificado.
Masas
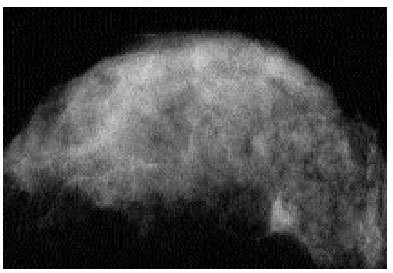
Se cataloga como masa el hallazgo de una lesión tridimensional y con márgenes reconocibles que la separan del tejido circundante. Ante toda masa, es necesario realizar un cuidadoso análisis de su localización, densidad, tamaño, forma, márgenes y multiplicidad4,8. Parece prudente considerar como sospechoso de malignidad toda masa sólida mayor de 0,8 cm4. Todas las lesiones con márgenes mal definidos o espiculados que sugieran infiltración deben ser biopsiadas o aspiradas, pero no se debe olvidar que lesiones de márgenes bien definidos pueden ser malignas (fig. 2).
Fig. 2. Nódulo de 1 cm, en la parte posterior externa, de bordes parcialmente mal definidos, con alguna espícula, sospechoso de malignidad. El resultado de la biopsia con aguja fue de carcinoma ductal invasivo.
Calcificaciones sin masa asociada
La mamografía es la única exploración capaz de representar las calcificaciones malignas de la mama, siendo éste uno de los principales motivos de la hegemonía de esta técnica sobre el resto de las técnicas diagnósticas de imagen en patología mamaria.
La mayoría de las mujeres presentan alguna imagen calcificada en la mamografía, y todavía son más frecuentes si se observan al microscopio. Afortunadamente, la mayoría de las calcificaciones son de característ icas benignas, pero existen formas y patrones que requieren biopsia; los cánceres más pequeños detectados en la mamografía se asocian con gran frecuencia a microcalcificaciones5 y, como norma general6, se recomienda una actitud más agresiva con las microcalcificaciones agrupadas que con las masas, pues es más difícil descartar su malignidad y el seguimiento mamográfico es menos sensible. La escasa penetración de la mamografía se ha identificado como el mayor problema de la calidad de la imagen y se recomienda una ligera sobrepenetración; una vez detectadas, hay que estudiarlas de la forma más completa posible y definir su número, forma, tamaño y distribución. En la práctica,
el 60% de las biopsias localizadas se realizan por la presencia de calcificaciones, y sólo el 27% serán malignas9.
El tamaño en la mamografía varía desde apenas perceptibles hasta amplias y enormes; mamográficamente, empiezan a ser perceptibles a partir de 0, 2 mm y hablamos de microcalcificaciones hasta un tamaño de 2 mm, pero las que con más frecuencia se asocian a cáncer son menores de 0, 5 mm; en general, las mayores de 2 mm son benignas.
Las calcificaciones asociadas a carcinoma tienden a ser pleomórficas e irregulares, con formas anguladas, puntiformes o ramificadas y se han descrito como «cristal roto» y patrón «punto-raya». La probabilidad de que exista un carcinoma se incrementa conforme aumenta el número de microcalcificaciones en un área determinada. No existe un nivel de seguridad absoluto pero se considera sospechoso 5 o más microcalcificaciones agrupadas en un área de 1 cm2.
Distorsión de la arquitectura
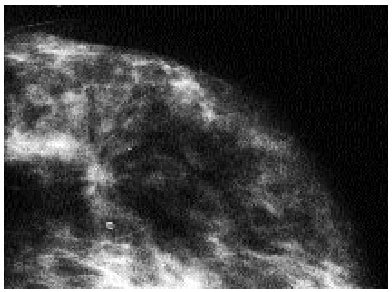
En la arquitectura mamaria, en una placa mamográfica se observa cómo sus estructuras fibroglandulares están orientadas y dirigidas hacia el pezón. Cualquier alteración de esta orientación, especialmente si existe una «atracción» hacia algún punto de la mama fuera del pezón, requiere un cuidadoso examen y la realización de proyecciones adicionales, pues a veces no corresponden a lesiones reales y están provocadas por superposición de estructuras; pero si la distorsión sigue existiendo es obligado descartar malignidad, salvo que exista certeza de que los cambios han sido ocasionados por cirugía previa10. Afortunadamente, la distorsión de la arquitectura, también conocida como «lesión estrellada», no siempre es maligna y con frecuencia está en relación con cicatrices posquirúrgicas, cicatrices radiales y focos de adenosis esclerosante (fig. 3).
Fig. 3. Distorsión del parénquima mamario (lesión estrellada) que fue biopsiada previa localización con arpón metálico. El resultado fue una cicatriz radial.
Asimetría del tejido mamario
Se define la asimetría del tejido mamario como la existencia de un área de densidad aumentada en la mamografía, de forma no homogénea, que no forma masa, no presenta márgenes ni tiene un centro definido, pero es diferente al área correspondiente en la mama contralateral. La arquitectura de la mama está conservada.
Esta «anomalía» es muy frecuente y se da en un 3-5% de los casos11, normalmente, está causada por un desarrollo asimétrico del tejido mamario. La biopsia de esta entidad sólo está indicada si se acompaña de microcalcificaciones sospechosas o corresponde a una lesión palpable4.
Focalidad asimétrica
Se entiende por focalidad asimétrica una estructura tridimensional que tiende a presentar márgenes, aunque éstos se desvanecen en el parénquima circundante, se reconoce una zona densa central y la densidad disminuye hacia la periferia. Esta lesión sí debe considerarse sospechosa de malignidad.
Otros hallazgos
El resto de alteraciones cambios cutáneos, alteraciones del pezón y adenopatías axilares se pueden considerar como cambios asociados y son menos importantes desde el punto de vista de la imagen.
Mamografía digital y sistemas computarizados de ayuda en la detección y diagnóstico
El interés por la mamografía digital ha sido paralelo al interés por la imagen digital en otros órganos. En un intento por mejorar la mamografía tradicional, se ha publicado que aproximadamente un 10-20% de los tumores palpables no son visibles en la mamografía convencional debido al insuficiente contraste entre tejido sano y tejido patológico12,13.
La digitalización de imágenes consiste en la representación numérica de su contenido. Para ello, se cuadricula y se asigna a cada elemento de la matriz (píxel) un valor numérico en función de su nivel de gris.
Se han realizado varios intentos, desde digitalizar la imagen de la mamografía convencional a la adquisición directa de datos digitales, siendo este último el sistema que ofrece mejores resultados. Una de las ventajas de la digitalización directa de la imagen es la menor dosis de radiación necesaria para conseguir la imagen. También existe la posibilidad de manipular la imagen y la de eliminar la película radiográfica como método de almacenamiento de la información, usando discos ópticos de fácil acceso. Este hecho facilita enormemente el archivo de imágenes en diferentes soportes, permitiendo un acceso inmediato a la imagen y posibilitando la transmisión rápida, segura y eficaz de la imagen dentro y fuera del centro de trabajo. Por último, facilita el uso de sistemas inteligentes que ayuden en el análisis de zonas sospechosas, es decir, sistemas computarizados de ayuda en la detección y diagnóstico (computer aided detection and diagnosis, CAD)14.
Como conclusión podemos decir que la mamografía digitalizada está en plena investigación y es probable que en los próximos años permita aumentar la detección del cáncer de mama y mejorar su estadificación. Hasta ahora las microcalcificaciones han sido la lesión más beneficiada del desarrollo de esta nueva técnica15. También ha demostrado su utilidad como medio guía para localizar lesiones no palpables, siendo una técnica precisa, rápida y que emplea menor dosis de radiación. Actualmente, se está analizando su uso como método de cribado16,17.
Respecto a los sistemas CAD, éstos están en constante investigación pero todavía no se dispone de estudios suficientes que demuestren de forma evidente sus ventajas18,19.
Ultrasonidos (US)
Como todas las nuevas técnicas, el uso de los ultrasonidos (US) despertó un gran entusiasmo inicial, que ha sido reemplazado por unas limitadas aplicaciones prácticas derivadas de la experiencia. Jackson, en 199020, y Basset, en 199121, publicaron sendos estudios sobre este tema y sus principales conclusiones siguen siendo vigentes. Los US pueden tener las siguientes aplicaciones:
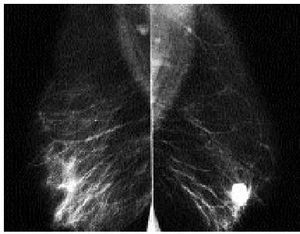
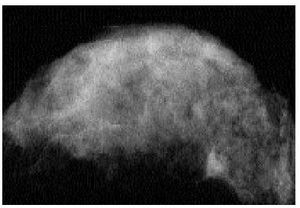
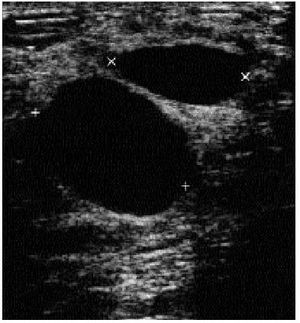
Diferenciación entre quistes y masas sólidas, con un 96-100% de seguridad (fig. 4, 5).
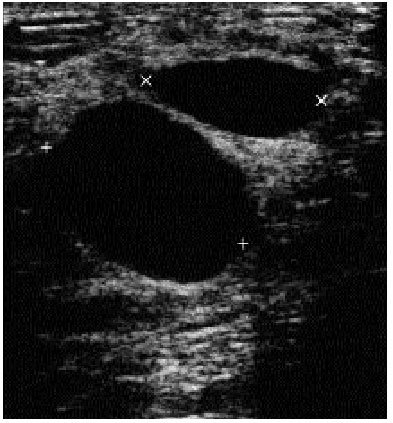
Fig. 4. Mamografía bilateral. Se observa un aumento de densidad en la zona retroareolar de la mama izquierda respecto a la derecha sin que se identifiquen nódulos. Se realizó una ecografía que se presenta en la figura 5.
Fig. 5. La ecografía demostró la existencia de quistes mamarios simples bilaterales, existiendo una acumulación de 3-4 quistes de mayor tamaño en la zona retroareolar de la mama izquierda.
Caracterización de lesiones líquidas y valorar las paredes de los quistes.
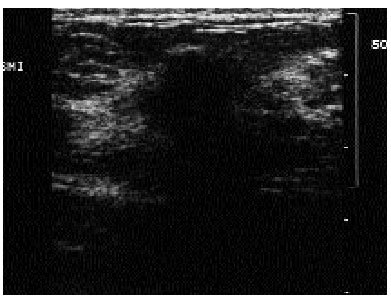
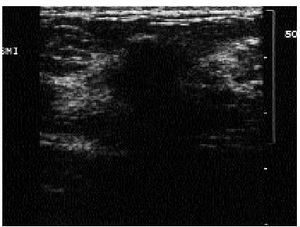
Estudio de lesiones palpables no visibles en la mamografía (fig. 6).
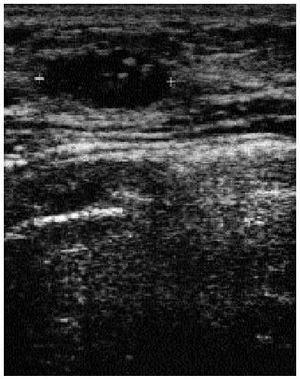
Fig. 6. Ecografía correspondiente a un área de palpación anómala no visible en la mamografía. Se observa una zona de mala transmisión sónica, sin clara formación de nódulo, que correspondió a un carcinoma ductal invasivo.
Estudio de mujeres menores de 30 años con masa palpable.
Seguimiento de la mama infectada con o sin absceso.
Estudio de masas que por su localización no puedan estudiarse satisfactoriamente por mamografía.
Búsqueda de ganglios linfáticos, siendo más sensible que la mamografía y la exploración clínica para detectar ganglios en la región axilar.
Como guía de procedimientos intervencionistas: citología, aspiración, localización prequirúrgica, biopsia con aguja y biopsia con sistemas de vacío22. Estas utilidades son cada vez más apreciadas.
Por el contrario, la ecografía no siempre permite diferenciar entre masas sólidas benignas o malignas (figs. 7, 8). Aunque existen signos que lo facilitan23, en la evaluación de una asimetría de densidad apreciada en la mamografía también hay discrepancias; pero hay acuerdo en que no debe usarse como cribado en mujeres asintomáticas. Algunos autores los han propuesto como método de cribado en mujeres con mamas densas pero no se ha demostrado su eficacia.
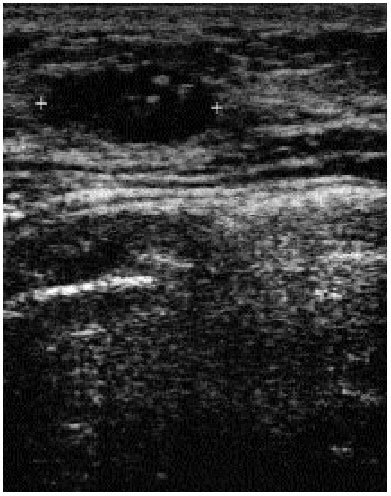
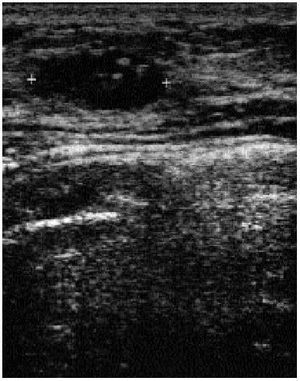
Fig. 7. Nódulo ovalado, sólido, lobulado de 1, 4 cm en una paciente de 40 años, con una ecoestructura heterogénea, bordes bien definidos. El resultado de la biopsia con aguja gruesa fue de carcinoma ductal invasivo.
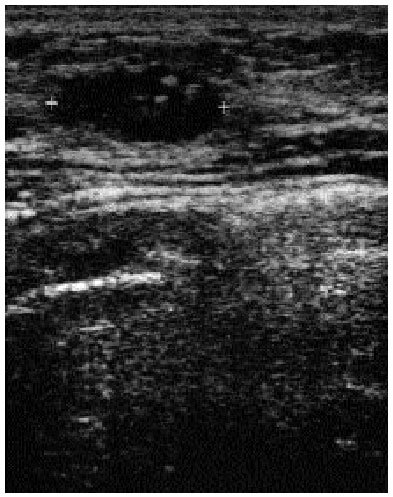
Fig. 8. Nódulo ovalado, sólido, de 1, 6 cm, ecoestructura heterogénea, en una paciente de 33 años. El resultado de la biopsia con aguja gruesa fue de fibroadenoma.
De todos modos, es evidente que los US usados junto con la mamografía permiten incrementar la sensibilidad y la especificidad de forma significativa24.
Últimamente, se está prestando especial atención al papel que pueden desempeñar la eco-Doppler color usando contrastes intravenosos formados por microburbujas; según algunos autores, aumenta la capacidad de discernir entre patología benigna y maligna25. También se propone el uso de los US para el control de los implantes de silicona26. Por todos esos motivos, el uso de los US para distinguir entre lesiones sólidas malignas y benignas sigue siendo un importante tema de controversia27. Se ha referido un 99,5% de resultados con valor predictivo negativo para el cáncer en nódulos con características ecográficas de benignidad28.
Resonancia magnética
Tras la disponibilidad de la RM en los años ochenta, su uso como método diagnóstico en patología mamaria comenzó, como toda nueva técnica, con un optimismo excesivo. La RM sin contraste no es útil en el diagnó stico del cáncer de mama; la única aplicación demostrada de los estudios sin contraste es la diferenciación entre lesiones sólidas y líquidas. Su empleo como método de cribado también está descartado; los altos costes del equipo y su escasa sensibilidad la hacen inviable para tal fin.
La introducción de agentes de contrastes (gadolinio DTPA), las mejoras técnicas y la creación de nuevos protocolos han hecho de la RM una técnica prometedora en la detección, diagnóstico y estadificación del cáncer de mama29; es el método más seguro en el control de implantes mamarios30; hay que resaltar su uso en la identificación de tumores en mamas densas, en el diagnóstico diferencial de cicatrices frente al carcinoma y en la evaluación prequirúrgica cuando se plantea cirugía local; es útil en la búsqueda de multicentricidad, multifocalidad, bilateralidad y en la valoración del componente intraductal extenso. También se emplea en pacientes con adenopatías axilares positivas para carcinoma de mama con mamografía normal; se está evaluando su uso para valorar la respuesta al tratamiento y también la posibilidad de diagnosticar el carcinoma in situ, pero son necesarios estudios más amplios para demostrar de forma convincente su eficacia29,30.
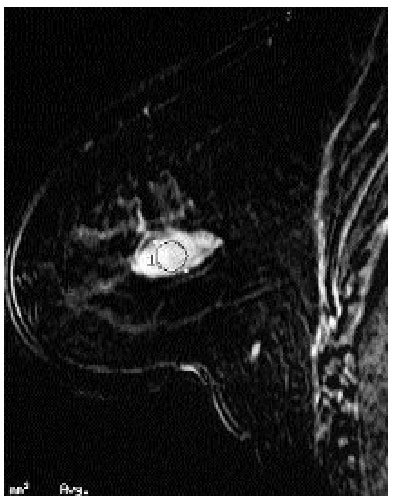
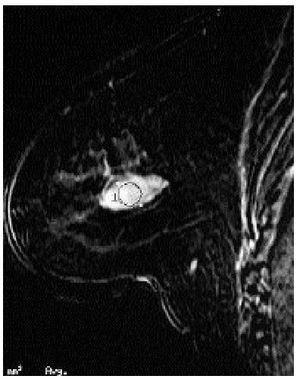
Las lesiones que peores resultados ofrecen son las menores de 5 mm y las microcalcificaciones. Se ha observado que lesiones benignas como la mastitis, la enfermedad fibroquística y algún fibroadenoma pueden presentar captación del contraste (fig. 9). También se ha empleado como método de localización para puncionar y biopsiar lesiones sospechosas, aunque todavía no se ha comercializado ningún sistema.
Fig. 9. RM de mama. Estudio con contraste que revela una lesión ovalada, en la parte posterior, tanto las características morfológicas, como la curva de captación (no expuesta) sugieren una lesión benigna: fibroadenoma.
Medicina nuclear
Las principales técnicas se describen a continuación
Gammagrafía
El uso de la medicina nuclear en la patología tumoral se basa en la captación del radionúclido o del radiofármaco por parte del tumor, más elevada que en el resto del organismo, lo que permitiría su detección. Lamentablemente, no existe ningún radionúclido o radiofármaco completamente específico para el cáncer de mama, los trazadores más utilizados son: 99mTC-MDP, cloruro de talio 201TL, 99mTC-tetrofortin y 99mTC-SESTAMIBI, siendo este último el más usado.
El SESTAMIBI tiene una especificidad para detectar el cáncer de mama entre el 52 y el 95% y un valor predictivo negativo del 61-98%31. La captación tumoral del MIBI depende del tamaño tumoral, el grado de malignidad y la presencia de neoangiogénesis. Su principal problema es su escasa sensibilidad para detectar neoplasias o adenopatías menores de 1 cm, hecho que impide su uso en el diagnóstico precoz, aunque recientemente se han publicado resultados prometedores en tumores menores de 1 cm32. Se ha valorado su utilidad en33 mamografías dudosas por alta densidad, prótesis, diferenciación entre cicatriz y recidiva tumoral, extensión adenopática, evaluación de respuesta a la quimioterapia y como guía de punciones-biopsias.
En un estudio comparativo entre RM y escintilomamografía con MIBI, ambas técnicas han demostrado ser útiles para evaluar el cáncer de mama, pero la RM es más sensible y más específica que la ganmagrafia34.
Tomografía por emisión de positrones
Los radisótopos más utilizados son: carbono (C11), nitrógeno (N13), oxígeno (O15) y flúor (F18). Todos tienen una vida media corta, por lo que aportan dosis baja de radiación. Se puede marcar casi cualquier sustancia. En la mama, el más usado es el fluordesoxiglucosa (FDG-F18), que ha demostrado en la detección de tumores una sensibilidad del 92% y una especificidad del 97%, y en la afección axilar una sensibilidad del 82% y una especificidad del 95%. Parece ser útil en la valoración de los ganglios de la mamaria interna, en la detección de metástasis a distancia y en la valoración de la respuesta tumoral a la quimioterapia31,35, pero en este momento debemos considerar la PET como una técnica experimental sin eficacia clínica probada de forma suficiente.
Entre los inconvenientes, hay que mencionar la dificultad para detectar tumores menores de 1,5 cm y el elevado coste que supone, dado que hay que producir los positrones en el mismo edificio (vida media corta). El coste aproximado de un ciclotrón y de una cámara de positrones es de unas 800.000.000 ptas.
Hacia una estandarización de los informes de las pruebas diagnósticas de imagen
Es evidente la conveniencia de que exista un lenguaje común que permita la comunicación entre diferentes profesionales eliminando la ambigüedad de ciertos términos y la posibilidad de que el clínico interprete de forma errónea el informe recibido. Además, el fallo en la comunicación de la información puede acarrear retrasos en el diagnóstico, ser perjudicial para la paciente y ser fuente de problemas medicolegales para los facultativos.
El formato básico del informe debe incluir:
1. Datos clínicos de la paciente.
2. Tipo de estudio realizado.
3. Indicar si se trata de un control de estudios previos.
4. Descripción de la distribución del tejido mamario, lo que da una indicación de la sensibilidad del estudio. En la mama densa la capacidad de la mamografía para detectar cánceres tempranos es menor y el médico que solicita la exploración y recibe el informe debe ser consciente de ello.
5. Descripción de los hallazgos.
6. Valoración de los hallazgos. Quizás sea ésta la parte más importante del informe o al menos suele ser la parte a la que presta mayor atención el médico que solicita la exploración. El Colegio Americano de Radiología, dándose cuenta de la importancia del informe mamográfico, ideó un sistema BI-RADS (breast imaging reporting and data system) que facilita unos informes estandarizados, precisos, claros, comprensibles y que, además, indican al receptor del informe la siguiente decisión a tomar. Este sistema puede aplicarse no sólo a la mamografía sino también a otras pruebas de imagen36. Además, los códigos empleados pueden incorporarse a sistemas informáticos para mejorar el proceso. Toda prueba siguiendo las recomendaciones del BI-RADS37 deberá incluirse en uno de los seis apartados siguientes:
Categoría 0. Necesidad de estudios adicionales. Se refiere a la necesidad de completar el estudio mediante compresión localizada, magnificación, ecografía y otras proyecciones. La evaluación de la imagen será incompleta mientras no pueda ser encuadrada en una de las cinco categorías restantes.
Categoría 1. Mamografía negativa sin ningún hallazgo que reseñar. No requiere ninguna actuación.
Categoría 2. Mamografía negativa con hallazgos benignos, sin ningún dato que sugiera cáncer: adenopatías intramamarias, fibroadenomas calcificados o lesiones que contengan grasa. No requiere ninguna actuación.
Categoría 3. Probablemente benigno (< 2-5% de malignidad). Se sugiere seguimiento mamografía a los 6 meses (p. ej., en el caso de masas bien delimitadas, calcificaciones agrupadas redondas y lisas). En casos especiales se puede realizar una punción guiada por imagen.
Categoría 4. Sospechosa. La lesión tiene una moderada probabilidad de ser maligna aunque estadísticamente es más probable que sea benigna (25% de malignidad). Es necesario llegar a un diagnóstico definitivo mediante aspiración o biopsia.
Categoría 5. Maligna. Lesión que con gran probabilidad de ser maligna (superior al 80%). Requiere confirmación histológica.
Aunque el BI-RADS es un sistema de informes creado en los Estados Unidos, en nuestro país hay muchos centros que lo utilizan dada la gran aceptación internacional que presenta; no obstante, este sistema no es perfecto y la ACR prevé que evolucionará con el tiempo. Lo que sí parece claro es que su uso mejora la comunicación de los resultados de las pruebas de imagen facilitando una mejora continua en la calidad4; por ello, es importante que lo conozca no sólo el radiólogo sino todos los médicos implicados en el tratamiento de la patología mamaria.