Caso clínico
Mujer de 72 años de edad y con los siguientes antecedentes: a) hipertensión arterial de larga evolución; b) diabetes mellitus de 10 años de evolución en tratamiento con antidiabéticos orales y dieta; c) accidente vascular isquémico en territorio de la arteria cerebral media izquierda hacía 20 años, quedando como secuela una leve paresia braquial derecha; d) cardiopatía isquémica que se inició en forma de angor de esfuerzo hace 6 meses. Se practicó un cateterismo cardíaco que evidenció lesiones significativas en las arterias descendente anterior, circunfleja y coronaria derecha. La ventriculografía demostró una hipocinesia anterior con una fracción de eyección del 30%. Sigue desde entonces tratamiento médico con antagonistas del calcio (amlodipino y diltiazem), mononitrato de isosorbide y aspirina con mal control de la sintomatología anginosa, y e) hipercolesterolemia tratada con simvastatina.
La paciente consulta por disnea progresiva hasta ser de reposo de 10 días de evolución, con ortopnea y episodios de disnea paroxística nocturna. En las 24 h previas al ingreso se añade dolor centrotorácico opresivo, motivo por el cual acude a un centro comarcal. En su ingreso presenta una situación de paro respiratorio, por lo que se procede a intubación y ventilación mecánica y se traslada a nuestro centro.
Exploración física
Presión arterial de 80/40 mmHg, frecuencia cardíaca de 103 lat/min, temperatura 36,7 °C. Aparato respiratorio: crepitantes húmedos consonantes bilaterales. Aparato cardiocirculatorio: arritmia cardíaca, soplo pansistólico II/VI plurifocal de predominio en focos de la base, ingurgitación yugular 6 cm, edemas bimaleolares. Aparato neurológico: sedación farmacológica. Resto de exploración normal.
Exploraciones complementarias
Analítica: hematíes 4,28 ×1012/l, hemoglobina 119 g/l, hematócrito 38 l/l, VCM 87,6 fl, leucocitos 15,51 × 109/l (83% S, 12% NS, 1% L, 4% Mo), plaquetas 194 × 109/l, glucemia 174 mg/dl, Na 142 mEq/l, K 2,8 mEq/l, GOT 157 U/l, LDH 578 U/l, CK 618 U/l, CK-MB 92 U/l, troponina I 2,2 ng/ml. (VN: 0,2 ng/ml) Radiografía de tórax: silueta cardíaca aumentada a expensas de cavidades izquierdas con signos de redistribución vascular y líneas B de Kerley.
Descripción de los ECG
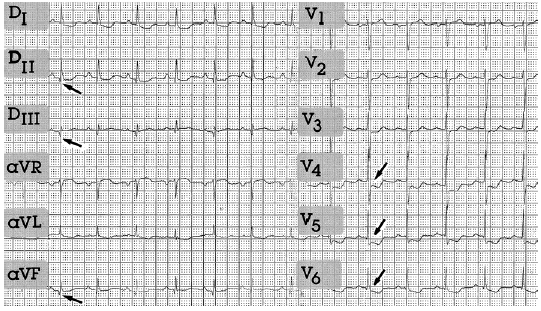
ECG efectuado en intensivos (fig. 1): Bigeminismo ventricular. Los complejos están agrupados de dos en dos, es decir, el primero es el sinusal y el segundo el extrasistólico, cuya morfología es muy diferente al complejo básico, son complejos enormes, de una duración superior a 0,12 s y de considerable voltaje.
Fig. 1.
El aQRS está a 0°; PR 0,12 s además de presentar un bloqueo incompleto de rama izquierda del haz de His. QRS ancho (< 0,8 s) con R-R' en V5-V6, DI y aVL.
Diagnóstico electrocardiográfico
Extrasístoles ventriculares izquierdos bigeminados y bloqueo incompleto de la rama izquierda del haz de His.
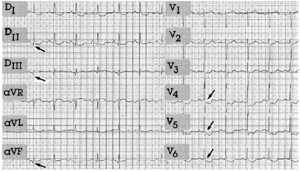
ECG efectuado en sala (fig. 2)
Fig. 2.
Ritmo sinusal, PR 0,16 s, bloqueo incompleto de rama izquierda del haz de His.
Ondas Q en DII, DIII y aVF (si bien las de DII y aVF no cumplen los criterios ECG establecidos para ser sugestivas de necrosis).
Descenso del ST en V4-V6.
Diagnóstico electrocardiográfico
Infarto agudo de cara inferior.
Lesión subendocárdica en cara lateral baja.
Bloqueo incompleto de la rama izquierda del haz de His.
Discusión
En las interpretaciones electrocardiográficas de nuestro paciente se objetivan las siguientes alteraciones: en el ECG (fig. 1), observamos un bigeminismo ventricular, sin lesiones sugestivas de isquemia, o necrosis. Las extrasístoles ventriculares se detectan fácilmente por la morfología de su QRS aberrante y, dicho complejo, habitualmente no va precedido de la onda P correspondiente a la despolarización auricular. Este complejo suele ser alto, deformado, o bien mellado y seguido de una onda T opuesta al QRS en relación con la línea isoeléctrica. Según el lugar de origen podemos distinguir extrasístoles ventriculares derechas, las cuales estarán representadas por imágenes de bloqueo de rama izquierda en las precordiales izquierdas, y extrasístoles ventriculares izquierdas, que presentarán una morfología de bloqueo de rama derecha en precordiales derechas. En nuestro caso podemos considerar que se trata de extrasístoles ventriculares izquierdas, ya que aparecen extrasístoles ventriculares con morfología de bloqueo de rama derecha en las derivaciones precordiales derechas.
Dicho trastorno podría tener una clara relación con el tipo de pruebas exploratorias tales como catéteres o vías venosas centrales. Otros factores a tener en cuenta en la génesis de dichas arritmias ventriculares pueden ser las alteraciones electrolíticas, como la hipopotasemia, la hipomagnesemia y la hipocalcemia. Cabe resaltar también la estimulación simpática refleja o farmacológica, la hipoxemia, la distensión miocárdica y la presencia de una cardiopatía estructural.
Entre otras causas de extrasistolias ventriculares se incluyen el consumo de fármacos, como digitálicos, antipalúdicos y anestésicos. Mención especial merecen también los estimulantes como la cafeína, el tabaco y el alcohol. Por último, se ha descrito que la estimulación vagal y el ejercicio pueden hacer que aparezcan dichas arritmias, incluso en los individuos normales.
En el ECG (fig. 2) se objetiva una onda Q valorable y sugestiva de necrosis en DIII, mientras que las que se observan en DII y aVF no cumplen de forma exacta, los criterios ECG establecidos para una necrosis (0,04 s de anchura por 0,25 mV de profundidad). No obstante, se observa una infradesnivelación clara del segmento ST en V4-V6, a los 7 días de su ingreso. Todo ello podría corresponder a una lesión subendocárdica de cara lateral baja.
Por último, cabe resaltar que dicho ECG presenta una hipertrofia ventricular izquierda (HVI) leve según el índice de Sokolow-Lyon, que es de 25 mm. Dicho índice mide las ondas R de V5 o V6 más las ondas S de V1, y cuando esta suma es superior a 35 mm podemos afirmar que cumple por criterios ECG una HVI importante.
Aunque el tema en cuestión hace referencia a los trastornos eléctricos aprovechamos la ocasión para hacer una breve referencia acerca de la alteración enzimática que presenta dicha enferma con las troponinas. Dicho complejo consiste en tres subunidades (TnT, TnI y TnC), de las cuales el miocardio contiene las isomorfas TnT y TnI que no están presentes en el músculo esquelético y pueden ser determinadas por técnicas inmunológicas. Después de un infarto agudo de miocardio las concentraciones TnI y TnT empiezan a aumentar de forma similar a las CK-MB, pero vuelven a los valores normales después de períodos de tiempo más prolongados (aproximadamente una semana). Al mismo tiempo son de gran utilidad para detectar una necrosis miocárdica mínima y por este motivo están teniendo nuevas aplicaciones clínicas, en particular la estratificación del riesgo en pacientes con angina inestable.
Bibliografía general
Chapelle JP. Cardiac troponin I an troponin T: recent players in the field of myocardial markers. Clin Chem Lab Med 1999;37: 11-20.
Ebell MH, Flewelling D, Flynn CA. A sistematic review of troponin T and I for diagnostic acute myocardial infarction. J Fam Prac 2000;49:550-6.
García-Costo Mir F. Arritmias cardíacas. En: Diaz-Rubio M, Espinós D, editores. Tratado de medicina interna. Vol I, Madrid: Médica Panamericana, 1996; p. 335-57.
Hamm CW, Goldmann Britta U, Heeschen C, Kreymann G, Berger J, Meinertz T. Emergency room triage of patients with acute chest pain by means of rapid testing cardiac troponin T or troponin I. N Engl J Med 1977;337;648-53.
Marriott HJL, Myerburg RJ. Identificación de las arritmias y de los trastornos de la conducta cardíaca. En: Willist Hurts J, et al, editores. El corazón. Vol I. México: Interamericana-McGraw-Hill, 1988; p. 479-525.
Mont Girbau L, Brugada Terradellas J. Arritmias cardíacas. En: Farreras-Rozman, editor. Tratado de medicina interna. 14.a ed. Vol I. Harcout, Madrid: 2000; p. 573-603.
Rice MS, MacDonald DC. Apropiate roles of cardiac troponins in evaluating patients with chest pain. J Am Board Fam Prac 1999; 12:214-8.
Rullière R. Electrocardiografía Práctica. Barcelona: Toray-Masson, 1973.
Takayama K, Takahata O, Sengoku K, Fujimoto K, Iwasaki H. Sick sinus syndrome (SSS) after induction of anesthesia in a patient with intracranial pressure and ischemic heart disease. Masui (Japan) 2000;49:289-91.