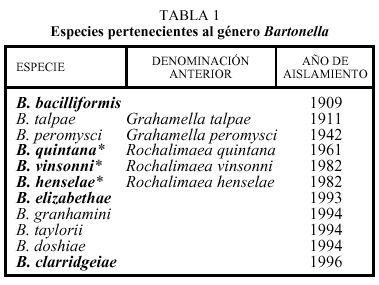
Hasta 1993 la única especie asociada a patología humana era Bartonella bacilliformis, agente causal de la enfermedad de Carrión. En este mismo año tuvo lugar una reclasificación taxonómica y tres especies patógenas más pasaron a formar parte de este género: B. quintana, B. henselae y B. elizabethae. La primera de ellas ha resurgido como agente etiológico en los últimos cinco años. En 1996 se aisló una nueva especie con implicación en patología humana, B. clarridgeiae.
Taxonomía
En 1993 se realizó el análisis filogenético y se secuenció la fracción 16S del ARN ribosómico y como consecuencia de ello, se situó el género Bartonella en la subdivisión *2 de proteobacteria. Debido a la mayor proximidad filogenética de Bartonella a géneros como Brucella y Agrobacterium que a otros como Rickettsia, fue retirado del orden Rickettsiales. Además se incorporaron especies previamente pertenecientes al género Rochalimaea. Por tanto, el género Bartonella queda compuesto por 11 especies con fuerte similitud de secuencia que aparecen recogidas en la tabla 1, en la que se muestran en negrita las especies patógenas para el ser humano.
Características microbiológicas
Los microorganismos pertenecientes al género Bartonella son pequeños bacilos polimorfos aerobios y con estructura de gramnegativos. Por sus requerimientos nutricionales son considerados microorganismos exigentes. Se colorean con las tinciones de Gram y de Giménez. Sólo dos miembros del género están provistos de flagelos: B. bacilliformis y B. clarridgeiae.
Se consideran microorganismos intracelulares facultativos y se han localizado en el interior de hematíes humanos (B. bacilliformis), de gato (B. henselae), y en el interior de células endoteliales humanas en el curso de endocarditis (B. quintana y B. henselae).
Las colonias en medios inertes son rugosas, adherentes e incrustadas en el ágar en un primer aislamiento, pero tras varios subcultivos pasan a ser lisas y pierden adherencia.
Características fisiopatológicas
Un aspecto destacado como único entre las bacterias que infectan al ser humano es la capacidad que poseen los miembros de este género de inducir lesiones angioproliferativas de aspecto tumoral.
La penetración en el interior de los hematíes está documentada desde 1937, y ello está producido por la fijación a la membrana del hematíe por medio de fimbrias; a continuación se producen fenómenos de deformación de ésta que conducen a la internalización del microorganismo mediante la formación de vacuolas.
El origen de las lesiones angioproliferativas es el tropismo que poseen estos organismos por las células endoteliales, como en el caso de B. bacilliformis, B. quintana y B. henselae. En B. quintana se puede observar su presencia en el interior de vacuolas citoplásmicas, con aspecto de mórula, mediante tinciones especiales.
Epidemiología
Infección por Bartonella bacilliformis (enfermedad de Carrión)
Se encuentra circunscrita a ciertos valles de la vertiente occidental andina, sobre todo de Perú, zona que coincide con la distribución geográfica del vector de la enfermedad, «la mosca de la arena» (Lutzomya verrucarum), transmisor también de Leishmania en la zona. Este hecho previene la diseminación de la enfermedad. Aunque sólo se ha demostrado la enfermedad en el ser humano, existe la posibilidad de un reservorio animal, ya que se ha conseguido inducir ésta en varios animales.
B. quintana y B. henselae
Ambas son muy ubicuas. B. quintana tiene como único reservorio conocido el ser humano. La transmisión interhumana se produce a través del piojo corporal (Pediculus humanus corporis) y no puede realizarse ni a través del piojo de la cabeza (Pediculus humanus capitis) ni a través de ladillas (Pthirus pubis). La transmisión, posiblemente, se produce por vía de las excretas del piojo inoculadas a través de soluciones de continuidad de la piel, hecho que se ve favorecido por el rascado.
B. henselae tiene como principal reservorio al gato doméstico, especialmente los animales jóvenes en los que se producen bacteriemias asintomáticas. Se ha aislado la bacteria de numerosos gatos analizados, llegando esta propoción a un 41% de los gatos analizados en San Francisco. Además, se han encontrado gatos bacteriémicos en el entorno de pacientes con enfermedad por arañazo de gato, angiomatosis bacilar o endocarditis. La transmisión entre la población felina se produce a través de la pulga del gato (Ctenocephalis felis). La transmisión al hombre se produce principalmente por inoculación directa desde el gato mediante arañazo, mordedura o contacto con saliva, aunque también podría ser por vía indirecta a través de picadura de sus pulgas.
Otras especies de Bartonella
La epidemiología de B. elizabethae permanece aún sin dilucidar. En cuanto a B. clarridgeiae sólo ha sido aislada de gatos domésticos en los EE.UU., Francia y Países Bajos, por lo que éste podría ser su principal reservorio.
Formas clínicas
Las distintas especies de Bartonella producen en el ser humano diversos cuadros clínicos que se resumen en la tabla 2. A continuación se comentan brevemente cada uno de estos cuadros.
Infección por Bartonella bacilliformis
La enfermedad de Carrión, ligada a la infección por Bartonella bacilliformis desde 1909, existe en dos formas clínicas, aguda (fiebre de Oroya) y crónica (verruga peruana).
Fiebre de Oroya
Consiste en una anemia hemolítica aguda acompañada de septicemia, a consecuencia de la invasión masiva de hematíes por parte de la bacteria, y ésta puede visualizarse en el interior de los glóbulos rojos por tinción de Giemsa de un frotis. Su curso clínico es grave, alcanzando una mortalidad del 40-85% en ausencia de tratamiento. En caso de mortalidad, ésta va precedida de un período clínicamente silente, de aparente curación, pero en el que se documenta bacteriemia. En caso contrario, tras la fase aguda, la bacteriemia asintomática puede permanecer hasta 15 meses.
Verruga peruana
Se produce generalmente tras algunos meses de haber sufrido la fiebre de Oroya, pero puede ser la primera manifestación de la enfermedad. Consiste en lesiones cutáneas seudotumorales, angiomatosas y que sangran al contacto. Pueden ser únicas o múltiples y limitarse a la dermis (formas miliares) o extenderse al tejido subcutáneo (formas nodulares).
Fiebre de las trincheras
También llamada fiebre de Wolhinie, pretibial o quintana, fue descrita en la Primera Guerra Mundial. Se trata de una septicemia por B. quintana que tiene un período de incubación de 15-25 días. Sus manifestaciones clínicas son muy variables, y pueden oscilar desde una infección asintomática hasta una sepsis grave. El comienzo suele ser agudo, con fiebre, cefalea y dolores óseos pretibiales que pueden llegar a ser muy intensos. La fiebre se produce habitualmente cada 5 días (intervalo de 4 a 8 días) lo que le da el nombre de «quintana». Cursa en crisis que se repiten durante unas 4 a 6 semanas, pero cada una de ellas es más leve que la anterior. En ocasiones aparece esplenomegalia. Aunque a veces resulta invalidante, el pronóstico es generalmente bueno.
Desde la Gran Guerra se han descrito casos esporádicos, pero en la actualidad existe una epidemia de piojos en Burundi, por lo que además del tifus se transmite la fiebre de las trincheras.
Bacteriemia por B. quintana en vagabundos
La bacteriemia prolongada por B. quintana ya se documentó en soldados en la Primera Guerra Mundial, y actualmente existe una «fiebre de las trincheras urbana» en vagabundos y sujetos de condiciones socioeconómicas desfavorables. La persistencia de individuos bacteriémicos asintomáticos favorece la transmisión de la infección mediante piojos corporales, así como su diseminación. No se conoce el papel que pueda tener esta bacteriemia crónica en la génesis de la endocarditis, aunque se cree que puede ser relevante. Se han realizado dos grandes estudios de bacteriemia por B. quintana en vagabundos. El primero de ellos llevado a cabo por Spach et al en 1995, describe 10 casos en Seattle (EE.UU.). Los únicos signos acompañantes fueron fiebre y adelgazamiento, y esplenomegalia sólo en 2 casos. En cuatro de los pacientes la bacteriemia duró 10 días, y en un sujeto que rechazó el tratamiento se prolongó hasta 8 semanas. El segundo gran estudio lo realizó el grupo de Raoult en 71 vagabundos de los que 10 de ellos presentaron bacteriemia, siendo ésta crónica en la mitad de ellos. El 30% presentaron anticuerpos específicos frente a B. quintana y se detectó ADN de la bacteria en los piojos de tres sujetos. La mayoría de los pacientes referían dolores intensos en los miembros inferiores y presentaban lesiones de rascado.
La seroprevalencia de anticuerpos específicos en vagabundos ha aumentado del 2% en 1994 al 17,5% en 2000. Actualmente, el grupo de Raoult realiza un estudio en piojos de África (Burundi, Zaire), Francia y Rusia, aislándose B. quintana en todos los ectoparásitos analizados, hecho que refleja la importancia de la epidemia.
Endocarditis
El primer caso descrito en 1993 fue producido por B. quintana en un paciente infectado por el virus de la inmunodeficiencia humana (VIH), pero el resto de casos comunicados posteriormente han sido en pacientes VIH negativos. En 1995 Raoult et al comunicaron varios casos de endocarditis por B. quintana en vagabundos VIH negativos. En todos los casos con sospecha, el diagnóstico fue confirmado anatomopatológicamente sobre biopsia valvular. En todos los casos se detectó la presencia de anticuerpos específicos frente a B. quintana y el diagnóstico etiológico se confirmó por el aislamiento de la bacteria en hemocultivos y por la evidencia de bacterias en tejido valvular mediante técnicas inmunohistoquímicas o de amplificación genómica. Este mismo grupo ha comunicado 11 casos más desde 1996.
Desde 1993 se ha asociado a B. henselae con varios casos de endocarditis. Al igual que en el caso de B. quintana, se produce con mayor frecuencia la afección de válvula nativa.
Hasta finales de 1997 se han comunicado alrededor de 50 casos de endocarditis por Bartonella, de los cuales 41 han sido diagnosticados por el referido grupo de Marsella. De todos ellos sólo uno ha sido producido por B. elizabethae.
La etiología por Bartonella ha de sospecharse en cualquier caso de endocarditis con hemocultivos negativos y especialmente cuando el contexto epidemiológico sea compatible con dicho microorganismo. Debido a la existencia de reacciones cruzadas entre Bartonella y Chlamydia se cree que muchas endocarditis adjudicadas a Chlamydia en el pasado en realidad podrían haber sido producidas por Bartonella.
Con el ánimo de caracterizar los hechos clínicos y epidemiológicos específicos de cada especie y en relación a otros agentes patógenos el grupo francés anteriormente referido llevó a cabo un estudio de casos y controles. De los 64 pacientes que presentaban endocarditis por Bartonella, en cuanto a los factores epidemiológicos documentados globalmente considerados, el 40% era vagabundo, el 52% alcohólico, el 21% había estado en contacto con piojos, el 29% refería mordedura o arañazo de gato y el 21% había estado en contacto con
pulgas de gato. Por lo que hace referencia a las manifestaciones clínicas, el 56% tenía valvulopatía previa conocida, en el 86% se documentó fiebre y en el 41% fenómenos embólicos; en el 78% de los casos fue necesaria cirugía valvular por daño grave en el momento del diagnóstico. La evolución se conoció en 53 pacientes de los cuales el 71% se recuperó. Se obtuvo evidencia directa de la presencia de Bartonella en el 53% de los casos. Existen distintos factores de riesgo asociados a endocarditis por Bartonella en función de la especie responsable del cuadro. Por un lado B. quintana es más frecuente en individuos de bajo nivel socioeconómico en los que se dan circunstancias como alcoholismo, ausencia de domicilio fijo, falta de higiene, presencia de ectoparásitos (sarna, piojos), pobreza, y que no poseen historia de cardiopatía previa; por otro lado B. henselae se ha identificado en aquellos casos en que se documenta el contacto con gatos o pulgas de gato y en pacientes con valvulopatía previa.
Angiomatosis bacilar
Este cuadro clínico está producido por dos especies, B. henselae y B. quintana. Está caracterizado por una proliferación vascular generalmente a nivel cutáneo, pero que puede diseminarse a órganos como bazo, hígado, intestino, riñón, pulmón y cerebro. La afectación neurológica está más asociada a B. quintana. Afecta principalmente a inmunodeprimidos (trasplantados y sobre todo individuos infectados por el VIH). Epidemiológicamente se asocia la presencia de gatos en el domicilio con B. henselae y la existencia de condiciones socioeconómicas deficitarias con B. quintana. Las lesiones (aisladas o múltiples) consisten en pápulas o nódulos que pueden ser superficiales (de aspecto rojizo, púrpura o incoloro) o diseminarse a tejidos más profundos pudiendo producir afección ósea, que radiológicamente se evidencia en forma de erosión o geodas. Con frecuencia se acompañan de una adenopatía regional en la zona de drenaje linfático de la lesión, y este hecho está más asociado a B. henselae. La principal entidad que exige un diagnóstico diferencial es el sarcoma de Kaposi, del que puede ser clínicamente indistinguible.
En la tabla 3 se resumen las características diferenciales de la angiomatosis bacilar en función de la especie implicada.
Peliosis bacilar
De forma inicial sólo se conocía la peliosis hepática y se presentaba en pacientes con tuberculosis, cáncer avanzado o en tratamiento con esteroides anabolizantes. En la actualidad, se habla de peliosis bacilar ante un cuadro de angiomatosis bacilar que afecta a órganos sólidos que poseen elementos reticuloendoteliales, como hígado, bazo, ganglios linfáticos e incluso médula ósea. Se trata de lesiones parenquimatosas caracterizadas por proliferación vascular con dilatación capilar que conduce a la formación de lagos vasculares. El órgano que se afecta con más frecuencia es el hígado.
Hasta la fecha sólo se ha implicado como agente causal B. henselae, confirmándose su presencia por medio de la tinción de plata de Warthin-Starry al observar en muestras de biopsia hepática masas de bacilos en material granular. A pesar de ello la biopsia hepática estaría contraindicada como método diagnóstico por el riesgo de hemorragia masiva que conlleva.
La peliosis bacilar se documenta principalmente en pacientes inmunodeprimidos, sobre todo en individuos infectados por el VIH, en los que se puede asociar a cuadros de angiomatosis bacilar.
Enfermedad por arañazo de gato
Esta entidad clínica fue descrita en 1950 en París, pero hasta 1983 no se confirmó su origen bacteriano por medio de la tinción de Warthin-Starry de material de biopsia de la zona de inoculación. En 1988 se aisló un bacilo gramnegativo de los nódulos linfáticos, hecho que condujo a la descripción de una nueva especie, Afipia felis. Posteriormente se identificó este microorganismo como un contaminante del agua, y no fue hasta 1993 cuando se aisló B. henselae de los ganglios linfáticos. Los estudios serológicos realizados en pacientes con enfermedad por arañazo de gato revelaron en un 88% de los casos la presencia de anticuerpos es pecíficos frente a B. henselae; por tanto existen ya datos tanto microbiológicos como epidemiológicos que implican a B. henselae como agente causal de la enfermedad por arañazo de gato. El reservorio natural del agente etiológico es el gato, y en particular los animales jóvenes en los que se dan bacteriemias asintomá-< BR> ticas.
Por lo que hace referencia a las características epidemiológicas es de destacar que el 80% de los pacientes son menores de 21 años en los EE.UU., y es la causa más frecuente de adenopatía infecciosa.
La enfermedad se inicia con una pápula o pústula en el lugar de inoculación y tras 1-3 semanas aparece la afección ganglionar en el área de drenaje, que suele ser única y de localización principalmente axilar, seguida en frecuencia por la cervical y la epitroclear. Esta última ubicación, a pesar de ser menos frecuente es altamente sugestiva de enfermedad por arañazo de gato. La adenopatía aumenta de tamaño hasta alcanzar varios centímetros y, en este punto, puede evolucionar de dos formas distintas. En primer lugar y de forma típica, se mantiene estacionaria para posteriormente remitir de forma espontánea. En segundo lugar, y sólo en el 10-15% de los casos, se produce la abscesificación de los ganglios.
Existen dos grandes series ya clásicas, la de Carithers et al, con 1.200 casos y la de Margileth et al con 1.700, y en conjunto, en el 50-60% de los casos la enfermedad por arañazo de gato se presenta sin más síntomas que la adenopatía. Existe un bajo porcentaje que oscila entre el 5 y el 10% de casos en los que el curso es atípico y aparecen fundamentalmente afección oculoglandular (síndrome de Parinaud: conjuntivitis con adenopatía preauricular) o encefalitis.
Linfadenopatía crónica y nuevas infecciones por Bartonella
Se ha aislado B. quintana de la sangre de un paciente inmunocompetente afebril con linfadenopatías crónicas cervicales y mediastínicas. El cultivo de material de los nódulos fue negativo pero el examen histológico de éstos y de la muestra de médula ósea evidenció una reacción granulomatosa. La detección de anticuerpos específicos en suero también fue negativa.
Recientemente se ha aislado B. quintana de un paciente con enfermedad de Gouguerot-Sjögren que recibía tratamiento con corticoides y presentaba linfadenopatía crónica.
Además de este cuadro por B. quintana están apareciendo nuevos cuadros producidos por otras especies como B. clarridgeiae y B. vinsonii.
Cuadros producidos por B. quintana y B. henselae
A modo de recapitulación interesa recordar que B. quintana puede producir por una parte infecciones agudas como la fiebre de las trincheras o meningoencefa litis y, por otra, infecciones de curso crónico como angiomatosis bacilar, linfadenopatía o bacteriemia crónicas. Esta última entidad podría ser el origen de la endocarditis por B. quintana.
En lo que respecta a los cuadros producidos por B. henselae, la forma de presentación de éstos va a depender básicamente del estado inmunitario del paciente. En pacientes inmunocompetentes se producirá una respuesta a la infección por B. henselae de tipo granulomatoso y supurativo. Éste sería el caso de la enfermedad por arañazo de gato. Por el contrario, en los pacientes inmunodeprimidos la respuesta será principalmente de tipo vascular proliferativo, como en el caso de la angiomatosis y peliosis bacilar.
Diagnóstico de las infecciones humanas por Bartonella
El diagnóstico de las infecciones anteriormente descritas se basa en los siguientes puntos: a) presencia de un cuadro clínico compatible; b) antecedentes epidemiológicos que orienten hacia una infección por Bartonella; c) despistaje razonado de otras causas; d) histología compatible, y e) diagnóstico microbiológico.
El diagnóstico diferencial ha de realizarse de forma general frente a otras causas de adenopatía tanto infecciosas (Francisella tularensis, Mycobacterium tuberculosis, citomegalovirus, VIH, virus de Epstein Barr, Toxoplasma gondii) como no infecciosas (linfomas y carcinomas). En función de la edad del paciente, el diagnóstico se orienta con preferencia hacia unas u otras condiciones. Si se trata de un paciente infectado por el VIH se han de descartar entre otras entidades clínicas el sarcoma de Kaposi y la infección por herpesvirus humano tipo 6 (HVH 6).
En cuanto al diagnóstico histológico, éste se basa fundamentalmente en el uso de impregnación argéntica, y la técnica más empleada es la tinción de Warthin-Starry. Se utilizan también técnicas inmunohistoquí micas.
Diagnóstico microbiológico
Dentro de las técnicas de diagnóstico directo se puede realizar en primer término el aislamiento del agente causal o en segundo lugar se pueden aplicar técnicas de amplificación genómica como la reacción en cadena de la polimerasa (PCR). En un segundo bloque queda rían encuadradas las técnicas de diagnóstico indirecto o serológicas.
Diagnóstico directo
El aislamiento de Bartonella puede abordarse a partir de sangre o muestras de biopsia de diversos tejidos. Para ello se puede realizar el cultivo tanto en medios inertes como en distintas líneas celulares. El medio más utilizado dentro de los inertes es el ágar sangre enriquecido (Columbia) y es preferible la sangre de caballo o conejo a la habitualmente usada de carnero. El cultivo es difícil y lento, ya que precisa de entre 30 y 45 días para el primer aislamiento y algunos más para el subcultivo. El crecimiento bacteriano depende de la presencia de hemina en el medio, y se ve favorecido en una atmósfera con un 5% de anhídrido carbónico (CO2). Se lleva a cabo a 37 °C para todas las especies excepto para B. bacilliformis cuyo crecimento óptimo tiene lugar a 28 °C. Se requiere la inspección semanal de las placas de Petri.
También se puede realizar el aislamiento a partir de frascos con medio de hemocultivo, pero para ello se necesita un período prolongado, de aproximadamente 2 meses. El tiempo necesario para la aparición de las colonias varía entre 15 y 80 días, y se obtiene mayor eficacia si la sangre es hemolizada (p. ej. mediante congelación-descongelación) previamente a su inoculación. El crecimiento bacteriano puede no ser detectado por los sistemas de hemocultivo automatizados debido a la escasa turbidez producida y a que se trata de un microorganismo que produce pequeñas cantidades de CO2, compuesto que desencadena el sistema automático de detección de crecimiento. Por tanto se requiere una inspección periódica mediante tinción con naranja de acridina, así como la realización de subcultivos en placas de ágar-sangre.
El cultivo celular se puede llevar a cabo en distintas líneas celulares, pero la que aporta mayor sensibilidad es la de células endoteliales. El grupo de Raoult del Centro de Referencia de Rickettsias de Marsella ha puesto a punto la técnica de Shell Vial para aislamiento de Bartonella. Ésta se basa en el uso de células endoteliales humanas (línea ECV 304) y detección del crecimiento mediante anticuerpos monoclonales. Para la identificación se utilizan técnicas basadas en la PCR.
Con independencia de la modalidad de cultivo escogida, ha de procederse a la identificación de los aislados, donde la morfología de las colonias y las tinciones de Gram y Giménez aportan cierta ayuda, hecho que no sucede con las pruebas bioquímicas que en el caso de este microorganismo apenas aportan información relevante. Por todo ello, la identificación de la especie puede realizarse con antisueros murinos específicos mediante técnicas de inmunofluorescencia o mediante el patrón de cromatografía de ácidos grasos de la pared bacteriana, pero las técnicas más empleadas son las basadas en la amplificación genómica.
Las técnicas de amplificación genómica utilizan como diana el gen de la citrato oxidasa o la fracción 16S del ARN ribosómico y, posteriormente, se detectan los productos amplificados mediante hibridación a sondas, secuenciación o análisis de los patrones de fragmentos de restricción (RFLP).
Diagnóstico indirecto (serológico)
Debido a todo lo expuesto, este tipo de diagnóstico es el más fácil de realizar. En la actualidad se dispone de técnicas de enzimoinmunoanálisis (ELISA) e inmunofluorescencia indirecta (IFI) para B. bacilliformis, B. henselae y B. quintana, con características adecuadas de especificidad y sensibilidad. El antígeno empleado para la detección de anticuerpos tiene dos posibles orígenes: el cultivo de la bacteria, bien en placas de ágar, bien en células Vero. Se ha demostrado que en función de cuál sea el método de obtención de antígeno el título de anticuerpos medido va a variar en distintos intervalos. En el caso de antígenos obtenidos en placas de ágar los títulos de anticuerpos observados serán de 1/400-1/800 y en el caso de haberse empleado la línea de células Vero éstos serán de 1/6.400-1/12.800.
Se ha documentado la existencia de reacciones cruzadas entre B. henselae y B. quintana y de ambas especies con Chlamydia y Coxiella burnetti; este hecho tiene implicaciones diagnósticas ya que los tres agentes son productores potenciales de endocarditis con cultivo negativo, pero los títulos de anticuerpos específicos frente a Bartonella en los casos de endocarditis suelen ser tan elevados que una reacción cruzada de pequeña magnitud no ha de ofrecer dudas en cuanto a la etiología del cuadro.
El punto de corte de la inmunofluorescencia no está determinado, pero se recomienda un título de 1/100 para el diagnóstico de la fiebre de las trincheras y la enfermedad por arañazo de gato, y de 1/800 para el de endocarditis. Las técnicas serológicas aportan resultados satisfactorios en el diagnóstico de estas tres entidades, pero en el caso de angiomatosis bacilar se prefieren técnicas genómicas que permitan la identificación de es pecie.
Situación en España
En España solamente se ha comunicado detección y no aislamiento de B. quintana/B. henselae. En pacientes inmunocompetentes el 75% de los cuadros descritos corresponden a enfermedad por arañazo de gato. En los pacientes inmunodeprimidos se han comunicado casos de angiomatosis bacilar, peliosis hepática y 2 casos de endocarditis (en Cantabria y Mallorca). Al examinar la bibliografía de las últimas tres décadas mediante Medline se observa que se han publicado básicamente casos clínicos aislados. Se han descrito una cincuentena de casos de enfermedad por arañazo de gato y angiomatosis bacilar, siendo las tres cuartas partes de ellos correspondientes a la primera de estas entidades. La mayor serie de casos de enfermedad por arañazo de gato corresponde a Aguirrebengoa et al, y cuenta con 14 pacientes. Hasta ahora se han descrito 12 casos de angiomatosis bacilar, todos en pacientes VIH positivos de los cuales tres pertenecen al grupo de Oteo et al.
Respecto a los estudios seroepidemiológicos, éstos son escasos y destacan dos de ellos. En primera instancia el realizado por Oteo et al, en el que se obtienen seroprevalencias del 28,9% en individuos que conviven o mantienen contacto con gatos, del 17,3% en individuos VIH positivos y del 5,9% en donantes sanos. En segundo lugar el estudio de Segura et al obtiene una seroprevalencia en donantes algo superior, del 8,7%, pero merece la pena destacar el hecho de que no se excluyó de la muestra de donantes a aquellos que tenían contacto con gatos, lo que explicaría las diferencias con el estudio anteriormente comentado en el que sí se procedió a esta exclusión.
Bibliografía general
Aguirrebengoa K, Benito JR, Montejo M, Berciartua E, Pérez-Irezábal J, González-Zárate P. Enfermedad por arañazo de gato: serie de 14 casos. Utilidad del diagnóstico serológico. Enferm Infecc Microbiol Clin 1999; 17: 15-18.
Blanco JR, Oteo JA. Epidemiología en la infección por Bartonella sp. en España. II Reunión Nacional del grupo de Rickettsias y Borrelias de la SEIMC. Sitges, 27 y 28 de octubre de 2000. Libro de resúmenes; 19.
Brouqui P, Lascola B, Roux V, Raoult D. Chronic Bartonella quintana bacteriemia in homeless patients. N Engl J Med 1999; 340: 184-189.
Buckles EL, McGinnis Hill E. Interaction of Bartonella bacilliformis human erythrocyte membrane proteins. Microb Pathog 2000; 29: 165-174.
Cimolai N, Benoit L, Hill A, Lyons C. Bartonella henselae infection in British Columbia: evidence for an endemic disease among humans. Can J Microbiol 2000; 46: 908-912.
Chamberlin J, Laughlin L, Gordon S, Romero S, Solorzano N, Regnery RL. Serodiagnosis of Bartonella bacilliformis infection by indirect fluorescence antibody assay: test developement and application to a population in an area of bartonellosis endemicity. J Clin Microbiol 2000; 38: 4269-4271.
Doern GV. Detection of selected fastidious bacteria. Clin Infect Dis 2000; 30: 166-173.
Drancourt M, Mainardi JL, Brouqui P, Vandenesch F, Carta A, Leh-nert F et al. Bartonella (Rochalimaea) quintana endocarditis in
three homeless men. N Engl J Med 1995; 332: 419-423.
Handley SA, Regnery RL. Differentiation of pathogenic Bartonella species by infrequent restriction site PCR. J Clin Microbiol 2000; 38: 3010-3015.
Jacomo V, Raoult D. Human infections caused by Bartonella spp. Part 1. Clin Microbiol Newsl 2000; 22: 1-5.
Jacomo V, Raoult D. Human infections caused by Bartonella spp. Part 2. Clin Microbiol Newsl 2000; 22: 9-13.
Jensen WA, Fall MZ, Rooney J, Kordick DL, Breitschwerdt EB. Rapid identification and differentiation of Bartonella species using a single-step PCR assay. J Clin Microbiol 2000; 38: 1717-1722.
Karem KL. Immune aspects of Bartonella. Crit Rev Microbiol 2000; 26: 133-145.
Karem KL, Paddock CD, Regnery RL. Bartonella henselae, B. quintana, and B bacilliformis: historical pathogens of emerging significance. Microbes Infect 2000; 2: 1193-1205.
Kosek M, Lavarello R, Gilman RH, Delgado J, Maguina C, Verastegui M et al. Natural history of infection with Bartonella bacilliformis in a nonendemic population. J Infect Dis 2000; 182: 865-872.
Liang Z, Raoult D. Differentiation of Bartonella species by a microimmunofluorescence assay, sodium dodecyl sulfate-polyacrylamide gel electrophoresis, and Western immunoblotting. Clin Diagn Lab Immunol 2000; 7: 617-624.
Maguina C, Gotuzzo E. Bartonellosis. New and old. Infect Dis Clin North Am 2000; 14: 1-22.
Margileth AM. Recent advances in diagnosis and treatment of cat scratch disease. Curr Infect Dis Rep 2000; 2: 141-146.
Minnick MF, Anderson BE. Bartonella interactions with host cells. Subcell Biochem 2000; 33: 97-123.
Raoult D, Fournier PE, Drancourt M, Marrie TJ, Etienne J, Cosserat J et al. Diagnosis of 22 new cases of Bartonella endocarditis. Ann Intern Med 1996; 125: 646-652.
Spach DH, Vanter AS, Douherty MJ, Larson AM, Coyle MB, Brenner DJ et al. Bartonella (Rochalimaea) quintana bacteriemia in inner-city patients with chronic alcoholism. N Engl J Med 1995; 332: 424-428.
Tsukahara M, Tsuneoka H, Iino H, Murano I, Takahashi H, Uchida M. Bartonella henselae infection as a cause of fever of unknown origin. J Clin Microbiol 2000; 38: 1990-1991