La parálisis cerebral infantil (PCI) es un grupo de trastornos heterogéneos y crónicos, no progresivos aunque sí variables desde el punto de vista clínico, que afectan al movimiento o la postura, de comienzo temprano, cuyo origen se sitúa en una lesión producida en un cerebro inmaduro1.
La heterogenicidad de la PCI comprende las características clínicas, etiológicas y pronósticas. Clínicamente es frecuente observar otras alteraciones como retraso mental, epilepsia, déficit sensoriales, visuales o auditivos, o trastorno del aprendizaje y de la conducta.
Desde el punto de vista social, esta afectación presenta una gran relevancia por la discapacidad que genera en el paciente, la angustia familiar que conlleva y los recursos sociales y económicos que precisa, entre otros.
Incidencia
Las mejoras obstétricas y neonatológicas han reducido notablemente la incidencia de esta afección en recién nacidos a término en los últimos años. Esta situación se relaciona directamente con la disminución de la incidencia observada en décadas pasadas. Sin embargo, desde 1970-1980 se ha observado un nuevo incremento en la frecuencia de PCI que está probablemente relacionado con la mayor supervivencia de los grandes pretérminos con pesos al nacimiento inferiores a 1.500-1.000 g.
En la actualidad se estima una prevalencia global de este trastorno en 2-2,5 por 1.000 recién nacidos vivos en países desarrollados2; la prematuridad es un hallazgo asociado en el 45% de los casos. La prevalencia estimada en España, según encuesta del INSERSO, es de 1,36 por 1.000 habitantes, lo que supone una población superior a los 50.000 afectados. Otros estudios recientes evidencian una frecuencia similar (1,23/1.000), en niños menores de 3 años que sufren parálisis cerebral clínicamente moderada o grave3.
La distribución por sexos ha demostrado ser muy variable, con una relación entre varones y mujeres de 1,5/1, aproximadamente4.
Etiología y factores de riesgo
Como señalábamos en apartados anteriores, la PCI es un trastorno plurietiológico en el que interviene el propio fenómeno lesivo y la predisposición o características del paciente (tabla 1).
Tradicionalmente se ha relacionado la PCI con la asfixia perinatal. Hoy conocemos que este fenómeno tan sólo podría justificar el 10-20% de todas las PCI5.
Los factores prenatales, especialmente las infecciones congénitas y la leucomalacia periventricular, están notablemente relacionados con la PCI observada en el recién nacido a término.
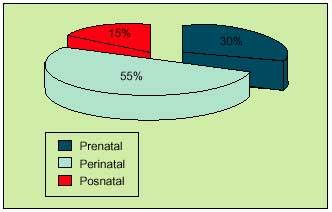
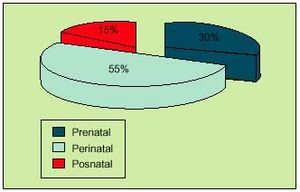
Los factores perinatales serían los predominantes en la etiología de la PCI que afecta al recién nacido pretérmino, y hoy globalmente son los más prevalentes (fig. 1).
Fig. 1. Frecuencias globales de los factores involucrados en la PCI.
Por último, los factores posnatales como las convulsiones o las infecciones justificarían un 10-15% de los casos con PCI.
Factores de riesgo
La prematuridad y el crecimiento intrauterino retardado (CIR) son los factores de riesgo más importantes en la PCI.
La prematuridad se asocia con una mayor prevalencia de PCI espástica respecto a los recién nacidos a término. Un 20-25% de los niños con PCI espástica demuestran el antecedente de bajo peso al nacer (< 1.500 g) y un 60-75% de los pacientes con diparesia espástica habían tenido un peso al nacimiento inferior a 2.500 g6.
El CIR es un factor de riesgo conocido, cuyos mecanismos de base para la justificación de la PCI no han sido completamente aclarados. Sin embargo, el riesgo de PCI se multiplica por seis ante la presencia de este factor7.
La gemelaridad también se ha apuntado como factor de riesgo en la PCI, y se ha encontrado este antecedente en el 10% de los casos afectados.
Factores predictivos
Tradicionalmente, se ha intentado establecer diferentes parámetros clínicos, neurofisiológicos o analíticos capaces de evidenciar o predecir la aparición de una alteración en el neurodesarrollo.
El estudio del bienestar fetal intraparto se ha estandarizado en la mayor parte de los protocolos clínicos de países desarrollados con medidas variables como el registro del ritmo cardiofetal, la determinación del equilibrio ácido-base del feto o el estudio del líquido amniótico8. Sin embargo, su utilidad a la hora de predecir episodios neuropatológicos sigue siendo controvertida.
El registro cardiotocográfico es una práctica habitual en España. La presencia de deceleraciones leves o moderadas se ha relacionado con exámenes neurológicos anormales en el neonato, pero no así en el niño mayor. Solamente se ha observado un examen neurológico anormal en el 10% de los pacientes que presentaron deceleraciones múltiples, graves o tardías durante el registro. Aunque el riesgo de parálisis cerebral es significativamente superior en pacientes con este tipo de registros, la mayor parte de los pacientes no presentarán esta encefalopatía.
La presencia de líquido amniótico teñido de meconio tampoco se ha revelado como un posible factor predictivo.
La monitorización del pH fetal es otra práctica habitual. Tan sólo la acidosis fetal intensa o mantenida es un factor predictivo importante. Un pH de la arteria umbilical menor de 6,70 se asocia con una encefalopatía hipoxicoisquémica en más del 80% de los casos y menos de un 12% cuando el pH supera la cifra de 6,90.
Del mismo modo, la valoración clínica del recién nacido se ha correlacionado con el pronóstico neurológico, diferentes estudios han evidenciado la escasa utilidad de las puntuaciones del test de Apgar en el primer y quinto minuto de vida como factor predictivo de la PCI9. Sin embargo, puntuaciones menores de 3 a los 10 o 20 min se han asociado con una frecuencia de fallecimiento en el primer año de vida del 48 y 59%, y de parálisis cerebral en los demás casos del 5 y el 57%, respectivamente.
Por último, diferentes hallazgos neurofisiológicos o neurorradiológicos se han relacionado con una mayor frecuencia de secuelas neurológicas. Estos aspectos se expondrán detalladamente en el apartado diagnóstico.
Clasificación de la PCI establecida1,10,11
Hemiplejía espástica
Es la forma más frecuente de PCI en recién nacidos a término. Representa el 25-40% del total de las PCI, afecta con mayor frecuencia a varones y predomina la afectación del hemisferio izquierdo.
El origen es prenatal en más del 75% de los casos, y está relacionada con atrofia o lesiones porencefálicas en el territorio de la arteria cerebral media (fig. 2), o bien con displasias corticales.
Fig. 2. Resonancia magnética nuclear (RNM) cerebral potenciada en T2. Lesión extensa en el territorio de la arteria cerebral media derecha en paciente con hemiplejía congénita izquierda.
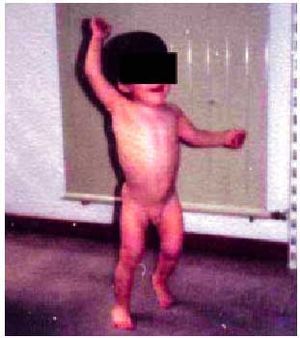
Clínicamente se manifiesta por afectación de un hemicuerpo, ROT vivos, con mayor participación clínica de la extremidad superior (fig. 3). En la mayoría de los casos se describe un período libre de síntomas de 4-6 meses. Sólo en el 10% se asocia hemianopsia homónima y es excepcional la afección facial.
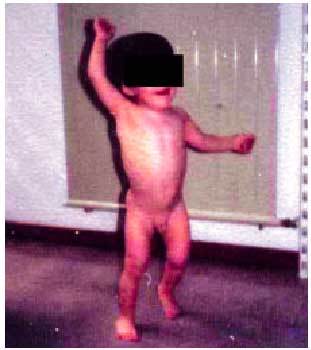
Fig. 3. Varón de 21 meses con marcha hemipléjica derecha.
La prevalencia de epilepsia en esta población varía entre el 30 y el 55%; las crisis suelen ser focales o parciales con generalización secundaria, y el control farmacológico es satisfactorio en más del 80% de los niños.
En aproximadamente un 20-50% de los casos se asociará retraso mental. Esta complicación se encuentra directamente relacionada con la gravedad clínica de la hemiparesia y la presencia de crisis convulsivas.
Diplejía espástica
Representa el 10-35% de los pacientes con PCI. Se asocia con la prematuridad en el 50-70% de los casos; un 5-10% de los RNPT con peso menor de 1.500 g desarrollará este trastorno motor.
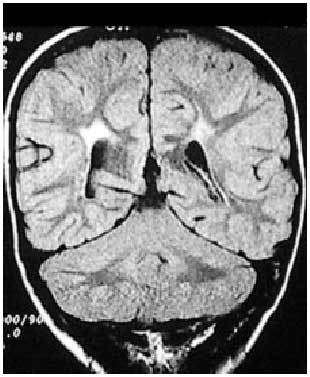
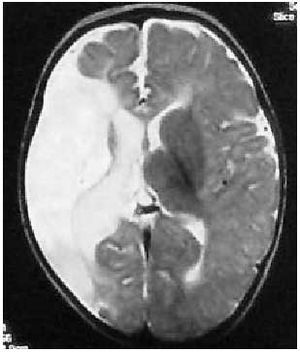
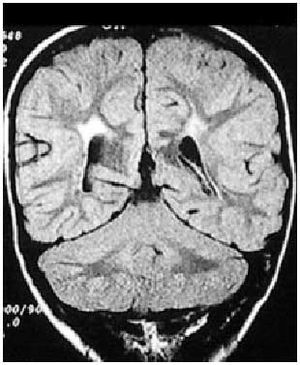
Aunque se han descrito diferentes hallazgos neurorradiológicos en casos aislados, la leucomalacia periventricular (fig. 4) es el patrón anatomopatológico y radiológico más común.
Fig. 4. RNM cerebral potenciada en T1, corte coronal. Leucomalacia periventricular en RNPT con diparesia espástica.
Clínicamente se caracteriza por la afección predominante de las extremidades inferiores, en ocasiones asimétrica, que se manifiesta de forma evidente a partir de los 6-8 meses tras una hipotonía persistente las primeras semanas de vida.
La epilepsia se observa en el 15-30% de los casos y en un 20-30% de los casos se asociará retraso mental.
El estrabismo bilateral convergente es especialmente frecuente en este grupo: se ha descrito hasta en el 45% de los niños.
Tetraplejía espástica
Es la forma más grave y supone el 5% de las PCI. Su origen es múltiple, y se ha relacionado con mecanismos patogénicos pre, peri o posnatales. Son frecuentes las lesiones extensas bihemisféricas, como la encefalomalacia multiquística, las infecciones del sistema nervioso o las malformaciones cerebrales extensas.
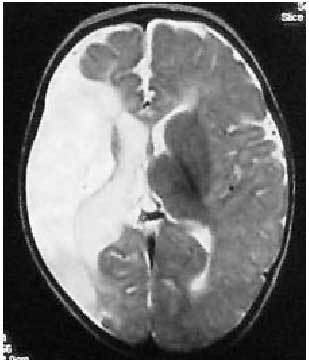
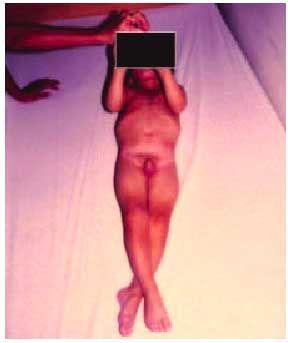
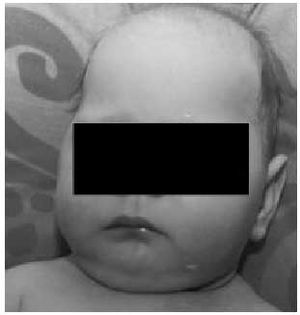
Clínicamente se caracteriza por espasticidad generalizada, opistótonos, microcefalia (figs. 5 y 6), parálisis bulbar con disfagia y disatria graves. Sólo el 50% de los casos conseguirá la marcha autónoma.
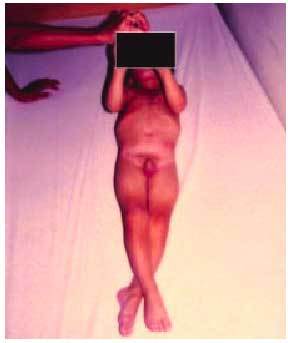
Fig. 5. Varón de 4 años con tetraparesia espástica.
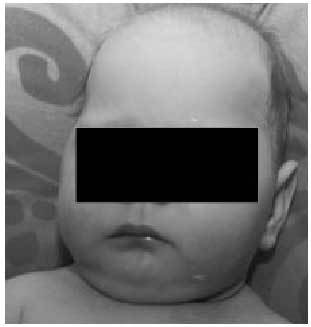
Fig. 6. Microcefalia grave en lactante con encefalomalacia multiquística y tetraparesia espástica.
La epilepsia se observa en el 50-90% de los casos, y se asocian con mucha frecuencia alteraciones visuales y auditivas. El retraso mental es un hallazgo prácticamente constante, con una prevalencia superior al 90%.
Parálisis cerebral discinética
Representa el 10-20% de las PCI y se caracteriza por posturas o movimientos anormales.
Clínicamente se puede subdividir en dos grupos: distónica y coreoatetósica. En el primero predomina la dis tonía (movimientos involuntarios, tónicos, mantenidos, que afectan a tronco y regiones proximales de los miembros), mientras que en el segundo aparece corea (movimientos irregulares, asimétricos, no repetitivos y azarosos) y atetosis (movimientos de los miembros en la zona distal, lentos, involuntarios y sostenidos). Generalmente el diagnóstico clínico establecido no se realiza hasta los 24-36 meses de edad.
Ambas formas se asocian con una lesión de carácter variable en ganglios basales y tálamo. Globalmente, la causa de esta forma de PCI suele ser la encefalopatía hipoxicoisquémica y/o la hiperbilirrubinemia. La forma distónica es característica del recién nacido a término con crecimiento intrauterino retardado e hipoxia perinatal. El subtipo coreoatetósico es más frecuente en el grupo de recién nacidos pretérmino con hiperbilirrubinemia y/o asfixia perinatal.
Estos pacientes tienen generalmente un buen nivel cognitivo; la inteligencia se encuentra dentro de parámetros normales en el 85-95% de los casos con coreoatetosis y en el 50-65% de los pacientes distónicos. El lenguaje, así como la deglución, está con frecuencia afectado por el componente discinético de la musculatura bucofaringeolaríngea.
Los problemas visuales se observan en la tercera parte de los casos, y la hipoacusia se establece en la mitad de los pacientes coreoatetósicos. Las crisis epilépticas se objetivan en el 10-30% de los casos, y son más frecuentes en la forma distónica.
El pronóstico motor es favorable en la forma coreoatetósica; sin embargo, el 90% de los pacientes con afección distónica no alcanzan la marcha autónoma.
Parálisis cerebral atáxica
Representa el 5-15% de todos los casos de PCI. La causa es prenatal en más del 65% de los pacientes. Este término engloba trastornos conocidos de gran heterogeneidad, esporádicos o familiares, con patrones de herencia muy diversos. Los hallazgos anatómicos son paralelamente muy variables (disgenesias, hipoplasias, etc.).
Desde el punto de vista clínico, el síntoma predominante es la ataxia no progresiva, aunque en la mayoría de los casos al final del primer año se observa un síndrome cerebeloso completo (hipotonía, ataxia, dismetría, incoordinación). Se puede observar retraso mental leve asociado, pero rara vez grave. Las crisis convulsivas son excepcionales.
Parálisis cerebral hipotónica
Es una forma infrecuente de PCI (< 5%). Se presume un origen prenatal en la mayoría de los casos.
Se caracteriza por hipotonía muscular con hiperreflexia miotática. Con frecuencia asocia una fuerza normal en las extremidades superiores, por lo que en el pasado se ha denominado diplejía atónica. Clásicamente se refiere de manera característica el signo de Förster: flexión de las extremidades inferiores sobre la cadera cuando se mantiene cogido al niño por las axilas. Con frecuencia, con la edad algunos de estos pacientes manifiestan hipertonía, ataxia o signos extrapiramidales.
Diagnóstico
El diagnóstico de la PCI es predominantemente clínico. Debe basarse inicialmente en la presencia de rasgos clínicos compatibles con la sospecha diagnóstica, apoyados secundariamente en factores etiológicos pre, peri o posnatales, cuando esta circunstancia sea posible.
El buen conocimiento del neurodesarrollo desempeña un papel primordial en el diagnóstico temprano de esta afección. De hecho, en la totalidad de los protocolos médicos de atención primaria en pediatría se propone un seguimiento neurológico próximo del niño, especialmente en los primeros 18 meses de edad.
La presencia de una hipotonía marcada, persistencia de reflejos arcaicos por encima de los 6 meses, retrasos motores, hipertonía-hiperreflexia, exploración motora asimétrica u otros hallazgos clínicos como ataxia, convulsiones, trastornos posturales, etc., son criterios suficientes para remitir al paciente al especialista. La mayor parte de estos signos clínicos han sido tradicionalmente recogidos para conseguir un diagnóstico temprano (tabla 2).
En el grupo de pacientes con algún «factor de riesgo neurológico», recomendamos un seguimiento más especializado por parte del neuropediatra12. Dentro de este grupo incluimos la vigilancia de todo prematuro nacido antes de la semana 32 o con peso inferior a 1.500 g, o recién nacidos a término o pretérmino con sintomatología neurológica al nacer persistente, microcefalia, ictericia que precisó exanguinotransfusión, convulsiones neonatales que persisten al alta, Apgar < 3 a los 5 minutos o pH en la arteria umbilical < 7, infección del sistema nervioso central (SNC), neuroimagen patológica (ecografía cerebral) o cardiopatías intervenidas. En estos pacientes recomendamos el control bimensual tras el alta, hasta los 6 meses, con controles posteriores a los 8, 12, 18 y 24 meses. En estos controles se debe proceder al estudio radiológico mediante ecografía cerebral (6 meses), estudio auditivo (2 meses), estudio visual mediante potenciales (4 meses) y estudio EEG (4 meses).
Exploraciones complementarias
La utilidad de los estudios complementarios viene determinada por el apoyo diagnóstico, tanto clínico como etiológico, el diagnóstico diferencial con encefalopatías progresivas que puedan tener un tratamiento específico, y el estudio de enfermedades asociadas.
El estudio inicial siempre debe incluir la eco cerebral transfontanelar. Esta técnica es altamente fiable para el diagnóstico de la leucomalacia periventricular, alteración de los ganglios basales, lesiones hemorrágicas o quísticas que van a predecir o apoyar las secuelas motrices. Sin embargo, no es infrecuente que tengamos que recurrir a la tomografía axial computarizada (TAC) o a la resonancia magnética nuclear (RNM) cerebral ante la normalidad ecográfica o al cierre de la fontanela; esta última técnica puede apoyar el diagnóstico incluso en fases tempranas, cuando sospechamos la afección motora descrita, y puede demostrar con gran precisión alteraciones corticales o de la sustancia blanca que no son evidenciables con otras técnicas.
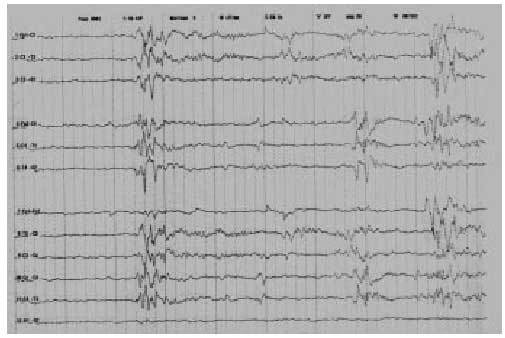
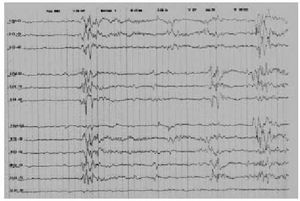
El apoyo con EEG, potenciales evocados visuales o auditivos muestra su utilidad en el reconocimiento temprano de alteraciones asociadas. El EEG neonatal tiene un valor predictivo sobreañadido13, una actividad de base muy alterada, con la presencia de anomalías como el trazado de salvas supresión (burst-suppression) (fig. 7), asimetrías superiores al 50%, trazados inactivos o hipoactivos, entre otros, apuntan un pronóstico neurológico muy desfavorable, con evolución hacia el fallecimiento, epilepsias graves o encefalopatías motoras. Posteriormente, la lectura del trazado EEG debe ser «prudente». Con frecuencia el trazado electroencefalográfico es anormal en estos pacientes y no por ello debemos señalar la presencia de epilepsia; ante esta circunstancia, debemos indagar sobre la existencia de fenómenos «epilépticos» que puedan haber pasado desapercibidos a los padres. Sólo en casos de elevada sospecha de epilepsia sin el reconocimiento familiar, procederemos a otras exploraciones (vídeo-EEG).
Fig. 7. Trazado de salvas supresión en paciente con encefalopatía malformativa y epilepsia.
Diferentes parámetros analíticos en sangre y líquido cefalorraquídeo (LCR) se han correlacionado con la presencia de encefalopatía motora. Las concentraciones elevadas de mediadores de la inflamación, especialmente los interferones, y algunos factores de la coagulación, antitrombina III, han sido detectados en algunos tipos de parálisis cerebral14.
Tratamiento
El mejor tratamiento en la PCI es el preventivo. Las mejoras obstétricas y neonatales se acompañan siempre de una menor frecuencia de PCI, o una menor agresividad clínica de las mismas.
La intervención terapéutica en la PCI es notablemente multidisciplinaria. Uno de los papeles más importantes debe ser el del pediatra. Entre un 25 y un 50% de los casos con PCI no existe ningún factor de riesgo neurológico que pueda predecir la evolución clínica del mismo, por lo que el pediatra debe saber reconocer este trastorno de manera temprana. Un diagnóstico temprano facilita el inicio de medidas terapéuticas precoces. Indudablemente, el seguimiento neurológico estricto y periódico de los pacientes con factores de riesgo es obligado.
Medidas no farmacológicas
Una vez diagnosticado el problema, el pediatra debe conocer las características básicas de esta afección, aportando la información correcta a los padres y evitando la seudoprotección o sobreangustia familiar. Igualmente debe colaborar con otros especialistas que podrán estar relacionados con los cuidados de estos pacientes: neuropediatras, rehabilitadores, ortopedas, oftalmólogos, gastroenterólogos y otorrinolaringólogos, entre otros.
Desde el punto de vista terapéutico, el pediatra debe manejar básicamente las características de los tratamientos empleados para mejorar la motricidad, los fármacos empleables, sus indicaciones o efectos colaterales. Del mismo modo, un conocimiento amplio de los posibles trastornos asociados redundará en su detección temprana y tratamiento adecuado.
Fisioterapia15
El tratamiento inicial debe ser siempre la fisioterapia. La metodología de la fisioterapia dependerá de cada escuela, aunque básicamente todas intentan obtener una relajación de la musculatura espástica, un mejor control y una coordinación muscular, y la potenciación de la musculatura antagonista a la parética.
Los métodos empleados son múltiples y prácticamente la totalidad de los mismos ejercen un beneficio funcional constatado. En nuestro medio, los más utilizados se recogen brevemente en la tabla 3.
La frecuencia con la que cada paciente debe recibir fisioterapia-rehabilitación dependerá de cada caso. Sin embargo, no debemos olvidar que estamos trabajando con niños que precisan otros estímulos sociales y un aprendizaje escolar adecuado a su nivel cognitivo. La frecuencia adecuada para estos pacientes debería ser de 4-5 sesiones de fisioterapia por semana, condición con la que obtenemos un beneficio físico y funcional, sin un perjuicio en las otras áreas a las que hacíamos mención.
Ortopedia
Uno de los propósitos más importantes para el rehabilitador y ortopeda es prevenir las deformidades esqueléticas (escoliosis, luxación de caderas, etc.) y evitar las retracciones musculotendinosas. Aunque generalmente se intenta proporcionar la mayor movilidad autónoma al paciente, es frecuente tener que recurrir al empleo de férulas para garantizar el estiramiento muscular. Igualmente se facilitarán las posturas adecuadas mediante instrumentos específicos, como abrazaderas, calzado estabilizador, andadores, silla de ruedas, etc. En ocasiones hay que recurrir al tratamiento quirúrgico ortopédico, y la cirugía incluye comúnmente intervenciones para la elongación o trasposición musculotendinosa. La tendencia actual es posponerlas en la medida de lo posible.
El alargamiento del tendón de Aquiles es la cirugía más frecuente en la PCI. Está especialmente indicado cuando la espasticidad es adinámica o irreversible, preferentemente tras el crecimiento óseo característico de los 4 y 10 años para evitar su efecto temporal. La reducción o alargamiento tendinoso no quirúrgico bajo anestesia tras la administración de toxina botulínica ha demostrado ser eficaz en pacientes con limitación articular moderada, favoreciendo posponer o evitar el abordaje quirúrgico, situación que coincide claramente con nuestra experiencia.
Procedimientos neuroquirúrgicos
En los últimos años, la rizotomía dorsal selectiva ha demostrado mejorar la espasticidad en niños con PCI16. Esta técnica disminuye la potencia del reflejo medular mediante la sección parcial de las aferencias sensitivas entre L1 y S1, mejorando el tono muscular. Del mismo modo, la cirugía estereotáxica de los núcleos de la base está aportando resultados globales favorables en las formas distónicas y coreoatetóxicas.
Tratamientos farmacológicos
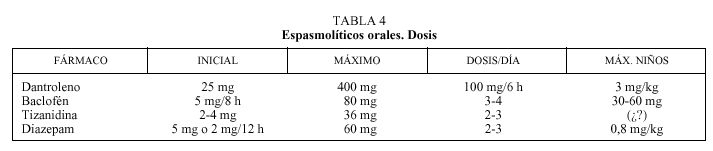
Espasmolíticos orales (tabla 4)
La elevada frecuencia de las formas espásticas y discinéticas en la parálisis cerebral favorece el empleo de este grupo de medicaciones17. Su acción sobre el tono elevado o disfuncional podría tener una utilidad en la mejora funcional de estos pacientes, especialmente cuando la alteración del tono muscular es generalizada. El empleo de medicaciones como dantroleno, baclofén oral, tizanidina, benzodiacepinas, etc., ha demostrado ser útil en la mejora del tono muscular. Sin embargo, la mejoría en el tono no siempre se ha asociado con una mejora funcional. Por otro lado, estas medicaciones no están exentas de efectos adversos como sedación (benzodiacepinas, baclofén), debilidad muscular generalizada, hepatotoxicidad (dantroleno), etcétera.
Una alternativa a la vía oral del baclofén es su administración intratecal que ha demostrado una disminución de la espasticidad en la mayoría de los niños tratados, con una mejora sustancial en la funcionalidad diaria18. A escala funcional se ha obtenido una mejoría en la marcha en la tercera parte de los casos tratados. La necesidad de intervenciones ortopédicas se reduce un 65%. Las complicaciones son escasas, con una frecuencia aproximada del 8%, relacionadas generalmente con el catéter. La descripción de infecciones neuromeníngeas relacionadas con esta técnica es probablemente su mayor limitación.
Toxina botulínica (TBA)
La toxina botulínica es una sustancia producida por Clostridium botulinum, una bacteria anaerobia. El mecanismo de acción principal es el bloqueo de la liberación de acetilcolina a escala presináptica; esta toxina inhibe de forma irreversible el almacenamiento y fusión de las vesículas que contienen acetilcolina en las terminaciones nerviosas presinápticas.
Desde un punto de vista farmacocinético, la dosificación inicial de la toxina en el niño se realizará atendiendo al peso del mismo y las características del músculo afectado. La absorción es rápida por su administración intramuscular, produciendo una relajación muscular lenta sin la participación de metabolitos activos. Una parte mínima pasa a sangre, sin llegar a traspasar la barrera hematoencefálica.
Las indicaciones en el caso de la PCI son mejorar la funcionalidad del miembro afectado, mejorar la calidad de los cuidados y la higiene, evitar contracturas patológicas y el dolor durante los cuidados diarios o la fisioterapia. Por otro lado, ayuda a retrasar o evitar la cirugía en estos pacientes19.
La aplicación se realiza por vía intramuscular con agujas de 23-26 gauges. La infiltración se realiza próxima a la placa motora; para este propósito es necesario el conocimiento anatómico-neurofisiológico de la musculatura a infiltrar. Para la localización también podemos hacer uso del electromiógrafo; nosotros reservamos esta técnica para la localización de músculos profundos o músculos pequeños.
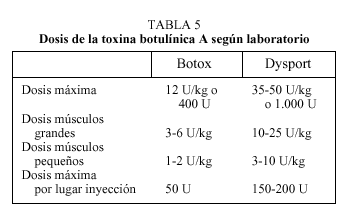
En cuanto a la dosificación, ésta será diferente según el preparado comercial (tabla 5), reinyectándose el tratamiento pasados 3-6 meses según necesidad.
Si consideramos los propósitos iniciales de la infiltración de TBA, podemos definir en relación a la eficacia, que más del 60% mejoran en el tono y la funcionalidad, más del 90% mejoran en la higiene y el dolor con los cuidados, y la mejora en la calidad de la fisioterapia en más del 90%.
Los efectos adversos de este tratamiento son escasos y transitorios, siendo los más frecuentes la debilidad transitoria (5-11%), la inflamación o dolor local (10%), la marcha anormal (4%) y en algún caso se registra una crisis o fiebre en los tres primeros meses después de su infiltración. Este último efecto probablemente está relacionado con la condición patológica de base y no con el propio tratamiento.
Tratamiento de los trastornos asociados
Aunque la parálisis cerebral viene determinada por la afectación motora propia de la patología, con enorme frecuencia se va acompañar de diferentes trastornos, no siempre potenciados por el déficit motor, que el pediatra deberá conocer, reconocer y tratar adecuadamente.
Trastornos alimentarios y nutricionales20
Los trastornos alimentarios son muy frecuentes en los pacientes con PCI u otros tipos de afecciones neurológicas. Los mecanismos básicos son la pérdida de la sensibilidad oral, los movimientos anormales o ausentes, la propia dificultad en el aprendizaje, el tono cefálico pobre o anormal, o la mayor frecuencia de reflujo gastroesofágico. Para mejorar o solucionar estos trastornos será necesario buscar los refuerzos positivos, el empleo de materiales apropiados, la estimulación sensorial con sabores o texturas diferentes, la propia fisioterapia para el control cefálico, las medidas posturales, los tratamientos procinéticos o finalmente el abordaje quirúrgico específico del problema base.
De forma paralela, las alteraciones nutricionales evidencian una gran prevalencia en esta población, y se ha observado desnutrición en el 45% de los niños y obesidad en el 9% de los pacientes con PCI. Generalmente esta situación se relaciona con la propia gravedad del problema motor. Las alteraciones descritas con más frecuencia son el incremento del porcentaje de agua, la depleción de los depósitos grasos, la presencia de compartimientos musculares pobres, la densidad mineral ósea disminuida y la asociación con talla baja. El origen de estos fenómenos colaterales se encuentra en los propios trastornos alimentarios, el encamamiento prolongado, la alteración propioceptiva en el crecimiento, la afectación del eje hipotálamo-hipofisario o el empleo de medicaciones que pueden favorecer esta circunstancia. Indudablemente, la desnutrición favorecerá la debilidad de la musculatura respiratoria, la insuficiencia cardíaca congestiva, la inmunodepresión, el menor desarrollo cognitivo y social, la irritabilidad y las fracturas frecuentes. Las medidas para mejorar esta situación pasan por el control estricto de los índices nutricionales ajustados, la administración de un correcto aporte calórico, la movilización constante del niño, la corrección temprana de los déficit metabólicos y endocrinológicos o la conducta generalizada para evitar las medicaciones que no sean estrictamente necesarias.
Por último, anotaremos en este apartado la elevada frecuencia de estreñimiento en la PCI, que es 20 veces más frecuente que en la población sana, favoreciendo la dispepsia, la distensión y dolor abdominal y la irritabilidad, entre otros.
Trastornos respiratorios
Los problemas respiratorios son más frecuentes por
la propia afectación muscular, los defectos esqueléticos, la presencia de patologías colaterales (broncodisplasia en el prematuro), la acumulación de secreciones que van a favorecer las complicaciones bacterianas bronconeumónicas y las broncoaspiraciones ocasionales.
Los procesos infecciosos leves no son especialmente más frecuentes en esta población, aunque sí pueden conllevar un mayor número de complicaciones.
Recomendamos un control estrecho de los procesos infecciosos, el empleo de fisioterapia respiratoria ante la sospecha de retenciones mucosas, así como valorar de forma cautelosa el empleo de mucolíticos o antibióticos con mayor precocidad.
No debemos obviar que la enfermedad respiratoria es directamente la causa de fallecimiento del 7% de los pacientes con PCI y actúa como coadyuvante del fallecimiento en un 36% de éstos.
Trastornos musculoesqueléticos
Son frecuentes la cifoscoliosis, la luxación de cadera, las retracciones tendinosas o la marcha con pie equino.
La fisioterapia temprana, los procedimientos ortopédicos y el empleo de espasmolíticos pueden aminorar la intensidad o frecuencia de estos problemas.
Epilepsia21
La incidencia de crisis convulsivas es del 15-55% de niños y adultos con parálisis cerebral, aunque ésta dependerá, entre otros factores, del subtipo clínico, de su gravedad y de su origen.
Globalmente, las crisis tonicoclónicas generalizadas son las más frecuentes, aunque parece lógico sospechar que un gran número de éstas serán inicialmente parciales. La frecuencia de este tipo de crisis supera el 50% en la mayor parte de las series, excepto en los hemipléjicos espásticos donde las crisis parciales suponen el 70% del total de las convulsiones. Sin embargo, se ha descrito todo tipo de crisis en la PCI. La frecuencia de cuadros epilépticos graves como el síndrome de West se describe en el 2-28% de estos pacientes, evidenciando la prevalencia más elevada en pacientes tetrapléjicos.
El abordaje terapéutico es generalmente aceptable en el 80% de los pacientes, y se emplea un solo agente anticomicial en el 50% de éstos. En otros casos habrá que recurrir a la politerapia, e incluso al abordaje neuroquirúrgico en pacientes muy seleccionados. En general, el 20-30% de los pacientes estarán libres de crisis, y se puede entonces valorar la retirada de la medicación.
Trastornos neurosensoriales
La prevalencia global de estos problemas es del 11 y 8% para las alteraciones visuales y auditivas, respectivamente.
Los especialistas correspondientes deberán realizar un seguimiento específico de pacientes con factores de riesgo neurosensorial; por ejemplo, el cribado de enfermedades como la retinopatía o la hipoacusia en el recién nacido pretérmino.
Aunque tras la confirmación diagnóstica de la PCI, nosotros recomendamos un seguimiento periódico multidisciplinario, el pediatra debe perseguir la aparición de trastornos como el estrabismo, los defectos campimétricos, la alteración de la agudeza visual, la discriminación auditiva y su relación con el desarrollo del lenguaje. Este seguimiento se podrá realizar generalmente en cualquier consulta médica, remitiendo al paciente al oftalmólogo u otorrinolaringólogo según la sospecha diagnóstica. El pediatra debe recordar que en ocasiones un comportamiento anómalo puede ser el resultado aislado de la privación sensorial.
Déficit intelectual. Dificultades de aprendizaje
La presencia de retraso mental no es una situación habitual. En algunas series se ha observado una prevalencia próxima al 50%, aunque la estimación varía con el tipo de PCI, su gravedad, la asociación con crisis convulsivas o el origen del mismo.
Con frecuencia resulta complejo determinar el nivel cognitivo en algunos pacientes por sus problemas motores y dificultades en el lenguaje.
La estimulación psicomotriz es recomendable ante un diagnóstico confirmado. Existe gran controversia en el empleo de la misma en pacientes con factores de riesgo neurológicos, aunque nosotros siempre hemos optado por un seguimiento periódico estrecho y el inicio de las sesiones ante la confirmación clínica del trastorno.
La escolarización de estos niños es un tema complejo, tanto por las dificultades motoras como por la presencia de dificultades cognoscitivas. El neuropediatra y el psicólogo infantil deberán conjuntamente proponer las necesidades o requerimientos escolares, el tipo de escolarización y las ayudas aplicables.
De forma paralela, los trastornos de aprendizaje son enormemente frecuentes en estos niños. El retraso del lenguaje, bien de origen comprensivo y/o articulatorio es uno de los problemas más importantes, objetivándose en el 30% de los casos. Esta afección se va a relacionar paralelamente con el nivel intelectual y auditivo.
Deberemos remitir al logopeda los pacientes con estas dificultades, especialmente en las formas dispráxicas o disártricas, donde la utilidad se ha mostrado evidente. En otros casos se planteará el empleo de técnicas de comunicación no verbales.
Por último, habrá que controlar y vigilar los mecanismos adaptativos del paciente, su relación con el medio, su conducta, etc., ya que los trastornos comportamentales o psiquiátricos son de seis a siete veces más frecuentes en niños con PCI que en la población normal.
Conclusiones
El diagnóstico temprano y el tratamiento terapéutico de la parálisis cerebral son dos tareas complejas. De forma independiente del abordaje adecuado, el pronóstico del paciente puede ser desfavorable en el 30-40% de los casos por la discapacidad que origina la propia enfermedad, por su mortalidad temprana o por la comorbilidad referida.
Las mejoras en el control terapéutico del recién nacido prematuro, los avances farmacológicos y la calidad de la atención pluridisciplinaria son los factores de los que depende el presente y futuro de estos niños. El pediatra desempeña un papel trascendental en este argumento; será primer responsable en el control del desarrollo neurológico, conocerá las características clínicas y etiológicas de la PCI para administrar una información familiar adecuada a cada situación, colaborará con otros especialistas en la atención multidisciplinaria, vigilará los tratamientos empleados y la aparición de posibles efectos colaterales, y reconocerá de forma temprana la aparición de enfermedades asociadas para un control clínico temprano.